13 травня, 2018
Междисциплинарный подход к лечению глаукомы и патологии сетчатки
1-2 марта в г. Киеве состоялась научно-практическая конференция с международным участием «Алгоритмы диагностики и лечения сосудисто-эндокринных заболеваний. Патология сетчатки. Глаукома. Междисциплинарный подход». В рамках конференции проходило рабочее совещание экспертов Украинского глаукомного общества, также были представлены доклады ведущих специалистов. Мероприятие вызвало огромный интерес у медицинской общественности.
 Организационный комитет под руководством члена-корреспондента Национальной академии медицинских наук (НАМН) Украины, доктора медицинских наук, профессора З. Ф. Веселовской собрал на конференции таких отечественных ведущих специалистов, как профессор Б. Н. Маньковский, профессор Е. И. Митченко, профессор И. Н. Безкоровайная, профессор И. Я. Новицкий, профессор О. В. Недзведская и др., а также многих ученых из других стран: I. Kreissig (Германия), U. Spandau (Швеция), Jc. Schmidt (Швейцария), Sh. Yamamoto (Япония), A. Konstas (Греция), K. Martin (Великобритания).
Организационный комитет под руководством члена-корреспондента Национальной академии медицинских наук (НАМН) Украины, доктора медицинских наук, профессора З. Ф. Веселовской собрал на конференции таких отечественных ведущих специалистов, как профессор Б. Н. Маньковский, профессор Е. И. Митченко, профессор И. Н. Безкоровайная, профессор И. Я. Новицкий, профессор О. В. Недзведская и др., а также многих ученых из других стран: I. Kreissig (Германия), U. Spandau (Швеция), Jc. Schmidt (Швейцария), Sh. Yamamoto (Япония), A. Konstas (Греция), K. Martin (Великобритания).
Одной из наиболее интересных частей мероприятия была сессия, посвященная глаукоме. На этой сессии выступили мировые лидеры офтальмологической науки: A. Konstas, K. Martin, P. Garasymowitch, П. А. Бездетко, В. Н. Сердюк, О. Я. Недзвецкая, И. Я. Новицкий, Г. Я. Пархоменко. Сессию по глаукоме открыла член-корреспондент НАМН З. Ф. Веселовская, которая представила современный обзор ситуации с глаукомой в отечественной медицине, обозначила международные тенденции, на которые равняется Украина, подчеркнула важность внедрения передового опыта зарубежных стран. Профессор Веселовская отметила несомненно высокий потенциал украинской науки, который должен реализоваться в сотрудничестве с европейским сообществом.
 День глаукомы в программе конференции был отмечен интересными лекциями и острыми дискуссиями по современным подходам к медикаментозному и микрохирургическому лечению глаукомы не только наших профессоров, но и лидеров Европейского и Всемирного глаукомных обществ, таких как Keith Martin (президент Всемирного глаукомного общества, директор департамента клеточных технологий Кембриджа, Великобритания), профессор Paul Garasymowycz (директор Института Глаукомы, Канада) и A. Konstas (директор Глазного центра, Греция).
День глаукомы в программе конференции был отмечен интересными лекциями и острыми дискуссиями по современным подходам к медикаментозному и микрохирургическому лечению глаукомы не только наших профессоров, но и лидеров Европейского и Всемирного глаукомных обществ, таких как Keith Martin (президент Всемирного глаукомного общества, директор департамента клеточных технологий Кембриджа, Великобритания), профессор Paul Garasymowycz (директор Института Глаукомы, Канада) и A. Konstas (директор Глазного центра, Греция).
Дискуссия по методам традиционной дренирующей хирургии глаукомы проходила под лозунгом «Какой должна быть хирургия глаукомы? Что ожидает от нас пациент?», который озвучила профессор З. Ф. Веселовская. Две блестящие лекции профессора P. Garasymowycz были дополнены не менее интересным и информативным материалом лекций В. Н. Сердюка, И. Я. Новицкого, О. Я. Недзвецкой и Г. Я. Пархоменко. Перспективное направление нейропротекции в лечении глаукомных пациентов было представлено в уникальном материале K. Martin по имплантации стволовых клеток и в лекциях З. Ф. Веселовской и П. А. Бездетко по местному и системному применению отдельных групп медикаментозных препаратов прямого нейропротекторного действия.
Хочется отдельно остановиться на медикаментозной коррекции глаукомы как важном этапе, часто предопределяющем все последующее течение заболевания.
Научный доклад профессора З. Ф. Веселовской был посвящен европейским стандартам терапии первичной открытоугольной глаукомы (ПОУГ), роли суточных колебаний внутриглазного и системного давления как ведущих факторов риска прогрессирования глаукомы, необходимости их жесткого контроля в профилактике потери зрения при глаукоме.
 Доклад профессора Anastasios G. P. Konstas (г. Салоники, Греция) был посвящен 24-часовому контролю внутриглазного давления (ВГД) с помощью фиксированной комбинации (ФК) дорзоламида и тимолола (ФКДТ). ФК были внедрены в медицину с целью улучшения приверженности лечению хронических асимптоматических пожизненных заболеваний, поскольку низкий комплаенс считается наиболее важным препятствием к успешному результату. Метаанализ с участием 11925 пациентов, применявших ФК, и 8317 больных, использовавших сочетание соответствующих действующих веществ по отдельности, показал, что применение ФК повышало приверженность на 26%, что сопровождалось лучшими последствиями для состояния здоровья (Bangalore et al., 2007). В наше время противоглаукомные ФК объединяют 2 активных компонента, что позволяет уменьшить лекарственную нагрузку и мотивировать пациента применять препарат в соответствии с рекомендациями врача. Преимуществами применения ФК в лечении глаукомы является уменьшение количества препаратов и, соответственно, неудобства и лишних затрат на лечение, меньшее время, затрачиваемое на ежедневное применение препарата, меньший контакт с различными консервантами, меньшая токсичность, лучшая переносимость и, возможно, лучший долговременный результат после хирургического вмешательства. Ограничением применения ФК является невозможность определения и подтверждения терапевтической эффективности каждого отдельного компонента, снижение гибкости индивидуализированного подбора лечения (например, ФК содержат исключительно 0,5% тимолола), назначение комбинаций без четкого понимания врачом профиля эффективности/безопасности. Таким образом, следует четко определить, каким больным с глаукомой необходимо назначать ФК. Стандартным подходом к лечению глаукомы является применение монотерапии до достижения целевого ВГД. ФК используются в тех случаях, когда не удалось достичь целевых показателей с помощью монотерапии и/или требуется дополнительное снижение ВГД. В современной клинической практике ФК отдается преимущество перед одновременной терапией двумя средствами (Рекомендации Европейского общества глаукомы, 2015).
Доклад профессора Anastasios G. P. Konstas (г. Салоники, Греция) был посвящен 24-часовому контролю внутриглазного давления (ВГД) с помощью фиксированной комбинации (ФК) дорзоламида и тимолола (ФКДТ). ФК были внедрены в медицину с целью улучшения приверженности лечению хронических асимптоматических пожизненных заболеваний, поскольку низкий комплаенс считается наиболее важным препятствием к успешному результату. Метаанализ с участием 11925 пациентов, применявших ФК, и 8317 больных, использовавших сочетание соответствующих действующих веществ по отдельности, показал, что применение ФК повышало приверженность на 26%, что сопровождалось лучшими последствиями для состояния здоровья (Bangalore et al., 2007). В наше время противоглаукомные ФК объединяют 2 активных компонента, что позволяет уменьшить лекарственную нагрузку и мотивировать пациента применять препарат в соответствии с рекомендациями врача. Преимуществами применения ФК в лечении глаукомы является уменьшение количества препаратов и, соответственно, неудобства и лишних затрат на лечение, меньшее время, затрачиваемое на ежедневное применение препарата, меньший контакт с различными консервантами, меньшая токсичность, лучшая переносимость и, возможно, лучший долговременный результат после хирургического вмешательства. Ограничением применения ФК является невозможность определения и подтверждения терапевтической эффективности каждого отдельного компонента, снижение гибкости индивидуализированного подбора лечения (например, ФК содержат исключительно 0,5% тимолола), назначение комбинаций без четкого понимания врачом профиля эффективности/безопасности. Таким образом, следует четко определить, каким больным с глаукомой необходимо назначать ФК. Стандартным подходом к лечению глаукомы является применение монотерапии до достижения целевого ВГД. ФК используются в тех случаях, когда не удалось достичь целевых показателей с помощью монотерапии и/или требуется дополнительное снижение ВГД. В современной клинической практике ФК отдается преимущество перед одновременной терапией двумя средствами (Рекомендации Европейского общества глаукомы, 2015).
Одна из причин популярности ФК в терапии глаукомы – успех ФКДТ (Косопт, Сантен). Эта комбинация вышла на фармацевтический рынок в 1998 г., став первой ФК, одобренной FDA для применения 2 р/сут.
В фазе пика ФКДТ снижает ВГД на 9 мм рт. ст. (32,7%). Было показано, что данные ФК снижают ВГД на 2,8 мм рт. ст. больше в фазе пика и на 1,1-1,3 мм рт. ст. больше в фазе плато, чем тимолола малеат 0,5%. ФКДТ продемонстрировали клиническую эквивалентность нефиксированной комбинированной терапии с наибольшим, хотя и недостоверным отличием в 16.00 (дополнительно снизив ВГД –0,7 мм рт. ст.) (Frampton, Perry, 2006).
Следовательно, преимущества ФКДТ при глаукоме – это упрощение режима терапии, большее удобство для пациента, снижение временных и финансовых затрат на лечение. Ключевым моментом является также улучшение комплаенса. Интересно, что в реальной клинической практике ФКДТ вызывают еще более выраженное снижение ВГД, чем в опубликованных рандомизированных контролированных исследованиях. Существующая доказательная база свидетельствует о большей эффективности ФКДТ (на 1,5-2,1 мм рт. ст.) по сравнению с нефиксированной комбинацией тимолола и дорзоламида (Choudhri et al., 2000; Bacharach et al., 2003; Konstas et al., 2004).
Профессор Konstas отметил, что однократного измерения ВГД раз в несколько месяцев недостаточно, поскольку ВГД широко варьирует на протяжении суток, и однократное измерение в случайно выбранный момент позволяет пропустить значительную долю патологических состояний (Wax et al., 2002; Konstas et al., 2015). Начало медикаментозной терапии на основе частичных данных о ВГД пациента и поддержка/изменение этой терапии на основе случайных одноразовых проверок ВГД выступают лимитирующим фактором успешности лечения. Поскольку глаукома является круглосуточным заболеванием, оптимальным методом контроля эффективности лечения является 24-часовой контроль ВГД, проведение которого крайне необходимо в реальной клинической практике. Компромиссом выступает оценка кривой ВГД на протяжении дня. У пациентов с глаукомой, ранее не получавших терапию, это позволит подтвердить диагноз и определить истинные характеристики патологического процесса, а у пациентов, подлежащих лечению, это позволит установить успешность применяемой терапии (Moodie et al., 2010). Несомненно, наиболее ценным является 24-часовой мониторинг, однако наилучший компромисс – это оценка 8-часовой дневной кривой на основе трех моментов времени: 09:00, 13:00, 17:00 (± 1 час). Проведение 24-часового мониторинга способно помочь определить, какая именно терапия улучшает течение болезни для каждого отдельного пациента и каждой специфической формы глаукомы.
Важным является равномерный контроль ВГД на протяжении дневного и ночного периодов. Тимолол как β-адреноблокатор (БАБ) лучше работает в дневное время, а дорзоламид (ингибитор карбоангидразы, ИКА) достоверно снижает выработку водянистой влаги ночью. Метаанализ показал, что дорзоламид является единственным противоглаукомным средством, более мощно действующим ночью, чем днем: снижение ВГД в 10:00 составляет 18%, в 14:00 – 14%, в 18:00 – 15%, в 22:00 – 21%, в 02:00 – 20%, в 6:00 – 23% (Toris et al., 2004; Stewart et al., 2008). ФКДТ обеспечивают стабильное круглосуточное снижение ВГД, что особенно важно в лечении глаукомы, а также характеризуется незначительными колебаниями ВГД на протяжении суток (3,8-4,6 мм рт. ст.), особенно при длительном применении (больше 6 мес.).
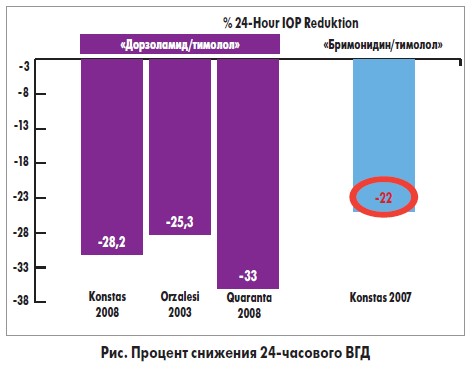 Согласно одному из проведенных нами исследований, ФКДТ обеспечивают лучший суточный контроль ВГД, чем латанопрост (Quaranta, Miglior, Konstas et al., 2008). Другое проспективное рандомизированное исследование было посвящено сравнению ФК дорзоламид/тимолол и бримонидин/тимолол у пациентов с ПОУГ. 64 пациента были рандомизированы в группы вышеназванных комбинаций, однако по 2 пациента из каждой группы были в дальнейшем исключены из исследования. При всех измерениях (6:00, 10:00, 14:00, 18:00, 22:00, 02:00, общий показатель за 24 ч) эффективность ФКДТ по снижению ВГД превышала аналогичный показатель сочетания бримонидин/тимолол. При измерениях в 18:00 и 02:00, а также для общего суточного показателя разница оказалась статистически достоверной. Таким образом, исследование показало высокую эффективность ФКДТ, в первую очередь в связи со снижением выраженности действия бримонидина/тимолола поздним вечером и ночью, что совпадает с данными предыдущих исследований (рис.).
Согласно одному из проведенных нами исследований, ФКДТ обеспечивают лучший суточный контроль ВГД, чем латанопрост (Quaranta, Miglior, Konstas et al., 2008). Другое проспективное рандомизированное исследование было посвящено сравнению ФК дорзоламид/тимолол и бримонидин/тимолол у пациентов с ПОУГ. 64 пациента были рандомизированы в группы вышеназванных комбинаций, однако по 2 пациента из каждой группы были в дальнейшем исключены из исследования. При всех измерениях (6:00, 10:00, 14:00, 18:00, 22:00, 02:00, общий показатель за 24 ч) эффективность ФКДТ по снижению ВГД превышала аналогичный показатель сочетания бримонидин/тимолол. При измерениях в 18:00 и 02:00, а также для общего суточного показателя разница оказалась статистически достоверной. Таким образом, исследование показало высокую эффективность ФКДТ, в первую очередь в связи со снижением выраженности действия бримонидина/тимолола поздним вечером и ночью, что совпадает с данными предыдущих исследований (рис.).
В случаях недостаточности монотерапии аналогами простагландинов (АПГ) часто используется переход с АПГ на ФК, а также добавление ФК к АПГ. В авторском исследовании было изучено 3 варианта противоглаукомной терапии у 32 пациентов с недостаточным контролем ВГД (>20 мм рт. ст.) на монотерапии латанопростом. Варианты терапии включали ФКДТ 2 р/сут, латанопрост+тимолол 1 р/сут вечером, ФКДТ+латанопрост. ВГД измерялось на протяжении суток каждые 4 часа (10:00, 14:00, 18:00, 22:00, 02:00, 06:00). Все виды изученной терапии улучшали показатели по сравнению с исходными уровнями на монотерапии латанопростом (переход на ФКДТ обеспечивал дополнительное снижение на 2,2 мм рт. ст.). Наиболее выраженное снижение ВГД в исследовании было получено при добавлении к латанопросту ФКДТ. Подобные результаты были получены Sonty и соавт. (2008), сообщившими о снижении ВГД на 2,4-3,5 мм рт. ст. от исходных показателей при переводе с латанопроста на ФКДТ.
Таким образом, поскольку глаукома является круглосуточным заболеванием, следует, во‑первых, ориентироваться не на однократное измерение ВГД, а на его 24-часовой профиль, а во‑вторых, стремиться применять в терапии препараты, способные обеспечить равномерный суточный контроль. ФКДТ обеспечивают важные преимущества по сравнению с нефиксированным сочетанием тех же действующих веществ, а именно: мощное круглосуточное снижение ВГД и лучший профиль переносимости.
В секции, посвященной новым взглядам на синдром сухого глаза (ССГ), профессор Н. С. Луценко (Запорожская медицинская академия последипломного образования МЗ Украины) представила аудитории современный анализ известных групп медикаментозных препаратов и рекомендованные подходы к их назначению при болезни сухого глаза (БСГ) на основе современного Европейского протокола 2017 г. ССГ поражает до 34% людей во всем мире. Было установлено, что в США связанные с этим синдромом прямые медицинские затраты составляют 783 доллара на одного пациента, а ассоциированное с БСГ снижение продуктивности обходится в 11 302 доллара на одного пациента в год.
Профессор И.В. Шаргородская (НМАПО им. П. Л. Шупика) представила данные о том, что БСГ – это многофакторное заболевание глазной поверхности, характеризующееся потерей гомеостаза слезной пленки, а также сопровождающееся глазными симптомами, при которых этиологическую роль играют нестабильность слезной пленки, гиперосмолярность, воспаление и повреждение глазной поверхности, нейросенсорные нарушения.
Профессор И. Н. Безкоровайная (Украинская медицинская стоматологическая академия) информировала о современных новациях в диагностике глаукомы.
 Конечной целью менеджмента БСГ является восстановление гомеостаза глазной поверхности, разрушение замкнутого круга болезни и обеспечение долгосрочных вариантов предотвращения возобновления симптомов. Алгоритм лечения БСГ не является жестким ступенчатым подходом. Следует учитывать этиологию и тяжесть заболевания, начинать с общих методов лечения, в дальнейшем переходя к более современным и конкретным, учитывающим патофизиологию болезни методикам. Начинать необходимо со стандартных общедоступных методов лечения, таких как безрецептурные слезозаменители. Лечение можно разделить на 4 этапа в зависимости от тяжести БСГ.
Конечной целью менеджмента БСГ является восстановление гомеостаза глазной поверхности, разрушение замкнутого круга болезни и обеспечение долгосрочных вариантов предотвращения возобновления симптомов. Алгоритм лечения БСГ не является жестким ступенчатым подходом. Следует учитывать этиологию и тяжесть заболевания, начинать с общих методов лечения, в дальнейшем переходя к более современным и конкретным, учитывающим патофизиологию болезни методикам. Начинать необходимо со стандартных общедоступных методов лечения, таких как безрецептурные слезозаменители. Лечение можно разделить на 4 этапа в зависимости от тяжести БСГ.
Первый этап включает просветительскую работу по вопросу БСГ, ее лечения, ухода и прогноза; изменение местной окружающей среды; модификацию диеты (в т. ч. диетические добавки незаменимых омега‑3-жирных кислот); исключение системных и местных препаратов, могущих вызывать сухость, особенно содержащих консерванты средств; слезозаменители различных типов (при наличии дисфункции мейбомиевых желез предпочтение отдается средствам, содержащим липиды); гигиену век и теплые компрессы различных типов.
Второй этап предусматривает переход на бесконсервантные слезозаменители; лечение на протяжении ночи (мази, увлажнители); сохранение слезы окклюзией слезной точки; увлажняющие очки и устройства; в лечебном учреждении – согревание мейбомиевых желез и эвакуация их содержимого, импульсная светотерапия. Рецептурными препаратами для лечения БСГ являются топические антибиотики или комбинация антибиотик/кортикостероид (КС), используемые для лечения переднего блефарита при его наличии; топические КС; топические стимуляторы секреции; топические неглюкокортикоидные иммуномодулирующие препараты (циклоспорин); топические препараты-антагонисты функционально связанного антигена‑1 лимфоцитов (лифитеграст); пероральные макролиды или тетрациклиновые антибиотики.
На третьем этапе применяются пероральные стимуляторы секреции; глазные капли аутологичной / аллогенной сыворотки; терапевтические контактные линзы (мягкие бандажные, жесткие склеральные).
Четвертый этап включает применение топических КС пролонгированного действия; покрытие амниотической оболочкой; хирургическую окклюзию слезных точек; другие хирургические подходы (тарзорафия, пересадка слезных желез).
 Учитывая интрес к вопросу о терапии данной патологии, приведем более широкие данные из доклада Н. С. Луценко (ЗМАПО МЗ Украины).
Учитывая интрес к вопросу о терапии данной патологии, приведем более широкие данные из доклада Н. С. Луценко (ЗМАПО МЗ Украины).
В основе лечения БСГ лежит замещение слезы глазными лубрикантами, которые всего лишь замещают нарушенную слезную пленку, не оказывая патогенетического воздействия. Заменители слезной жидкости восстанавливают осмолярность слезы, увлажняют поверхность глазного яблока, заменяют дисфункциональные слои слезной пленки, уменьшают механическое раздражение, ускоряют заживление повреждений эпителия, сохраняют физиологическую толщину роговицы, сохраняют необходимую плотность бокаловидных клеток, устраняют симптомы сухости.
Во множестве препаратов для увлажнения поверхности глаза используется гиалуроновая кислота (ГК) – полисахарид, молекула которого состоит из множества одинаковых небольших фрагментов (простых сахаридов), соединенных в цепочку. Свойства ГК зависят от концентрации и молекулярной массы (высокомолекулярная ГК – молекулы >300 кДа, низкомолекулярная – <300 кДа). Увеличение концентрации ГК вызывает затуманивание зрения и не совместимо с контактными линзами, что ограничивает применение. Увеличение молекулярной массы ГК улучшает репарацию клеток и оказывает большее противовоспалительное действие. Окутиарз («Сантен») содержит ГК высокой молекулярной массы; ускоряет заживление ран; стимулирует деление клеток; восстанавливает гидратацию тканей; уменьшает выраженность зуда и жжения более чем в 2 раза.
Опыт применения препаратов для лечения БСГ показал, что идеальный препарат искусственной слезы должен быть изотоничным слезной жидкости, иметь идентичный электролитный состав, изготавливаться без консервантов или содержать современные, менее токсичные консерванты, которые позволяют улучшать переносимость глазных капель. На сегодняшний день более 50% глазных капель для лечения БСГ в целях предотвращения роста патогенной микрофлоры производятся с применением консервантов. Остальные глазные капли данной фармакологической группы изготавливаются без консервантов, в некоторых случаях в виде монодоз.
 В предотвращении испарения слезы важную роль играет липидный слой, для восстановления которого применяются микроэмульсии липидов (размер частиц <10 нм), не вызывающие затуманивания зрения.
В предотвращении испарения слезы важную роль играет липидный слой, для восстановления которого применяются микроэмульсии липидов (размер частиц <10 нм), не вызывающие затуманивания зрения.
Катионорм («Сантен») является бесконсервантной катионной эмульсией типа «масло в воде», предназначенной для лечения БСГ. Катионорм имеет уровень pH примерно 7 и очень низкую вязкость, т. е. хорошо переносится и не затуманивает зрение. Кроме того, он гипотоничен и не содержит консервантов. Катионорм восстанавливает стабильность слезной пленки более выраженно по сравнению с 0,5% карбоксиметилцеллюлозой (Abelson M. et al., 2002). Катионорм также превышает сочетание поливинилового спирта с повидоном в снижении индекса патологии глазной поверхности (OSDI), представляющего собой совокупную выраженность симптомов (раздражение, жжение, сухость глаз, зуд, боль в глазах, чувство инородного тела / песка за веками, светобоязнь) в баллах.
Удержание слезы при помощи очков с увлажняющими камерами рекомендуется при БСГ 2 уровня тяжести и выше. Очки увеличивают влажность в периокулярном пространстве и обеспечивают более длительные интервалы между миганиями и более короткие по времени мигания. Однако клинических данных по подобным устройствам мало.
Поскольку ССГ является хроническим заболеванием, требующим длительного лечения, эффект которого может развиваться постепенно, ключом к лечению БСГ является обучение пациента. Рекомендации по лечению ССГ основаны на степени тяжести заболевания. Лечение направлено на восстановление гомеостаза слезной пленки. Заменители слезы, осмопротекторы, задержка оттока слезы или усиление ее секреции могут быть использованы для облегчения симптомов или лечения лежащих в основе БСГ причин. Предпочтение следует отдавать бесконсервантным формам.
В рамках конференции также состоялось совещание экспертов УГО «Рациональный подход в индивидуализации терапии глаукомы в фокусе сохранения зрительной функции», в котором приняли активное участие член-корреспондент НАМН Украины, доктор медицинских наук, профессор З. Ф. Веселовская, доктор медицинских наук, профессор П. А. Бездетко, доктор медицинских наук, профессор И. Н. Безкоровайная, доктор медицинских наук, профессор Н. Н. Веселовская, кандидат медицинских наук, доцент И. Б. Жеребко, доктор медицинских наук, профессор Н. Г. Завгородняя, кандидат медицинских наук, доцент М. А. Карлийчук, доктор медицинских наук, профессор Н. С. Луценко, доктор медицинских наук, профессор О. В. Недзвецкая, доктор медицинских наук, профессор И. Я. Новицкий, доктор медицинских наук, профессор А. А. Путиенко, доктор медицинских наук, профессор С. А. Рыков, доктор медицинских наук, профессор В. Н. Сердюк, доктор медицинских наук, профессор И. В. Шаргородская, главный врач Днепропетровской областной клинической офтальмологической больницы С. Б. Устименко.
Во вступительном докладе профессор З. Ф. Веселовская подчеркнула, что, к сожалению, в Украине не существует Национального реестра больных глаукомой, однако, по приблизительным оценкам, в нашей стране насчитывается около 300 тыс. пациентов с этим заболеванием, что обуславливает большую важность данной проблемы. В процессе дискуссии экспертов рабочей группы профессор Веселовская также сделала акцент на необходимости 24-часового контроля ВГД при назначении медикаментозного лечения. При дифференцированном выборе препаратов для лечения впервые выявленного заболевания нужно индивидуально подходить к известным анамнестическим данным, цифрам ВГД, общему состоянию органа зрения. Нужно помнить, что потеря ганглиозных клеток, то есть повреждение зрительного нерва, больше всего происходит именно в начале заболевания. Даже при назначении монотерапии при неудовлетворительном снижении ВГД в течение двух лет необходимо принимать решение о назначении ФК.
 В обзорном докладе заведующий кафедрой офтальмологии Харьковского национального медицинского университета, доктор медицинских наук, профессор П. А. Бездетко осветил актуальные вопросы современного назначения различных классов антиглаукомных препаратов.
В обзорном докладе заведующий кафедрой офтальмологии Харьковского национального медицинского университета, доктор медицинских наук, профессор П. А. Бездетко осветил актуальные вопросы современного назначения различных классов антиглаукомных препаратов.
Глаукома определяется как многофакторное, прогрессирующее нейродегенеративное расстройство, которое характеризуется приобретенной гибелью клеток сетчатки, потерей их аксонов, атрофией зрительного нерва и потерей нейронов по ходу зрительно-нервного пути. Хотя на сегодняшний день повышенное ВГД является только частью определения глаукомы, оно остается самым легко изменяемым и управляемым фактором риска, контроль которого направлен на предотвращение слепоты. Соблюдение рекомендованных показателей офтальмотонуса для каждой конкретной стадии глаукомы с учетом дополнительных факторов риска является эффективным механизмом сдерживания прогрессирования заболевания.
Согласно исследованию EMGT, на каждый 1 мм рт. ст. падения ВГД приходится 10% снижение риска прогрессирования глаукомы. Австралийское исследование Blue Mountain продемонстрировало, что у лиц с ВГД >21 мм рт. ст. в 4,7 раза выше вероятность развития глаукомы, чем у пациентов с нормальным давлением. Повышение ВГД на 1 мм рт. ст. приводит к 10%-му увеличению риска прогрессирования глаукомы (Heijl A. et al., 2002; Leske C. et al., 2003). Только половина оперированных пациентов (50,74%) при сроке наблюдения 2,97±3,93 лет не нуждаются в антиглаукомной гипотензивной терапии.
В настоящее время около 10-15% больных глаукомой, даже при адекватном лечении, обречены на слепоту. Так, недавняя серия крупных многоцентровых рандомизированных клинических исследований представила информацию о том, что достижение целевого ВГД не является синонимом стабилизации прогрессирования глаукомы. Проведенный ретроспективный анализ установил, что за 4,5 г 25,97% пациентов перешли из группы с начальной стадией болезни в группу с развитой стадией заболевания, а еще у 7,36% стала диагностироваться далеко зашедшая глаукома.
Хотя снижение ВГД остается основным наиболее доказанным методом противоглаукомной терапии, такое лечение часто является лишь частично эффективным. Для более действенного решения этой проблемы требуется парадигма дополнительного нейропротективного лечения. По мнению S. V. Kulkarni и соавт. (2008), характеристики желаемого эффективного лечения глаукомы должны включать доказанную эффективность круглосуточного снижения ВГД до уровня, достаточного для защиты зрительного нерва и зрительных функций от дальнейшего повреждения; минимальные местные и системные побочные эффекты; отсутствие тахифилаксии и хорошую переносимость при длительном применении; минимальную дозировку для обеспечения комплаенса; наличие нейропротективных свойств; применимость в различных популяциях пациентов и при различных формах глаукомы.
 Местное введение офтальмологических препаратов является наиболее удобным способом введения для лечения глазных заболеваний. Тем не менее биодоступность препаратов после инстилляций глазных капель является очень низкой. Самым простым объяснением служит то обстоятельство, что глазные капли быстро стекают по глазной поверхности и, следовательно, время эффективного контакта препарата с тканями глаза значительно снижается. Имеются данные, что в течение двух минут после закапывания более 80% лекарства выводится через носослезную дренажную систему.
Местное введение офтальмологических препаратов является наиболее удобным способом введения для лечения глазных заболеваний. Тем не менее биодоступность препаратов после инстилляций глазных капель является очень низкой. Самым простым объяснением служит то обстоятельство, что глазные капли быстро стекают по глазной поверхности и, следовательно, время эффективного контакта препарата с тканями глаза значительно снижается. Имеются данные, что в течение двух минут после закапывания более 80% лекарства выводится через носослезную дренажную систему.
В результате чего биодоступность лекарственного препарата очень низкая и составляет всего 1-5%.
ПОУГ представляет собой хроническую оптическую нейропатию, часто требующую пожизненного лечения. Согласие пациентов, приверженность и настойчивость при терапии играют жизненно важную роль в улучшении результатов. В литературе, посвященной этой проблеме у больных глаукомой, указано, что до 80% пациентов с глаукомой не соблюдают режим дозирования препаратов, предписанный врачом. По данным S. C. Patel и G. L. Spaeth (1995), при назначении 1 препарата предписаний врача придерживаются 49% пациентов, а при назначении 2 средств – только 32%.
Препараты первого ряда, влияющие на уровень ВГД, можно разделить на следующие группы: вещества, уменьшающие выработку внутриглазной жидкости (ВГЖ) (симпатомиметики (α-агонисты), БАБ, в т. ч. селективные, ИКА) и вещества, стимулирующие увеосклеральный отток (АПГ, α-агонисты).
БАБ снижают выработку камерной влаги; выпускаются в виде 0,25 и 0,5% растворов; длительность их действия составляет 12 ч; назначаются 2 р/сут. Местные реакции на введение БАБ включают дискомфорт, жжение и зуд в глазах, сухость, гиперемию. Со стороны сердечно-сосудистой системы возможны сердечная недостаточность, брадикардия, значительное снижение частоты пульса, аритмия, артериальная гипотензия; со стороны дыхательной системы, органов грудной клетки и средостения – одышка, астматические приступы; со стороны нервной системы – головная боль, головокружение, слабость. БАБ сужают сосуды, в т. ч. и диска зрительного нерва. Согласно исследованию, средний возраст пациентов с глаукомой на момент диагностирования заболевания составляет 64,3 года. Сопутствующих заболеваний не было только у 30,9% человек; артериальная гипертензия разных стадий была диагностирована у 53,7% пациентов, артериальная гипотония – у 33,2%, сахарный диабет 2 типа – у 12,01%; состояние после острого нарушения мозгового кровообращения – у 4,5%, что обуславливает важность контроля риска развития побочных явлений БАБ.
Преимуществом применения БАБ у больных глаукомой является их низкая цена. На фармацевтическом рынке Украины представлен селективный β-блокатор бетаксолол. Терапевтический эффект бетаксолола развивается в течение 30 мин и достигает пика в течение 2 ч. При применении терапевтической дозы бетаксолола фармакологический эффект длится в течение 12 ч. При местном применении бетаксолол практически не оказывает влияния на размер зрачка, сердечно-сосудистую и дыхательную систему. Однако при продолжительном применении или применении высоких доз бетаксолола у пациентов возможно развитие уменьшения сердечного выброса. Относительно невыраженное гипотензивное действие и выраженные нейропротективные свойства бетаксолола предполагают широкие возможности применения препарата у больных с нормотензивной глаукомой и сосудистой офтальмопатологией.
Несмотря на противопоказания и профиль побочных явлений БАБ, тимолол является наиболее часто используемым препаратом для лечения глаукомы во всем мире благодаря его доступности, более низкой стоимости и длительному опыту применения (Kulkarni S. V. et al., 2008). Это подтверждает многоцентровое исследование Л. Д. Абашевой (2015): выбор БАБ превалировал как в монотерапии, так и при использовании комбинированных схем. Максимальная частота назначения БАБ (69,42-85,71%) отмечена в начале лечения глаукомы. Доля АПГ имела тенденцию к увеличению в зависимости от порядкового номера режима. Изначально их доля составляла 37,01% (по всей видимости, за счет монотерапии), но уже при первой смене лечения увеличилась до 58,74% и была стабильно высокой до самого конца наблюдения. Увеличивается также доля ИКА: с 14,32% на старте до 63,63% при смене режима.
Дорзоламид является высокоспецифичным неконкурентным и обратимым ингибитором карбоангидразы (КА)-II, основного изофермента в отростках цилиарного тела, который регулирует образование ВГЖ в задней камере глаза. Селективное ингибирование этого фермента блокирует образование бикарбонатных ионов, что ведет к уменьшению транспорта натрия через ресничный эпителий и, следовательно, подавлению продукции ВГЖ, уменьшая таким образом ВГД. На фоне монотерапии дорзоламидом офтальмотонус снижается примерно на 6,8±0,9 мм рт. ст., или 25% от исходного уровня. Побочное действие дорзоламида минимально: местные реакции – жжение, покалывание, зуд в глазах, слезотечение, затуманивание зрения, раздражение век, горечь во рту. Дорзоламид в 6,5 раза активнее, чем бринзоламид, и является единственным антиглаукомным препаратом, улучшающим кровоток в диске зрительного нерва и ретробульбарных сосудах. За счет этого полезным является применение дорзоламида при нормотензивной глаукоме, при большинстве видов вторичной глаукомы, в послеоперационном периоде после внутриглазных операций.
Наиболее мощными лекарственными препаратами для снижения ВГД у больных глаукомой на сегодняшний день являются АПГ. Реализация гипотензивного эффекта АПГ осуществляется за счет работы 2 путей оттока – трабекулярного и увеосклерального. Представитель АПГ тафлупрост является фторированным аналогом простагландина F2σ. Препарат тафлупроста Тафлотан («Сантен») представляет собой единственный из АПГ, доступный в бесконсервантной форме. Усиление увеосклерального оттока при использовании АПГ обусловлено взаимодействием со специфическими рецепторами, переходом неактивных матричных протеаз ресничной мышцы в активную форму, разрушением протеазами коллагеновых фибрилл внеклеточного матрикса, снижением толщины цилиарной мышцы и сопротивления оттоку водянистой влаги (Mishima H. K. et al., 1996). Примесь провоспалительных простагландинов Е1 и Е2 в препаратах этой группы ограничивает их применение у больных со вторичной глаукомой, при сочетанной патологии макулярной области, после внутриглазных операций.
Рациональная тактика ведения пациентов с глаукомой подразумевает соблюдение основных принципов лечения. Так, лечение, как правило, начинают с монотерапии глаукомы, а в случае отсутствия эффекта либо его недостаточного действия заменяют либо другим лекарственным средством, либо используют комбинацию препаратов. Для достижения более выраженного гипотензивного эффекта возможны 2 пути: использование 2, в исключительных случаях 3 препаратов, когда одно из назначаемых средств является комбинацией, а также применение ФК антиглаукомных препаратов (два активных ингредиента в одном флаконе). Согласно Рекомендации EGS (2014), не стоит одновременно назначать более двух видов глазных капель для снижения ВГД, поскольку это может ухудшить комплаенс.
Преимуществами ФК являются снижение кратности назначения капель и повышение гипотензивной эффективности за счет снижения воздействия консервантов, что улучшает переносимость препарата; устранения эффекта вымывания, связанного с недостаточным временным интервалом между несколькими инстилляциями; упрощения схемы лечения, которая способствует соблюдению режима лечения и в результате стабилизации ВГД. Наиболее частой ФК является сочетание БАБ и АПГ (например, Таптиком, «Сантен»). Популярность такой комбинации объясняется рядом естественных факторов: известно, что гипотензивный эффект тимолола в ночное время резко снижен из-за естественного уменьшения продукции ВГЖ (ведь именно ночью уровень эндогенных катехоламинов самый низкий, что существенно уменьшает эффективность БАБ). В свою очередь, простагландины действуют круглосуточно, понижая уровень ВГД за счет увеличения увеосклерального оттока, а кроме этого, добавление АПГ снижает риск развития побочных эффектов, свойственных БАБ, за счет естественного разбавления (Topper J. E., Brubaker R. F., 1985; Brubaker R. F., 1991; Mishima H. K. et al., 1997; Orzalesi N. et al., 2000).
Комбинация ИКА и БАБ (Косопт, Сантен) содержит дорзоламид 20 мг/мл и тимолол 5 мг/мл. Каждый из компонентов понижает внутриглазное давление посредством уменьшения секреции ВГЖ. Дорзоламид снижает секрецию ВГЖ, не вызывая спазм аккомодации, миоз, гемералопию. Тимолол является неселективным БАБ, при местном применении понижающим ВГД за счет уменьшения образования водянистой влаги и небольшого увеличения ее оттока. Косопт закапывают по 1 капле в конъюнктивальный мешок 2 р/сут.
ФКДТ понижает офтальмотонус в среднем на 33% от базового, а максимальное уменьшение уровня ВГД достигает 45%. Снижение ВГД начинается через 1 ч после однократной инстилляции, достигает максимума через 4-6 ч и сохраняется в течение 24 ч. Подтверждена эффективность ФКДТ (Косопт) для снижения офтальмотонуса у пациентов с исходно высоким уровнем ВГД. Так, J. D. Henderer и соавт. (2005) указали, что при исходном уровне 37,5±1,0 мм рт. ст. через 60 сут терапии ФКДТ ВГД снизилось до 21,1±0,9 мм рт. ст., т. е. более чем на 40%. B. Pajic (2003) обнаружил, что назначение ФКДТ пациентам с впервые выявленной глаукомой позволило снизить офтальмотонус на 12,5 мм рт. ст. (38%). Этот же автор установил, что в случаях, если пациенты (n=891) предварительно получали монотерапию БАБ или даже комбинированное лечение другими препаратами, дополнительное достоверное снижение уровня ВГД составило 5,6 и 3,4 мм рт. ст. соответственно. В исследовании Н. И. Курышевой и соавт. (2013) ФКДТ (Косопт) продемонстрировал наивысшую антиоксидантную активность, превосходившую показатель других ФК.
ФК не являются лекарствами первой линии, они показаны только пациентам, которые нуждаются в дополнительной терапии из-за невозможности достичь эффективного контроля ВГД с помощью монотерапии. Известно однако, что наиболее масштабные потери ганглиозных клеток сетчатки в процессе прогрессирования глаукомы происходят именно в начальной стадии. В связи с этим возникают вопросы, возможно ли применение ФК при стартовой терапии глаукомы? Возможно, если есть необходимость снижения ВГД более чем на 30% или уверенного, гарантированного и длительного снижения ВГД у больных с ограниченными возможностями наблюдения за ними и регулярного контроля ВГД. Возможно ли сочетание ФК с монопрепаратами? Без нарушения принципов комплаенса возможно применение не более 2 препаратов и поэтому допустимы сочетания ФК + монопрепарат с дополнительным механизмом гипотензивного действия или прием двух ФК с дополняющими друг друга механизмами гипотензивного действия. Профессор Бездетко добавил, что глазные капли генериков могут отличаться от брендовых (оригинальных) капель, поэтому необходимо тщательно мониторировать таких пациентов в плане контроля ВГД и полей зрения.
Профессор В. Н. Сердюк обратил внимание коллег, что необходимо интенсифицировать научный обмен между УГО и Европейским обществом глаукомы. Что касается выбора терапии, он должен быть сугубо индивидуальным и дифференцированным. Важно, что назначение недорогих генериков в ущерб эффективности, возможно, не является хорошей терапевтической стратегией.
Профессор С. А. Рыков отметил, что существующие приказы по лечению глаукомы необходимо пересматривать каждые три года. Поскольку документы Министерства здравоохранения носят обобщающий характер, более детально менеджмент заболевания должен быть отображен в рекомендациях УГО. Кроме того, на основе всех этих документов должна быть создана государственная программа по поддержке и лечению пациентов с глаукомой.
Профессор О. В. Недзведская высказала предложение, что по аналогии с флюорографией необходимо инициировать внедрение ежегодного прохождения измерения ВГД один раз в год лицами, достигшими 40-45 лет.
По мнению профессора И. Я. Новицкого, тяжело охватить все направления в формировании новых подходов в лечении и диагностике глаукомы, поэтому УГО должно распределить между своими членами определенные участки работы. Особенно важными являются взаимодействие с государственными органами и населением страны, научное сотрудничество с профильными обществами других стран и т. д.
По окончании заседания был принят Меморандум. Ниже приводим его текст в сокращенном виде.
МЕМОРАНДУМ
Рабочего совещания экспертов УГО «Рациональный подход в индивидуализации терапии глаукомы в фокусе сохранения зрительной функции»
Цель: оптимизировать поточную практику обеспечения медицинской помощи пациентам с глаукомой путем организации научной дискуссии, опирающейся на действующие украинские рекомендации, глобальные и собственные клинические данные.
Краткий анализ ситуации
Хорошо известно, что за последние годы в Украине сформировались тенденции к ухудшению офтальмологического здоровья, в частности возрастает распространенность глаукомы. Во многих странах мира в связи с увеличением ожидаемой продолжительности жизни глаукома занимает 1-е место среди причин слепоты и инвалидности по классу болезней органа зрения и его придаточного аппарата среди взрослых. Следует подчеркнуть, что за последние годы болезнь молодеет и все чаще поражает пациентов в возрасте уже от 35 лет.
Эпидемиологических скрининговых исследований, изучения качества жизни пациентов с диагнозом глаукома, различных социально-гигиенических аспектов глаукомы, которые могли бы стать основой для разработки региональных программ по профилактике и своевременному выявлению глаукомы среди взрослого населения Украины, абсолютно недостаточно, что подчеркивает актуальность разработок разнообразных опросников. Нет единого реестра больных с глаукомой. Не определена ситуация с алгоритмами диагностики и лечения на региональном уровне, в частности в связи с отсутствием общенационального алгоритма, не определены приоритеты выбора лекарственных средств.
Важным является осознание практикующими врачами парадигмы, что целью лечения глаукомы является сохранение зрительной функции пациента и относительного качества его жизни (European Glaucoma Society (EGS), 2014). Т. е. не просто снижение ВГД, которое выявляется при его измерении при повторных осмотрах. И с этой целью следует назначать препараты с 24-часовым стабилизирующим действием на ВГД и дополнительными патогенетически обусловленными влияниями. Персонализированное лечение глаукомы обеспечивает ведение соответственно с индивидуальными потребностями пациента: больные с тяжелыми функциональными нарушениями либо молодые индивиды с выраженными проявлениями болезни требуют более интенсивного лечения и более тщательного наблюдения, чем пациенты с невысоким риском или вообще без него (например, пациенты с офтальмогипертензией или люди пожилого возраста с незначительными изменениями поля зрения и низким уровнем ВГД). Своевременный выбор индивидуально направленной терапии тем или иным препаратом у конкретного больного и, в частности, фиксированными комбинациями, недостаточно четко очерчен в существующих регламентирующих документах. Перечисленные выше практические аспекты требуют освещения в следующей редакции общеукраинских рекомендаций по глаукоме, учитывающих мировой опыт и стандарты, на основе которых прикладные аспекты будут осуществляться на региональном уровне.
В разработке этих рекомендаций необходимо опираться на некоторые рекомендации EGS (2014):
- При оценке эффективности терапии необходимо учитывать исходный уровень ВГД.
- Если назначенная пациенту монотерапия не обеспечивает достижения индивидуального целевого уровня ВГД, рассматривается назначение фиксированных комбинаций, в частности ИКА/БАБ, АПГ/БАБ и т. п.
- Не рекомендуется одновременно назначать более двух видов глазных капель для снижения ВГД, поскольку это может ухудшить комплаенс.
- В использовании ФК являются более удобными, чем инстилляция двух средств по отдельности.
- Вместе с тем ФК не являются лекарствами первой линии, они показаны лишь пациентам, требующим дополнительной терапии в связи с невозможностью достичь эффективного контроля ВГД при помощи монотерапии.
- Генерики могут отличаться от патентованных капель, поэтому после переведения пациента на генерики первое время необходимо тщательное наблюдение.
- Обязательным условием эффективного снижения ВГД и предупреждения прогрессирования глаукомы является участие пациента в лечебном процессе, что характеризуется комплаенсом и приверженностью к назначенному терапевтическому сопровождению глаукомы. Лекарства не лечат, если их не принимать.
При дальнейшем недостижении эффекта (ухудшение поля зрения, прогрессирование оптической нейропатии, снижение остроты зрения, ухудшение показателей тонографии) рекомендован контроль исполнения пациентом рекомендаций врача, проведение других видов лечения.
Практикующий врач должен помнить, что существуют доказательства возможности сохранения зрительных функций (остроты зрения, полей зрения) и уровня ВГД в границах нормы, отсутствия прогрессирования атрофии зрительного нерва на протяжении длительного времени при постоянном наблюдении за состоянием пациента и своевременной коррекции лечения.
Постановление
1. Признать, что более важным заданием эффективного ведения пациентов с глаукомой является не только терапия офтальмогипертензии, а своевременное выявление и лечение пациентов с риском значительной потери зрительной функции. Крайне необходимым является создание Национального реестра больных глаукомой.
2. Признать, что современная концепция рекомендаций – лечение должно быть направлено лишь на поддержку ВГД в границах диапазона среднестатистической нормы – на данный момент утратила актуальность.
3. Способствовать пересмотру нормативных документов Министерства здравоохранения Украины, регламентирующих ведение больных с глаукомой в разделе выбора топических, в частности комбинированных, лекарственных средств.
4. Признать необходимость пересмотра подходов к назначению препаратов с большей индивидуализацией, в т. ч. ФК, в соответствии с клиническими рекомендациями, которые должны быть созданы с учетом наиболее информативных положений рекомендаций EGS (2014), в частности с учетом 24-часового контроля ВГД и влияния на отличные от ВГД патогенетические факторы развития глаукомы.
Подготовила Лариса Стрильчук
Медична газета «Здоров’я України 21 сторіччя» № 8 (429), квітень 2018 р.


