8 червня, 2018
Хронический атрофический гастрит: современные представления и реальные возможности лечения больных
 Хронический атрофический гастрит (ХАГ) – мультифакторное заболевание, которое характеризуется прогрессирующим развитием атрофических изменений слизистой оболочки желудка (СОЖ) с уменьшением количества желез. ХАГ представляет собой предраковое состояние, наличие которого значимо повышает риск последующего развития у пациента рака желудка (РЖ). Согласно действующей Сиднейской системе классификации гастрита (Sydney System Classification, впервые предложена в 1990 г., обновлена в 1994 г.), ставшей первой с момента открытия в 1982 г. Helicobacter pylori (H. pylori) подробной классификационной системой данного заболевания, выделяют 2 основные формы ХАГ: мультифокальный атрофический гастрит и аутоиммунный атрофический гастрит.
Хронический атрофический гастрит (ХАГ) – мультифакторное заболевание, которое характеризуется прогрессирующим развитием атрофических изменений слизистой оболочки желудка (СОЖ) с уменьшением количества желез. ХАГ представляет собой предраковое состояние, наличие которого значимо повышает риск последующего развития у пациента рака желудка (РЖ). Согласно действующей Сиднейской системе классификации гастрита (Sydney System Classification, впервые предложена в 1990 г., обновлена в 1994 г.), ставшей первой с момента открытия в 1982 г. Helicobacter pylori (H. pylori) подробной классификационной системой данного заболевания, выделяют 2 основные формы ХАГ: мультифокальный атрофический гастрит и аутоиммунный атрофический гастрит.
Считается, что аутоиммунный атрофический гастрит обусловлен образованием аутоантител к париетальным клеткам и поражает преимущественно тело желудка, а развитие мультифокального атрофического гастрита ассоциировано с H. pylori, вредным воздействием различных экзогенных факторов и особенностями питания. Установлено, что ключевой и универсальной гистологической характеристикой обеих указанных форм ХАГ является метаплазия СОЖ. Поэтому в настоящее время для их обозначения рекомендуется использовать общий термин «метапластический»: аутоиммунный метапластический атрофический гастрит и экзогенный мультифокальный метапластический атрофический гастрит.
Именно метаплазия (преимущественно кишечная), выявляемая в биоптатах СОЖ, взятых у пациентов с ХАГ, высокорелевантна в плане как патогенеза этого заболевания, так и его осложнений (таких как пернициозная анемия, дисплазия и РЖ). Последовательность событий, с течением времени приводящих к развитию аденокарциномы желудка (нормальная слизистая оболочка → атрофический гастрит → кишечная метаплазия (КМ) → дисплазия → аденокарцинома кишечного типа), была описана P. Correa еще в 1988 г. и хорошо известна как каскад Корреа.
Учитывая значение ХАГ как предракового состояния, становится очевидным, почему с момента установления этого факта и до настоящего времени не ослабевает интерес, проявляемый учеными и клиницистами к возможностям профилактики и лечения данного заболевания. Так, в ходе проведенного Y.S. Park и соавт. в 2008 г. многоцентрового проспективного клинического исследования с участием 389 человек была предпринята попытка установить факторы риска развития ХАГ и КМ. Анализ полученных результатов убедительно подтвердил, что наиболее важными общими факторами риска развития ХАГ и КМ выступают инфекция H. pylori и возраст (≥61 года).
Важнейшими факторами риска развития ХАГ оказалась вирулентность H. pylori (положительный результат анализа на наличие антигенов СagA и VacA), а также локализация H. pylori в антруме и теле желудка. В развитии КМ, помимо инфицирования H. pylori и пожилого возраста, значимую роль играло употребление очень острой пищи, курение в анамнезе, а также повышение уровня провоспалительных факторов, в частности интерлейкина (IL)-10-592. Примечательно, что IL6-572 G, напротив, характеризовался протективными свойствами в плане развития КМ.
Особенности патогенеза ХАГ и прогнозирование канцерогенеза
С позиций патогенеза выделяют 2 основных пути формирования атрофии СОЖ:
1) непосредственная деструкция железистого аппарата желудка или деструкция на фоне хронического воспаления;
2) избирательная деструкция специализированных эпителиоцитов в условиях сохранения стволовых клеток, триггерами которой выступают инфекция H. pylori, аутоиммунные реакции, химические и медикаментозные воздействия (в том числе желчные кислоты – ЖК, нестероидные противовоспалительные препараты – НПВП) и др.
В последнее время все большее значение придается синергичному воздействию различных факторов, способных повреждать СОЖ, и в первую очередь – сочетанному пагубному воздействию на нее H. pylori и ЖК.
Так, под воздействием бактериальной фосфолипазы H. pylori ослабевают гидрофобные защитные свойства желудочной слизи и уменьшается толщина слизистого слоя, что облегчает реализацию прямого повреждающего действия на слизистую оболочку ЖК и других химических факторов. При этом повреждающий эффект ЖК зависит от их концентрации, конъюгации и значения интрагастрального рН: в кислой среде СОЖ активно повреждают тауриновые конъюгаты ЖК, в нейтральной и слабощелочной – неконъюгированные ЖК. Кроме того, при наличии в желудке желчи усиливается агрессивность таких «классических» повреждающих агентов, как НПВП, ацетилсалициловая кислота и факторы патогенности H. pylori.
Что же касается риска канцерогенеза, то к сожалению, Сиднейская система классификации гастритов и гастропатий, несмотря на широкое использование в клинической практике, не дает возможности его прогнозировать. В этом контексте существенным шагом вперед стало появление в 2008 г. классификационной шкалы OLGA (Operative Link for Gastritis Assessment), учитывающей степень атрофических изменений СОЖ (от отсутствия до тяжелой атрофии), их локализацию (антрум, тело желудка) и на основании этого выделяющей гистологические фенотипы для прогнозирования низкого либо высокого риска канцерогенеза.
Профилактические и терапевтические стратегии
Ключевая цель профилактики и лечения ХАГ и КМ – снижение распространенности РЖ в популяции. Поскольку доказано, что ключевым этиопатогенетическим фактором развития данных предраковых состояний выступает инфекция H. pylori, ни у кого не вызывает сомнений, что основной стратегией профилактики РЖ должна быть ее эрадикация. Вместе с тем комплексный подход к ведению пациентов с ХАГ и КМ предусматривает также выявление и коррекцию других вышеупомянутых триггеров и факторов риска (C.A.Gonzales, A. Agudo et al., 2012).
Результаты некоторых исследований свидетельствуют о том, что эрадикация H. pylori до формирования КМ может быть эффективна в снижении риска развития РЖ (J.G. Fox, T.C. Wang, 2001), однако вопрос о том, насколько она способна повлиять на естественное течение уже имеющейся КМ, остается открытым. Результаты длительного (6-7 лет) наблюдения за пациентами с ХАГ тела желудка и КМ (n=179/106 соответственно; E. Lahner et al., 2005) показали, что в течение этого периода атрофия слизистой оболочки тела желудка и КМ продолжали персистировать независимо от наличия инфекции H. pylori.
При этом у 8% пациентов развились неопластические изменения (Р <0,0001). В более поздних исследованиях (2010) было установлено, что через год после эрадикации H. pylori восстановление СОЖ было достигнуто лишь у 13,3% пролеченных пациентов, частичное регрессирование воспалительных изменений – у 58,6%. При этом у 28,2% пациентов сохранялось исходное воспаление – этот факт авторы связали с повышенной активностью ферментов циклоокисгеназы (ЦОГ) и индуцируемой синтазы оксида азота.
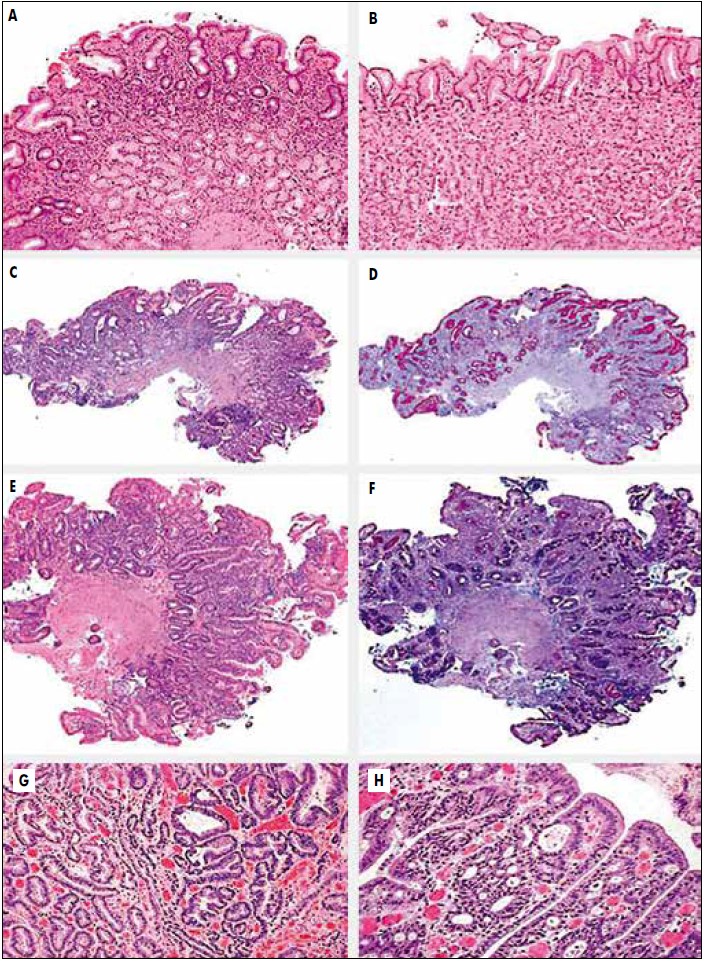
Рис. 1. Морфологические изменения СОЖ в процессе канцерогенеза (M. Dinis-Ribeiro et al., 2012)
A, B – неатрофический гастрит без атрофии желез и/или КМ: (A) антрального отдела (окрашивание гематоксилином и эозином ×40); (B) тела желудка (окрашивание гематоксилином и эозином, ×100). C, D – умеренная атрофия глубоких антральных желез (уменьшение количества желез на 30-60%) без КМ: (C) окрашивание гематоксилином и эозином, ×40; (D) реактив Шиффа – окрашивание альциановым синим (×40), выявляющее утрату желез и наличие единичного фокуса КМ в поверхностной части СОЖ. E, F – тяжелая атрофия слизистой оболочки антрального отдела желудка с утратой более чем 60% изначального количества секретирующих слизь желез, замещенных КМ: (E) окрашивание гематоксилином и эозином, ×40; (F) реактив Шиффа – окрашивание альциановым синим, ×40. G, H – дисплазия и внутрислизистая карцинома: (G) низкая степень дисплазии слева и высокая – справа (окрашивание гематоксилином и эозином, ×100); (H) внутрислизистая карцинома (окрашивание гематоксилином и эозином, ×200).
В 2012 г. в журнале Endoscopy M. Dinis-Ribeiro и соавт. были опубликованы Рекомендации по ведению предраковых состояний и повреждений слизистой оболочки желудка (MAPS), разработанные экспертами Европейского общества гастроинтестинальной эндоскопии (ESGE), Европейской группы по изучению H. pylori (EHSG), Европейского общества патологии (ESP) и Португальского общества эндоскопических исследований желудочно-кишечного тракта (SPED).
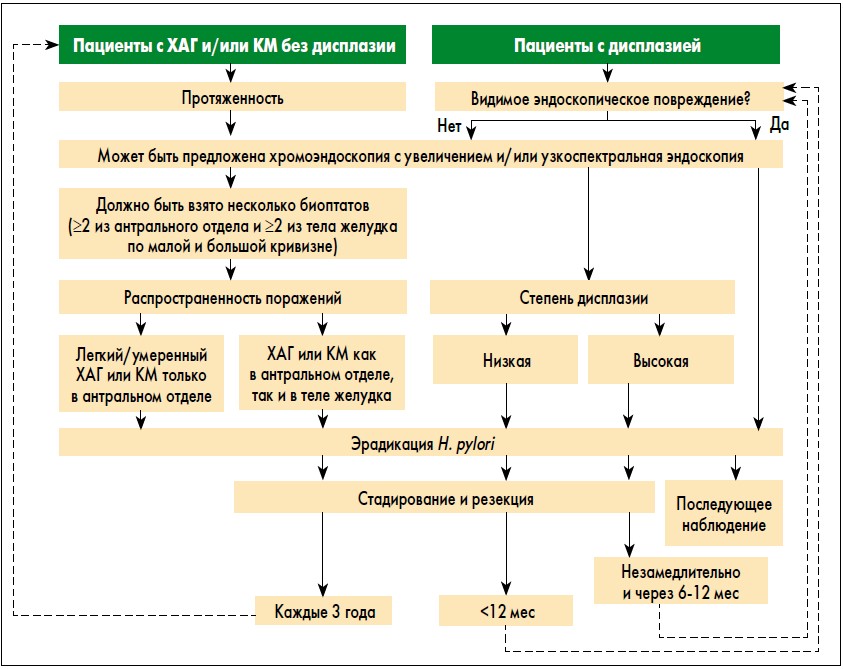
В этом документе подчеркивается, что ХАГ, КМ и дисплазия желудочного эпителия (рис. 1) отмечаются достаточно часто и несомненно ассоциированы с повышенным риском РЖ. Поэтому в случае их выявления необходимо адекватное установление точной стадии патологического процесса, а также динамическое клинико-лабораторно-инструментальное наблюдение за пациентами в соответствии с предложенным экспертами алгоритмом (рис. 2).
Рис. 2. Алгоритм ведения пациентов с предраковыми состояниями и повреждениями слизистой оболочки желудка (MAPS)
В соответствии с данными рекомендациями эрадикация H. pylori способствует излечению хронического неатрофического гастрита и может приводить к частичному регрессированию ХАГ (уровень доказательности I+, класс рекомендации В). Как указывается в рекомендациях, хотя эрадикация H. pylori у пациентов с КМ и не вызывает ее обратного развития, она может замедлять прогрессирование неоплазии и следовательно все равно настоятельно рекомендуется (уровень доказательности I+, класс рекомендации В). Эрадикация H. pylori также показана пациентам с предшествующей неоплазией после эндоскопического либо хирургического лечения (уровень доказательности I++, класс рекомендации А).
В данных рекомендациях также освещены дополнительные меры, которые могут быть использованы в ведении пациентов с предраковыми состояниями желудка. Так, по мнению экспертов, в настоящее время пока не может быть утверждено применение ингибиторов ЦОГ‑2 с целью снижения риска прогрессирования предраковых изменений СОЖ (уровень доказательности I+, класс рекомендации В). На момент принятия рекомендаций экспертами также не поддерживалось использование диетических добавок на основе антиоксидантов (аскорбиновая кислота и бета-каротин) в качестве средств для уменьшения распространенности атрофии и КМ (уровень доказательности I+, класс рекомендации В).
Вместе с тем контроль других факторов риска, не связанных с инфекцией H. pylori, рассматривается в качестве перспективного и активно изучающегося подхода, который в будущем способен повлиять на кумулятивную частоту развития РЖ. С этой целью продолжаются исследования потенциального профилактического эффекта адекватного потребления свежих овощей и фруктов. Следует отметить, что положительное антиоксидантное влияние витамина С, фолиевой кислоты и бета-каротина уже было установлено в некоторых ранее проведенных исследованиях (P. Correa, E.T. Fantham et al., 2000), хотя и не подтверждено в выполненных к настоящему времени метаанализах. Высказывается предположение, что дополнительные преимущества пациентам с ХАГ и КМ может принести подход, включающий сочетание эрадикации H. pylori с соблюдением определенных диетологических рекомендаций и употреблением пищевых добавок (G. Bjelakovic, D. Nikolova et al., 2004).
Особого внимания заслуживает возможность применения у пациентов с ХАГ мукоцитопротекторов – препаратов, способных уменьшать либо устранять повреждения слизистой оболочки гастродуоденальной зоны, вызванные различными воздействиями. В качестве оптимальных мукоцитопротекторов для пациентов с ХАГ в настоящее время могут рассматриваться висмута субцитрат коллоидный и урсодезоксихолевая кислота (УДХК, Урсохол®).
Висмута субцитрат коллоидный обладает антибактериальным действием, повышает эффективность эрадикации, обеспечивает противовоспалительный эффект, частично связывает ЖК, проявляет антиоксидантное действие, что способствует уменьшению экспрессии онкогенов (А.В. Яковенко и соавт., 2006; А.В. Кононов и соавт., 2011; В.Т. Ивашкин и соавт., 2014). Назначение УДХК (Урсохол®) обеспечивает влияние на одну из основных не связанных с H. pylori причин, поддерживающих хроническое воспаление в СОЖ, – агрессивное воздействие ЖК, что особенно актуально у пациентов с дуоденогастральным рефлюксом и рефлюкс-гастритом. УДХК вытесняет токсичные ЖК, делая рефлюктат менее агрессивным, и встраивается в фосфолипидный слой мембран, повышая его устойчивость к повреждающим факторам. Терапия УДХК предотвращает индуцированный гидрофобными ЖК апоптоз, снижает литогенность желчи и обеспечивает улучшение ее эвакуации из желчного пузыря.
Учитывая длительность курсов приема УДХК, немаловажное значение для пациентов приобретает стоимость препарата, которая, безусловно, не должна становиться препятствием для эффективного и современного лечения. В клинической практике хорошо зарекомендовал себя отечественный препарат УДХК Урсохол® (ЧАО «Фармацевтическая фирма «Дарница»), выпускаемый в форме капсул по 250 мг и имеющий наиболее доступную (в сравнении с зарубежными препаратами УДХК) стоимость.
Применение препарата Урсохол® в комплексной терапии у пациентов с ХАГ/КМ после эрадикации H. pylori дает возможность на практике реализовать индивидуальный подход к коррекции ключевых факторов риска, способствующих поддержанию хронического воспаления в СОЖ и повышению риска малигнизации, а именно – нивелировать агрессивное воздействие ЖК и обеспечить мукоцитопротекцию.
Список литературы находится в редакции.