11 червня, 2018
Профилактика и лечение синдрома гиперстимуляции яичников среднетяжелой и тяжелой степени

Обзор рекомендаций Практического комитета Американского общества репродуктивной медицины 2016
Синдром гиперстимуляции яичников (СГЯ) – это редкое, но весьма серьезное ятрогенное осложнение, в основе которого лежит гиперергический неконтролируемый ответ яичников на введение гонадотропинов в циклах стимуляции овуляции и программах вспомогательных репродуктивных технологий (ВРТ). При развитии СГЯ, создающего угрозу жизни женщины, показан комплекс лечебных мероприятий, осуществлять которые необходимо оперативно и с минимальными ошибками. Кроме того, следует учитывать, что наиболее тяжелые формы синдрома возникают на фоне наступившей беременности.
Предлагаем вашему вниманию обзор рекомендаций Практического комитета Американского общества репродуктивной медицины, в котором освещены факторы риска СГЯ, клинические и лабораторные его признаки, методы профилактики и лечения этой категории больных.
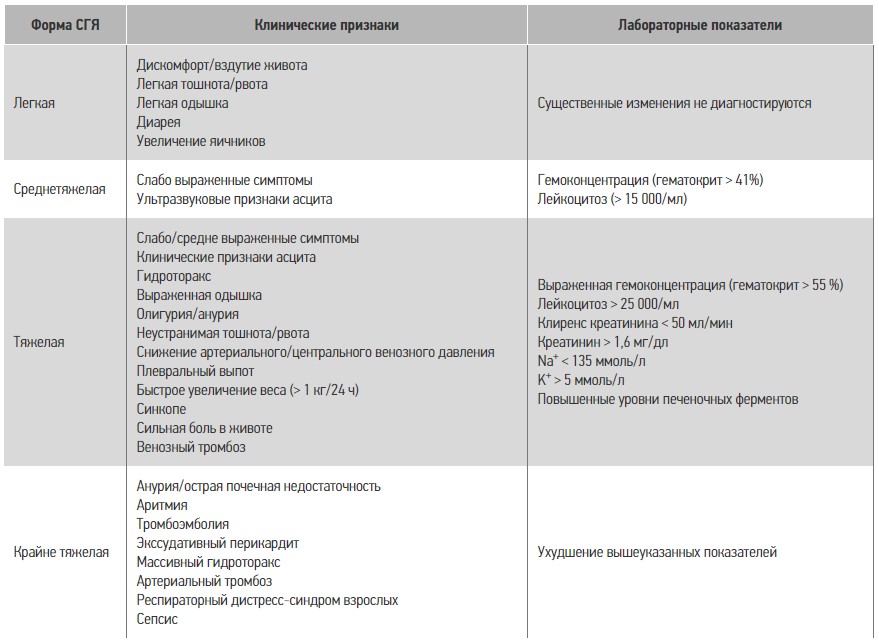
Известно, что среднетяжелая и тяжелая формы СГЯ диагностируются приблизительно в 1-5 % циклов. Однако истинную его частоту сложно установить ввиду отсутствия четкого консенсусного определения синдрома. Термином «синдром гиперстимуляции яичников» традиционно описывается целый спектр таких патологических изменений, как увеличение яичников, асцит, гемоконцентрация, гиперкоагуляция и электролитный дисбаланс. СГЯ классифицируют по степени тяжести симптомов (легкий, средней тяжести и тяжелый), а также по срокам их появления (ранний и поздний) (табл.). Тяжелая форма синдрома может привести к развитию плеврита, острой почечной недостаточности и венозной тромбоэмболии.
Таблица. Характеристика СГЯ по степени тяжести
Так как СГЯ является наиболее серьезным последствием контролируемой стимуляции яичников, врачу необходимо предпринять максимум усилий для идентификации пациенток, относящихся к группе повышенного риска. Понимание патофизиологии этого состояния может помочь в определении мер профилактики его развития и лечения сопутствующих симптомов. Классические физиологические изменения при СГЯ представлены вазодилатацией артериол и увеличением проницаемости капилляров, что приводит к переходу внутрисосудистой жидкости во внесосудистое пространство. Такое перераспределение жидкости в организме обусловливает возникновение гиповолемической гипонатриемии. В развитие и прогрессирование СГЯ вовлечены несколько факторов. В частности, сосудистый эндотелиальный фактор роста (СЭФР), участвующий в росте фолликулов, функционировании желтого тела, ангиогенезе, стимуляции пролиферации сосудистых эндотелиальных клеток, по всей видимости, имеет большое значение в возникновении СГЯ. Учеными установлено, что у лиц с гиперстимуляцией яичников отмечается повышение концентрации СЭФР в сыворотке крови. При этом его активность коррелирует с тяжестью клинических проявлений синдрома. Другие системные и местные вазоактивные вещества, в т.ч. интерлейкин 6, интерлейкин 1β, ангиотензин II, инсулиноподобный фактор роста 1, трансформирующий фактор роста β, а также компоненты ренин-ангиотензиновой системы также напрямую и косвенно задействованы в патогенезе СГЯ.
Если имплантация зародыша не произошла, это осложнение является самокупирующимся и, как правило, нивелируется с приходом очередной менструации, редко достигая тяжелой формы. У женщин, которым удалось забеременеть, нарастание уровня хорионического гонадотропина человека (ХГЧ) сопряжено с пролонгированием стимуляции яичников, в результате чего симптомы СГЯ могут персистировать до конца I триместра.
Специалистами Американского общества репродуктивной медицины был осуществлен систематический поиск литературы в электронной базе данных MEDLINE через службу PubMed для того, чтобы ответить на три вопроса относительно СГЯ: кто находится в группе высокого риска его развития, каковы методы профилактики и как правильно лечить эту группу пациенток? В результате были проанализированы 144 исследования, отвечавшие критериям включения, с использованием научных данных высокого качества (I, II-1 и II-2 уровней).
Категория лиц, подверженных высокому риску среднетяжелого и тяжелого СГЯ
СГЯ теоретически может развиться у любой женщины, подвергающейся процедуре контролируемой индукции овуляции гонадотропинами. Тем не менее, согласно доказательным данным, существует категория лиц, подверженных гораздо более высокому риску. Идентификация этих пациенток имеет важное значение для снижения частоты и потенциального устранения СГЯ.
Демографические характеристики
При оценке риска развития СГЯ следует учитывать такие характеристики со стороны пациенток, как возраст, индекс массы тела (ИМТ), расовая принадлежность, наличие установленного диагноза бесплодия и другие показания к применению ВРТ. Согласно результатам крупнейшего исследования по изучению факторов риска СГЯ (Luke B. et al., 2010), в котором использовались данные Общества вспомогательных репродуктивных технологий (SART), продемонстрировано, что среди 214 219 циклов ВРТ более молодой возраст, принадлежность к негроидной расе, наличие нарушений овуляции, трубного фактора и бесплодия неясного генеза ассоциировались с повышенным риском СГЯ. Это единственное исследование, в котором расовая принадлежность оценивалась в качестве предиктора СГЯ. В четырех ретроспективных (Luke B. et al., 2010; Johnson M. D. et al., 2014; Ashrafi M. et al., 2015; Sousa M. et al., 2015) и двух проспективных (Mathur R. S. et al., 2000; Aramwit P. et al., 2008) исследованиях авторы проанализировали влияние возраста на риск развития СГЯ и доказали, что молодые женщины более подвержены этому осложнению. В самом крупном из них > 60 % больных с СГЯ были в возрасте < 35 лет. Из шести исследований, в которых изучалась взаимосвязь ИМТ с риском развития СГЯ, в двух подтверждена корреляция между низким ИМТ и возникновением синдрома (Danninger B. et al., 1996; Aramwit P. et al., 2008), тогда как в остальных четырех никакой прогностической значимости этого показателя обнаружено не было (Delvigne A. et al., 1993; Lee T. H. et al., 2008; Ashrafi M. et al., 2015; Sousa M. et al., 2015). Несколько обсервационных исследований также иллюстрируют более высокую частоту развития СГЯ у женщин с диагнозом нарушения овуляции и синдрома поликистозных яичников (СПКЯ) (Swanton A. et al., 2010; Jayaprakasan K. et al., 2012; Sousa M. et al., 2015).
Маркеры овариального резерва
Маркеры овариального резерва также могут быть использованы для оценки риска развития СГЯ. В проспективной когорте 262 женщин, проходящих процедуру экстракорпорального оплодотворения (ЭКО), более высокий сывороточный уровень антимюллерова гормона (АМГ) (пороговое значение 3,36 нг/мл) с более высокой вероятностью указывал на СГЯ, нежели возраст и ИМТ, при чувствительности 90,5 % и специфичности 81,3 % (Lee T. H. et al., 2008). В другом исследовании (Nakhuda G. S. et al., 2006) у пациенток с СГЯ уровни АМГ в 6 раз превышали таковые у лиц контрольной группы, сопоставимых с ними по возрасту и массе тела. В ретроспективном когортном исследовании (Tal R. et al., 2014), включавшем 134 участницы с повышенным (> 5 нг/мл) уровнем АМГ, у женщин с таковым > 10 нг/мл СГЯ возникал более чем в 3 раза чаще.
Количество антральных фолликулов также является предиктором развития СГЯ. При проспективном анализе 1012 первичных циклов ВРТ риск СГЯ повышался с 2,2 % у пациенток с количеством антральных фолликулов < 24 до 8,6 % с таковым ≥ 24 (Jayaprakasan K. et al., 2012).
Авторы только двух исследований (Moos J. et al., 2009; Ocal P. et al., 2011) оценивали прогностическую значимость уровней ингибина A и B, в обоих случаях продемонстрировав отсутствие корреляции между концентрацией ингибина в сыворотке крови (или в фолликулярной жидкости) и развитием СГЯ.
Параметры стимуляции яичников
Оценка таких параметров, как наличие множества развивающихся фолликулов, повышенный уровень эстрадиола, большое число полученных ооцитов, может оптимизировать прогнозирование развития СГЯ. Несколько проспективных исследований (Papanikolaou E. G. et al., 2006; Kahnberg A. et al., 2009) показали, что большое количество растущих фолликулов является независимым предиктором СГЯ. K. Jayaprakasan et al. (2007) отмечают, что развитие ≥ 20 фолликулов при стимуляции яичников в программах ВРТ ассоциируется со значительным повышением риска СГЯ.
В шведском проспективном когортном исследовании (Kahnberg A. et al., 2009) с участием 624 пациенток, проходивших первичный цикл ЭКО, посредством многофакторного анализа ученые определили модель прогнозирования риска СГЯ с чувствительностью 82 % и специфичностью 90 % при достижении следующих пороговых значений: созревание > 25 фолликулов перед процедурой забора яйцеклеток, > 19 фолликулов крупных/средних размеров перед введением ХГЧ и забор > 24 ооцитов. По данным реестра Общества вспомогательных репродуктивных технологий, при анализе 256 381 цикла установлено, что получение > 15 ооцитов значительно повышает риск развития СГЯ без улучшения показателей живорождения в свежих аутологичных циклах ЭКО (Steward R. G. et al., 2014).
Высокая концентрация эстрадиола в сыворотке крови также сопряжена с возникновением СГЯ. Так, в большинстве исследований средние значения этого гормона у пациенток с СГЯ превышали 3500 пг/мл.
Выводы
- Имеются достаточно убедительные доказательства (уровень II-2) того, что СПКЯ, повышенные уровни АМГ, пиковые значения эстрадиола, развитие множества фолликулов и получение большого количества ооцитов ассоциируются с повышенным риском развития СГЯ (сила доказательств − степень В).
- Несмотря на то что пороговые значения должны быть валидизированы, уровень АМГ > 3,4 нг/мл, количество антральных фолликулов > 24, развитие ≥ 25 фолликулов, концентрация эстрадиола > 3500 пг/мл, а также получение ≥ 24 ооцитов, несомненно, связаны с повышенным риском СГЯ (В).
Профилактика развития СГЯ
Влияет ли вид протокола стимуляции на риск СГЯ?
На сегодняшний день проведено несколько исследований, продемонстрировавших, что назначение протоколов стимуляции с использованием антагонистов гонадотропин-рилизинг гормона (ГнРГ) для подавления овуляции связано с более низкой частотой развития СГЯ по сравнению с протоколами с применением агонистов ГнРГ. По-видимому, это обстоятельство объясняется снижением уровня циркулирующего эстрадиола при подавлении гипофизарной функции антагонистом ГнРГ. В крупном двуцентровом открытом рандомизированном исследовании с участием 1050 пациенток авторы сравнивали показатели частоты развития тяжелого СГЯ при применении антагонистов и агонистов ГнРГ (Toftager M. et al., 2016). В результате было установлено, что частота возникновения тяжелой формы синдрома была значительно ниже в группе антагониста ГнРГ по сравнению с агонистом ГнРГ (5,1 [27/528] против 8,9 % [44/495]; р = 0,02). Показатели живорождения не отличались между группами, составив 22,8 (122/534) и 23,8 % (123/516) соответственно. Эти выводы подтвердились в других небольших рандомизированных контролируемых исследованиях (РКИ) (Qiao J. et al., 2012; Borges E. Jr. et al., 2016). В исследовании R. D. Firouzabadi et al. (2010) рандомизировали 235 пациенток, проходивших первичные циклы ВРТ, на группы использования стандартного длинного протокола с агонистом и антагонистом ГнРГ. Аналогично предыдущему исследованию частота возникновения СГЯ была значительно ниже при выборе протокола с антагонистом ГнРГ по сравнению с агонистом ГнРГ (2,7 против 12 %). Интересными представляются работы M. A. Hosseini et al. (2010) и T. G. Lainas et al. (2010), в которых доказаны преимущества назначения протоколов стимуляции с антагонистами ГнРГ для подавления овуляции по сравнению с агонистами ГнРГ у больных СПКЯ, которые принадлежат к группе повышенного риска СГЯ. Следует отметить, что ХГЧ (а не агонист ГнРГ) был использован в качестве триггера овуляции во всех вышеуказанных РКИ. Проведено также несколько систематических обзоров, в которых подтверждена целесообразность применения антагонистов ГнРГ для подавления овуляции и последующего сокращения частоты СГЯ (Mancini F. et al., 2011; Xiao J. et al., 2014).
Остается неясным, влияет ли добавление кломифена в протокол стимуляции с использованием антагониста ГнРГ на риск развития СГЯ. Два РКИ демонстрируют, что присоединение кломифена для контролируемой стимуляции овуляции связано с меньшим количеством случаев СГЯ по сравнению с протоколами с применением агониста ГнРГ без кломифена (Weigert M. et al., 2002; Karimzadeh M. A. et al., 2010). Авторы двух систематических обзоров пришли к выводу, что назначение протоколов с кломифеном и антагонистом ГнРГ сопровождается значительным снижением частоты СГЯ по сравнению с протоколами без кломифена (0,5 против 4,1 %; p = 0,01) (Figueiredo J. B. et al., 2013) или с агонистом ГнРГ (отношение шансов [ОШ] 0,23; 95 % доверительный интервал [ДИ]: 0,10-0,52) (Gibreel A. et al., 2012).
Выводы
- Имеется множество доказательств в поддержку использования протоколов стимуляции яичников с антагонистами ГнРГ с целью снижения риска СГЯ (А).
- Существует недостаточно доказательств того, что кломифен сам по себе снижает риск СГЯ (C).
Может ли ацетилсалициловая кислота снизить риск СГЯ?
На данный момент проведено два рандомизированных исследования, в которых ацетилсалициловая кислота (АСК) применялась для предупреждения развития СГЯ. Усиленная активация тромбоцитов вследствие повышения содержания СЭФР может привести к высвобождению таких веществ, как гистамин, серотонин, тромбоцитарный фактор роста и лизофосфатидная кислота, что может дополнительно усиливать каскад патологических реакций при СГЯ. Исходя из этой теории, ученые предположили, что АСК может играть определенную роль в снижении риска СГЯ. В исследовании A. Revelli et al. (2008) рандомизировали пациенток для приема низких доз АСК (100 мг/сут) с первого дня стимуляции и до дня выполнения теста на беременность + преднизолон в различных дозах (10-30 мг) в тех же временных рамках (n = 97) или плацебо (n = 298) в дополнение к рутинно назначаемым лекарственным средствам в циклах ЭКО. В результате у женщин, использующих комбинацию АСК и преднизолона, было получено большее количество ооцитов при более низкой частоте развития тяжелого СГЯ (1,7 против 6,5 %). В исследовании A. Varnagy et al. (2010) пациентки с высоким риском СГЯ (наличие в анамнезе случаев возникновения синдрома, поликистозных яичников, возраст до 30 лет) начали принимать 100 мг АСК с первого дня менструального цикла, в котором было выполнено ЭКО, и продолжали до наступления менструации, получения отрицательного результата теста на беременность или до момента ультразвуковой регистрации сердечной деятельности эмбриона. На фоне терапии АСК отмечалась более низкая частота тяжелого СГЯ, требующего госпитализации, по сравнению с лицами, не получавшими этот препарат (0,25 [2/780] против 8,4 % [43/412]; р < 0,001). Разница в исходах беременности между группами выявлена не была.
Выводы
- На основании результатов двух рандомизированных исследований имеются достаточно убедительные доказательства того, что прием АСК снижает частоту развития СГЯ (В).
Связана ли терапия метформином со снижением риска СГЯ?
Метформин является инсулин-сенсибилизирующим препаратом, используемым для лечения сахарного диабета 2-го типа и широко изученным среди больных СПКЯ. Андрогенный прайминг – это концепция, согласно которой андрогены усиливают ответ яичников на стимуляцию гонадотропинами путем активизации раннего фолликулярного роста. За счет урегулирования интраовариальной гиперандрогении метформин, вероятно, может влиять на ответ яичников посредством уменьшения количества непредовуляторных фолликулов и тем самым снижать секрецию эстрадиола. В ходе клинических исследований ученые изучали вопрос: может ли применение метформина (500 мг три раза в день или 850 мг дважды в день) во время стимуляции яичников в циклах ЭКО у больных СПКЯ снизить риск СГЯ? T. Tang et al. (2006) впервые доказали, что прием метформина от начала подавления овуляции до получения ооцитов при назначении ГнРГ-протоколов снижает частоту развития СГЯ у пациенток с СПКЯ (3,8 против 20,4 %; р = 0,023). Последующими РКИ эти результаты были подтверждены (Qublan H. S. et al., 2009; Palomba S. et al., 2011). Согласно данным систематического обзора 10 РКИ (Palomba S. et al., 2013), терапия метформином снижает риск возникновения СГЯ у пациенток СПКЯ (ОШ 0,27; 95 % ДИ: 0,16-0,46). Недавний метаанализ, включавший 12 исследований с 1516 участницами, показал отсутствие различий в показателях наступления беременности, живорождения и самопроизвольных абортов между группами, принимавшими метформин и плацебо. Однако риск СГЯ был значительно ниже при приеме метформина (относительный риск [ОР] 0,44; 95 % ДИ: 0,26-0,77) (Huang X. et al., 2015). Ученые предприняли попытки определить подгруппу пациенток с СПКЯ, у которых лечение метформином будет наиболее эффективным в снижении риска СГЯ. Некоторые исследования иллюстрируют, что метформин не снижает риск СГЯ у больных СПКЯ, не страдающих ожирением (Kumbak B., Kahraman S., 2009), а также у лиц, у которых диагностируются только морфологические поликистозные изменения в яичниках (Swanton A. et al., 2011).
Выводы
- Имеется достаточно доказательств того, что метформин снижает риск развития СГЯ у пациенток с СПКЯ (А).
Применение агонистов дофамина
Патофизиология СГЯ в значительной степени связана с увеличением проницаемости сосудов яичников и перитонеальных капилляров, вызванным овариальной гиперсекрецией СЭФР. Ученые доказали, что лечение агонистами дофаминовых рецепторов, такими как каберголин, может способствовать уменьшению выработки СЭФР и последующему сокращению риска СГЯ. В этой связи было проведено восемь РКИ касательно целесообразности назначения дофаминомиметиков (каберголина) для снижения частоты развития и степени тяжести СГЯ. Проспективное рандомизированное двойное слепое исследование (Alvarez C. et al., 2007) включало доноров ооцитов, которые принимали каберголин 0,5 мг/сут (n = 37) или плацебо (n = 32) со дня введения ХГЧ в течение 8 сут. Согласно полученным результатам, распространенность средней формы СГЯ составила 20 % в группе каберголина и 43,8 % в группе плацебо (р = 0,04). Авторы также обнаружили более низкую частоту развития асцита (скопление перитонеальной жидкости в кармане > 9 см2) у женщин, принимавших каберголин (25,7 %), по сравнению с лицами, не получавшими этот препарат (59,4 %; р = 0,005). Впоследствии еще в одном проспективном рандомизированном исследовании исходов лечения каберголином против отсутствия такового у 40 пациенток с высоким риском СГЯ (уровень эстрадиола > 4000 пг/мл, > 20 фолликулов) установлено, что частота среднетяжелого СГЯ также была снижена в группе приема каберголина (15 %) по сравнению с группой контроля (50 %; р = 0,04). При этом показатели заболеваемости тяжелой формой СГЯ значительно не отличались между группами (0 и 10 % соответственно) (Amir H. et al., 2015). В нескольких систематических обзорах ученые оценивали эффекты каберголина по сравнению с плацебо в снижении риска СГЯ. По результатам одного из них, включавшем семь исследований с участием 858 женщин, установлено, что терапия каберголином сопровождалась снижением частоты развития СГЯ по сравнению с отсутствием таковой (ОР 0,38; ДИ: 0,29-0,51; р < 0,00001), при этом она не влияла на показатели наступления беременности (ОР 1,02; 95 % ДИ: 0,78-1,34; четыре исследования; n = 561) (Leitao V. M. et al., 2014).
Выводы
- Имеется достаточно доказательств того, что применение агонистов дофаминовых рецепторов со дня инъекции ХГЧ в течение нескольких дней снижает частоту развития СГЯ (А).
Возможно ли посредством назначения других препаратов или манипуляций снизить риск развития СГЯ?
Отсрочка начала стимуляции овуляции заключается в откладывании применения гонадотропинов на период максимум в 4 дня. В соответствии с результатами РКИ и систематических обзоров существует недостаточно доказательств пользы такой тактики в профилактике возникновения СГЯ (C).
Выбор триггера для финального созревания ооцитов перед их забором
На протяжении десятилетий использование ХГЧ в качестве триггера овуляции перед забором ооцитов в циклах ВРТ с целью имитации эндогенного преовуляторного пикового выброса лютеинизирующего гормона (ЛГ) являлось стандартной практикой. Вместе с тем длительный период полураспада ХГЧ вызывает поддержание ЛГ-подобной активности после забора яйцеклеток. Такая стимуляция ЛГ-рецепторов на нескольких желтых телах в яичниках может приводить к развитию СГЯ. Поэтому новой областью активных исследований стал подбор других триггеров и корректировка дозировок, необходимых для созревания ооцитов.
- В ходе исследований получено недостаточно доказательств, чтобы рекомендовать введение ХГЧ в более низких дозах для снижения риска СГЯ (C).
- Имеются достаточные доказательства целесообразности использования агонистов ГнРГ как триггеров созревания ооцитов перед их забором с целью снижения риска СГЯ (А).
- Существуют убедительные данные касательно более низких показателей живорождения после введения агониста ГнРГ в свежих аутологичных циклах ВРТ, но не в циклах донор-реципиент (А).
- Получены убедительные доказательства улучшения репродуктивных исходов при совместном использовании ХГЧ в низких дозах и агониста ГнРГ в качестве триггеров для поддержки лютеиновой фазы (В).
Применение альбумина
Альбумин имеет низкую молекулярную массу и средний период полувыведения 20 дней. Известно, что его связывающие и транспортные свойства могут играть определенную роль в профилактике СГЯ. В основе действия альбумина – способность повышать коллоидно-онкотическое давление плазмы крови, оставаясь в сосудистом русле, и снижать вероятность отеков. Кроме того, альбумин может связываться с вазоактивными веществами, в частности с факторами ренин-ангиотензиновой системы и СЭФР. Однако результаты клинических исследований по оценке эффективности альбумина в профилактике СГЯ являются спорными. Поэтому в связи с неоднозначностью литературных данных не представляется возможным утверждать, что альбумин снижает риск СГЯ (C).
Назначение препаратов кальция для предупреждения СГЯ
В ряде исследований ученые пытались выяснить, влияют ли внутривенные инфузии кальция (10 мл 10 % кальция глюконата в 200 мл физиологического раствора) в день забора ооцитов и через 1; 2 и 3 дня после его осуществления на снижение риска СГЯ. Предположительно повышение содержания кальция ингибирует цАМФ-стимулированную секрецию ренина, в результате чего снижается синтез ангиотензина II и его последующее влияние на продукцию СЭФР.
На сегодняшний день получены достаточно убедительные доказательства того, что препараты кальция снижают риск СГЯ (В).
Криоконсервация
Элективная криоконсервация всех эмбрионов с их последующим переносом в нестимулированных циклах может выполняться во избежание эндогенного роста концентрации ХГЧ в свежих циклах ВРТ, который может привести к позднему появлению симптомов и более длительному течению СГЯ.
На основании результатов двух небольших рандомизированных клинических исследований получены убедительные доказательства того, что криоконсервация предотвращает развитие СГЯ (В).
Дополнительные профилактические мероприятия для предотвращения возникновения СГЯ
Имеется недостаточное количество данных, чтобы рекомендовать использование антагониста ГнРГ в лютеиновую фазу, летрозола, метилпреднизолона, прогестерона внутримышечно или кетоконазола для снижения риска СГЯ.
Лечение СГЯ
Симптомный СГЯ среднетяжелой или тяжелой степени – это гиповолемически-гипонатриемическое состояние. Его лечение обычно включает восполнение объема потерянной жидкости для поддержания внутрисосудистой перфузии и симптоматическую терапию. Редким, но жизнеугрожающим для пациенток последствием тяжелой гиповолемии является артериальная и венозная тромбоэмболии. Поэтому профилактическое назначение антикоагулянтов оправданно у лиц с тяжелой формой СГЯ от момента постановки диагноза и до конца I триместра беременности (Rova K. et al., 2012).
Большинство исследований по изучению лечебных тактик при СГЯ являются ретроспективными когортными. В них оценены исходы применения плазмозамещающих средств, а также выполнения оперативных вмешательств, показанные пациенткам с манифестацией симптомов СГЯ. Имеются более надежные данные, поддерживающие целесообразность таких хирургических манипуляций, как парацентез и кульдоцентез, по сравнению с инфузионной терапией.
Выполнение парацентеза пациенткам с СГЯ в амбулаторных условиях
Авторы нескольких когортных исследований сравнивали исходы проведения парацентеза больным с СГЯ в стационарных либо амбулаторных условиях и нехирургической тактики их ведения. Хотя некоторые ученые выражают обеспокоенность относительно возможного повреждения сосудов и увеличенных яичников при выполнении процедуры парацентеза (Borenstein R. et al., 1989; Casals G. et al., 2013), результаты исследований с выполнением аспирации под ультразвуковым контролем не подтверждают существование риска такого травмирования.
В когортном исследовании (Lincoln S. R. et al., 2002) 48 женщинам с СГЯ и асцитом проводили лечение посредством многократного трансвагинального кульдоцентеза в амбулаторных условиях и внутривенной регидратации растворами кристаллоидов и альбумина каждые 1-3 дня до разрешения симптомов или возникновения необходимости в госпитализации. Среднее количество процедур составило 3,4; 91,6 % пациенток получали терапию амбулаторно и не нуждались в госпитализации. В большом когортном исследовании H. S. Qublan et al. (2012) анализировали влияние многократной трансвагинальной аспирации на репродуктивные исходы у пациенток с тяжелой формой СГЯ. Стационарное лечение получали 65 женщин с тяжелой ранней формой СГЯ, которое предполагало трансвагинальную аспирацию жидкости в количестве < 3 (контрольная группа; n = 29) или ≥ 3 (множественные аспирации) (основная группа; n = 36) процедур. Пациенткам обеих групп также назначали внутривенное введение жидкостей и человеческого альбумина, а также тромбопрофилактику. Согласно полученным результатам, в основной группе отмечалось значительно меньшее количество койко-дней по сравнению с контрольной группой (4,2 ± 1,3 и 6,7 ± 2,4 дня соответственно; p < 0,01). Кроме того, после множественных аспираций наблюдалось значительное повышение частоты наступления беременности наряду с существенным уменьшением числа случаев ее прерывания (по сравнению с проведением < 3 процедур).
В когортном исследовании (Shrivastav P. et al., 1994) из 18 женщин с тяжелым СГЯ восьми потребовалась госпитализация и внутривенная инфузионная терапия. Средняя продолжительность пребывания в стационаре у них составила 11 дней. Остальным 10 пациенткам проводили трансабдоминальный парацентез под ультразвуковым контролем в амбулаторных условиях. На фоне внутривенного восполнения жидкости у больных было получено 1-3 л аспирата в течение 2-3 ч. Ни в одном из случаев повторная процедура и госпитализация не требовались. Авторы пришли к выводу, что амбулаторное выполнение парацентеза под ультразвуковым контролем является безопасной альтернативой госпитализации у пациенток с тяжелой формой СГЯ.
Выводы
- Имеются достаточно убедительные доказательства того, чтобы рекомендовать больным с СГЯ проведение парацентеза и кульдоцентеза в амбулаторных условиях (В).
Применение плазмозамещающих средств в лечении пациенток с СГЯ
В небольшом ретроспективном когортном исследовании Y. Abramov et al. (2001) сравнивали эффективность и безопасность коллоидного 6 % раствора гидроксиэтилированного крахмала (ГЭК) (n = 6) и человеческого альбумина (n = 10) в лечении тяжелых форм СГЯ у 16 больных. В итоге у пациенток, которым вводили ГЭК, был большим диурез, требовалось меньшее количество процедур абдоминального парацентеза и торакоцентеза (у 33 против 80 %), а также отмечалась меньшая длительность пребывания в больнице (15,7 ± 5,7 против 19,0 ± 8,2 дня) по сравнению с лицами, получавшими раствор человеческого альбумина. Разницы в частоте побочных эффектов между группами не установлено. Полученные данные позволяют предположить, что 6 % раствор ГЭК более эффективен, нежели раствор альбумина, в лечении тяжелых форм СГЯ.
В небольшом проспективном обсервационном исследовании (Morris R. S. et al., 1995) 13 пациенткам с тяжелой формой СГЯ назначали консервативное стационарное лечение. Последнее предполагало довольно агрессивное введение плазмозамещающих средств, диуретиков и дофамина внутривенно каждые 8 ч у лиц с олигурией. Средний период времени до разрешения СГЯ и выписки из больницы составил 6 дней (от 2 до 11). По сравнению с показателями при поступлении никаких существенных различий в уровнях натрия, калия и креатинина после купирования синдрома отмечено не было. При этом показатели гемоглобина и гематокрита были значительно снижены (р < 0,03). Случаев развития респираторного дистресс-синдрома взрослых или тромбоза не зафиксировано. Назначения инвазивных методов лечения, таких как парацентез, не требовалось. У всех женщин беременность не была прервана. Авторы исследования сделали заключение, что такое консервативное лечение СГЯ является приемлемой опцией для этой категории больных.
Следует обратить внимание на то, что все вышеуказанные небольшие исследования, в которых оценивались исходы введения плазмозамещающих средств пациенткам с симптомами СГЯ, не были рандомизированными контролируемыми. Остается неизвестным, будет ли купировано данное состояние аналогичным образом при использовании только кристаллоидов. Кроме того, одновременное назначение диуретиков некоторым участницам этих исследований еще больше усложняет оценку эффективности терапии.
Выводы
- Доказательств в поддержку применения плазмозамещающих средств в качестве монотерапии у пациенток с СГЯ (C) на сегодняшний день недостаточно. Протоколы исследований, в которых изучалась эффективность данных препаратов, не были унифицированными. В некоторых исследованиях сообщается об использовании в лечении СГЯ не только плазмозамещающих растворов, но и диуретиков или дофамина.
Заключение
СГЯ является грозным осложнением контролируемой стимуляции яичников. В идеале женщины, входящие в группу риска, должны быть идентифицированы перед проведением процедуры стимуляции. При этом им необходимо подобрать соответствующие протоколы стимуляции для минимизации риска СГЯ. Применение протоколов стимуляции яичников антагонистами ГнРГ и агонистов ГнРГ (с/без ХГЧ в низких дозах) для индукции финального созревания ооцитов является оптимальной стратегией. К другим подходам, позволяющим снизить риск СГЯ, относят использование каберголина и криоконсервацию всех эмбрионов для будущего переноса. При неэффективности вышеперечисленных стратегий профилактики СГЯ или при развитии его тяжелой формы больным показаны инфузионная терапия, симптоматическое лечение, парацентез и профилактическая тромбопрофилактика антикоагулянтами.
Обобщение рекомендаций
- Пациенткам с СПКЯ, повышенным уровнем АМГ и большим количеством антральных фолликулов показаны протоколы стимуляции яичников, снижающие риск развития СГЯ (В).
- У лиц с высоким риском СГЯ предпочтительнее использовать протоколы стимуляции яичников с антагонистами ГнРГ (А).
- Применение агонистов ГнРГ в качестве триггеров созревания ооцитов перед их забором рекомендуется для снижения риска СГЯ при высоких пиковых уровнях эстрадиола и развитии множества фолликулов во время стимуляции (А). Назначение в низких дозах ХГЧ как ко-триггера, гормональная поддержка лютеиновой фазы, криоконсервирование эмбрионов являются стратегиями, позволяющими повысить частоту наступления беременности у этой категории пациенток (В).
- Применение агонистов дофаминовых рецепторов со дня инъекции ХГЧ в течение нескольких дней также способствует снижению частоты СГЯ (А).
- Дополнительные мероприятия по предотвращению развития СГЯ включают использование метформина у больных СПКЯ (А), прием АСК (А) и криоконсервацию эмбрионов (В).
- Основное лечение СГЯ представлено инфузионной терапией и профилактической тромбопрофилактикой антикоагулянтами. Парацентез или кульдоцентез может быть рекомендован для купирования СГЯ у лиц с выраженным асцитом (В).
Подготовила Марина Малей
По материалам: ASRM. Prevention and treatment of moderate and severe ovarian hyperstimulation syndrome: a guideline.Fertil Steril, 2016; 106: 1634-47.
Журнал «Медичні аспекти здоров'я жінки» ‘ 2018. Спецвипуск «Гормональна терапія та контрацепція»