12 червня, 2018
Кардиологи – семейным врачам: что нужно знать и к чему стремиться в клинической практике?
Ежедневно семейному врачу приходится сталкиваться с аритмиями. Приступы сердцебиения, головокружения, загрудинная боль, одышка, ощущение перебоев в работе сердца и даже потеря сознания – с такими симптомами пациенты обращаются за помощью к врачу. Очень часто аритмии протекают малосимптомно или вовсе бессимптомно, что оттягивает обращение за медицинской помощью вплоть до появления осложнений. Какова тактика ведения пациента с нарушениями ритма, какие рекомендации актуальны сегодня? На эти и многие другие вопросы постарались ответить специалисты в области аритмий в рамках VIII научно-практической конференции ассоциации аритмологов Украины «Мастер-класс по аритмологии для врачей по специальности «Семейная медицина», которая прошла 17-18 мая в г. Киеве.
 Открыла конференцию докладом «Фибрилляция предсердий: диагностика, особенности терапии» старший научный сотрудник отдела аритмий ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины» (г. Киев), кандидат медицинских наук Елена Николаевна Романова.
Открыла конференцию докладом «Фибрилляция предсердий: диагностика, особенности терапии» старший научный сотрудник отдела аритмий ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины» (г. Киев), кандидат медицинских наук Елена Николаевна Романова.
– У пациентов в возрасте ≥65 лет для раннего выявления нарушений ритма необходимо осуществлять внеплановый скрининг фибрилляции предсердий (ФП) с проведением ЭКГ, а в случае транзиторной ишемической атаки или ишемического инсульта в анамнезе – круглосуточный ЭКГ-мониторинг (72-часовой, минимально). Альтернативным методом исследования «немой» ФП является использование имплантируемого петлевого регистратора ЭКГ (Implantable Loop Recorder). Помимо полного кардиоваскулярного обследования (анализа истории болезни, тщательного клинического исследования, оценки сопутствующих патологий), ЭКГ, необходимо назначить трансторакальную ЕхоКГ для более точного выбора тактики лечения и подбора лекарственного средства.
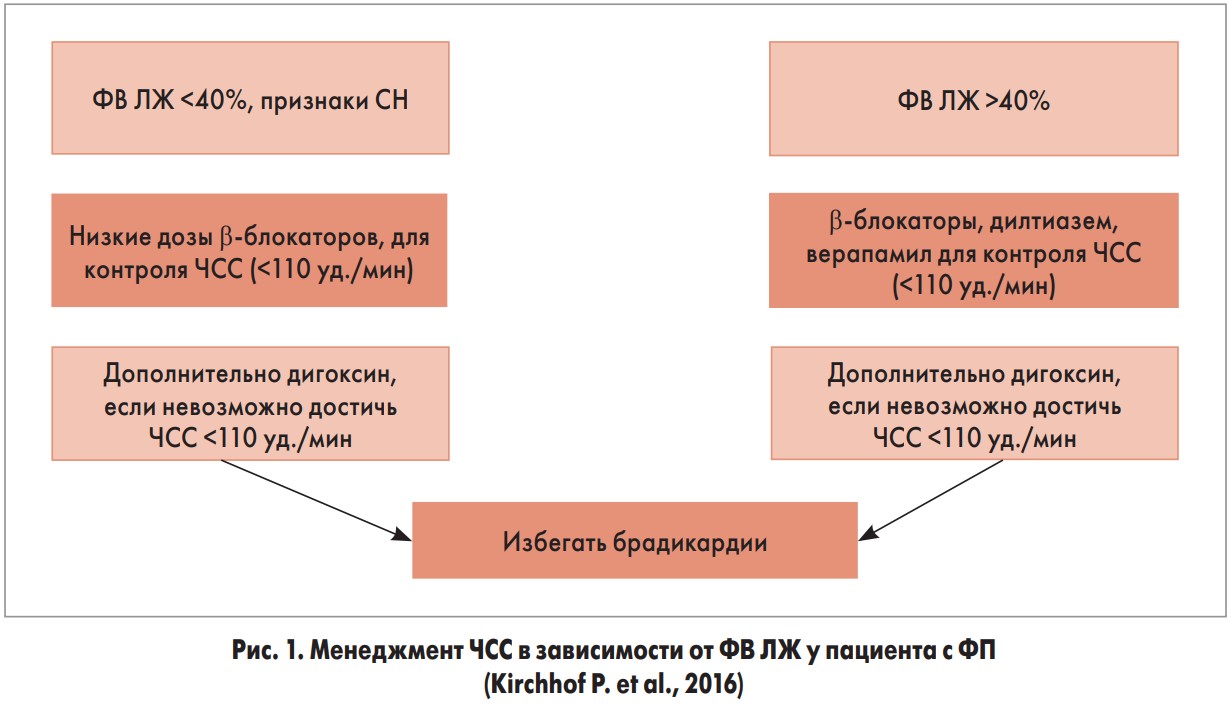
Что касается контроля частоты сердечных сокращений (ЧСС), то в ведении пациентов современные рекомендации предлагают отталкиваться от величины фракции выброса левого желудочка (ФВ ЛЖ) (рис. 1).
У пациентов с ФП и наличием симптомов, если необходим долгосрочный контроль ритма, следует учитывать общепринятое разграничение на 3 группы (рис. 2).
При неэффективности вышеуказанных подходов нужно рассмотреть вариант перехода на другой антиаритмический препарат (ААП), повторную абляцию или же гибридную терапию. Последняя предусматривает одновременное использование всех известных подходов лечения аритмий (открытая хирургия, катетерная абляция, ААП). Данное решение должно приниматься командой экспертов (Atrial fibrilation HeartTeam), которая может состоять из семейных врачей, кардиологов, кардиохирургов. Благодаря такому взаимодействию удается выбрать оптимальную тактику лечения, чтобы максимально долго сохранить синусовый ритм.
Контроль ритма может помочь уменьшить симптомы у пациентов с ФП. Он предусматривает подбор ААП с учетом коморбидности, кардиоваскулярного риска, экстракардиальных токсических эффектов, предпочтений пациента и симптомов. Наиболее эффективным препаратом для профилактики рецидивов ФП является амиодарон. Но экстракардиальные токсические эффекты, нарастающие со временем, не позволяют использовать его для профилактики ФП. Поэтому инициально рекомендовано другие ААП.
Кардиоверсия у пациентов с ФП рекомендована при длительно персистирующей ФП как часть терапии контроля. Электрическая кардиоверсия назначается только при острой гемодинамической нестабильности для восстановления сердечной деятельности. С целью повышения эффективности кардиоверсии рекомендована предварительная терапия амиодароном, флекаинидом, ибутилидом или пропафеноном.
Таким образом, обязательный скрининг пациентов из групп риска и ведение согласно современным рекомендациям позволят минимизировать осложнения ФП.
 В докладе «Антитромботическая терапия при фибрилляции предсердий» старшего научного сотрудника отдела аритмий ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины», кандидата медицинских наук Таисии Вячеславовны Гетьман были детально рассмотрены вопросы антикоагулянтной терапии.
В докладе «Антитромботическая терапия при фибрилляции предсердий» старшего научного сотрудника отдела аритмий ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины», кандидата медицинских наук Таисии Вячеславовны Гетьман были детально рассмотрены вопросы антикоагулянтной терапии.
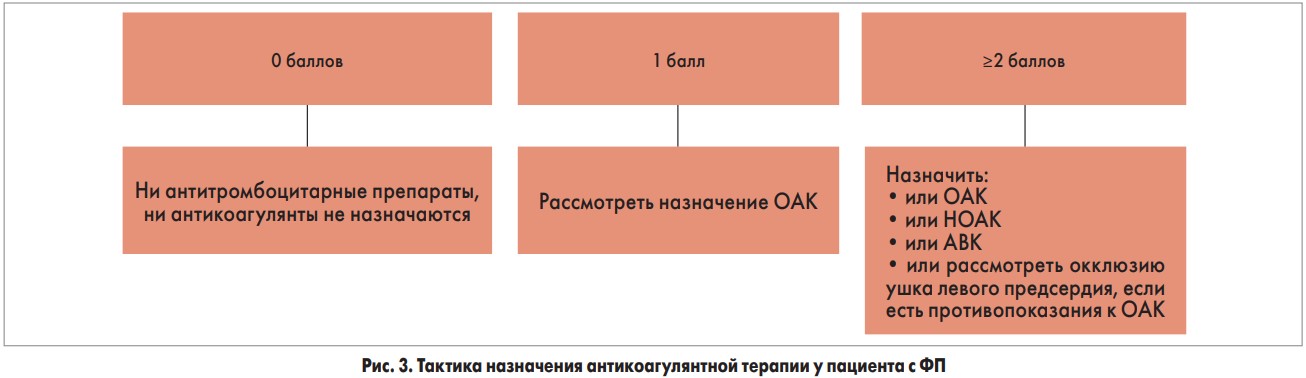
– Как известно, антитромботическая терапия у пациентов с ФП должна проводиться независимо от того, какую тактику ведения выбирает врач (контроль ритма, контроль ЧСС или катетерная абляция). Для точного выбора антикоагулянтной терапии при ФП Европейская ассоциация кардиологов (ЕSC) рекомендует пользоваться обновленной шкалой CHA2DS2-VASc от 2016 года (рис. 3).
Также для профилактики инсульта ЕSC не советует применять антитромбоцитарную монотерапию. В спорных ситуациях нужно использовать биомаркеры (высокочувствительный тропонин или натрийуретический пептид), высокая чувствительность которых доказана в исследовании ARISTOTLE (2011).
Для лучшего контроля рисков кровотечения выделяют модифицируемые и немодифицируемые факторы. Коррекция модифицируемых (артериальная гипертензия, лабильное международное нормализованное отношение (МНО), прием препаратов, предрасполагающих к кровотечению, избыток алкоголя), а также потенциально модифицируемых факторов (анемия, нарушение работы печени и почек, снижение количества тромбоцитов) должна стать целью работы с пациентом, имеющим ФП.
Не следует бояться назначать оральные антикоагулянты (ОАК), так как в исследовании было выявлено, что риск развития инсульта вследствие отказа от применения значительно превышает риск кровотечения при приеме ОАК (Friberg et al., 2012). Пероральную антикоагулянтную терапию ЕSC рекомендует начинать с новых оральных антикоагулянтов (НОАК; ривароксабан, дабигатран, апиксабан или эдоксабан).
Препарат следует выбирать в зависимости от наличия и выраженности сопутствующей патологии. Так, дабигатран на 80% выводится почками, при снижении клиренса креатинина его концентрация может повыситься в 3-5 раз, что значительно увеличивает риск кровотечения. Ривароксабан и апиксабан на 35 и 27%, соответственно, выводятся почками; при повышении клиренса креатинина концентрация препаратов может вырасти лишь на 30-40%. Значит, 60-70% ривароксабана и апиксабана метаболизируются в печени, что следует учитывать при печеночной недостаточности.
Показатель МНО (либо протромбиновый индекс) может использоваться только для оценки коагуляционного эффекта антагонистов витамина К (АВК) и непоказателен для НОАК и АСК. Причем единоразовое МНО не будет объективно отображать состояние системы свертывания. Необходимо брать во внимание показатель МНО за последние 6 мес без учета первых 3 нед терапии, и если ≥4 показателей из 10 будут выходить за пределы терапевтического окна (МНО 2-3), пациент не будет защищен от риска кровотечения или тромбоза. Для объективного подсчета показателей МНО можно использовать метод Розендаля (подсчитывается процент дней, когда МНО находилось в терапевтическом окне).
У пациентов, принимающих НОАК для контроля коагуляции, следует использовать показатель концентрации препарата в крови (дорогостоящая и непростая процедура, которая может применяться в исключительных случаях), активированное частичное тромбопластиновое время (для дабигатрана) и тромбиновое время (для дабигатрана, ривароксабана и апиксабана).
Таким образом, каждый визит пациента, который использует антикоагулянтную терапию, должен сопровождаться инструктажем по поводу важности соблюдения жесткого графика приема, оценкой побочных эффектов, минимизацией модифицируемых факторов, а также оценкой выбора НОАК и его дозы.
 Выступление научного сотрудника отдела аритмий ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины», доктора медицинских наук Юрия Васильевича Зинченко было посвящено желудочковым нарушениям ритма сердца, их диагностике и современным методам лечения, а также профилактике внезапной кардиальной смерти (ВКС).
Выступление научного сотрудника отдела аритмий ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины», доктора медицинских наук Юрия Васильевича Зинченко было посвящено желудочковым нарушениям ритма сердца, их диагностике и современным методам лечения, а также профилактике внезапной кардиальной смерти (ВКС).
– Желудочковые аритмии (ЖА) – довольно опасные патологии, поскольку смертность от них значительно превышает таковую от наджелудочковых аритмий. Причинами ЖА могут быть как функциональные (психогенные, рефлекторные, при физических нагрузках), так и органические факторы (ишемия, нарушения гемодинамики, инфекционно-токсические факторы, миокардиодистрофия, врожденные нарушения проводящей системы, эндокринные нарушения и т. д.).
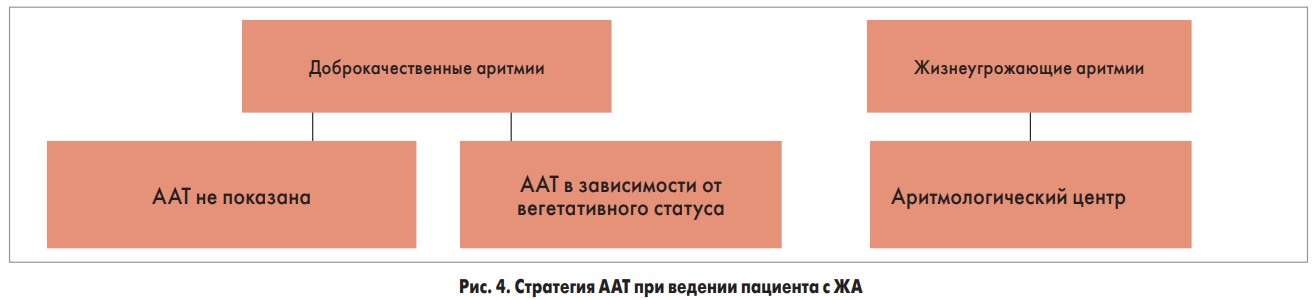
Для простоты восприятия все желудочковые тахикардии можно разделить на доброкачественные (не влияют на прогноз) и злокачественные (жизнеугрожающие). Злокачественные нарушения, в свою очередь, могут приводить к ВКС.
ВКС – это нетравматическая остановка кровообращения, которая развилась в течение 1 ч после появления симптомов у клинически здорового субъекта, находящегося в стабильном состоянии на протяжении 24 ч. С ВКС чаще ассоциируются такие патологии, как инфаркт миокарда и сердечная недостаточность (СН; 80%), реже кардиомиопатии (15%), а также врожденные и органические нарушения сердца (5%).
Приблизительную структуру аритмий при ВКС можно проследить в исследовании A. Bayés de Luna и соавт. (1989):
- 62% – желудочковые тахикардии, которые перешли в фибрилляцию желудочков;
- 17% – брадиаритмии;
- 13% – «пируэтные» тахикардии;
- 9% – первичная фибрилляция желудочков.
Для объективной оценки ЖА необходимо придерживаться плана обследования.
1. Анамнез заболевания (80% информации для предварительного диагноза).
2. Клиническое обследование.
3. Лабораторные исследования (исключение экстракардиальных причин).
4. Инвазивные и неинвазивные инструментальные исследования, пробы.
Наиболее информативным в диагностике ЖА является круглосуточный ЭКГ-мониторинг до 72 ч (холтер, наружный или имплантируемый монитор ЭКГ, событийный ЭКГ-монитор, электрокардиостимулятор (ЭКС) / имплантируемый кардиовертер-дефибриллятор (ИКД) с функцией телемониторинга).
Не менее информативным считается нагрузочный тест при использовании холтеровского мониторирования: необходимо заставить пациента подвигаться, побегать, поприседать с целью ускорения синусового ритма, что увеличит вероятность диагностирования нефиксированной в покое ЖА. Наиболее опасные аритмии проявляются или усугубляются во время физической нагрузки.
При неинформативности вышеуказанных методов следует перейти к инвазивным (контрастная коронарография и внутрисердечное электрофизиологическое исследование с программируемой электростимуляцией).
В связи с этим хотелось бы процитировать М. С. Кушаковского: «Стремясь устранить аритмию, необходимо в первую очередь иметь в виду ее этиологию, то есть лежащее в основе заболевание» и «Врач должен настойчиво и последовательно искать причину приступов желудочковой тахикардии, особенно у «здоровых людей».
Первым пунктом в терапии ЖА должно быть лечение основной и сопутствующих патологий (ишемическая болезнь сердца, СН, артериальная гипертензия), далее – медикаментозная антиаритмическая терапия (ААТ) (рис. 4).
Дифференцирование вегетативного статуса актуально при выборе ААТ. Больные с преобладанием симпатоадреналовой системы требуют назначения β-блокаторов. Для лиц с преобладанием парасимпатической системы последние противопоказаны, при этом им необходимы психотерапия, седативная терапия, эпизодическое применение ААП короткого действия (с холинолитическим эффектом) при наличии симптомов. Но даже самая лучшая ААТ приводит только к снижению частоты ЖА, а не к полному ее прекращению. В связи с этим последнее слово – за хирургическими методами лечения ЖА (катетерная абляция, имплантация ИКД и ЭКС, реваскуляризация миокарда и другие кардиохирургические методики).
 Об особенностях лечения нарушений ритма у беременных рассказала кандидат медицинских наук Марина Захаровна Чередниченко (ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины»).
Об особенностях лечения нарушений ритма у беременных рассказала кандидат медицинских наук Марина Захаровна Чередниченко (ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины»).
– Беременность является значительной нагрузкой на сердечно-сосудистую систему, хоть и считается при этом физиологическим состоянием для женщины. Наблюдаются увеличение объема циркулирующей крови (на 30-50%), ЧСС (на 15%), сердечного выброса (на 30-40%); снижение артериального давления (в среднем на 10 мм рт. ст.), системного сосудистого сопротивления (на 20%); повышение чувствительности и возбудимости миокарда за счет увеличения количества адренорецепторов.
Все вышеуказанные факторы могут привести к появлению наиболее распространенного осложнения гестации – аритмии (регистрируются у 20% беременных, у 5% – сложные нарушения ритма). Наиболее подвержены появлению аритмий беременные со структурными заболеваниями сердца, аритмиями в анамнезе и врожденными пороками сердца. Только в 15% случаев есть необходимость назначать медикаментозное лечение, а 43% аритмий имеют функциональный генез.
Структура аритмий в период беременности:
- суправентрикулярные экстрасистолии – 28-67%;
- желудочковые экстрасистолии – 16-59%;
- суправентрикулярные тахикардии (СВТ) – 20-44%;
- желудочковые тахикардии – 27%.
Следует обратить внимание, что у 52% пациенток с ранее диагностированной ФП отмечаются новые пароксизмы аритмий.
Ведение беременных с нарушением сердечного ритма основывается на: лечении основного заболевания; устранении провоцирующих факторов и причин возникновения или усиления аритмий; назначении ААП (при необходимости); использовании электроимпульсной терапии, электрокардиостимуляции, радиочастотной абляции (по показаниям).
К применению ААП в период гестации, учитывая их тератогенный эффект и ограниченное количество исследований у беременных, следует подходить с особой осторожностью.
По выраженности тератогенного эффекта выделяют категории лекарственных препаратов «A-X». Так, категория «А» соответствует безопасным средствам, а «Х» – препаратам с наиболее выраженным тератогенным эффектом (FDA, США, 2002). Назначать лекарственные препараты в период беременности необходимо только при наличии клинически значимых симптомов и нестабильной гемодинамики, несмотря на то, что алгоритм их ведения аналогичен таковому у небеременных.
Бессимптомные экстрасистолии не требуют медикаментозной коррекции. Лечение симптоматической экстрасистолии следует начинать с ликвидации провоцирующих факторов (курение, прием кофе, алкоголя, чрезмерные эмоциональные и физические нагрузки). При неэффективности можно рассмотреть назначение β-блокаторов (метопролол, пропранолол).
В случае СВТ пароксизм можно купировать с помощью вагусных проб (массаж каротидного синуса, форсированный кашель, проба Вальсальвы и др.). Если пробы неэффективны, рекомендованы аденозин или внутривенно метопролол/пропранолол, или синхронизированная кардиоверсия (особенно при нестабильной гемодинамике). Для длительного ведения пациента с СВТ назначают метопролол/пропранолол или дигоксин. В случае неэффективности последних следует рассмотреть соталол либо флекаинид.
ФП редко возникают у беременных без структурных изменений сердца или тиреотоксикоза. С целью коррекции данной аритмии у гемодинамически стабильных пациенток без значительных органических нарушений можно применить фармакологическую кардиоверсию (ибутилид, флекаинид, пропафенон). Для контроля ЧСС используют β-блокаторы, верапамил, дигоксин, а при выраженных симптомах – профилактические ААП (соталол, флекаинид, пропафенон, учитывая уровень тератогенности). В случае нестабильной гемодинамики имеет смысл прибегнуть к электрической кардиоверсии.
Таким образом, только тщательное клиническое обследование, взвешенный подход к выбору тактики лечения помогут врачу принять правильное решение в лечении аритмий у беременных.
 С европейскими рекомендациями по ведению онкологических больных с аритмиями ознакомил присутствующих кандидат медицинских наук Евгений Владимирович Могильницкий (ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины»).
С европейскими рекомендациями по ведению онкологических больных с аритмиями ознакомил присутствующих кандидат медицинских наук Евгений Владимирович Могильницкий (ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины»).
– В современной практике онкологические заболевания не являются приговором для пациента. Часто семейным врачам и терапевтам приходится сталкиваться с трудностями выбора тактики ведения больных, у которых сочетаются онкологическая и кардиологическая патологии.
Аритмии у таких пациентов наблюдаются в 16-36% случаев. Как правило, они возникают до, во время и вскоре после химиотерапии.
Чтобы выбрать тактику лечения в таком случае, нужно оценить конкурирующие риски онкологических и кардиальных заболеваний, предполагаемую продолжительность жизни, ее качество и возможные осложнения.
Препараты, которые применяются в онкологической практике, могут вызывать удлинение интервала QT и провоцировать возникновение аритмий. Следовательно, контроль ЭКГ необходим у больных, которые получают противораковую терапию. При выявлении удлиненного интервала QT необходим многократный контроль ЭКГ. Среди факторов, которые могут также удлинять интервал QT, можно выделить электролитные нарушения (гипо- калий, кальций и магниемии), возникающие из-за рвоты, диареи, применения петлевых диуретиков.
Единственными действенными и безопасными для коррекции интервала QT в этом случае являются β-блокаторы. Если интервал QT >500 мс, следует рассмотреть альтернативную противораковую терапию или даже прекращение лечения.
Не менее важной проблемой, возникающей у онкобольных, являются тромбоэмболии. Частота венозных тромбоэмболий (ВТЭ) у онкологических пациентов в 4 раза выше, чем в популяции, а на фоне применения химиотерапии возрастает в 6-7 раз. У 2,5-10,7% больных при обследовании выявляют бессимптомные тромбозы, при этом смертность пациентов, перенесших ВТЭ, повышается в 2 раза.
Процесс тромбообразования провоцируется самой опухолью (под воздействием тканевого фактора, выработки прокоагулянтных молекул, активации тромбоцитов и подавления системы фибринолиза). В тромбированном сосуде создаются условия для адгезии опухолевых клеток, как следствие, метастазирования.
Для профилактики ВТЭ следует использовать антикоагулянтную терапию. Учитывая особенности коагуляции у онкобольных, требуется полное обследование пациента (ЭхоКГ, оценка риска кровотечения и сопутствующих патологий), а также нужно принимать во внимание его предпочтения по лечению.
Существуют абсолютные и относительные противопоказания к лечению антикоагулянтами. К абсолютным противопоказаниям относят: недавнее внутричерепное кровотечение; наличие очага в ЦНС с высоким риском кровотечения; продолжающееся кровотечение (>2 гемотрансфузий за последние 24 ч).
Относительными противопоказаниями являются: тромбоцитопения (<50×109/л), коагулопатия, хроническое клинически значимое кровотечение за последние 48 ч, недавнее оперативное вмешательство с высоким риском кровотечения, высокий риск травм головы, спинальная анестезия / люмбальная пункция.
На практике можно использовать АВК (варфарин), но ввиду затруднения контроля МНО их применения часто избегают. Альтернативой служат низкомолекулярные гепарины, а также рекомендованные для приема ESC НОАК. К сожалению, исследования использования НОАК у онкобольных еще не завершены, но ESC предлагает эти препараты как безопасные.
Таким образом, не следует бояться лечить сопутствующие патологии у онкобольных пациентов, назначать варфарин и ОАК. При этом не стоит забывать о рисках, учитывать понятия ожидаемой продолжительности жизни и целесообразность лечения в тяжелых случаях.
 Доклад доктора медицинских наук, профессора Лианы Николаевны Бабий (ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины») посвящен реабилитации пациентов с аритмиями.
Доклад доктора медицинских наук, профессора Лианы Николаевны Бабий (ГУ «ННЦ «Институт кардиологии им. Н. Д. Стражеско» НАМН Украины») посвящен реабилитации пациентов с аритмиями.
– Кардиореабилитация – долгосрочная программа, включающая рекомендации по дальнейшему лечению, медицинскому обследованию, модификации факторов риска, реабилитационные упражнения и т. д. Ее целью является повышение качества жизни, уменьшение частоты развития повторных сердечно-сосудистых событий и госпитализаций, повышение выживаемости кардиологических больных.
Выделяют физическую, психологическую и социальную реабилитацию пациента. Физическая реабилитация с учетом модификации факторов риска значительно снижает риск смертности и повторного инфаркта миокарда (Eisenberg M. J., Afilalo J., Lawler P. R. et al., 2011).
Согласно постановлению Фонда социального страхования от 13.07.2017 № 39 произошли изменения, касающиеся компенсации затрат на реабилитацию, повышения ее доступности. Теперь нет необходимости в путевках соцстраха. Направление на реабилитацию может выдать любой стационар, а больной может выбирать санаторий и количество дней пребывания в нем (18-24).
Показаниями к направлению на реабилитацию являются: состояния после восстановления синусового ритма у пациентов с ФП, суправентрикулярные и желудочковые нарушения ритма; период после проведения инвазивных вмешательств (радиочастотной абляции, кардиоверсии, имплантации стимуляторов ритма).
Для направления в санаторий на реабилитацию нужно добиться от больного минимальной физической активности (дозированная ходьба до 100 м в 2-3 приема и подъем по лестнице на 17-23 ступеньки).
В процессе реабилитации необходим мультидисциплинарный подход с привлечением кардиолога, эрготерапевта (специалиста по физическим нагрузкам), диетолога, врача функциональной диагностики, психолога или психотерапевта. Также следует обратить внимание на адекватность физических нагрузок, проводить контроль показателей гемодинамики, ЭКГ.
Актуализация авторами докладов проблемы аритмии – действенный инструмент, помогающий терапевтам, врачам общей практики семейной медицины, а также семейным врачам интегрировать современные наработки в аритмологии, отображенные в рекомендациях, в повседневную клиническую практику.
Подготовил Сергей Панчев
Медична газета «Здоров’я України 21 сторіччя» № 10 (431), травень 2018 р.