15 червня, 2018
Сучасні погляди на діагностику та лікування аутоімунного гепатиту
Незважаючи на те що після впровадження у клінічну практику діагнозу «аутоімунний гепатит» (АІГ) минуло кілька десятиліть, діагностика та лікування захворювання, як і раніше, пов’язані зі значними труднощами. Це зумовлено двома основними причинами. По-перше, АІГ – порівняно рідкісне захворювання, а по-друге – досить гетерогенне. АІГ може мати як практично непомітний субклінічний перебіг, так і гострий, іноді зі швидким розвитком тяжкої печінкової недостатності (ПН). Ця патологія може бути пов’язана з цілою низкою інших захворювань печінки, зокрема холестатичними – первинним біліарним холангітом (ПБХ) або первинним склерозуючим холангітом (ПСХ), а також із вірусним гепатитом та іншими хворобами печінки.
Сьогодні у лікуванні АІГ Міністерство охорони здоров’я (МОЗ) України рекомендує використовувати сучасні європейські та міжнародні рекомендації. Актуальними є рекомендації Американської асоціації з вивчення захворювань печінки (AASLD) 2010 року та рекомендації Європейської асоціації з вивчення захворювань печінки (EASL) 2015 року.
АІГ – хронічне захворювання печінки, що уражує переважно жінок і характеризується перипортальним гепатитом, гіпергаммаглобулінемією, наявністю циркулюючих аутоантитіл, зв’язком із лейкоцитарними антигенами людини (HLA DR3 і DR4) та сприятливою відповіддю на імуносупресивну терапію [5]. Без лікування захворювання часто призводить до розвитку цирозу, ПН та смерті.
На початку 1950-х рр. шведський лікар Waldenstrom, а згодом Kunkel описали новий вид хронічного гепатиту з певними особливостями перебігу та системними проявами. У 1955 р. у таких пацієнтів виявлено лабораторні маркери червоного вовчака, на підставі чого Mackay в 1956 р. запропонував використовувати для позначення цього виду гепатиту термін «вовчаковий гепатит». Через кілька років цей термін замінено на «аутоімунний гепатит», цей термін упроваджений у науковий обіг Міжнародною групою з вивчення АІГ (IAIHG) у 1990-ті рр. та використовується дотепер [19].
АІГ вважається рідкісним захворюванням, його поширеність у європейській популяції становить 16-18 випадків на 100 тис. населення [1, 35]. АІГ утричі частіше зустрічається у жінок. Останнім часом спостерігається зростання захворюваності як серед жінок, так і чоловіків. Випадки АІГ реєструють у різних популяціях та в усіх вікових категоріях, найчастіше у пубертаті та у проміжку між 30 та 60 роками. За даними датського епідеміологічного дослідження, відзначається значне зростання захворюваності АІГ. Наприклад, поширеність АІГ у Данії за період із 1994 по 2012 р. зросла майже удвічі, сягнувши у 2012 р. показника 24 випадки на 100 тис. населення (35 на 100 тис. серед жінок) [18]. Дані щодо поширеності АІГ в Україні відсутні. За оцінками нещодавно проведених досліджень, у структурі захворюваності збільшилась частка пацієнтів старшої вікової групи (>65 років) [7].
Клінічні особливості
Спектр клінічних проявів АІГ – різноманітний: від відсутності виражених проявів ураження печінки до тяжкої форми, яка є практично ідентичною гострому або блискавичному вірусному гепатиту [20]. Дійсно, у приблизно 25% пацієнтів на момент звернення за медичною допомогою спостерігаються гострі прояви АІГ, подібні за фенотипом до гострого гепатиту іншої етіології [1, 31]. Гострі прояви АІГ можуть зумовлювати 2 клінічні форми. Одна з них – загострення хронічного АІГ (недіагностованого або неправильно діагностованого АІГ), інша – істинний гострий АІГ без хронічних гістологічних змін (гостра форма АІГ) [31].
Діагностику захворювання може ускладнити те, що у деяких пацієнтів із гострими проявами АІГ рівень імуноглобуліну G (IgG) не підвищується, а антитіла до гладеньких м’язів (SMA) за даними першого скринінгу не визначаються, у зв’язку з чим клініцист може і не запідозрити АІГ [20]. У таких випадках доцільно виконати більш широке та більш чутливе серологічне дослідження на маркери аутоімунного ураження печінки.
Слід підкреслити, що у деяких випадках аутоантитіла можуть визначатися лише через кілька місяців після початку захворювання. Потрібно враховувати те, що гострі прояви АІГ можуть переходити у гостру ПН (хоча це і рідко трапляється). Встановлення діагнозу АІГ як причини гострого гепатиту і/або блискавичної ПН має важливе значення, оскільки несвоєчасна діагностика і зволікання із призначенням лікування погіршують прогноз АІГ, тоді як своєчасна терапія із застосуванням кортикостероїдів дозволяє уникнути трансплантації печінки (ТП) [9, 24].
З іншого боку, майже у третині випадків спостерігається безсимптомний початок захворювання з поступовим прогресуванням без вираженої симптоматики. Діагноз АІГ зазвичай встановлюють у ході обстеження пацієнта з приводу незрозумілого підвищення активності сироваткових трансаміназ [15, 35]. Однак на момент встановлення діагнозу приблизно 30-50% хворих вже мають пізню стадію з цирозом, який пов’язаний з меншою загальною тривалістю життя незалежно від наявності симптомів [26, 35]. Останній факт, поряд із гістологічними ознаками хронічного ураження печінки у біопсійному матеріалі, у частини пацієнтів із гострими проявами АІГ означає наявність субклінічного процесу протягом тривалого часу [24]. Це належить до основних труднощів у діагностиці, оскільки появі симптомів захворювання часто передує його субклінічний перебіг, а з іншого боку, після перших проявів можливі тривалі періоди субклінічного перебігу.
Обґрунтованість поділу АІГ на підтипи у цей час є предметом дискусій [20]. Залежно від визначених аутоантитіл захворювання класифікують на 2 або 3 підтипи. Спочатку було запропоновано виділити два основні підтипи – АІГ‑1 та АІГ‑2 (табл. 1) [5]. АІГ‑1 характеризується наявністю антинуклеарних антитіл (ANA) і/або антитіл до гладеньких м’язів (SMA) [13, 21]. АІГ‑2 – наявністю специфічних антитіл 1 типу до мікросом печінки/нирок (анти-LKM1) або, рідше, анти-LKM 3 типу (анти-LKM3) і/або антитіл до цитозольного антигену печінки 1 типу (анти-LC1) [13, 17]. Спочатку цей поділ ґрунтувався тільки на визначенні циркулюючих антитіл, але згодом були описані також інші відмінності між різними підтипами АІГ. Визначення аутоантитіл до розчинних печінкових антигенів (анти-SLA) – антитіл анти-SLA/LP, які є ідентичними раніше описаним антитілам до білків печінки/підшлункової залози (анти-LP), дозволило виділити 3 підтип – АІГ‑3 (табл. 2) [22]. Відмінності між АІГ‑1 та АІГ‑3 виражені менше, ніж відмінності між АІГ‑1 та АІГ‑2. Деякі автори відзначають більш тяжкий перебіг захворювання і необхідність імуносупресії протягом усього життя у більшості, якщо не у всіх пацієнтів із АІГ‑3 [22]. Отже, згідно з останніми європейськими рекомендаціями, виділяють 3 підтипи АІГ.
АІГ асоційований з широким спектром інших аутоімунних або імунно-опосередкованих захворювань [32]. Оскільки у пацієнтів з АІГ часто зустрічаються супутні аутоімунні захворювання, доцільним є проведення більш ґрунтовного обстеження на наявність інших аутоімунних захворювань, особливо аутоімунного тиреоїдиту, як на етапі встановлення діагнозу, так і регулярно протягом диспансерного спостереження [32]. Аутоімунні захворювання може мати не тільки пацієнт з АІГ, вони з більш високою частотою зустрічаються у родичів першого ступеня спорідненості таких хворих, тому існує необхідність у ретельному аналізі сімейного анамнезу.
Лабораторні показники
Біохімічний профіль захворювання характеризується переважно картиною гепатиту зі збільшенням рівнів амінотрансфераз та білірубіну, починаючи від незначного до понад 50-кратного перевищення верхньої межі норми, а також із нормальною або помірно підвищеною активністю показників холестазу [13, 19]. Однак ступінь підвищення активності аланінамінотрансферази (АЛТ) не відображає гістологічну тяжкість АІГ. За результатами нещодавно проведених досліджень встановлено, що у пацієнтів з АІГ поряд зі збільшенням активності амінотрансфераз може спостерігатися підвищення активності гамма-глутамілтранспептидази (ГГТ), але не лужної фосфатази (ЛФ), причому цей показник можна використовувати як незалежний прогностичний фактор [26].
З огляду на хвилеподібний перебіг захворювання активність амінотрансфераз і ГГТ може спонтанно нормалізуватися (спонтанна біохімічна ремісія), попри збереження гістологічних ознак запальної активності, а іноді й вираженого запалення. Такі спонтанні біохімічні ремісії мають критичне значення, оскільки іноді вони призводять до несвоєчасного встановлення і/або недооцінки діагнозу.
Підвищення рівня γ-глобуліну або IgG у сироватці крові спостерігається майже у 85% пацієнтів з АІГ, навіть за відсутності цирозу [2]. У 25-39% пацієнтів із гострим початком захворювання показники рівня IgG – у межах норми [36]. Високий рівень IgG – це відмінність, оскільки зазвичай показники рівнів IgA і IgM – у межах норми [13]. Нормалізація активності амінотрансфераз і рівня IgG є діагностичним маркером повної біохімічної ремісії [21].
Аутоантитіла
Специфічні аутоантитіла – основний лабораторний показник АІГ. Реакція непрямої імунофлюоресценції (РНІФ) – найкращий та оптимальний метод визначення аутоантитіл у повсякденній практиці [34], за винятком анти-SLA/LP. Водночас АМА можна легко визначити шляхом попереднього РНІФ-скринінгу, що допомагає встановити поєднання або варіантні форми АІГ-ПБХ. Сироватку слід титрувати. При виконанні РНІФ у дорослих значним титром вважається 1:40 і вище. Інші імуногістохімічні методи, зокрема твердофазного імуноферментного аналізу (ІФА) або імуноблотинг, можна використовувати для визначення таких антитіл, як анти-LKM1, анти-LKM3, анти-LC1 та анти-SLA/LP.
ANA і SMA – маркери АІГ‑1, який зустрічається у 75-90% пацієнтів [33], однак вони не є специфічними і мають широкий діапазон гетерогенності, а також широкий спектр титрів. Незважаючи на те що цільовий антиген чітко встановлений, ні анти-LKM1, ні анти-LC1 не є специфічними для АІГ. Вони описані у невеликої частини (5-10%) дорослих і дітей із хронічним гепатитом C [16].
Анти-SLA/LP – єдине специфічне для АІГ аутоантитіло, тому має високу діагностичну значимість. Анти-SLA/LP визначаються приблизно у 30% пацієнтів з АІГ і частіше пов’язані з наявністю звичайних аутоантитіл, нерідко – анти-Ro‑52 [25], але іноді їх виявляють як єдине антитіло. Наявність цих антитіл дозволяє виявити пацієнтів із більш тяжким ураженням печінки [11], хоча їх прогностична значимість однозначно не встановлена [25]. АМА – специфічний серологічний маркер ПБХ – іноді виявляється у пацієнтів із класичним фенотипом АІГ без ознак ПБХ (у 8-12% хворих) і може бути показником наявності ПБХ як супутнього або основного захворювання [12]. Так чи інакше, групування та лікування пацієнтів слід здійснювати відповідно до клінічних даних.
Гістологія
Необхідною умовою для встановлення діагнозу АІГ є дані біопсії печінки [3]. Гістологічне дослідження слід проводити не тільки з метою діагностики, а й для вибору тактики лікування. За відсутності протипоказань його слід виконати до початку лікування [3]. Типова гістологічна картина АІГ передбачає наявність кожної з таких ознак: перипортального гепатиту, лімфоплазмоцитарного інфільтрату в портальних трактах, який поширюється на дольки, емперіполез (активне проникнення однієї клітини у більшу клітину без пошкодження останньої) та формування гепатоцитарних розеток.
Діагноз АІГ, як правило, ґрунтується на аналізі типових проявів захворювання і виключенні інших причин хронічного ураження печінки (табл. 2) [3].
Група експертів IAIHG у 1993 р. кодифікувала діагностичні критерії АІГ і діагностичну систему їх кількісної оцінки [19]. У 1999 р. їх переглянули [3], а нещодавно у спрощеному вигляді запропонували для повсякденного застосування у клінічній практиці (табл. 3) [13].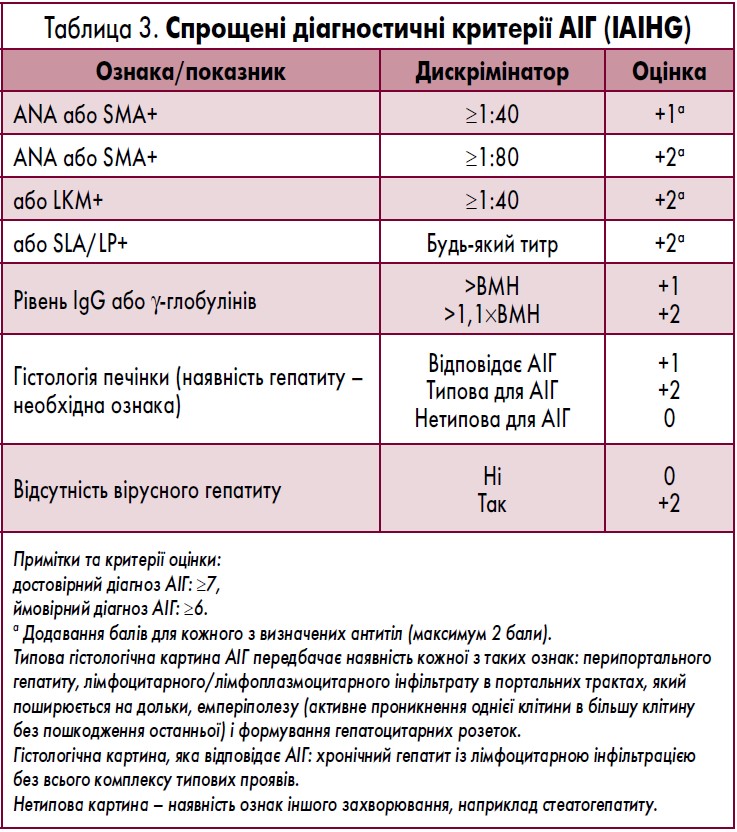
Очевидні прояви захворювання дозволяють запідозрити АІГ, а застосування вказаних критеріїв – встановити діагноз [19]. На жаль, у багатьох випадках виникають труднощі у діагностиці. Таких пацієнтів рекомендовано направляти до гепатолога, який має досвід діагностики та лікування АІГ. У пацієнтів із безсимптомним початком і поступовим прогресуванням захворювання без виражених симптомів діагноз ґрунтується, головним чином, на лабораторних даних. Таким чином, план обстеження пацієнтів з АІГ включає такі основні елементи, як визначення органонеспецифічних аутоантитіл та типової або характерної гістологічної картини за відсутності маркерів вірусного гепатиту. Дані гістологічного дослідження також є підставою для встановлення діагнозу.
Лікування АІГ
Мета лікування АІГ – досягнення повної ремісії захворювання та запобігання прогресуванню ураження печінки. Для цього необхідна практично постійна підтримувальна терапія або індукція стійкої ремісії з подальшою відміною лікування.
Сучасні схеми імуносупресивної терапії засновані на результатах досліджень, опублікованих понад 20-30 років тому [5, 8, 30]. У ході цих досліджень встановлено, що раніше не лікований помірний або тяжкий АІГ характеризується дуже поганим прогнозом, а імуносупресивна терапія покращує біохімічні показники функції печінки, зменшує вираженість симптомів та продовжує життя пацієнтів.
Сумнівною виглядає користь імуносупресивної терапії в аспекті поліпшення результатів лікування у пацієнтів похилого віку без клінічних проявів зі слабкою некрозапальною активністю за даними біопсії печінки, тому тактика лікування у таких випадках чітко не регламентована. Зниження ризику субклінічного прогресування захворювання та його переходу у клінічно виражену форму, а також досягнення повної або стійкої відповіді на лікування переважує пов’язані з ним побічні ефекти.
Однак слід визнати, що нелікований АІГ часто характеризується хвилеподібним непрогнозованим перебігом і у значної частини пацієнтів без клінічних проявів симптоми з’являться у подальшому [15], з можливим його прогресуванням до термінальної стадії ураження печінки [5]. Хвилеподібний перебіг захворювання і ризик субклінічного прогресування зумовлюють необхідність регулярного обстеження, у тому числі виконання біопсії печінки, тих пацієнтів із легкою формою хвороби, які не отримують лікування та у яких спостерігаються зміни активності АЛТ і/або рівня IgG.
Лікування пацієнтів із клінічними проявами АІГ та з вираженим фіброзом/цирозом необхідно розпочинати відразу, оскільки ці показники є негативними прогностичними факторами [2, 15]. З огляду на прогресуючий характер АІГ та ефективність імуносупресивної терапії рекомендовано проводити лікування усіх пацієнтів з активним захворюванням. Слід наголосити, що навіть за наявності вираженого фіброзу та цирозу у результаті успішного лікування можна досягти значного регресу склеротичних змін.
Окрім поданого вище, ведення пацієнтів з АІГ передбачає своєчасне розпізнавання позапечінкових проявів і симптомів асоційованих із АІГ аутоімунних захворювань, а також спостереження на предмет специфічних для цього захворювання і пов’язаних з лікуванням ускладнень. У деяких випадках не потребують лікування тільки хворі зі спонтанною ремісією. Таких пацієнтів слід активно спостерігати та проводити обстеження кожні 3-6 міс.
Для лікування пацієнтів з АІГ застосовують комбінацію преднізо(ло)н + азатіоприн, яка відрізняється найбільш сприятливими характеристиками, поєднуючи високу ефективність і мінімальні побічні ефекти.
Незважаючи на те що ефективність монотерапії преднізоном і комбінації преднізон + азатіоприн вважають однаковою [21], краще призначати комбіновану терапію першої лінії, особливо у пацієнтів із високим ризиком побічних ефектів (у постменопаузі, з остеопорозом, лабільним цукровим діабетом, лабільною гіпертензією, емоційною нестабільністю та ожирінням). Для жінок молодого віку важливим аспектом низького комплаєнсу є збільшення маси тіла і поява косметичних дефектів внаслідок лікування кортикостероїдами, що може негативно позначитися на результатах лікування.
Рекомендовані режими дозування преднізолону та азатіоприну представлені у таблиці 4 [5].  Лікування азатіоприном можна розпочинати в будь-якій ситуації, якщо у пацієнта рівень білірубіну нижче 100 мкмоль/л. Початкова доза азатіоприну становить 50 мг/добу. Підвищують початкову дозу, враховуючи наявність побічних ефектів та відповідь на підтримуючу дозу 1-2 мг/кг маси тіла. Азатіоприн слід застосовувати обережно у пацієнтів із цитопенією, злоякісними новоутвореннями, дефіцитом тіопуринметилтрансферази (ТМТ), а також у вагітних. У цих ситуаціях необхідно індивідуально оцінювати співвідношення ризику і користі.
Лікування азатіоприном можна розпочинати в будь-якій ситуації, якщо у пацієнта рівень білірубіну нижче 100 мкмоль/л. Початкова доза азатіоприну становить 50 мг/добу. Підвищують початкову дозу, враховуючи наявність побічних ефектів та відповідь на підтримуючу дозу 1-2 мг/кг маси тіла. Азатіоприн слід застосовувати обережно у пацієнтів із цитопенією, злоякісними новоутвореннями, дефіцитом тіопуринметилтрансферази (ТМТ), а також у вагітних. У цих ситуаціях необхідно індивідуально оцінювати співвідношення ризику і користі.
Крім класичного режиму преднізолон + азатіоприн, запропоновано кілька модифікацій, що використовуються у клінічній практиці декількох спеціалізованих центрів.
Ще одна обґрунтована раціональна стратегія – відстрочене застосування азатіоприну. Лікування починають із монотерапії преднізоном. Відстрочене застосування азатіоприну (здебільшого приблизно на 2 тижні) може виявитися доцільним у лікуванні пацієнтів з АІГ, оскільки, з одного боку, дозволяє вирішити питання зі встановленням діагнозу, а з іншого – уникнути діагностичної дилеми розмежування азатіоприн-індукованої гепатотоксичності та первинної відсутності відповіді на початкову терапію. Гепатотоксична дія азатіоприну спостерігається рідко, проте у пацієнтів із пізньою стадією ураження печінки частота цього побічного ефекту підвищується [20]. Загалом при АІГ терапію слід коригувати залежно від відповіді, режими лікування мають бути індивідуалізовані залежно від ефективності та переносимості терапії.
Найбільш бажаний результат лікування пацієнтів із АІГ – повна клінічна, біохімічна та гістологічна ремісія захворювання зі стійкою відповіддю після закінчення терапії. Однак у більшості хворих цієї мети досягти не вдається. У 80-90% пацієнтів активність амінотрансфераз після початку імуносупресивної терапії швидко знижується. Приблизно у 20% пацієнтів стійка ремісія після припинення імуносупресивної терапії досягається шляхом застосування обмеженої за тривалістю терапії (медіана спостереження понад 6 років) [10], причому цей показник можна покращити, якщо перед відміною лікування використовувати більш суворі критерії. Первинна неефективність імуносупресивної терапії спостерігається лише у невеликої частини хворих з АІГ.
У разі відсутності відповіді на лікування (або дуже слабкої відповіді) необхідно переглянути діагноз і/або проаналізувати дотримання пацієнтом режиму лікування. Наприклад, високий ризик неефективності лікування спостерігається в осіб молодого віку неєвропейського походження з гострим або блискавичним початком та проявами зливного некрозу у тканини печінки [23, 37]. Пацієнтів із ПН і відсутністю відповіді у вигляді зниження рівня білірубіну та індексу MELD на тлі лікування слід своєчасно направити у центр із трансплантації, оскільки без ТП захворювання з такими проявами характеризується високою смертністю [37].
У пацієнтів із неповною відповіддю, незважаючи на повторне підтвердження діагнозу і дотримання режиму лікування, слід підвищити дозу преднізолону та азатіоприну або призначити інші препарати (мофетил мікофенола, такролімус, циклофосфан або інші цитостатики). У пацієнтів із непереносимістю азатіоприну препаратом вибору другої лінії терапії є мофетил мікофенола (ММФ). Альтернативний варіант – застосування 6 меркаптопурину або 6 тіогуанінових нуклеотидів при непереносимості азатіоприну.
Пацієнтів із гострим тяжким АІГ слід починати лікувати якомога раніше високими дозами кортикостероїдів внутрішньовенно (≥1 мг/кг маси тіла). Відсутність поліпшення протягом кількох днів є показанням до включення пацієнта в лист очікування для першочергової ТП.
Біохімічною ремісією вважається нормалізація рівнів IgG та амінотрансфераз. Гістологічною ремісію вважається нормальна гістологічна картина або мінімальні прояви гепатиту (Індекс активності гепатиту – ІАГ <4).
Тривалість імуносупресивної терапії має становити мінімум 3 роки і не менше 24 міс після повної нормалізації рівнів IgG та амінотрансфераз. У разі недосягнення біохімічної ремісії лікування продовжують. Якщо біохімічна ремісія зберігається протягом більш ніж 2 роки, перед припиненням лікування слід провести біопсію печінки. Якщо гістологічна активність захворювання зберігається (ІАГ >3), лікування не припиняють.
Лише у деяких випадках ремісія зберігається без проведення підтримувальної терапії. Рецидив найчастіше виникає протягом 12 міс після припинення лікування, однак він можливий і через кілька років. Тому після відміни терапії пацієнтів слід активно спостерігати. Диспансерне спостереження таких хворих здійснюється протягом усього життя. У разі рецидиву підвищенню рівня IgG може передувати підвищення активності амінотрансфераз.
У разі рецидиву або загострення захворювання застосовують такі самі дози кортикостероїдів, як і при індукційному режимі. Своєчасне виявлення рецидиву дозволяє застосовувати більш низькі дози імунодепресантів для досягнення повної ремісії. У разі рецидиву захворювання після адекватної імуносупресії та відміни препаратів або у разі загострення на тлі адекватної підтримувальної терапії імуносупресивна терапія має бути постійною. У пацієнтів із легкою формою захворювання і непереносимістю азатіоприну можна застосовувати монотерапію преднізолоном.
Дозу препаратів при підтримувальній терапії слід підбирати таким чином, щоб забезпечити стабільну ремісію з нормалізацією рівнів IgG та амінотрансфераз. Частоту рецидивів після відміни преднізолону можна зменшити шляхом застосування азатіоприну в дозі до 2 мг/кг/добу.
У пацієнтів без цирозу як індукційну терапію можна застосовувати комбінацію будесониду з азатіоприном. Ця комбінація рекомендована пацієнтам із супутніми захворюваннями, які можуть загостритися на тлі лікування преднізо(ло)ном. Довгострокові дані щодо ефективності та безпеки будесоніду при АІГ відсутні. У пацієнтів із відповіддю на преднізо(ло)н, але з тяжкими специфічними для кортикостероїдів побічними ефектами за умови, якщо азатіоприн у достатній дозі не забезпечує підтримання ремісії, рекомендовано замінити преднізо(ло)н на будесонид.
Моніторинг ефективності лікування
До початку терапії комбінацією преднізолон + азатіоприн необхідно провести обстеження пацієнта за основними клінічними та лабораторними показниками, у подальшому протягом перших 4 тижнів лікування ці показники слід регулярно контролювати. Після зменшення дози кортикостероїдів інтервал між обстеженнями можна збільшити до 1-3 міс.
Перед початком терапії кортикостероїдами необхідно виміряти щільність кісткової тканини. Усі пацієнти, які отримують кортикостероїди, мають приймати вітамін D і препарати кальцію. У пацієнтів із неповною відповіддю на прийом будесоніду рекомендовано замінити його на преднізо(ло)н (початкова доза >20 мг/добу).
У деяких пацієнтів можна не досягти повної відповіді, тому метою лікування має бути мінімальна можлива біохімічна активність із мінімумом побічних ефектів. У таких випадках може виникнути потреба у гістологічному контролі ефективності лікування і/або прогресування захворювання.
Перехресний синдром ПБХ і АІГ
Через відсутність кодифікованого підходу до діагностики дані щодо поширеності цієї форми варіюють. Загалом вважається, що поширеність варіанта АІГ-ПБХ становить 8-10% серед дорослих із діагнозом ПБХ або АІГ [14]. Сьогодні для діагностування варіанта АІГ-ПБХ найчастіше застосовують Паризькі критерії – наявність не менше 2 із 3 основних критеріїв кожного захворювання.
Для ПБХ:
1) активність ЛФ ≥ 2 × ВМН або ГГТ ≥ 5 × ВМН;
2) наявність АМА;
3) виражені ураження жовчних проток у біопсії препарату печінки.
Для АІГ:
1) активність АЛТ ≥ 5 × ВМН;
2) рівень IgG ≥ 2 × ВМН у сироватці крові або наявність SMA;
3) помірний або виражений перипортальний або перісептальний лімфоцитарний дрібновогнищевий ступінчастий некроз у біопсії препарату печінки [5].
Встановлено, що критерії, чітко визначені Chazouilleres та співавт. [5], з високою чутливістю (92%) і специфічністю (97%) дозволяють виявити пацієнтів із клінічним діагнозом варіанта АІГ-ПБХ. У рекомендаціях зазначено, що можливість наявності цього варіанта завжди слід враховувати, якщо діагностований ПБХ слабко реагує на застосування урсодезоксихолевої кислоти (УДХК), оскільки це пов’язано з вибором особливої тактики лікування (наприклад, імуносупресії) [5]. Одночасна наявність ознак обох захворювань – звичне явище, проте зауважимо, що в окремих випадках початок АІГ за часом не відповідає розвитку ПБХ, який зазвичай розвивається раніше. Проте у більшості випадків можна встановити домінуюче захворювання – це переважно ПБХ [4].
За наявності ознак ПБХ і АІГ перебіг захворювання є більш тяжким, ніж при звичайному ПБХ, і характеризується вищою частотою поширеного фіброзу на момент встановлення діагнозу (навіть у пацієнтів молодого віку). У більшості публікацій відзначається також більш несприятливий прогноз у таких випадках стосовно біохімічної відповіді на прийом УДХК, прогресування фіброзу і смерті, пов’язаної з ПН [6]. Незважаючи на відсутність контрольованих досліджень, у рекомендаціях EASL на підставі результатів невеликих досліджень зазначено про необхідність додавання кортикостероїдів (преднізолону або будесоніду) або на момент встановлення діагнозу варіантного синдрому, або у разі недостатньої біохімічної відповіді після 3 міс застосування УДХК [29].
Нещодавно опубліковано результати масштабного багатоцентрового дослідження за участю 88 пацієнтів, у ході якого 30 хворих як терапію першої лінії отримували УДХК, 58 – комбінацію УДХК та імунодепресантів (преднізон ± азатіоприн). У пацієнтів із помірним перипортальним гепатитом ефективність монотерапії УДХК і комбінованої терапії стосовно біохімічної відповіді була подібною (80%), тоді як у хворих із тяжким гепатитом ефективність монотерапії УДХК була значно нижчою (14 vs 71%). Наявність поширеного фіброзу була пов’язана з відсутністю відповіді на комбіновану терапію, але не на монотерапію УДХК. У результаті терапії імуносупресивними препаратами другої лінії (циклоспорином, такролімусом і ММФ) досягнуто біохімічної ремісії у половини пацієнтів з відсутністю відповіді на початкову імуносупресію [27]. Ці дані свідчать на користь доцільності застосування комбінації УДХК та імунодепресантів як терапії першої лінії у хворих із ПБХ і тяжким перісептальним гепатитом. Існує думка, що при тривалому лікуванні за наявності відповіді дозу імуносупресивних препаратів можна зменшити, а частота успішного припинення лікування є вищою, ніж при класичному АІГ [27]. У пацієнтів із ПБХ, у яких розвивається АІГ (послідовний варіантний синдром) та які отримували УДХК, необхідно застосовувати імунодепресанти [28].
Отже, АІГ, незважаючи на чіткі діагностичні критерії та схеми лікування з доведеною ефективністю, є складним для курації. За наявності клінічних проявів захворювання завдання сімейного лікаря та терапевта – запідозрити АІГ. Підтверджувати діагноз, підбирати схеми лікування та здійснювати тривале спостереження таких пацієнтів мають гастроентерологи та гепатологи у спеціалізованих центрах.
Література
1. Abe M., Mashiba T., Zeniya M., Yamamoto K., Onji M., Tsubouchi H. et al. Present status of autoimmune hepatitis in Japan: a nationwide survey. J Gastroenterol, 2011; 46: 1136-1141.
2. Al-Chalabi T., Underhill J.A., Portmann B.C., McFarlane I.G., Heneghan M.A. Impact of gender on the long-term outcome and survival of patients with autoimmune hepatitis. J Hepatol, 2008; 48: 140-147.
3. Alvarez F., Berg P.A., Bianchi F.B., Bianchi L., Burroughs A.K., Cancado E.L. et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol, 1999; 31: 929-938.
4. Boberg K.M., Chapman R.W., Hirschfield G.M., Lohse A.W., Manns M.P., Schrumpf E. et al. Overlap syndromes: the International Autoimmune Hepatitis Group (IAIHG) position statement on a controversial issue. J Hepatol, 2011; 54: 374-385.
5. Chazouilleres O., Dalekos G., Drenth J. EASL Clinical Practice Guidelines: Autoimmune hepatitis J of Hepatol, 2015: 63.
6. Chazouilleres O., Wendum D., Serfaty L., Rosmorduc O., Poupon R. Long term outcome and response to therapy of primary biliary cirrhosis-autoimmune hepatitis overlap syndrome. J Hepatol, 2006; 44: 400-406.
7. Chen J., Eslick G.D., Weltman M. Systematic review with meta-analysis: clinical manifestations and management of autoimmune hepatitis in the elderly. Aliment Pharmacol Ther, 2014; 39: 117-124.
8. Cook G.C., Mulligan R., Sherlock S. Controlled prospective trial of corticosteroid therapy in active chronic hepatitis. Q J Med, 1971; 40: 159-185.
9. Czaja A.J. Autoimmune hepatitis in special patient populations. Best Pract Res Clin Gastroenterol, 2011; 25: 689-700.
10. Czaja A.J., Menon K.V., Carpenter H.A. Sustained remission after corticosteroid therapy for type 1 autoimmune hepatitis: a retrospective analysis. Hepatology, 2002; 35: 890-897.
...
38. Yeoman A.D., Westbrook R.H., Zen Y., Maninchedda P., Portmann B.C., Devlin J. et al. Early predictors of corticosteroid treatment failure in icteric presentations of autoimmune hepatitis. Hepatology, 2011; 53: 926-934.
Повний список літератури знаходиться в редакції.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 2 (48), травень 2018 р.





