3 липня, 2018
Ювенільний ідіопатичний артрит
3акінчення. Початок у № 1 (44), стор. 39-41.
 Центральне місце у проблемі ЮІА займають питання лікування, від своєчасності та адекватності якого залежить прогноз захворювання і, напевне, подальша доля дитини. Терапевтична доктрина, спрямована на боротьбу з цим серйозним захворюванням, ґрунтується на широкому арсеналі протиревматичних засобів, що включають НПЗП, ГК, базисні препарати. Накопичені в останні роки відомості про молекулярні механізми ревматичного запалення, особливості та роль цитокінової регуляції системи імунітету та аутоімунітету сприяли вдосконаленню методів лікування ЮІА.
Центральне місце у проблемі ЮІА займають питання лікування, від своєчасності та адекватності якого залежить прогноз захворювання і, напевне, подальша доля дитини. Терапевтична доктрина, спрямована на боротьбу з цим серйозним захворюванням, ґрунтується на широкому арсеналі протиревматичних засобів, що включають НПЗП, ГК, базисні препарати. Накопичені в останні роки відомості про молекулярні механізми ревматичного запалення, особливості та роль цитокінової регуляції системи імунітету та аутоімунітету сприяли вдосконаленню методів лікування ЮІА.
Головним орієнтиром для вибору адекватної схеми лікування є нозологічна форма ЮІА, прогноз перебігу та оцінка ризику інвалідизації пацієнта внаслідок захворювання. Терапія має бути обов’язково випереджаючою, агресивною, давати максимальний позитивний лікувальний ефект, але запобігати побічній дії медикаментозних препаратів. Лікування кожного пацієнта з ЮІА має бути індивідуальним, його призначає, контролює та коригує дитячий кардіоревматолог.
Лікувальна тактика при ЮІА:
- терапію розпочинають відразу після встановлення діагнозу ЮІА;
- тяжкість перебігу захворювання має визначати агресивність базисної терапії.
Головні завдання лікування ЮІА:
- ліквідація або значне зменшення клінічних проявів суглобового синдрому, відновлення функціонального стану опорно-рухового апарату;
- запобігання прогресуванню захворювання (залученню у патологічний процес внутрішніх органів, розвитку амілоїдозу);
- запобігання розвитку ускладнень призначеного лікування.
Немедикаментозна терапія
І. Модифікація способу життя.
- У період загострення обмежується рухова активність, але повна іммобілізація протипоказана, оскільки сприяє розвитку контрактур, остеопорозу, анкілозу. Індивідуально підібрані фізичні вправи сприяють збереженню функціональної активності суглобів.
- Виключають психоемоційні перевантаження, стреси. Дитина, навіть при адекватній терапії, повинна мати полегшений режим, домашнє навчання.
- Слід уникати перебування на сонці, перегрівання, переохолодження.
ІІ. Дієта має включати продукти з підвищеним вмістом кальцію, доцільно призначати вітамін D3 для профілактики остеопорозу. Раціон має бути з низьким вмістом вуглеводів та жирів, містити підвищену кількість вітамінів.
ІІІ. Лікувальна фізкультура – найважливіший компонент лікування ЮІА.
- Необхідні щоденні вправи для збільшення обсягу рухів у суглобах, усунення згинальних контрактур, відновлення м’язової маси.
- Лікувальну фізкультуру потрібно проводити відповідно до індивідуальних можливостей та загального стану хворого, обсягу ураження суглобів.
ІV. Ортопедичну корекцію має призначати лікар-ортопед із використанням ортопедичних пристроїв.
Клінічні рекомендації ACR (2011): групи лікування
Нові керівні принципи проведення та моніторингу лікування дітей із ЮІА були розроблені Американською колегією ревматологів (ACR, 2011) для широкого впровадження у практичну медицину. Цієї стратегії дотримуються при призначенні терапії дітям з ЮІА, яка передбачає застосування:
- НПЗП;
- внутрішньосуглобових ін’єкцій ГК;
- імуномодулюючих препаратів;
- біологічних імуномодулюючих препаратів;
- системних ГК.
Для прийняття терапевтичних рішень у запропонованих алгоритмах (рис. 1-4) використовують поняття «групи лікування» з метою стисло представити клінічні рішення терапії ЮІА. Виділяють 5 груп лікування ЮІА.
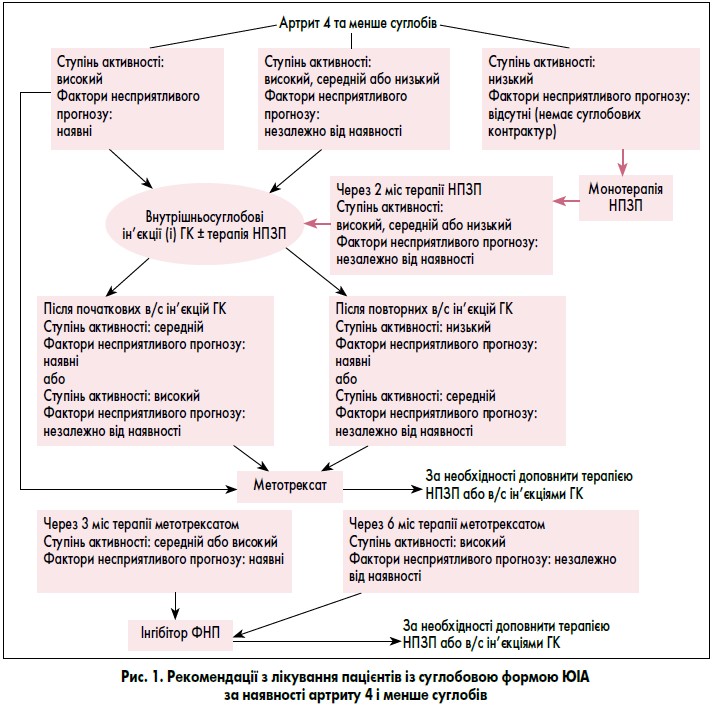
I група. Пацієнти з анамнезом артриту 4 і менше суглобів.
Ця група лікування включає пацієнтів таких категорій ILAR: з персистуючим олігоартритом, псоріатичним артритом, артритом, асоційованим з ентезитами, та недиференційованим артритом, у яких артрит протягом усього періоду захворювання розвинувся лише в 4 або менше суглобах. Пацієнтів, які тепер мають артрит 4 суглобів і менше, але в яких у минулому був артрит 5 суглобів і більше, слід відносити до категорії пацієнтів з анамнезом артриту 5 та більше суглобів. Пацієнти з системним артритом та сакроілеїтом належать до окремих груп лікування.
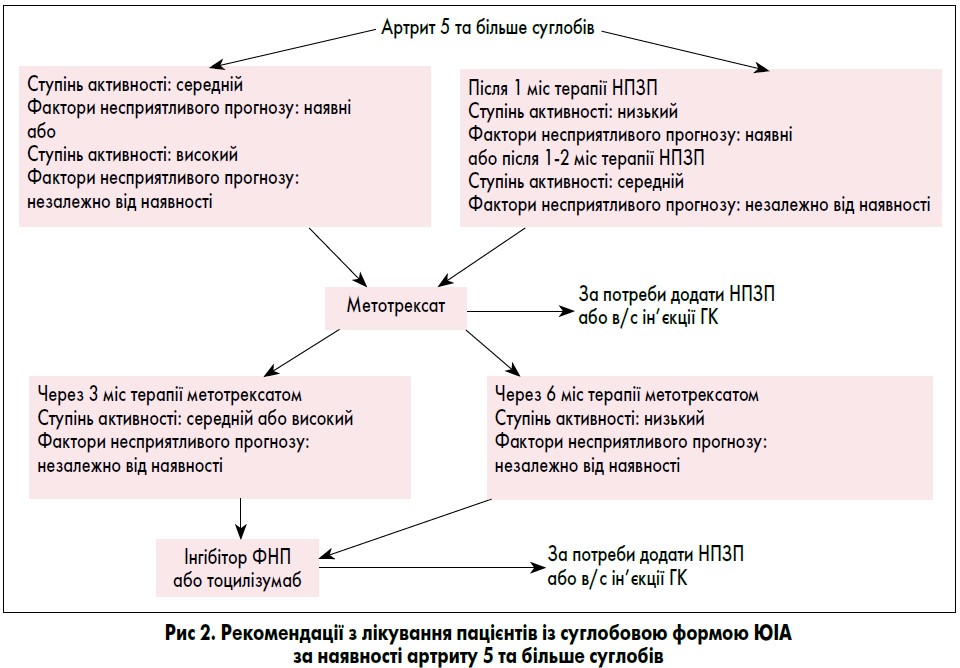
II група. Пацієнти з анамнезом артриту 5 та більше суглобів.
Ця група включає пацієнтів таких категорій ILAR: з поширеним олігоартритом, поліартритом із негативним РФ, із РФ-позитивним артритом, псоріатичним артритом, артритом, асоційованим із ентезитами, та недиференційованим артритом, у яких артрит протягом усього періоду захворювання розвинувся в 5 або більше суглобах. Пацієнти цієї групи необов’язково тепер повинні мати артрит 5 або більше суглобів. Пацієнти з системним артритом та сакроілеїтом належать до окремих груп лікування.
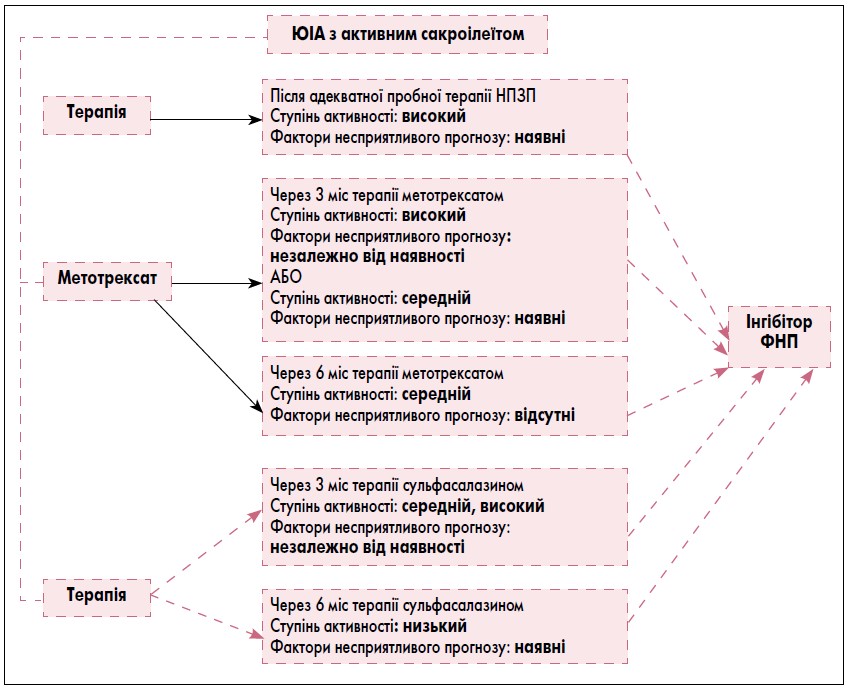
III група. Пацієнти з активним сакроілеїтом.
До цієї групи належать усі пацієнти з клінічними та радіологічними ознаками активного сакроілеїту, переважно пацієнти таких категорій ILAR: з артритом, асоційованим з ентезитами, та псоріатичним артритом.
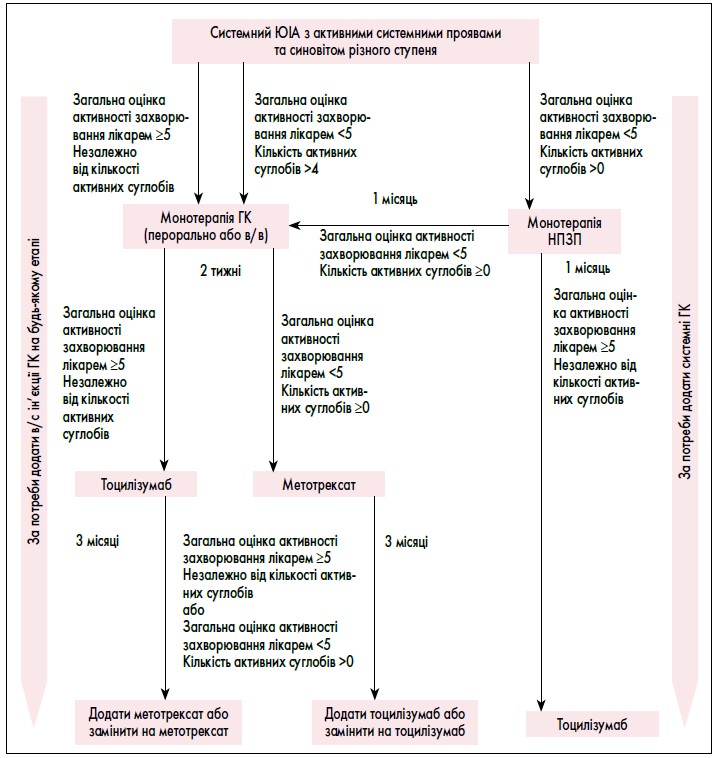
IV група. Пацієнти з системним ЮІА з активними системними проявами та синовітом різного ступеня.
У цю групу лікування включають усіх пацієнтів, які задовільняють ILAR-критерії системного артриту, мають системні прояви незалежно від кількості активних суглобів. Наприклад, до цієї групи належить пацієнт, у якого артрит швидко розрішився у результаті застосування НПЗП, але при цьому збереглася постійна підвищена температура і/або інші системні прояви.
Рис. 3. Рекомендації з лікування пацієнтів з ЮІА за наявності активних системних проявів та синовіту різного ступеня
NB! Якщо системні прояви (але не артрит) відповідають на терапію, подальші терапевтичні рішення мають ґрунтуватися на рекомендаціях для когорти «Системний ЮІА без активних системних проявів та з синовітом різного ступеня».
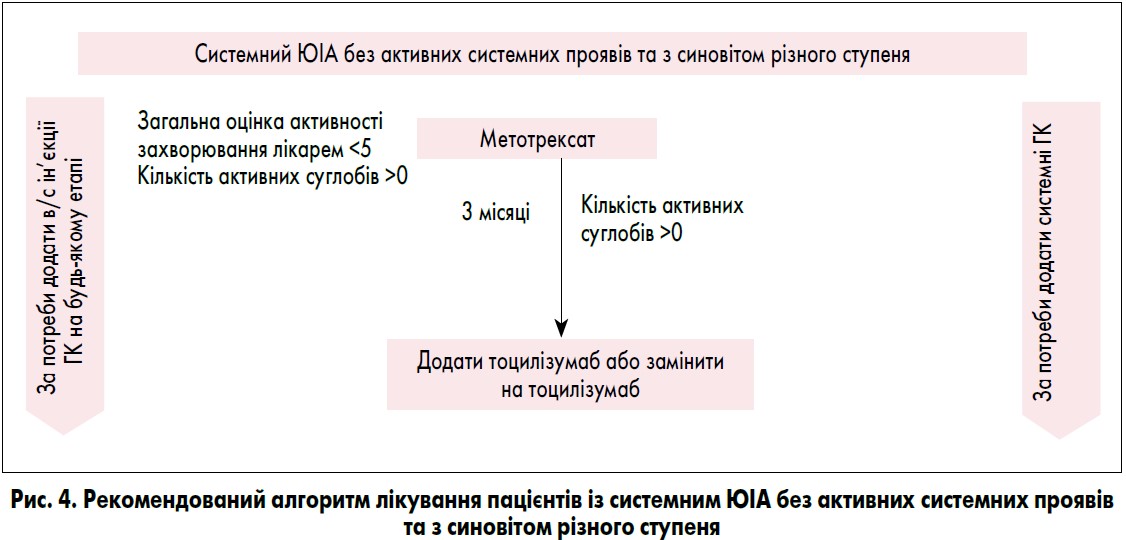
V група. Системний ЮІА без активних системних проявів та з синовітом різного ступеня.
У цю групу лікування включають усіх пацієнтів, які задовільняють ILAR-критерії системного артриту, але не мають активних системних проявів, у тому числі пацієнтів, у яких системні прояви (але не артрит) відповідають на терапію. Наприклад, до цієї групи належить пацієнт, у якого на тлі застосування метотрексату зникли системні прояви, але при цьому є активні суглоби; пацієнт, у якого на тлі застосування метотрексату досягнута мінімальна активність захворювання, зникли всі системні прояви, артрит розрішився, однак згодом розвинулося загострення без системних проявів, але з активним артритом.
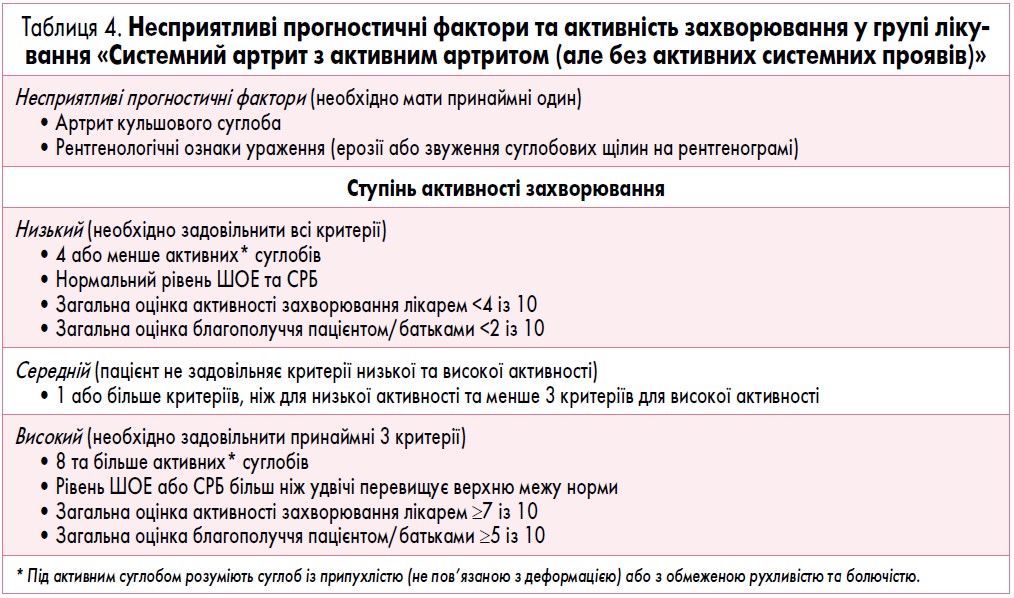
Вибір алгоритму лікування залежить саме від того, до якої категорії належить конкретний пацієнт. Окрім цього, для визначення алгоритму необхідно встановити ступінь активності захворювання і стратифікувати пацієнта залежно від наявності несприятливих прогностичних факторів.
Оцінка ступеня активності захворювання і стратифікація пацієнтів за наявністю несприятливих прогностичних факторів відрізняються для різних груп лікування (табл. 1-4).
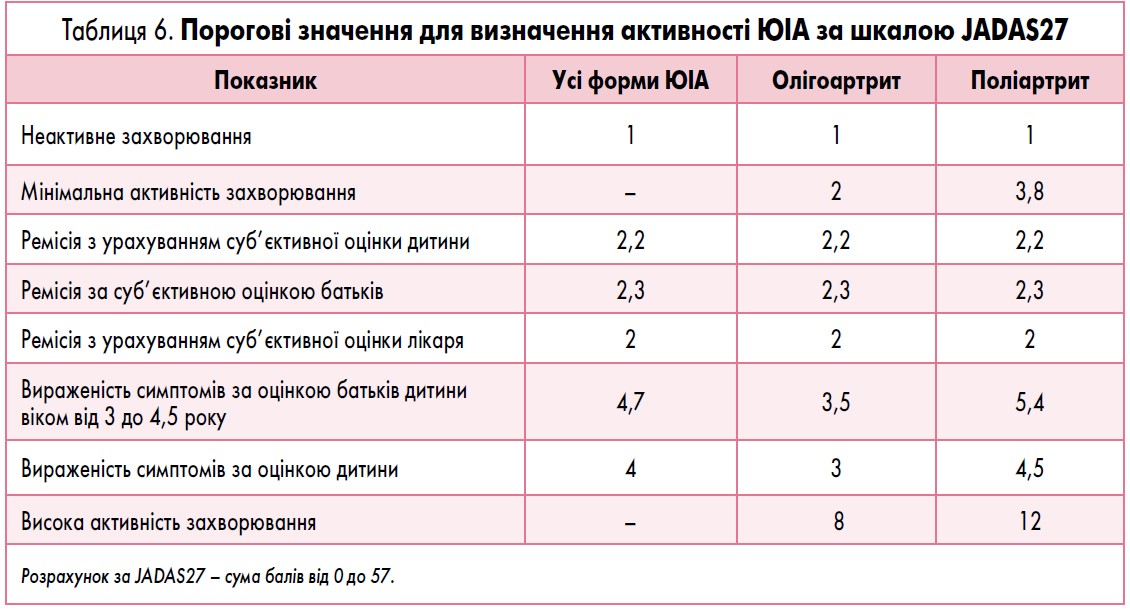
Для проведення оцінки активності ЮІА використовують шкалу JADAS (Juvenile Arthritis Disease Activity Score). Активність захворювання визначається як сума балів за такими показниками:
- загальна оцінка лікарем (від 0 до 10 балів);
- загальна оцінка пацієнтом/батьками (від 0 до 10 балів);
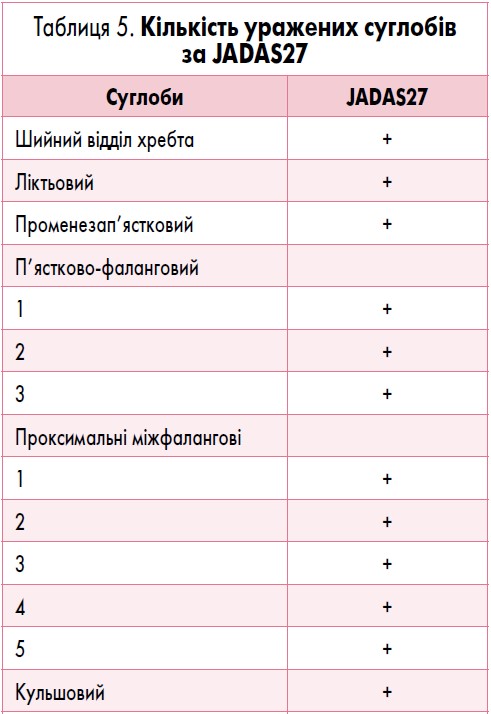
- оцінка стану 71, 27 або 10 певних суглобів і підрахунок кількості суглобів з активним артритом (найбільш доцільно використовувати JADAS27 – табл. 5);
- рівні ШОЕ (визначена методом Вестергрена) або СРБ (нормалізовані до шкали від 0 до 10)*;
 * ШОЕ <20 = 20 мм/год, ШОЕ >120 = 120 мм/год,
* ШОЕ <20 = 20 мм/год, ШОЕ >120 = 120 мм/год,
нормалізація ШОЕ за формулою: (ШОЕ‑20)/10;
СРБ <10 = 10 мг/л, СРБ >110 = 110 мг/л, нормалізація СРБ за формулою: (СРБ‑10)/10.
Загальну оцінку активності захворювання у дитини з ЮІА лікар проводить з урахуванням суб’єктивного сприйняття лікарем стану пацієнта (як підсумкова оцінка загального стану, даних лабораторних та інструментальних досліджень).
Загальна оцінка благополуччя пацієнтом/батьками є суб’єктивною і відображається на шкалі підсумкової оцінки загального стану самим пацієнтом або його батьками (самопочуття, рухова активність, ставлення до навколишнього світу тощо).
Порогові значення для визначення активності ЮІА за шкалою JADAS27 наведено у таблиці 6.
Клінічні рекомендації: медикаментозна терапія
При виборі НПЗП слід керуватися переліком дозволених до застосування в педіатричній практиці препаратів, а також враховувати оптимальне співвідношення ефективності та безпеки.
Дози та кратність прийому НПЗП, рекомендовані дітям і підліткам з ЮІА, такі:
- німесулід (пацієнтам старше 12 років) – по 2-3 мг на 1 кг маси тіла на добу, у 2 прийоми тривалістю курсу до 14 діб;
- мелоксикам (пацієнтам старше 12 років) – по 0,15-0,2 мг на 1 кг маси тіла на добу в 1 прийом;
- диклофенак натрію – по 2-3 мг на 1 кг маси тіла на добу у 3 прийоми;
- ібупрофен – по 20-30 мг на 1 кг маси тіла на добу у 3 прийоми.
Загальною рекомендацією щодо тривалості терапії НПЗП при ЮІА є орієнтування на збереження ознак активності захворювання (насамперед суглобового синдрому). Вибір НПЗП для лікування дитини з ЮІА ґрунтується, головним чином, на індивідуальній ефективності, тривалості дії та, на жаль, вартості препарату. Для зниження токсичності пацієнт має приймати НПЗП під час або після їди, його можна запивати молоком, відваром насіння льону. Необхідно систематично проводити опитування на предмет наявності побічної дії – болю в животі, нудоти, гіркоти та присмаку в роті тощо. При появі симптомів побічної дії, болю з боку ШКТ пацієнт має припинити прийом препаратів та звернутися до лікаря.
Побічні ефекти при застосуванні НПЗП:
- ураження травного тракту: диспептичні розлади, ерозії та виразки шлунка і дванадцятипалої кишки;
- ураження нирок (розвиток інтерстиціального нефриту);
- гематотоксичність: апластична анемія та агранулоцитоз;
- коагулопатія: гальмують агрегацію тромбоцитів (кровотеча з органів ШКТ);
- гепатотоксичність: підвищення активності трансаміназ, поява жовтяниці та розвиток гепатиту;
- реакції гіперчутливості: набряк Квінке, висип, анафілактичний шок;
- бронхоспазм: у хворих на бронхіальну астму.
Одним з основних компонентів комплексної терапії ЮІА є внутрішньосуглобове (в/с) введення ГК. Перевагою цього методу є спрямованість терапії, біодоступність препарату відносно патологічного вогнища, можливість заміни класичної терапії ГК, зменшення побічних ефектів при системному використанні. Для в/с введення використовують метилпреднізолон або комбінований препарат бетаметазону пролонгованої дії.
Загальні правила в/с введення лікарських засобів такі:
- частота введення в один і той самий суглоб не має перевищувати 1 раз на 3 міс;
- одночасно можна проводити пункцію не більше 2 суглобів;
- необхідно строго дотримуватися правил асептики та антисептики при проведенні пункції суглобів та введенні лікарських препаратів.
Протипоказаннями для в/с введення ГКС є інфекційно-запальний процес у суглобі або навколосуглобових тканинах, виражена деформація суглоба, значний остеопороз суглобових відділів кісток, резистентність до терапії системними ГК, відсутність терапевтичного ефекту від попереднього введення препарату.
Алгоритм призначення метотрексату:
- початкова доза – 10 мг/м2 1 раз на тиждень;
- за відсутності ефекту – 15-20 мг/м2 1 раз на тиждень;
- підшкірне введення при збільшенні дози >15 мг/м2 1 раз на тиждень;
- супровідна терапія фолієвою кислотою через добу після призначення препарату у дозі 5 мг на тиждень;
- пріоритет має підшкірне введення препарату.
Терапія інгібітором ФНП рекомендована пацієнтам, які отримали лікування метотрексатом протягом 3 міс та у яких зберігається висока активність захворювання незалежно від наявності несприятливих прогностичних факторів або ступінь активності захворювання середній та наявні несприятливі прогностичні фактори; або тим пацієнтам, у яких після 6 міс терапії метотрексатом ступінь активності захворювання середній та немає несприятливих прогностичних факторів.
За наявності тяжких системних проявів (васкуліту, пневмоніту, кардиту, полісерозиту, тромбоцитопенії) рекомендовано:
1) пульс-терапію метилпреднізолоном 10-20 мг/кг маси тіла протягом 3 днів із подальшим переходом на пероральний прийом ГК у дозі 1 мг/кг протягом 1 міс;
2) введення метотрексату підшкірно або внутрішньом’язово 15-20 мг/м2 1 раз на тиждень;
3) антиагреганти, антикоагулянти – за показаннями;
4) за відсутності ефективності вказаної терапії – тоцилізумаб у комбінації з метотрексатом. Тоцилізумаб дозволений для використання у лікуванні дітей з 2 років. Це імунобіологічний препарат, дія якого спрямована на блокування рецепторів до інтерлейкіну-6 (IL-6), який відіграє ключову роль у патогенезі системного ЮІА.
Системний ЮІА з проявами синдрому активації макрофагів
У 2016 р. за спільною ініціативою Європейської антиревматичної ліги (EULAR), Американської колегії ревматологів (ACR), Міжнародної організації з проведення клінічних досліджень у дитячій ревматології (PRINTO) були опубліковані валідовані класифікаційні критерії синдрому активації макрофагів (САМ) як ускладнення системного ЮІА (А. Ravelli et al., 2016). Вони включають:
- феритин >684 нг/мл;
і будь-які 2 критерії з таких:
- рівень тромбоцитів ≤181×109/л;
- аспартатамінотрансфераза (АСТ) >48 од/л;
- рівень тригліцеридів >156 мг/дл;
- фібриноген ≤360 мг/дл.
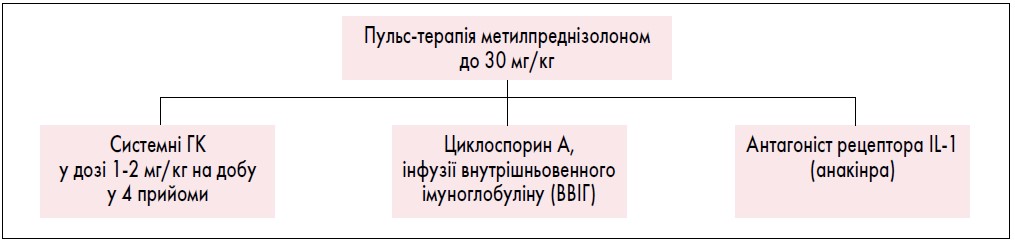
Терапія САМ включає високі дози ГК: пульс-терапія метилпреднізолоном до 30 мг/кг, системні ГК у дозі 1-2 мг/кг на добу, розділеній на 4 прийоми; циклоспорин А (ЦсА), інфузії ВВІГ (рис. 5). Використання імунобіологічних препаратів, у тому числі інгібіторів IL-1, IL-6, ФНП, нерідко асоціюється з розвитком САМ, тому є фактором, що обмежує терапію цими препаратами у вказаної категорії пацієнтів. Однак окремі клінічні описи свідчать про успішне застосування антагоніста рецептора IL-1 (анакінри) в терапії САМ.
Рис. 5. Алгоритм лікування пацієнтів із системним ЮІА з симптомами САМ
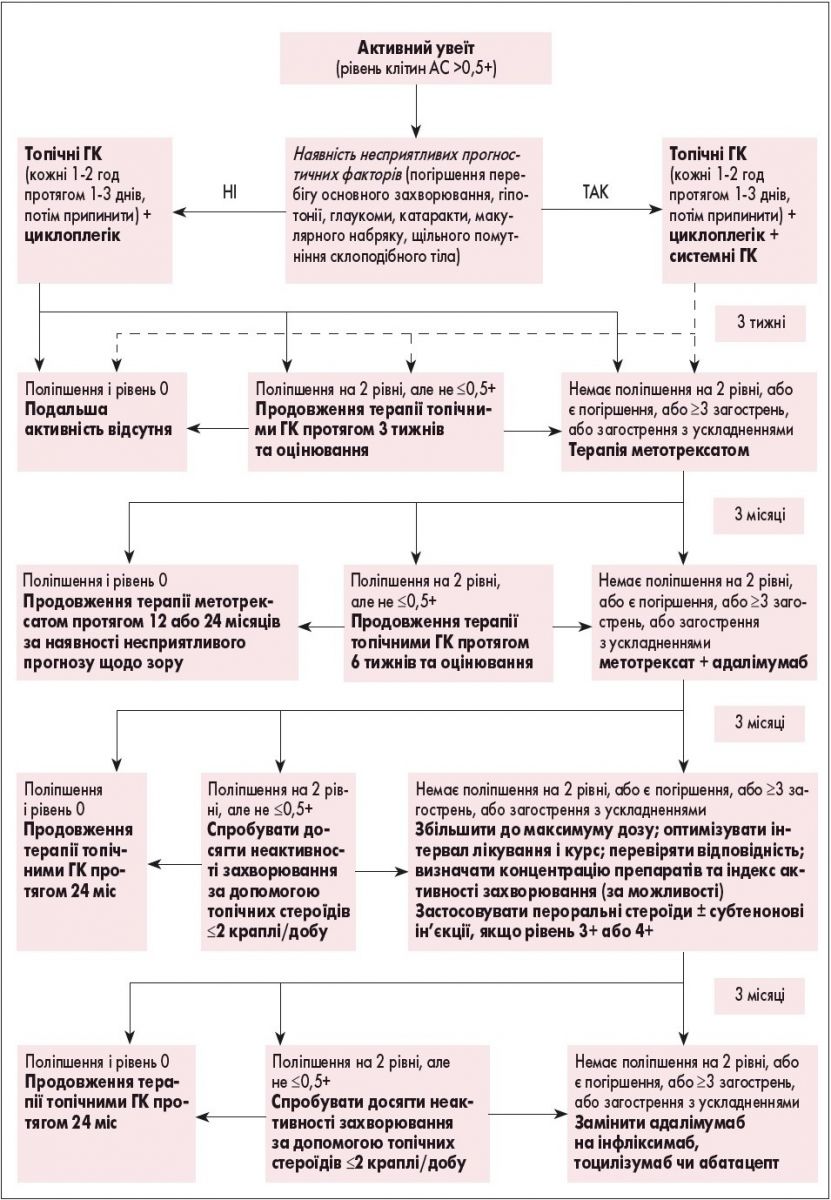
Рекомендації з лікування хворих на ЮІА з увеїтом
Лікування пацієнтів з увеїтом, пов’язаним із ЮІА (рис. 6), має бути послідовним та диференційованим (S.L.N. Clarke, 2016). Спочатку призначають місцеві ГК. У більшості пацієнтів отримують відповідь на початкове лікування. У приблизно 20% пацієнтів з ЮІА та увеїтом або зовсім відсутня відповідь на лікування, або вона є недостатньою. При високому ступені запальної активності, двобічному ураженні очей потрібно призначати системні ГК.
Рис. 6. Рекомендації з лікування хворих на ЮІА з увеїтом
При виборі базисної терапії надається перевага метотрексату. Пацієнтам з обмеженою відповіддю або відсутністю відповіді на призначене лікування як базисний препарат рекомендований адалімумаб. Призначення лікування, спостереження, аналіз ефективності лікування потребують консиліуму дитячого кардіоревматолога та офтальмолога.
Активний сакроілеїт
Як йдеться в матеріалах і методах дослідження F. Pamela та співавт., проведеного у 2014 році, активний сакроілеїт було визначено за наявністю клінічних та візуалізаційних ознак.
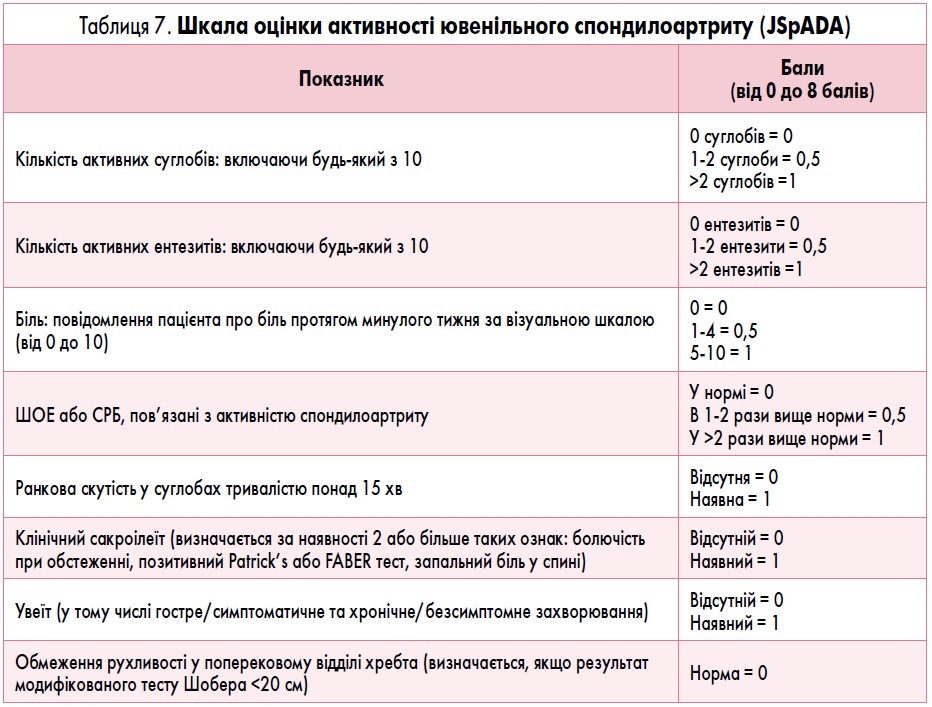
Шкалу оцінки активності захворювання у групі лікування «Пацієнти з активним сакроілеїтом» подано в таблиці 7, алгоритм лікування хворих на ЮІА з активним сакроілеїтом схематично зображено на рис. 7.
Рис. 7. Алгоритм лікування хворих на ЮІА з активним сакроілеїтом
Активність ювенільного спондилоартриту визначають як суму балів за 8 показниками. У кожній категорії кількість балів – від 0 до 1.
Загальна бальна оцінка активності захворювання може становити від 0 до 8 балів.
НПЗП показані при низькій активності запалення, больовому суглобовому синдромі. При виборі НПЗП слід керуватися переліком дозволених до застосування в педіатричній практиці препаратів, а також враховувати оптимальне співвідношення ефективності та безпеки.
Для в/с введення використовують метилпреднізолон або комбінований препарат бетаметазону пролонгованої дії.
Сульфасалазин є препаратом вибору при активності захворювання низького та середнього ступеня та наявності факторів несприятливого прогнозу. Покращення настає через 3 міс, потім дозу можна знизити до підтримуючої протягом періоду від 1 року.
Метотрексат є препаратом вибору при активності низького та середнього ступеня та наявності факторів несприятливого прогнозу.
Інгібітори ФНП. Початкову терапію інгібіторами ФНП рекомендовано пацієнтам з активним сакроілеїтом, які отримали адекватну терапію НПЗП і мають високий ступінь активності захворювання та несприятливі прогностичні фактори. Єдина група препаратів, які схвалено для лікування цієї категорії пацієнтів з ЮІА, – це інгібітори ФНП.
Початкову терапію інгібіторами ФНП також рекомендовано пацієнтам, які отримували метотрексат протягом 3 міс, з високим ступенем активності захворювання, незалежно від наявності несприятливих прогностичних факторів, або з помірною активністю захворювання та несприятливими прогностичними факторами, або тим, які 6 міс отримували метотрексат і мають помірну активність хвороби без несприятливих прогностичних факторів.
Також було рекомендовано починати терапію інгібіторами ФНП у пацієнтів, які 3 міс отримували сульфасалазин, з помірним або високим рівнем активності захворювання, незалежно від наявності несприятливих прогностичних факторів, або після 6 міс терапії сульфасалазином при низькій активності захворювання за наявності несприятливих прогностичних факторів.
Моніторинг безпеки фармакологічної терапії ЮІА
У процесі терапії ЮІА необхідно дотримуватися заходів моніторингу безпеки медикаментозної терапії (табл. 8), звести до мінімуму ризики токсичності та побічних ефектів (M.J. Santos et al., 2016).
Визначення відповіді на терапію, неактивного захворювання та ремісії при ЮІА
Для оцінки ефективності терапії у пацієнтів з ЮІА використовують педіатричні критерії Американської колегії ревматологів (JIA ACR), шкалу JSpADA, критерії неактивного захворювання, результати ультразвукового та рентгенологічного дослідження суглобів.
Патерни ремісії
Медикаментозна ремісія: наявність усіх критеріїв неактивного захворювання протягом 6 послідовних місяців медикаментозного лікування ЮІА.
Безмедикаментозна ремісія: наявність усіх критеріїв неактивного захворювання протягом 12 послідовних місяців, під час яких пацієнт не отримує препарати для лікування ЮІА та увеїту.
Лікар має контролювати споживання кальцію дітьми з ЮІА та надавати рекомендації щодо оптимального добового споживання кальцію, а також розглянути доцільність лікування пацієнтів з ЮІА за допомогою добавок кальцію та вітаміну D для перорального застосування.
Усі хворі на ЮІА потребують обов’язкового контролю сироваткового рівня 25(ОН)D. Рекомендована доза вітаміну D – 2000 МО/добу до досягнення оптимального рівня 25(ОН)D 30 нг/мл. У дітей з ЮІА, які отримують лікування ГК, підвищений ризик розвитку остеопорозу та остеопенії. Призначення курсу лікування ГК є додатковим показанням до застосування добавок кальцію та вітаміну D.
Диспансерне спостереження дітей з ЮІА
- Спостереження дітей з ЮІА в амбулаторно-поліклінічних умовах здійснює дитячий кардіоревматолог, лікар-педіатр з урахуванням рекомендацій спеціалізованого кардіоревматологічного відділення.
- Реабілітаційні заходи (ЛФК, масаж, фізіотерапевтичне лікування) призначає індивідуально консиліум дитячого кардіоревматолога та лікаря-реабілітолога.
- Клінічне обстеження проводять 1 раз на 1-3 міс (залежно від стану дитини, обсягу і тривалості лікування).
- При терапії імунодепресантами 1 раз на 2 тижні проводять клінічний та біохімічний аналіз крові (білок і фракції, сечовина, креатинін, білірубін, АЛТ, АСТ, ЛФ, кальцій, калій, натрій).
- ЕКГ – 1 раз на 3 міс.
- УЗД органів черевної порожнини, серця, нирок, рентгенографію грудної клітки, уражених суглобів проводять 1 раз на 3-6 міс, при загостренні – за показаннями.
- Хворим, які отримують НПЗП і ГК, 1 раз на 6 міс проводять фіброгастродуоденоскопію з біопсією слизової оболонки (на наявність Н. pylori і морфологічне дослідження).
- Огляд окуліста – 1 раз на 3 міс.
- Дітям із системними формами захворювання показане домашнє навчання.
- Під час відвідування школи таким дітям забороняють заняття фізкультурою в загальній групі. Показані заняття ЛФК.
- Дітям, які отримують терапію імунобіологічними препаратами, реакцію Манту і рентгенографію органів грудної клітки проводять кожні 6 міс.
Таким дітям корисно виконувати наземні вправи, рекомендована помірна фізична активність. 1-3 сеанси фізичних вправ на тиждень можуть покращити як функцію м’язів, так і аеробну відповідність фізичним потребам у кисні дітей з ЮІА, які можуть виконувати фізичні вправи в період ремісії хвороби. Наземні вправи як мінімум двічі на тиждень протягом принаймні 6 тижнів можуть допомогти зменшити симптоми та покращити витривалість.
Наземні вправи здатні забезпечити більш виражене покращення за такими показниками, як сила м’язів, виконання завдань з обмеженим відведеним часом, а також функціональний статус.
Вправи, пов’язані з підніманням ваги, необхідні для розвитку оптимальної товщини та щільності кісток у дитячому віці.
Вправи з опором, які обирають індивідуально та виконують під наглядом, є безпечними для дітей, причому вибір таких вправ може залежати від конкретних потреб та індивідуальних особливостей дитини.
Спостереження та лікування пацієнтів з ЮІА у віці старше 18 років
Коли пацієнту виповниться 16-17 років, необхідно здійснити планування його переходу для спостереження у лікаря-ревматолога, про що слід проінформувати батьків і пацієнта, а також встановити попередній контакт із лікарем-ревматологом, який буде проводити подальше спостереження та лікування хворого. План переходу необхідно задокументувати в медичній карті амбулаторного хворого.
Після досягнення пацієнтом 18-річного віку дитячий кардіоревматолог має оформити виписку з медичної карти амбулаторного хворого та направити пацієнта за попередньою домовленістю до лікаря-ревматолога для взяття на диспансерний облік, подальшого спостереження і лікування.
У виписці з медичної карти амбулаторного хворого необхідно вказати таку інформацію: вік пацієнта на початку захворювання, різновид перебігу в дебюті та на теперішній час, попередньо застосовані лікарські засоби із зазначенням ефективності та/або побічних реакцій, супутні захворювання та ускладнення ЮІА.
Після досягнення 18-річного віку спостереження та лікування пацієнтів із діагнозом ЮІА (М08 за МКХ‑10) продовжує здійснювати лікар-ревматолог. Діагноз ЮІА у дорослих підтверджує лікар-ревматолог на підставі попередньої медичної документації. Хворий на ЮІА після досягнення 18-річного віку у стадії ремісії або у період мінімальної активності захворювання потребує обов’язкового первинного огляду лікарем-ревматологом та взяття на диспансерний облік. Пацієнт з ЮІА перебуває на диспансерному обліку протягом усього життя.
Література
1. Ahmad H.S., Othman G., Farrag S.E., El-Hafez A.A., Monir A.A. Subclinical heart failure in juvenile idiopathic arthritis: a consequence of chronic inflammation and subclinical atherosclerosis. Egypt Rheumatol Rehabil, 2016; 43: 78-83.
2. American College of Rheumatology Recommendations for the Treatment of Juvenile Idiopathic Arthritis: Initiation and Safety Monitoring of Therapeutic Agents for the Treatment of Arthritis and Systemic Features. – 2011.
3. Ravelli A. et al. Classification Criteria for Macrophage Activation Syndrome Complicating Systemic Juvenile Idiopathic Arthritis / A European League Against Rheumatism / American College of Rheumatology / Paediatric Rheumatology International Trials Organisation Collaborative Initiative, 2016.
4. Aulie H.A., Selvaag A.M., Gnther A. et al. Arterial haemodynamics and coronary artery calcification in adult patients with juvenile idiopathic arthritis. Annals of the Rheumatic Diseases. Ann Rheum Dis, 2014; 74(8): 1515-1521.
5. Barut К., Adrovic A., ahin S. Juvenile Idiopathic Arthritis. Balkan Med J, 2017 (Mar); 34(2): 90-101.
6. Clarke S.L.N., Sen E.S., Ramanan A.V. Juvenile idiopathic arthritis-associated uveitis (2016). Pediatric. Rheumatoogy, 14: 27.
7. Clinical Commissioning Policy Statement: Biologic Therapies for the treatment of Juvenile Idiopathic Arthritis (JIA), 2015 (July).
8. Consolaro A. et al. Toward a treat-to-target approach in the management of juvenile idiopathic arthritis. Clin Exp Rheumatol, 2012; 30 (4, Suppl 73): 157-62.
9. Coulson E.J., Ng W.-F., Goff I., Foster H.E. Cardiovascular risk in juvenile idiopathic arthritis. Rheumatology, 2013; 52(7): 1163-1171.
10. Feldman D.E., Vinet ., Berard A. et al. Heart Disease, hypertension, gestational diabetes and pre-eclampsia/eclampsia in mothers with juvenile arthritis: A nested case-control study. Arthritis Care & Research, 2016.
11. Giancane G., Consolaro A., Lanni S., Davi S., Schiappapietra B., Ravelli A. Juvenile Idiopathic Arthritis: Diagnosis and Treatment. Rheumatol Ther, 2016; 3: 187-207.
12. Heiligenhaus A. et al. Review for disease of the year: epidemiology of juvenile idiopathic arthritis and its associated uveitis: the probable risk factors. Ocular Immunology Inflammation, 2013; 21(3): 180-91.
13. Weiss P.F., Colbert R.A., Xiao R., Feudtner Ch., Beukelman T., DeWitt E.M., Pagnini I., Wright T.B., Wallace C.A. Development and Retrospective Validation of the Juvenile Spondyloarthritis Disease Activity (JSpADA) Index // Arthritis Care Res (Hoboken). 2014 Dec; 66(12): 1775-1782.
14. Petty R.E., Wedderburn L.R. Juvenile Idiopathic ArthritisTextbook of Pediatric Rheumatology: Elsevier Saunders Company; 2016: 188-284.
15. Ruperto N., Martini A. Juvenile idiopathic arthritis and malignancy. Rheumatology, 2014; 53(6): 968-74.
16. Santos M.J. et al. 2016 Update of the Portuguese Recommendati ons for the Use of Biological Therapies in Children and Adolescents With Juvenile Idiopathic Arthritis.
17. Smolen J.S. et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheumatic Dis, 2016; 75(1): 3-15.
18. Sobel R.E. et al. Safety of celecoxib and nonselective nonsteroidal anti-inflammatory drugs in juvenile idiopathic arthritis: results of the Phase 4 registry. Pediatr Rheumatol (Online J), 2014;12:29.
19. Update of the 2011 American College of Rheumatology Recommendations for the Treatment of Juvenile Idiopathic Arthritis Recommendations for the Medical Therapy of Children With Systemic Juvenile Idiopathic Arthritis and Tuberculosis Screening Among Children Receiving Biologic Medications // ARTHRITIS & RHEUMATISM, 2013; Vol. 65; № 10 (october):
2499-2512.
20. Vastert S., Prakken B. Update on research and clinical translation on specific clinical areas: From bench to bedside: How insight in immune pathogenesis can lead to precision medicine of severe juvenile idiopathic arthritis. Best Practice Res Clin Rheumatol 2014;28(2):229-46.
21. Wallace CA, et al. Trial of early aggressive therapy in polyarticular juvenile idiopathic arthritis. Arthritis Rheumatism, 2012; 64(6): 2012-21.
Тематичний номер «Педіатрія» №2 (45), червень 2018 р.