5 липня, 2018
Подагра: стара та нова ера захворювання
За матеріалами міжнародного симпозіуму, 1-3 березня, м. Львів
На початку березня у Львові відбувся ІІІ міжнародний симпозіум «Захворювання кістково-м’язової системи та вік», присвячений 60-й річниці заснування ДУ «Інститут геронтології ім. Д. Ф. Чеботарьова НАМН України». У рамках заходу було організовано круглий стіл «Подагра: нова та стара ера захворювання», модераторами якого виступили професор кафедри терапії і ревматології Національної медичної академії післядипломної освіти ім. П. Л. Шупика (м. Київ), доктор медичних наук Н. М. Шуба, керівник відділу клінічної фізіології і патології опорно-рухового апарату ДУ «Інститут геронтології ім. Д. Ф. Чеботарьова НАМН України» (м. Київ), президент Української асоціації остеопорозу та Української асоціації менопаузи, андропаузи та захворювань кістково-м’язової системи, член правління Міжнародної асоціації остеопорозу (IOF), президент Українського підрозділу EVIDAS, віце-голова Наукового медичного товариства геронтологів і геріатрів України, доктор медичних наук, професор В. В. Поворознюк і головний ревматолог Киргизької Республіки, президент Асоціації остеопорозу Киргизстана, кандидат медичних наук, доцент О. В. Лобанченко (м. Бішкек).
 Доповідь професора Н. М. Шуби стосувалася підходів до лікування асимптомної та симптомної гіперурикемії. За визначенням, гіперурикемія – це порушення обміну сечової кислоти (СК) з підвищенням її рівня в плазмі крові понад 360 мкмоль/л у чоловіків і 320 мкмоль/л у жінок. Гіперурикемія може формувати клінічно маніфестну подагру. Протягом останнього десятиліття фундаментальні епідеміологічні й експериментальні дослідження довели значну роль СК як незалежного фактора ризику розвитку кардіоваскулярних і ниркових патологічних станів, особливо в пацієнтів з цукровим діабетом (ЦД) 2 типу, артеріальною гіпертензією (АГ) і серцевою недостатністю.
Доповідь професора Н. М. Шуби стосувалася підходів до лікування асимптомної та симптомної гіперурикемії. За визначенням, гіперурикемія – це порушення обміну сечової кислоти (СК) з підвищенням її рівня в плазмі крові понад 360 мкмоль/л у чоловіків і 320 мкмоль/л у жінок. Гіперурикемія може формувати клінічно маніфестну подагру. Протягом останнього десятиліття фундаментальні епідеміологічні й експериментальні дослідження довели значну роль СК як незалежного фактора ризику розвитку кардіоваскулярних і ниркових патологічних станів, особливо в пацієнтів з цукровим діабетом (ЦД) 2 типу, артеріальною гіпертензією (АГ) і серцевою недостатністю.
Американське дослідження NHANES (2007-2008) показало, що, хоча поширеність подагри становить 5,9% серед чоловіків і 2% серед жінок, розповсюдженість гіперурикемії є значно вищою й дорівнює 21,2% у чоловічій і 21,6% у жіночій популяції. Це ж дослідження виявило значне зростання частоти подагри порівняно з попереднім аналогічним аналізом, проведеним у 1988-1994 рр.
Сучасний стиль життя з низькими енергетичними витратами, надмірним вживанням висококалорійної їжі та солі, частими стресами призводить до формування метаболічних розладів, зокрема дисліпідемії та гіперурикемії. Унаслідок цих розладів можуть розвиватися АГ, ЦД, подагра, які, своєю чергою, можуть спричиняти передчасну інвалідність і зростання смертності на популяційному рівні.
Безпосередньою причиною виникнення гіперурикемії та подагри є так званий гіперурикемічний каскад. Багата пуринами дієта, нуклеїнові кислоти тканин та ендогенний синтез пуринів зумовлюють збільшення вмісту СК у крові. Гіперпродукцію СК на тлі її гіпоекскреції розглядають як причину гіперурикемії. Наслідками останньої є субклінічне відкладання кристалів СК у тканинах організму, подагра, а також її ускладнення (ниркові прояви, приєднання кардіоваскулярних подій, зростання ризику смерті).
Центральною ланкою біохімічних основ гіперурикемічного каскаду є ксантиноксидаза (КО), яка катаболізує пурини до СК. Генетична схильність і надмірне пуринове навантаження призводять до кількісних та якісних змін КО, що супроводжується оксидативним стресом й асимптомною гіперурикемією. Оксидативний стрес спричиняє інсулінорезистентність, ендотеліальну дисфункцію та окислення холестерину ліпопротеїнів низької щільності. Своєю чергою, негативні результати асимптомної гіперурикемії включають мітохондріальний оксидативний стрес, зниження біодоступності оксиду азоту, стимуляцію ренін-ангіотензин-альдостеронової системи (РААС), підвищення ліпогенезу й окислення жирних кислот.
Кристали СК фагоцитуються макрофагами (зокрема, моноцитами), де зумовлюють активацію інфламасом і каспазного шляху. У результаті цих процесів неактивний інтерлейкін (ІЛ) 1α переходить в активний ІЛ-1β – потужний медіатор запалення, здатний спричиняти міграцію нейтрофілів. Ще одним ефектом цього ІЛ є розвиток дисфункції ендотелію. Цікаво, що подібна активація інфламасом під впливом холестерину передує розвитку атеросклеротичних уражень. Асимптомна гіперурикемія також корелює з підвищенням низки маркерів запалення (кількість лейкоцитів, С-реактивний білок, ІЛ‑1, 6, 18; фактор некрозу пухлини) (Duewell P. et al., 2010; Rotherbacher T. et al., 2012; Inaba S. et al., 2013).
Розвиток АГ за умов гіперурикемії може відбуватися різними шляхами. На ранній стадії гіперурикемія активує РААС та знижує рівень оксиду азоту, що призводить до вазоконстрикції. На більш пізніх стадіях надходження СК у непосмуговані клітини судин зумовлює їх проліферацію, розвиток вторинного артеріосклерозу та порушення натрійурезу, а далі – виникнення чутливої до солі АГ. У першому випадку патологічні процеси можливо зупинити за допомогою уратознижувальної терапії, натомість у разі АГ подібний вплив на її патогенез неможливий (Mazzali M. et al., 2009).
Гіперурикемія також асоціюється з розвитком ожиріння, ЦД 2 типу, метаболічного синдрому. Метааналіз 11 проспективних когортних досліджень за участю 42 834 пацієнтів показав, що з кожним підвищенням рівня СК на 59,5 мкмоль/л (1 мг/дл) ризик виникнення ЦД 2 типу зростає на 17% (Galvan A. et al., 1995; Choi H. K. et al., 2007; Lv Q. et al., 2017).
Суттєву роль у патогенезі гіперурикемії та споріднених патологічних станів відіграють КО-залежні вільні радикали, здатні знижувати перфузію і скоротливість міокарда, зумовлювати його ремоделювання, підвищувати тонус судин, збільшувати рівень мозкового натрійуретичного пептиду, погіршувати перфузію периферійних тканин, спричиняти дисфункцію ендотелію. Усі ці ланки призводять до прогресування хвороб, пов’язаних з надмірним умістом СК.
Серцева недостатність супроводжується зростанням рівня СК через переважання катаболічних процесів над анаболічними, загибель клітин, гіпоксію тканин, активацію імунних реакцій, що опосередковують зростання активності КО, а також унаслідок порушення функції нирок і частої діуретичної терапії, які зменшують екскрецію СК. Своєю чергою, в нирках надлишок СК призводить до збільшення синтезу реніну та зменшення утворення оксиду азоту, розвитку інтерстиційного запалення й аферентної артеріопатії в поєднанні з інтерстиційним фіброзом (Feig D. I. et al., 2008; Kelkar A. et al., 2011).
Отже, постає питання: чи можливо попередити кардіоваскулярні та ренальні ускладнення, нормалізувавши рівень СК? Дані низки досліджень вказують на чіткий зв’язок між нормалізацією рівня СК та покращенням ендотеліальної функції. Така тенденція продемонстрована для хворих із застійною серцевою недостатністю, ЦД 2 типу, синдромом обструктивного апное уві сні, метаболічним синдромом, хронічними хворобами нирок, асимптомною гіперурикемією (Kanbay M. et al., 2013).
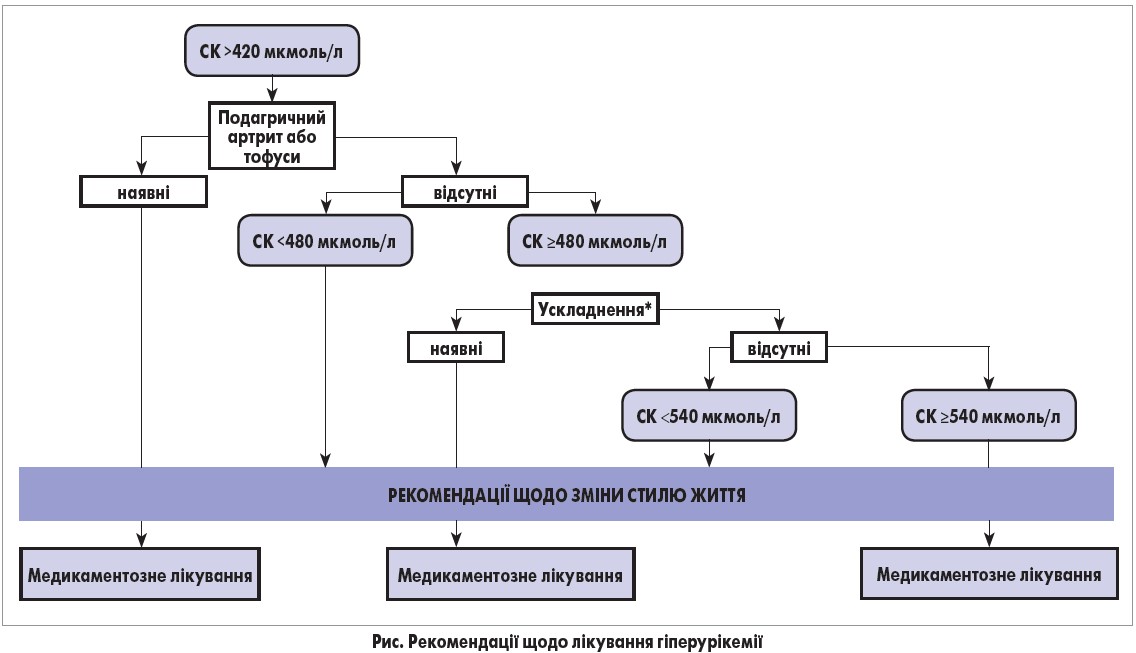
Рекомендації щодо лікування гіперурикемії залежать від рівня СК (рис.). Терапія передбачає застосування лікарських засобів, що гальмують продукцію СК (інгібітори КО алопуринол та фебуксостат); препаратів, що сприяють виведенню СК (пробенецид, бензбромарон, лезинурад); інших медикаментів, що зменшують рівень уратів (аторвастатин, лосартан) (Daskalopoulou S. S. et al., 2005; Yamanaka H., 2012).
Лікування із застосуванням інгібіторів КО сприяє покращенню функції ендотелію та зменшенню оксидативного стресу в пацієнтів з ішемічною хворобою серця; збільшенню толерантності до фізичного навантаження у хворих на стабільну стенокардію; зменшенню захворюваності та смертності серед осіб із застійною серцевою недостатністю та подагрою в анамнезі. Водночас лікарські засоби, що підвищують виведення СК (пробенецид, бензбромарон), не чинять сприятливого впливу на функцію ендотелію та стан гемодинаміки (George J. et al., 2006; Ogino K. et al., 2010; Harzand A. et al., 2012). Порівняльні дослідження встановили, що фебуксостат більш виражено пригнічує КО, ніж алопуринол (Malik U. K. et al., 2011).
Фермент ксантиноксидоредуктаза в організмі представлений у вигляді двох взаємозамінних форм: ксантиндегідрогенази (конституційна відновлена форма) та КО (окислена форма) (Pacher P. et al., 2006). Саме КО відповідальна за утворення активних форм кисню, які згодом спричиняють ушкодження тканин. Алопуринол пригнічує тільки відновлену форму ксантиноксидоредуктази, тобто ксантиндегідрогеназу, натомість непуриновий інгібітор КО фебуксостат здатен гальмувати обидві ізоформи, що супроводжується більш ефективним інгібуванням механізмів гіперурикемії. Додатковою перевагою фебуксостату є відсутність необхідності в корекції дози у пацієнтів літнього віку, хворих з легким порушенням функції печінки та легким/помірним порушенням функції нирок. Також не потрібно коригувати дозу в осіб, які паралельно приймають колхіцин, індометацин, напроксен, гідрохлортіазид, інгібітори CYP2D6 (кларитроміцин).
У дослідженні NU-FLASH було показано, що порівняно з алопуринолом фебуксостат має потужніший уратознижувальний, ефропротекторний, антиоксидантний та антиатерогенний ефекти. Це випробування також продемонструвало, що лікування фебуксостатом може покращувати довгостроковий прогноз (Sezai A., 2015).
Наприкінці виступу доповідач назвала препарати, що можуть знижувати рівень СК (лосартан, блокатори кальцієвих каналів, статини, фенофібрат) чи підвищувати його (діуретики, β-блокатори, ацетилсаліцилова кислота (АСК) у низьких дозах). Цю інформацію слід враховувати при підборі антигіпертензивної терапії пацієнтам із подагрою чи гіперурикемією.
Таким чином, гіперурикемія є провідним чинником розвитку не тільки подагри, а й кардіоваскулярних захворювань. Повноцінний контроль рівня СК у крові забезпечує цілий спектр сприятливих клінічних впливів, зокрема кардіопротекцію. Рутинні дослідження засвідчують, що блокування КО є дієвою стратегією лікування гіперурикемії. Високий ступінь селективності блокування КО здатен додатково збільшувати ефективність терапевтичних втручань у лікування пацієнтів з гіперурикемією.
 Професор В. В. Поворознюк у своєму виступі відзначив, що в наш час вік пацієнта на момент першої атаки подагри суттєво менший, ніж у попередні десятиліття. Так, у дослідженні K. H. Yu і S. F. Luo (2003; n=1095) середній вік учасників становив 43 роки, 23% включених було до 30 років. Ще однією тенденцією сучасної епідеміологічної ситуації є збільшення частоти подагри в жінок: згідно з даними Arromdee і співавт. (2002), за останні 20 років показник поширеності цього захворювання серед жіночого населення подвоївся. Імовірно, це можна пов’язати з підвищенням тривалості життя та більш ранньою менопаузою, на яку в певної частини жінок припадає близько третини життя.
Професор В. В. Поворознюк у своєму виступі відзначив, що в наш час вік пацієнта на момент першої атаки подагри суттєво менший, ніж у попередні десятиліття. Так, у дослідженні K. H. Yu і S. F. Luo (2003; n=1095) середній вік учасників становив 43 роки, 23% включених було до 30 років. Ще однією тенденцією сучасної епідеміологічної ситуації є збільшення частоти подагри в жінок: згідно з даними Arromdee і співавт. (2002), за останні 20 років показник поширеності цього захворювання серед жіночого населення подвоївся. Імовірно, це можна пов’язати з підвищенням тривалості життя та більш ранньою менопаузою, на яку в певної частини жінок припадає близько третини життя.
Утім, зростання тягаря гіперурикемії в жіночій популяції все ж є менш вираженим, ніж у чоловічій (Bhole V. et al., 2010). Глобальна поширеність подагри також збільшується: навіть у тих країнах, де ця патологія раніше була рідкістю, наразі хворіє на неї значно більша кількість населення. Згідно з порівнянням результатів дослідження NHANES 1994 року та 2007-2008 рр., показники розповсюдженості подагри в США зросли загалом на 44%, серед чоловіків – на 55%, а у віковій групі понад 80 років – на 114% (Zhu et al., 2011).
Причинами того, чому це відбувається, можуть бути постаріння світової популяції в цілому; збільшення частоти захворювань нирок, що супроводжуються погіршенням екскреції СК; часте застосування діуретиків; несприятливі зміни харчування; пандемія ожиріння. Медикаментами, що стимулюють розвиток подагри, є не тільки діуретики, які забезпечують збільшення реабсорбції СК, а й низькі дози АСК (більш ніж на 6% збільшують рівень СК і на 23% знижують її кліренс), а також етамбутол та ніацин.
Доповідач відзначив, що, за даними відділу (Поворознюк В.В., Дубецька Г.С., 2012), рівень СК у жінок прямо корелює з віком: найвищі показники фіксуються в осіб 75-79 років. Що стосується чоловіків, то загальна динаміка є подібною, однак найвища концентрація СК відзначається у віковій групі 60-74 роки, а в осіб 75-79 років цей показник дещо знижується. Отже, тенденція до зростання вмісту СК у крові більш виразно простежується в жінок. Частота гіперурикемії в пременопаузальному періоді значно нижча, ніж у постменопаузальному (приблизно 2% проти 21%), що пояснюється захисною уратознижувальною дією естрогенів.
Пацієнти з подагрою мають гірші показники виживання в порівнянні з такими групи контролю (без цього захворювання; Kuo et al., 2011). Крім того, подагра супроводжується високими фінансовими витратами, особливо в разі великої кількості гострих атак на рік. Наведені факти зумовлюють медико-соціальну актуальність своєчасної діагностики й адекватного лікування цього захворювання.
Основою терапії подагри є відповідна дієта. Сприяють розвитку подагри багаті пуринами продукти (м’ясо, морепродукти), алкоголь (передусім пиво, а також лікери та вина), фруктозо- та кофеїновмісна їжа і напої. Найвищий уміст пуринів визначається в пивних дріжджах, анчоусах (хамсі), оселедці, сардинах, мідіях та інших молюсках. Високою концентрацією пуринів характеризуються також бекон, пиво, печінка, лобстери, лосось, індичка та телятина. Своєю чергою, молочні продукти, що мають урикозуричні та протизапальні властивості, вишня, кава без кофеїну знижують ризик виникнення цього захворювання.
Стара схема фармакотерапії подагри передбачала вплив на запалення (нестероїдні протизапальні препарати, глюкокортикоїди, колхіцин), а також зниження гіперурикемії за допомогою алопуринолу, пробенециду, бензбромарону. Однак ці засоби не забезпечували оптимальної якості лікування подагри внаслідок неналежного комплаєнсу пацієнтів через відсутність розуміння мети терапії, ранню преципітацію атаки, продовження нападів подагри на тлі лікування тощо. Лікарям також іноді було складно визначитися з метою й цілями терапії, тож мали місце незадовільне моніторування рівня СК у сироватці, призначення неадекватних доз лікарських засобів, початок або припинення прийому препаратів, які знижують СК, протягом атаки; крім цього, слід зважати на складність лікування коморбідних станів, непереносимість препаратів, що знижують рівень СК (Edwards N. L., 2011; Keenan et al., 2011).
Широко призначуваний алопуринол має низку несприятливих властивостей. Зокрема, його слід обережно використовувати в пацієнтів з нирковою недостатністю. Максимальна добова доза може досягати 800 мг, однак літературних даних стосовно доз >300 мг мало. У 2% хворих при застосуванні алопуринолу спостерігаються незначні висипи на шкірі, ризик появи яких збільшується при паралельному призначенні ампіциліну, амоксициліну, тіазидних діуретиків, інгібіторів ангіотензинперетворювального ферменту. Гіперчутливість до алопуринолу спостерігається рідко – в 0,1% пацієнтів, проте в кожного п’ятого з них, тобто у 20% випадків, може бути фатальною.
До того ж є дані, що алопуринол може асоціюватися з підвищеним ризиком остеопоротичних переломів.У нових терапевтичних схемах подагри з метою зниження запалення застосовуються анакінра, рилонацепт, канакінумаб, а для ліквідації гіперурикемії – фебуксостат, пеглотиказа та лезинурид.
Протягом 2002-2004 рр. у 112 медичних центрах США та Канади було відібрано 762 пацієнти, які відповідають критеріям подагри Американської колегії ревматологів. Цих хворих рандомізували в групи прийому 80 мг (n=256) чи 120 мг (n=251) фебуксостату або 300 мг алопуринолу (n=253). З дослідження були виключені хворі з підвищеним (>133 мкмоль/л) рівнем креатиніну або його кліренсом <50 мл/хв/1,73 м2; вагітні та жінки, які годують груддю; особи, які приймають інші уратзнижувальні препарати, азатіоприн, 6-меркаптопурин, тіазидні діуретики, АСК у дозі >325 мг/добу, преднізолон (>10 мг/добу), замісну гормонотерапію, пероральні контрацептиви; пацієнти з індексом маси тіла >50 кг/м2; активним захворюванням печінки або печінковою недостатністю; хронічною алкогольною залежністю або споживанням >14 стандартних доз алкоголю на тиждень. Було встановлено, що фебуксостат у дозах 80 та 120 мг є більш ефективним, ніж фіксована доза алопуринолу 300 мг/добу, у зниженні рівня гіперурикемії та підтриманні стабільної концентрації СК у хворих на подагру.
Паралельно з останніми ефектами відбувалися зменшення площі тофусів та поступове зниження частоти загострень, що підтверджує користь стійкої нормоурикемії в профілактиці гострих і хронічних проявів подагри. До обмежень дослідження автори відносять застосування фіксованої, а не титрованої дози алопуринолу, яка могла виявитися недостатньо дієвою при високому ступені гіперурикемії, хоча безпека титрування алопуринолу за рівнем урикемії не встановлена. Іншим обмеженням є відносно короткий період дослідження, недостатній для повного прояву клінічних переваг фебуксостату.
На основі отриманих результатів було зроблено висновок, що фебуксостат відіграє важливу роль у лікуванні гіперурикемії та подагри. Він є препаратом першої лінії терапії цих станів, ефективність і безпеку якого підтверджено в багатьох наукових дослідженнях та щоденній клінічній практиці (Borghi C., Perez-Ruiz F., 2016).
 На закінчення своєї доповіді професор В. В. Поворознюк підкреслив, що, оскільки з віком спостерігається зростання частоти гіперурикемії та подагри, при розробленні нових підходів до лікування подагри враховувалися й біологічні основи цих станів. Контроль гіперурикемії та подагри забезпечує зниження ризику виникнення та прогресування коморбідних станів. Контроль концентрації СК дозволяє не тільки зменшити кількість нападів подагри, а й полегшити перебіг гіпертонічної хвороби та ішемічної хвороби серця.
На закінчення своєї доповіді професор В. В. Поворознюк підкреслив, що, оскільки з віком спостерігається зростання частоти гіперурикемії та подагри, при розробленні нових підходів до лікування подагри враховувалися й біологічні основи цих станів. Контроль гіперурикемії та подагри забезпечує зниження ризику виникнення та прогресування коморбідних станів. Контроль концентрації СК дозволяє не тільки зменшити кількість нападів подагри, а й полегшити перебіг гіпертонічної хвороби та ішемічної хвороби серця.
Кандидат медичних наук О. В. Лобанченко представила аудиторії клінічний випадок з власної практики, наголосивши, що однією з основних характеристик подагри є її системність, тобто залучення до патологічного процесу багатьох органів, у яких накопичується СК. Уражатися можуть не лише суглоби, а й травна, серцево-судинна та нервова системи. Як клінічний приклад було описано випадок хворого віком 60 років з 18-річним анамнезом подагри із частими гострими нападами, який скаржився на біль у спині. Під час візуалізаційного дослідження було виявлено килу міжхребцевого диска розміром 14 мм. Однак у ході нейрохірургічної операції виявилося, що це утворення є не килою, а скупченням кристалів СК. Після видалення утворення самопочуття пацієнта значно покращилося. Таким чином, подагричні тофуси можуть мати атипову локалізацію, тому лікарям слід бути особливо уважними.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 11-12 (432-433), червень 2018 р.