9 липня, 2018
Роль аргинина в физиологических процессах в норме и при патологических состояниях

Пути поступления аргинина:
- Синтез в системе тонкого кишечника–почек из тонкокишечного глутамина и глутамата, глутамина плазмы крови, пролина пищи, NH3 и CO2, образованных кишечной микрофлорой.
- Деградация белков тела.
- Поступление с пищей и всасывание в кишечнике.
- Локальные механизмы ферментативной рециркуляции цитруллина.
У млекопитающих существует метаболический путь для синтеза аргинина. У здоровых взрослых синтез аргинина не играет главной роли в регулировании его гомеостаза. Но при определенных условиях, включая воспаление, дисфункции тонкой кишки или почек, эндогенный синтез не может обеспечить достаточного количества аргинина [1-3]. Для взрослого человека среднесуточная норма потребления L-аргинина с пищей составляет от 3 до 6 г [4]. Аргинин служит предшественником различных молекул, включая NO, креатин, мочевину, полиамины, L-пролин, L-орнитин, глутамат и агматин [1-3]. Транспорт аргинина через клеточную мембрану осуществляется катионным аминокислотным транспортером САТ‑1/2 [1].
Эндотелиальный оксид азота
Оксида азота (NO) – важная вазореактивная молекула, которая синтезируется из L-аргинина тремя изоформами NO-синтазы (NOS): индуцибельной (iNOS) и двумя конституитивными – эндотелиальной (eNOS) и нейрональной (nNOS). eNOS – основная изоформа NOS в нормальной сосудистой стенке [5].
NO, синтезированный eNOS, выполняет целый ряд функций:
1) является одним из наиболее мощных вазодилататоров, релаксирующим фактором для гастроинтестинального тракта, дыхательных путей [5, 6];
2) опосредует сосудорасширяющие эффекты эндотелийзависимых вазодилататоров (ацетилхолина, брадикинина, гистамина и др.), тормозит образование эндотелиального сосудосуживающего фактора эндотелина‑1 и высвобождение норадреналина окончаниями симпатических нейронов, препятствует осуществлению чрезмерных эффектов других вазоконстрикторов (ангиотензина, тромбоксана A2). Благодаря этому NO принимает активное участие в регуляции сосудистого тонуса и кровотока, уровня артериального давления (АД), системной и региональной гемодинамики;
3) стимулирует синтез эндотелиального фактора роста и ангиогенез, но ингибирует пролиферацию, гипертрофию сосудов и миграцию гладкомышечных клеток, препятствуя образованию неоинтимы (рис.);
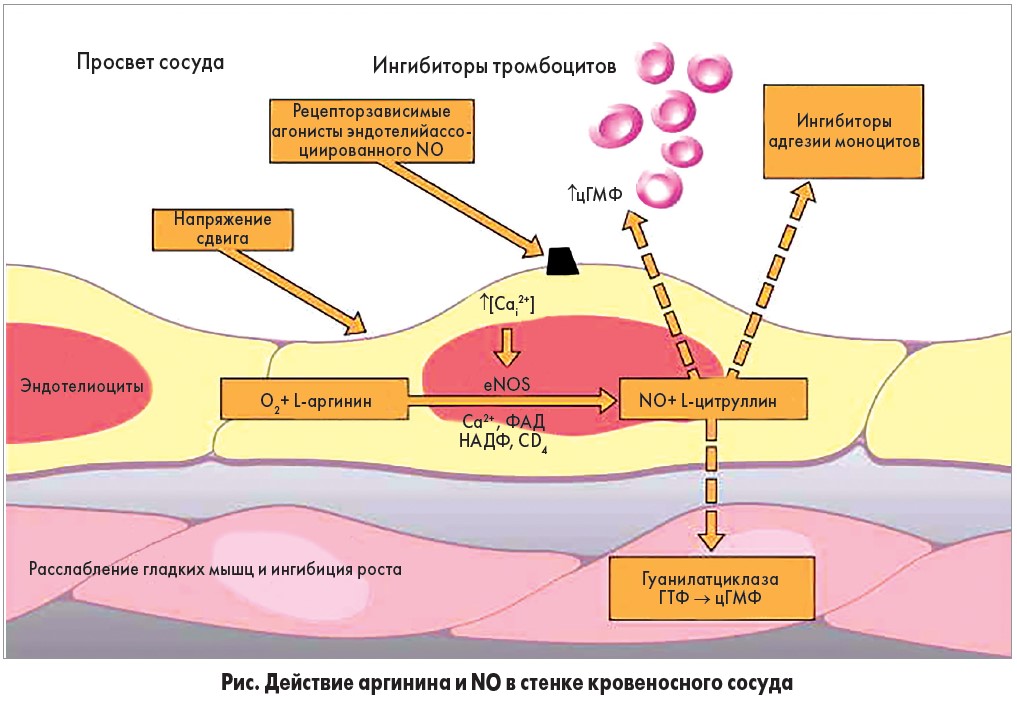 В эндотелии eNOS окисляет аргинин до NO и цитруллина. NO противодействует воспалительному процессу (в данном случае вызванному напряжением сдвига), ингибируя адгезию моноцитов, формирование тромба и релаксируя нижележащий слой гладкомышечной мускулатуры.
В эндотелии eNOS окисляет аргинин до NO и цитруллина. NO противодействует воспалительному процессу (в данном случае вызванному напряжением сдвига), ингибируя адгезию моноцитов, формирование тромба и релаксируя нижележащий слой гладкомышечной мускулатуры.
4) подавляет (в небольших концентрациях) или усиливает (в больших концентрациях) апоптоз, угнетает синтез внеклеточного матрикса, чем поддерживает нормальную структуру сосудистой стенки;
5) оказывает мощное противовоспалительное и антитромбогенное действие;
6) обладает антиоксидантными свойствами, препятствует патогенным влияниям липопротеинов низкой плотности [1, 6].
Роль аргинина в патологических процессах
Основным последствием дефицита аргинина в организме является снижение продукции NO.
Установлено, что ожирение связано с уменьшением продукции NO, вызванной нарушением биодоступности его субстрата – аргинина; увеличение содержания аргинина в эндотелии предотвращает гипертензию, вызванную ожирением [7].
NO, продуцируемый в эндотелии сосудов, отвечает за релаксацию гладких мышц и необходим для снижения АД. Любое улучшение функции эндотелия способствует профилактике сердечно-сосудистых заболеваний (ССЗ). Применение L-аргинина существенно улучшало эндотелиальную функцию сосудов. У пациентов с артериальной гипертензией прием L-аргинина эффективно снижал как систолическое, так и диастолическое АД (от 2,2 до 5,4 мм рт. ст. и от 2,7 до 3,1 мм рт. ст. соответственно) [8].
Концентрация L-аргинина значительно уменьшается у женщин с гестационной гипертензией или преэклампсией. Было отмечено, что у беременных с преэклампсией увеличиваются уровни супероксида, который связывает NO, что приводит к повышению АД. Поэтому увеличение продуцирования NO с использованием L-аргинина может преодолеть эффекты супероксида и существенно снизить АД.
Эти данные получены в исследовании с участием более чем 600 тыс. пациентов, у которых изменения показателей АД являются клинически значимыми, поскольку снижение систолического АД на 5 мм рт. ст. связано со снижением риска инсульта и ишемической болезни сердца на 14 и 9% соответственно [8].
Как почечный, так и нейрогенный механизмы обусловливают развитие гипертензии при ожирении [9]. В частности, усиленный симпатический отток (sympathetic outflow), хроническая активация ренин-ангиотензин-альдостероновой системы (РААС), окислительный стресс и снижение доступности NO, особенно в почках, могут привести к патогенезу артериальной гипертензии, связанной с ожирением.
Существуют данные, подтверждающие, что перенос L-аргинина при ожирении уменьшается. Нарушение транспорта L-аргинина может снизить биодоступность NO и тем самым усилить окислительный стресс и симпатический отток, вызвать активацию РААС и усилить последующие прогипертензивные эффекты симпатической нервной системы и РААС – порочный круг, ведущий к гипертензии.
Соответственно, стратегии лечения, которые увеличивают содержание аргинина и образование NO, вероятно, будут эффективны при гипертензии, связанной с ожирением [7].
У пожилых людей возрастает периферическое сопротивление, и артерии теряют способность эффективно дилатировать из-за эндотелиальной дисфункции. Эта сосудистая сенесценция повышает риск развития ССЗ при старении [4]. NO, высвобождаемый эндотелиальными клетками в ответ на напряжение сдвига, играет ключевую роль в поддержании сосудистой стенки в нормальном состоянии, ингибируя воспаление, клеточную пролиферацию и тромбоз. Эндотелиальная дисфункция, связанная со старением, может быть результатом уменьшения образования NO. Экспрессия клетками сосудов хемокинов, цитокинов и молекул адгезии увеличивается, что приводит к привлечению лейкоцитов, агрегации тромбоцитов и инициации атеросклеротического процесса [4, 10].
Напряжение сдвига, вызванное вязкой природой кровотока, активирует eNOS посредством фосфорилирования. NO диффундирует в клетки гладкой мускулатуры сосудов и индуцирует релаксацию гладких мышц [11], регулируя таким образом региональный кровоток.
При старении может снижаться доступность NO, что приводит к ослаблению вазодилатации и изменению региональной циркуляции и перфузии тканей [4]. Уменьшение количества субстрата может ограничивать скорость и снижать образование NO, а впоследствии – эндотелийзависимую вазодилатацию.
При катаболических состояниях хирургического или травматического происхождения, при которых ускоряется рост и восстановление, аргинин может стать условно незаменимой аминокислотой. В настоящее время изучается возможность использования L-аргинина в комплексном лечении «болезней возраста» для защиты сосудистой сети от разрушительных последствий старения и болезней [4].
L-аргинин стимулирует секрецию различных гормонов, включая соматотропный гормон (GH), инсулин, глюкагон, адреналин, норадреналин и пролактин [12]. Инсулин, в свою очередь, стимулирует экспрессию САТ‑1 и транспорт L-аргинина в эндотелиальные клетки. Поэтому у больных диабетом снижается содержание L-аргинина и NO в клетках сосудов [13].
Клинические исследования свидетельствуют о влиянии L-аргинина на агрегацию тромбоцитов. Так, при введении L-аргинина в течение 7 дней для лечения периферических артериальных обструктивных заболеваний наблюдали ингибирование спонтанной, коллаген- и аденозиндифосфорно (АДФ)-индуцированной агрегации тромбоцитов. Терапия этой аминокислотой уменьшала способность тромбоцитов к агрегации у пациентов с гиперхолестеринемией, инсулиннезависимым диабетом и артериальной гипертензией.
Положительный эффект от L-аргинина наблюдался также при острой коронарной недостаточности. Препарат улучшал эндотелиальную функцию и ингибировал АДФ-индуцированную агрегацию тромбоцитов [14].
Таким образом, полученные результаты демонстрируют, что L-аргинин может модифицировать гемостаз путем ингибирования коагуляции и активации фибринолиза.
L-аргинин регулирует множественные метаболические пути, связанные с обменом жирных кислот, глюкозы, аминокислот и белков посредством передачи сигналов в клетках и экспрессии генов. Кроме того, аргинин регулирует перекрестные взаимодействия между адипоцитами и мышцами и распределение энергии посредством секреции цитокинов и гормонов. Аргинин усиливает экспрессию и активность аденозинмонофосфат-активированной протеинкиназы, тем самым модулируя липидный обмен и энергетический баланс в сторону уменьшения количества триацилглицеринов. Все больше данных свидетельствуют в пользу того, что прием аргинина эффективно уменьшает количество белой жировой ткани у крыс с ожирением и пациентов с ожирением и сахарным диабетом 2 типа.
Таким образом, аргинин можно использовать для профилактики и лечения ожирения и связанного с ним метаболического синдрома [15].
L-аргинин также используется клетками иммунной системы и может помочь снизить уровень инфицирования, особенно в ситуациях, которые связаны с нарушением иммунной функции, такими как хирургическое вмешательство или серьезное заболевание [16].
Доказано, что для пациентов, длительное время находящихся на стационарном лечении, терапия L-аргинином значительно снижает возможность заражения внутрибольничной инфекцией и возникновение инфекционных осложнений, включая пневмонию, абсцесс брюшной полости, септический шок, фасцит и инфекции мочеполовой системы. У пациентов, принимавших препараты аргинина, количество CD4 Т-клеток значительно увеличивалось [8].
L-аргинин способствует синтезу белка и ускоряет заживление ран, усиливая синтез пролина, что важно для образования коллагена, а также синтез полиамина, стимулирующий рост клеток, их пролиферацию и дифференцировку [17]. L-аргинин также стимулирует высвобождение нескольких анаболических гормонов, таких как инсулин, гормон роста и инсулиноподобный фактор роста [18].
Выводы
Структура молекулы L-аргинина предполагает его участие в большом количестве клеточных процессов. Он находится в активных участках многих белков. Его структура благоприятна для связывания фосфатного аниона и поэтому катализирует реакции фосфорилирования. Аргинин играет важную роль в поддержании заряда многих белков. Он способствует детоксикации аммиака, секреции гормонов и участвует в поддержании иммунной системы. Превращение аргинина в NO способствует лечению различных физиологических патологий, таких как ССЗ, заболевания периферических сосудов, эректильная дисфункция, атеросклероз, головные боли, связанные с сосудами мозга, боли в груди, путем усиления вазодилатации.
Аргинин ускоряет синтез белков, контролирует истощение тканей у людей с миопатией, а также стимулирует продуцирование спермы. L-аргинин может оказывать комплексное воздействие на тромбоциты, коагуляцию и фибринолитические системы [19, 20].
Таким образом, следует учитывать большой терапевтический потенциал L-аргинина и продолжать изучение возможностей его использования в комплексной терапии при прогрессировании сосудистой дисфункции, связанной со старением и ССЗ. Особое внимание необходимо уделить способности L-аргинина модулировать сосудистую воспалительную и системную гормональную среду, что, в свою очередь, может оказать положительное влияние на эндотелиальную функцию сосудов.
Литература
1. Литвяков А. М., Сергиевич А. В. Аргинин-зависимые механизмы в патогенезе атеросклероза // Весцi НАН Беларусi. – 2013. – 1. – С. 103-112.
2. Morris S. M. Jr. Recent advances in arginine metabolism: roles and regulation of the arginases // Br. J. Pharmacol. – 2009. – 157, № 6. – P. 922-930.
3. Morris S. M. Jr. Arginine metabolism revisited // J. Nutr. – 2016. – 146, № 12. – P. 2579S‑2586S.
4. Heffernan K. S., Fahs C. A., Ranadive S. M., Patvardhan E. A. L-arginine as a nutritional prophylaxis against vascular endothelial dysfunction with aging //
J. Cardiovasc. Pharmacol. Ther. – 2010. – 15, № 1. – P. 17-23.
5. Марков Х. М. Молекулярные механизмы дисфункции сосудистого эндотелия // Кардиология. – 2005. – 6. – С. 87-95.
6. Durante W., Johnson F. K., Johnson R. A. Аrginase:
a critical regulator of nitric oxide synthesis and vascular function // Clin. Exp. Pharmacol. Physiol. – 2007. – 34, № 9. – P. 906-911.
7. Rajapakse N. W., Head G. A., Kaye D. M. Say NO to obesity-related hypertension: role of the L-arginine-nitric oxide pathway // Hypertension. – 2016. – 67, № 5. – P. 813-819.
8. McRae M. P. Therapeutic benefits of l-Arginine: an umbrella review of meta-analyses // J. Chiropr. Med. – 2016. – 15, № 3. – P. 184-189.
9. Pretnar-Oblak J. Cerebral endothelial function determined by cerebrovascular reactivity to L-arginine // Biomed. Res. Int. – 2014. – 2014. – P. 601515.
10. Deanfield J. E., Halcox J. P., Rabelink T. J. Endothelial function and dysfunction: testing and clinical relevance // Circulation. – 2007. – 115, № 10. – P. 1285-1295.
11. Michael S. K., Surks H. K., Wang Y. et al. High blood pressure arising from a defect in vascular function // Proc. Natl. Acad. Sci. U. S. A. – 2008. – 105, № 8. – P. 6702-6707.
12. Borucki K., Aronica S., Starke I. et al. Addition of 2.5g l-arginine in a fatty meal prevents the lipemia-induced endothelial dysfunction in healthy volunteers // Atherosclerosis. – 2009. – 205, № 1. – P. 251-254.
13. Dubó S., Gallegos D., Cabrera L. et al. Cardiovascular action of insulin in health and disease: endothelial L-Arginine transport and cardiac voltage-dependent potassium channels // Front. Physiol. – 2016. – 7. – P. 74.
14. Cylwik D., Mogielnicki A., Buczko W. L-arginine and cardiovascular system // Pharmacol. Rep. – 2005. – 57, № 1. – P. 14-22.
15. Tan B., Li X., Yin Y. et al. Regulatory roles for L-arginine in reducing white adipose tissue // Front. Biosci. (Landmark Ed). – 2012. – 17. – P. 2237-2246.
16. Popovic P. J., Zeh H. J. 3rd, Ochoa J. B. Arginine and immunity // J. Nutr. – 2007. – 137, № 6, Suppl 2. – P. 1681S‑1686S.
17. Stechmiller J. K., Childress B., Cowan L. Arginine supplementation and wound healing // Nutr. Clin. Pract. – 2005. – 20, № 1ю – P. 52-61.
18. Zuchi C., Ambrosio G., Lüscher T. F., Landmesser U. Nutraceuticals in cardiovascular prevention: lessons from studies on endothelial function // Cardiovasc. Ther. – 2010. – 28, № 4. – P. 187-201.
19. Verma N., Singh A. K., Singh M. L-arginine biosensors: A comprehensive review // Biochem. Biophys. Rep. – 2017. – 12. – P. 228-239.
20. Fuhrmann J., Schmidt A., Spiess S. et al. McsB is a protein arginine kinase that phosphorylates and inhibits the heat-shock regulator CtsR // Science. – 2009. – 324. – P. 1323-1327.
Медична газета «Здоров’я України 21 сторіччя» № 11-12 (432-433), червень 2018 р.


