9 липня, 2018
Препараты сульфонилмочевины в лечении сахарного диабета 2 типа – нужна ли альтернатива?
Роль препаратов cульфонилмочевины (СМ) в современных алгоритмах лечения пациентов с сахарным диабетом (СД) 2 типа не утрачивает своей значимости уже долгие годы. Это было продемонстрировано и в ходе научной конференции, состоявшейся 18 мая в Киеве. Прошла она в достаточно необычном формате телемоста, к которому присоединились еще пять городов Украины: Львов, Тернополь, Житомир, Черкассы и Ивано-Франковск. Благодаря возможностям телекоммуникаций в мероприятии смогли принять участие большее количество специалистов, в том числе и из-за рубежа. Учитывая длительный опыт применения препаратов СМ, было представлено много интересных данных, в том числе полученных в результате последних масштабных исследований.
Модератором мероприятия выступила профессор кафедры эндокринологии Национального медицинского университета им. А.А. Богомольца (г. Киев), заслуженный врач Украины, доктор медицинских наук Юлия Игоревна Комиссаренко. Доклад об особенностях и преимуществах одного из производных СМ был представлен заведующей кафедрой эндокринологии Львовского национального медицинского университета им. Даниила Галицкого, доктором медицинских наук, профессором Олесей Павловной Кихтяк.
 – Глимепирид (ГМ) (оригинальный препарат Амарил®) относится к 3-му поколению производных сульфонилмочевины (ПСМ) и сегодня применяется более чем в 60 странах мира. В 1995 году препарат был одобрен FDA как для монотерапии СД 2 типа, так и для использования в комбинации с метформином или инсулином. Механизм действия ГМ основан на стимуляции выработки инсулина β-клетками поджелудочной железы через АТФ-зависимые калиевые каналы. Примечательно, что аффинность ГМ к рецепторам значительно ниже по сравнению с другими СПМ. Связано это с тем, что ГМ взаимодействует с белковой субъединицей рецептора массой 65 кДа. Это обусловливает его более слабый эффект в блокировании рецептора по сравнению с другими препаратами и, соответственно, меньшую способность приводить к гипогликемии. Еще одна особенность ГМ – это влияние как на 1-ю, так и на 2-ю фазу инсулиновой секреции, тогда как большинство стимуляторов синтеза инсулина воздействуют только на первую. Эта особенность ГМ обеспечивает быстрое начало эффекта, его продолжительность, а также более высокую эффективность по сравнению с другими представителями группы ПСМ.
– Глимепирид (ГМ) (оригинальный препарат Амарил®) относится к 3-му поколению производных сульфонилмочевины (ПСМ) и сегодня применяется более чем в 60 странах мира. В 1995 году препарат был одобрен FDA как для монотерапии СД 2 типа, так и для использования в комбинации с метформином или инсулином. Механизм действия ГМ основан на стимуляции выработки инсулина β-клетками поджелудочной железы через АТФ-зависимые калиевые каналы. Примечательно, что аффинность ГМ к рецепторам значительно ниже по сравнению с другими СПМ. Связано это с тем, что ГМ взаимодействует с белковой субъединицей рецептора массой 65 кДа. Это обусловливает его более слабый эффект в блокировании рецептора по сравнению с другими препаратами и, соответственно, меньшую способность приводить к гипогликемии. Еще одна особенность ГМ – это влияние как на 1-ю, так и на 2-ю фазу инсулиновой секреции, тогда как большинство стимуляторов синтеза инсулина воздействуют только на первую. Эта особенность ГМ обеспечивает быстрое начало эффекта, его продолжительность, а также более высокую эффективность по сравнению с другими представителями группы ПСМ.
Фармакокинетика и фармакодинамика ГМ
ГМ обладает высокой абсорбцией. ТСmax (время достижения максимальной концентрации в плазме) составляет 2,5 ч после приема суточной дозы 4 мг перорально. Условный объем распределения ГМ составляет 8,8 л (113 мл/кг) и является наименьшим показателем среди всех ПСМ, что свидетельствует о циркуляции препарата в сосудистом русле без риска его кумуляции в тканях. Биодоступность ГМ по сравнению с остальными ПСМ является наиболее высокой и достигает почти 100% при пероральном приеме, что фактически сопоставимо с внутривенным введением.
Высокая связываемость с белками (99%) обеспечивает безопасность препарата в отношении гипогликемии. Также дополнительно снижает риск гипогликемии короткий период полувыведения – 3-6 ч, что в 2-3 раза меньше, чем у других пролонгированных ПСМ. При этом продолжительность его действия составляет 24 часа!
Монотерапия ГМ снижает как уровень глюкозы натощак, так и постпрандиальную гликемию, при этом эффективность препарата не изменяется в зависимости от приема пищи. Максимальная выработка инсулина наблюдается спустя 2 ч после еды, а минимальная – между приемами пищи. Т. е. инсулин не стимулируется вне приемов пищи, что является особенностью ГМ, не характерной для других препаратов.
У пациентов с нарушением функции почек увеличивается клиренс ГМ и снижается его средняя концентрация в крови за счет низкого связывания с белками. Поэтому Амарил® может применяться в этой группе больных без дополнительного риска кумуляции.
Гипогликемия после физических нагрузок на фоне ГМ характеризуется значительно более низкой инсулинемией по сравнению с глибенкламидом, несмотря на одинаковый уровень глюкозы в крови. Таким образом, рядом ученых было выдвинуто предположение, что ГМ обладает и внепанкреатическими эффектами.
Экстрапанкреатические эффекты ГМ
На фоне приема ГМ у пациентов с СД снижается эндогенная продукция глюкозы и улучшается ее периферический захват. Происходит это двумя путями:
- путем угнетения в печени глюконеогенеза за счет увеличения внутриклеточной концентрации фруктозо‑2,6-бифосфата – регуляторной молекулы, активирующей гликолиз;
- путем активации кавеолиновых рецепторов.
ГМ, связываясь с указанными рецепторами, запускает процесс последовательного фосфорилирования белков инсулин-рецепторного субстрата (ИРС‑1 и ИРС‑2), приводя к активации ключевого фермента в передаче инсулинового сигнала – фосфатидил-инозитол‑3-киназы (PI3K), который, в свою очередь, через цепь превращений повышает количество GLUT‑4 и его изоформ, увеличивающих транспорт глюкозы в клетку.
Остеоартропатии у пациентов с СД 2 типа
Ключевую роль в их развитии играют процессы роста и дифференциация остеобластов, на которые влияет большое количество сигнальных молекул, в том числе сигнальный путь PI3K-Akt (протеинкиназа В) и эндотелиальная NO-синтаза, широко экспрессируемая в стромальных клетках костного мозга, остеобластах и остеокластах. NO-синтаза и PI3K-Akt, в свою очередь, находятся в стимулирующем взаимодействии друг с другом, которое нарушается на фоне гипергликемии. Активируется апоптоз в эндотелиальных клетках и снижается уровень эндотелиального NO, что подавляет PI3K-Akt-сигнальный путь. Ранняя коррекция уровня гликемии активирует PI3K-Akt- сигнальный путь, и, как следствие, увеличивается синтез и дифференциация остеобластов.
По данным исследования PanMa и соавт. (2014), посвященного изучению вышеуказанных процессов при разном уровне гликемии, был сделан ряд выводов:
- высокий уровень глюкозы (16,5 ммоль/л) угнетает остеогенную дифференциацию и пролиферацию остеобластов у крыс;
- при этом ГМ активирует экспрессию эндотелиальной NO-синтазы в остеобластах крыс независимо от уровня глюкозы крови (в исследовании сравнивались концентрации 5,5 и 16,5 ммоль/л);
- на фоне действия ГМ повышалась пролиферация, снижался апоптоз и увеличивался уровень циклина D1 – маркера дифференциации остеобластов и деления клеток; также отмечалось повышение уровня кальция в остеобластах независимо от уровня глюкозы в крови.
Это и другие исследования (в частности, Vestengaard P. et. al., 2015) продемонстрировали, что назначение ГМ у пациентов с СД эффективно с точки зрения формирования костной ткани и предупреждает переломы. Также, кроме стимуляции выделения инсулина, ГМ активирует PI3K и Akt не только в остеобластах, но и в адипоцитах и скелетных мышцах. Поэтому на фоне применения ГМ отмечается стабилизация массы тела.
Режим приема и дозирование
Оптимальная доза ГМ, обеспечивающая практически максимальный антигипергликемический эффект, – 4 мг/сут однократно. Двукратное применение не продемонстрировало каких-либо преимуществ. Максимально допустимая доза ГМ – 6 мг/сут.
Хотя другие ПСМ и назначаются вместе с инсулином, только ГМ официально разрешен FDA в составе такой комбинированной терапии.
Начинать терапию ГМ рекомендуется с минимальных доз. Рекомендованная стартовая доза ГМ составляет 1-2 мг/сут до завтрака, поддерживающая доза – 1-4 мг/сутки. Комбинация инсулина с ГМ предусматривает снижение дозы инсулина при СД 2 типа.
ГМ позволяет пациенту принимать более низкую дозу по сравнению с гликлазидом, что повышает его комплайенс. Так, например, 4 мг ГМ соответствует 120 мг гликлазида.
Американская ассоциация клинических эндокринологов (American Association of Clinical Endocrinologists – ААСЕ) отнесла ПСМ к 3-й линии терапии СД из-за риска гипогликемии. Но не все ПСМ действуют одинаково. Так, годовая смертность на фоне глибенкламида составляет 8,7% (самый высокий показатель), а на фоне ГМ – всего 0,4%, что является наименьшим показателем среди всех ПСМ.
Рекомендации Американской диабетической ассоциации (ADA) включили ГМ в качестве 1-й линии терапии до назначения метформина.
Перспективные исследования (Швеция, 2018 г.)
Существующая на сегодня классификация разделяет СД на два типа, но СД 2 типа весьма гетерогенен, поэтому пересмотр классификации может дать возможность индивидуализировать подход к лечению и выделить лиц с повышенным риском осложнений. Учеными из Швеции (Ahlkvist E., Storm P. et al., 2018) был проведен кластерный анализ пациентов с впервые выявленным СД (n=8980) из национальной базы данных. Кластеры были основаны на определении 6 переменных: антитела к глутаматдекарбоксилазе, индекс массы тела, возраст на момент диагностики заболевания, HbA1c, HOMA-IR, HOMA-β, которые зависели от проспективных данных осложнений и назначенных препаратов.
В итоге авторы выделили 5 подгрупп СД 2 типа:
- Тяжелый аутоимунный диабет – 14,7%.
- Тяжелый инсулинзависимый диабет – 14%.
- Тяжелый инсулинрезистентный диабет – 10,6%.
- Мягкий диабет тучных – 19,8%.
- Мягкий возрастной диабет – 41,0%.
Вероятнее всего, в будущем классификация СД будет пересмотрена и позволит индивидуализировать лечение каждого пациента, и в терапии СД Амарил®, безусловно, как минимум сохранит свое место.
Участники телемоста получили возможность ознакомиться с международным опытом применения пероральных сахароснижающих препаратов благодаря докладу члена Королевской коллегии врачей Великобритании, члена Академии наук Камеруна, декана докторантуры в Школе медико-биологических наук, здоровья и окружающей среды, директора Центра биотехнологий в Университете Яунде (Камерун), профессора медицины и эндокринологии Жана Клода Мбаньи.
– Несмотря на наличие большого количества одобренных препаратов для лечения СД 2 типа, остается значительная доля больных, которым не удалось установить контроль над заболеванием – уровень HbA1c у них превышает 7% (в среднем – 8,12%). И таких пациентов большинство – 72,7%.
Лишь 3% людей осуществляют комплексный контроль своего состояния и стремятся к целевым показателям HbA1c, артериального давления и уровня холестерина. Поэтому очень важно найти средства и меры, которые помогут эффективно контролировать СД 2 типа.
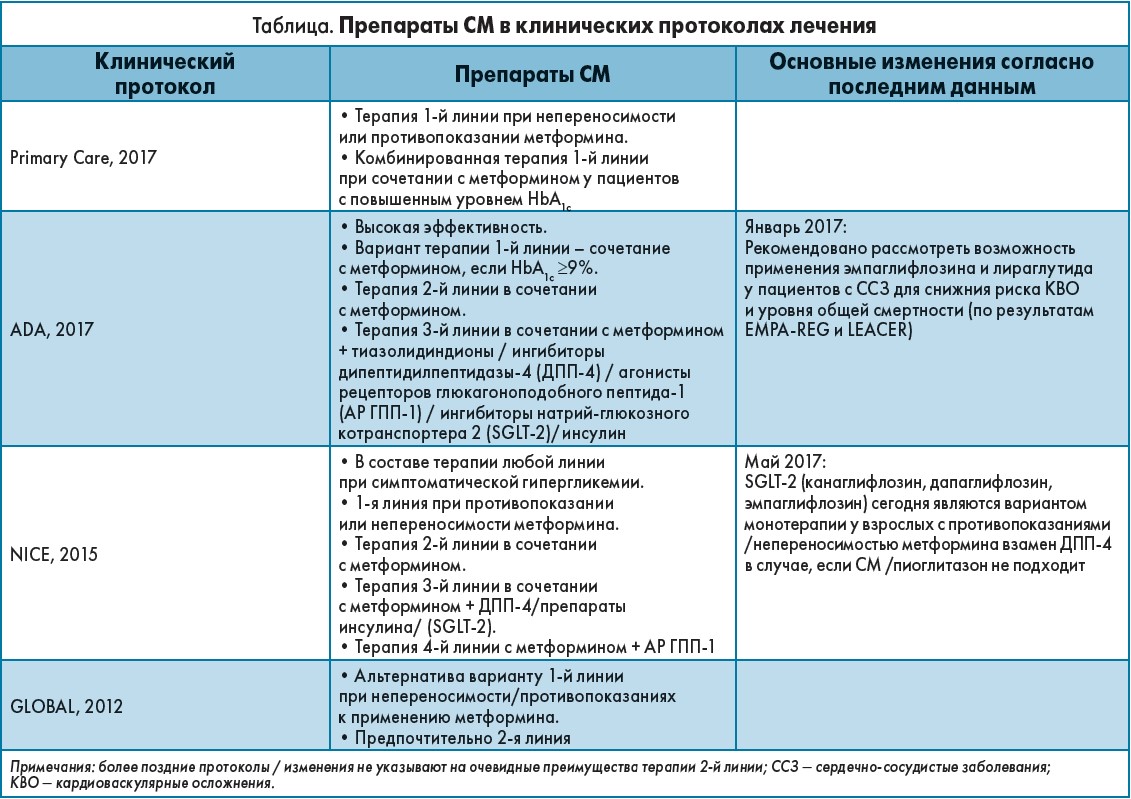
ПСМ включены во все протоколы лечения СД, и во многих из них являются терапией первой линии (табл).
Лечение СД 2 типа у пожилых людей
ПСМ также включены в руководство Международной диабетической федерации (IDF) по лечению СД 2 типа у пожилых людей. Они могут быть использованы в качестве 1-й, 2-й и 3-й линии в виде монотерапии или в составе комплексного лечения в сочетании с метформином, ДПП‑4 или АР ГПП‑1 и инсулином (3-я линия).
Общие рекомендации по ведению пациентов с СД
Модификация образа жизни – это первый и основной шаг в лечении пациентов с СД! Первой линией терапии в мире сегодня является метформин. Каждые 3 мес для пациентов с СД предусмотрена возможная интенсификация лечения, если не были достигнуты целевые значения HbA1c. На каждом этапе терапии могут использоваться стандартный и альтернативный подходы.
! При HbA1c ≥9% рекомендуется двойная терапия, при HbA1c ≥10% и уровне глюкозы в крови 300 мг/дл – комбинированная инъекционная терапия.
Метформин был выбран в качестве 1-й линии монотерапии по причине высокой эффективности и безопасности, низкой стоимости и отсутствия влияния на массу тела.
Исследования UKPDS и ADVANCE показали, что интенсивная терапия на фоне применения ПСМ улучшила результаты лечения в долгосрочной перспективе.
При необходимости двойной терапии в первую очередь рассматриваются ПСМ в сочетании с метформином благодаря высокой эффективности, среднего риска гипогликемии и отсутствию влияния на массу тела. Если не удается достичь контроля над уровнем гликемии, рекомендуется добавить к метформину и ПСМ третий препарат (ингибитор α-глюкозидазы или ДПП‑4 либо тиазолидиндион) или перевести больного на инсулинотерапию. Альтернативный препарат 3-й линии – ГПП‑1.
Результаты ключевых исследований, свидетельствующие в пользу назначения ПСМ
В последние годы были опубликованы результаты крупномасштабных длительных исследований влияния интенсивного контроля гликемии при СД 2 типа.
В исследованиях VADT, ACCORDION и ADVANCE-ON наблюдались пациенты с определенным стажем СД. Средний период наблюдения составил примерно 9 лет. К началу исследований подавляющее большинство участников получали 2-3 пероральных сахароснижающих препарата и инсулин. В основном это были метформин, глимепирид, гликлазид и тиазолидиндионы.
В результате этих исследований было доказано, что надлежащий гликемический контроль снижает риск развития осложнений в отдаленной перспективе.
! Каждое снижение уровня HbA1c на 1% уменьшало риск развития макро- и микрососудистых осложнений (ампутация нижних конечностей, микроангиопатия, катаракта, сердечная недостаточность, инфаркт миокарда, инсульт).
В ходе указанных исследований пациенты были разделены в группы интенсивной и стандартной терапии с поддержанием уровня HbA1c в диапазоне 6,3-6,5% и 7,5% соответственно. При этом была отмечена четкая взаимосвязь между уровнем HbA1c и микрососудистыми осложнениями. Повышение значений HbA1c у пациентов также коррелировало с повышением риска развития почечной недостаточности. Интересные результаты влияния терапии ПСМ на риск сердечно-сосудистых осложнений были получены в долгосрочных наблюдениях за пациентами с СД 2 типа в исследованиях ADVANCE/ADVANCE-ON и VADT/VADT-FS. Пациенты были разделены на 2 группы, получавшие интенсивную либо стандартную терапию, с применением ПСМ гликлазида.
В результате в основном и продленном наблюдениях (ADVANCE/ADVANCE-ON) у пациентов не было выявлено разницы в общей сердечно-сосудистой смертности (ССС) и возникновении сердечно-сосудистых заболеваний (ССЗ).
В исследовании VADT/VADT-FS (1791 тыс пациентов, 6 лет – основное исследование, 4 года – продленное исследование), где пациенты также были разделены на 2 группы, в которых получали интенсивную и стандартную терапию ПСМ глимепиридом. В течение первых 6 лет исследования не было выявлено разницы в общей ССС и возникновении ССЗ. Через 9,8 года группа, принимавшая интенсивную терапию, имела значимо более низкий риск развития ССЗ в сравнении с группой, принимавшей стандартную терапию (на 17% меньше).
Таким образом, своевременная диагностика и интенсификация терапии – ключ к снижению рисков и осложнений заболеваний в долгосрочной перспективе.
Еще одно исследование UKPDS, включившее 5102 пациента с впервые диагностированным СД 2 типа, также показало положительное влияние раннего контроля гликемии на развитие микрососудистых осложнений. В среднем продолжительность исследования составила 10 лет с последующим обсервационным наблюдением около 8,5 года. В группе интенсивного контроля большинство пациентов получали ПСМ и инсулин. За это время было отмечено достоверное снижение относительных рисков развития любых негативных клинических исходов, связанных с диабетом, а также микроангиопатий, инфаркта миокарда и общей смертности.
По результатам исследования ACCORD-EYE было отмечено, что риск развития диабетической ретинопатии снижался на 33% в течение 4 лет при интенсивном контроле уровня гликемии. Также было выявлено снижение риска развития ретинопатии на фоне применения фенофибрата и симвастатина. Поэтому можно сделать вывод, что интенсивный контроль гликемии значительно снижает риск развития ретинопатии, однако выбор тактики ведения должен быть индивидуальным в зависимости от сердечно-сосудистых рисков.
При метаанализе всех крупных исследований относительно СД был обнаружен значительный лечебно-профилактический эффект интенсивного контроля гликемии при ишемической болезни сердца – снизилась частота серьезных сердечно-сосудистых осложнений (ОР 0,91), инсульта (ОР 0,96), инфаркта миокарда (ОР 0,85), госпитализации или летального исхода от сердечной недостаточности (ОР 1,08).
Важно индивидуально подходить к выбору тактики ведения пациентов с учетом риска гипогликемии, веса и ожидаемой продолжительности жизни, а предпочтение отдавать наиболее безопасным ПСМ, таким как глимепирид.
ПСМ и гипогликемия
Гипогликемия на фоне приема ПСМ развивается в среднем в 10% случаев. При этом более тяжелые формы наблюдаются на фоне приема глибенкламида – в 6 раз чаще, чем при приеме ПСМ третьего поколения – глимепирида.
Как известно, общим недостатком ПСМ является их способность стимулировать апоптоз панкреатических β-клеток. По данным исследования F. Savada и соавт. (2014), в котором сравнивались разные представители ПСМ, оказалось, что наименьшее влияние на линию β-клеток MIN6 оказывает именно ГМ.
ПСМ не увеличивают смертность и частоту сердечно-сосудистых событий. Такой вывод можно сделать, резюмируя данные нескольких метаанализов и публикаций (Douros A., 2017; Simpson et al., 2015), по результатам которых прием ПСМ не ассоциируется с повышением риска общей смертности, кардиоваскулярной смерти, инфаркта миокарда или инсульта. Лишь глипизид из всех исследованных препаратов был ассоциирован с некоторым увеличением общей смертности и кардиоваскулярной смерти. Тогда как гликлазид и ГМ не повышали общую или кардиоваскулярную смертность.
! Таким образом, применение современных ПСМ является безопасным и не ассоциировано с повышением общей и сердечно-сосудистой смертности.
На основании более поздних исследований, сравнивавших ПСМ и пиоглитазон (исследование TOSCA.IT), также была подтверждена эффективность и безопасность ПСМ для сердечно-сосудистой системы. Аналогичные результаты были получены в исследовании CAROLINA (сравнение гликемического контроля на фоне глимепирида и линаглипина), а также GRADE, сравнивавшем гликемический контроль с применением различных групп препаратов, включающих и ПСМ.
Выводы
- ПСМ обеспечивают надежный и прогнозируемый гликемический контроль.
- Современные международные протоколы утвердили ПСМ в качестве одного из основных методов лечения СД 2 типа.
- ПСМ имеют низкие риски побочных эффектов, хорошую эффективность и пролонгированное действие.
- Современные ПСМ, такие как глимепирид, сохранили свои позиции в международных алгоритмах лечения благодаря высокой эффективности и невысокой стоимости лечения.
Выступление профессора Ж.К. Мбаньи вызвало оживленную дискуссию, в ходе которой докладчику были заданы вопросы относительно затронутых им тем. Приводим ответы на некоторые из этих вопросов.
? Какая доза глимепирида является наиболее оптимальной?
– Подбор индивидуальной дозы для каждого пациента требует ее титрования. В среднем это 4-6 мг, старт – с 1-2 мг с постепенным нарастанием дозы. Но важно учитывать, какие сахароснижающие препараты и/или инсулин пациент принимает дополнительно, а также оценивать индивидуальный риск развития гипогликемии. Хочу отметить, что в моей клинической практике случаев гипогликемии на фоне приема ГМ даже в дозе 6 мг практически не наблюдалось.
? Как часто профессор Мбанья назначает своим пациентам комбинированную терапию пероральными сахароснижающими препаратами в сочетании с инсулином?
– В своей практике важно делать упор на модификацию образа жизни и применение пероральных сахароснижающих препаратов. Тогда и потребность в инсулине для многих больных с СД можно снизить. С учетом широкой линейки пероральных сахароснижающих средств на фармацевтическом рынке их можно эффективно комбинировать, что также во многих случаях может стать хорошей альтернативой ранней инсулинотерапии. Но, несмотря на все прилагаемые усилия, 10-15% пациентов в Яунде все-таки получают инсулинотерапию, но к ее комбинации с пероральными препаратами камерунские специалисты подходят с осторожностью из-за высокого риска гипогликемии, предпочитая аналоговые инсулины, ассоциирующиеся с низким риском гипогликемий в сравнении с человеческими инсулинами.
? Кто оплачивает лечение больных СД в Камеруне: государство, страховые компании или сам пациент?
– Преимущественно это частные страховые компании. В Камеруне зарегистрированы десятки сахароснижающих препаратов разной ценовой категории, среди которых присутствует и Амарил®, поэтому страховка, как правило, покрывает лечение. Однако, если пациент не застрахован, назначение длительной терапии затруднительно. И таких пациентов в Камеруне, к сожалению, немало…
Конференция, по отзывам участников, была очень полезной и информативной. Она оставила позитивные впечатления – как от самого формата, так и от уровня приглашенных гостей. Очевидно, что профессиональный багаж украинских эндокринологов существенно пополнился благодаря образовательному мероприятию от компании «Санофи».
Інструкція для медичного застосування препарату Амарил®.
Наказ МОЗ України №213 від 07.02.2018. Реєстраційне посвідчення в Україні на препарат Амарил® (таблетки по 2 мг, 3 мг та 4 мг) №UA/7389/01/01, №UA/7389/01/02, №UA/7389/01/03.
Подготовила Ирина Чумак
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 2 (42) червень 2018 р.