10 липня, 2018
Современные достижения аллергологии и иммунологии
По материалам III Национального конгресса по иммунологии, аллергологии и иммунореабилитации, 17-19 апреля, г. Днепр
В этом году аллергологический конгресс был посвящен 50-летию создания аллергологической службы в Днепропетровской области. Первый день работы конференции ознаменовался торжественным открытием регионального аллергологического центра, 18 и 19 апреля в рамках научной программы свои доклады представили ведущие украинские аллергологи и европейские эксперты. Обзор некоторых выступлений мы приводим ниже.

Профессор Ральф Мосгес (Ralph Mosges, г. Кельн, Германия) приветствовал украинских коллег от имени Европейской академии аллергологии и клинической иммунологии (European Academy of Allergy and Clinical Immunology, EAACI). Сегодня эта организация насчитывает более 10 тыс. членов из 121 страны мира. EAACI проводит образовательные мероприятия для врачей, организует научные конгрессы и тематические встречи, принимает участие в разработке современных клинических рекомендаций. Продолжая выступление, профессор Мосгес обрисовал современные тренды в лечении аллергического ринита (АР).
– Значительной проблемой в менеджменте пациентов с АР остается установление контроля над симптомами заболевания. У части пациентов с хроническими заболеваниями верхних дыхательных путей они недостаточно контролируются, несмотря на адекватное фармакологическое лечение на основе рекомендаций.
У таких пациентов ухудшаются качество жизни, социальное функционирование, сон и профессиональная деятельность. Оценка степени контроля симптомов – серьезная задача, которую врач и пациент должны решать сообща. Для оценки степени контроля АР предложено использовать визуально-аналоговую балльную шкалу. Этот принцип лег в основу приложения The Allergy Diary MACVIAARIA (дневник аллергии), которое доступно для операционных систем iOS и Android. Каждый врач может рекомендовать своему пациенту использовать это приложение в смартфоне для оценки контроля симптомов АР.
В руководстве ARIA (Allergic Rhinitis and its Impact on Asthma, Аллергический ринит и его влияние на астму) в качестве основных классов препаратов для лечения АР указаны интраназальные глюкокортикоиды (ГК), системные или топические антигистаминные препараты (АГП), антагонисты лейкотриенов. Альтернативные препараты при неэффективности первой линии терапии – деконгестанты, ипратропиум, оральные ГК. Но, несмотря на большой арсенал средств для лечения, не все пациенты достигают контроля над симптомами.
В соответствии с рекомендациями ARIA (2016) у пациентов с сезонным АР следует применять интраназальные ГК в виде монотерапии или их комбинацию с оральным АГП. У лиц с персистирующим АР более предпочтительна монотерапия интраназальными ГК, чем их комбинация с оральным АГП. Оптимальной комбинацией для лечения как сезонного, так и персистирующего АР является сочетанное использование интраназальных ГК и топических АГП. Комбинированная терапия улучшает контроль над симптомами, но снижает комплайенс. Поэтому лучше использовать фиксированные комбинации. Примером удачной фиксированной комбинации являются препараты, содержащие топические ГК и АГП в одном флаконе.
 О современных подходах к лечению хронической крапивницы рассказал Энрико Хефлер (Enrico Heffler, г. Милан, Италия).
О современных подходах к лечению хронической крапивницы рассказал Энрико Хефлер (Enrico Heffler, г. Милан, Италия).
4– В 2017 г. вышло обновленное руководство по диагностике и лечению крапивницы (The EAACI/GA2LEN/EDF/WAO Guideline for the Definition, Classification, Diagnosis and Management of Urticaria) – результат консенсуса и совместной инициативы Европейской академии аллергологии и клинической иммунологии, Глобальной европейской сети по проблемам аллергологии и астмы, Европейского форума по проблемам дерматологии и других организаций. Согласно данному руководству выделяют острую (≤6 нед) и хроническую (>6 нед) крапивницу.
В зависимости от причинного фактора различают индуцированную и спонтанную. Индуцированную крапивницу устанавливают, если известен причинный фактор. Если триггер обнаружить не удается, крапивницу рассматривают как спонтанную. Спонтанная, в свою очередь, может иметь определенные причины для возникновения (аутоиммунные заболевания, инфекции) или быть идиопатической.
Хроническая спонтанная крапивница (ХСК) наблюдается у 2/3 пациентов с хронической крапивницей; женщины болеют в два раза чаще мужчин. Диагноз ХСК является диагнозом исключения, поэтому врач должен придерживаться алгоритма диагностики. Прежде всего следует установить, имеется ли у пациента другое аллергическое/аутоиммунное заболевание, которое может быть причиной сыпи и зуда. Если наличие такого заболевания исключено, необходимо установить давность симптомов. Если сыпь беспокоит пациента >24 ч, скорее всего, это не крапивница. В случае если появление симптомов не связано с действием какого-либо пищевого, физического фактора или контактом с аллергеном, диагноз ХСК является наиболее вероятным.
 ХКС негативно влияет на качество жизни пациентов, затрагивая практически все сферы деятельности. У таких лиц существенно снижена повседневная активность, изменен ментальный статус, ограничено социальное функционирование. Пациенты, как правило, стыдятся высыпаний на коже, испытывают страх в связи с тем, что сыпь может внезапно появиться на открытом участке кожи. При наличии зуда развиваются нарушения сна, появляется усталость, наблюдается снижение концентрации в дневное время. Чтобы оценить степень влияния симптомов ХСК на жизнь пациента, следует использовать шкалу UAS (Urticaria Activity Score, шкала активности крапивницы).
ХКС негативно влияет на качество жизни пациентов, затрагивая практически все сферы деятельности. У таких лиц существенно снижена повседневная активность, изменен ментальный статус, ограничено социальное функционирование. Пациенты, как правило, стыдятся высыпаний на коже, испытывают страх в связи с тем, что сыпь может внезапно появиться на открытом участке кожи. При наличии зуда развиваются нарушения сна, появляется усталость, наблюдается снижение концентрации в дневное время. Чтобы оценить степень влияния симптомов ХСК на жизнь пациента, следует использовать шкалу UAS (Urticaria Activity Score, шкала активности крапивницы).
В соответствии с современными рекомендациями лечение ХСК следует начинать с назначения АГП. Предпочтение следует отдавать препаратам второго поколения. Если симптомы сохраняются более 24 нед, следует повысить дозу АГП (до 4 доз). Если в течение 24 нед адекватный контроль над симптомами крапивницы не был достигнут, показан омализумаб. При неэффективности омализумаба в течение 6 мес терапии рекомендован циклоспорин.
Еще один доклад Энрико Хефлера был посвящен трудностям в диагностике и лечении мастоцитоза.
– Мастоцитоз – это редкое заболевание, которое характеризуется аномальной пролиферацией и накоплением тучных клеток в тканях. Согласно современной классификации выделяют кожный (пигментная крапивница, диффузный кожный мастоцитоз, мастоцитома кожи) и системный мастоцитоз (индолентный, агрессивный системный мастоцитоз, тучноклеточный лейкоз, тучноклеточная саркома и др.).
У детей мастоцитоз, как правило, ограничивается поражением кожи, а у взрослых чаще развивается системный мастоцитоз.
Пигментная крапивница представляет собой одно из манифестных проявлений накопления тучных клеток и характеризуется рецидивирующими красновато-коричневыми макулопапулярными высыпаниями, которые могут сопровождаться зудом.
Патогномоничным для кожного мастоцитоза считается симптом Дарье, когда в результате механического повреждения (расчеса) пятно или папула набухают и приобретают форму волдыря. Этот симптом обусловлен высвобождением из гранул тучных клеток большого количества гистамина, гепарина, серотонина и гиалуроновой кислоты и, как следствие, расширением сосудов, повышением проницаемости их стенок, выходом жидкости в окружающие ткани и усилением зуда.
 Диффузный кожный мастоцитоз проявляется в виде сплошной инфильтрированной поверхности кожи с разной высотой папул (т. н. апельсиновая корка). Одиночные мастоцитомы выглядят как коричневатые или розово-красные отечные папулы, которые при раздражении кожи дают образование волдыря (положительный симптом Дарье). Нередко встречаются несколько мастоцитом на коже ребенка. Более редкие варианты кожного мастоцитоза – диффузный буллезный кожный мастоцитоз (встречается в основном у детей) и макулярная эруптивная персистирующая телеангиэктазия (описана преимущественно у взрослых).
Диффузный кожный мастоцитоз проявляется в виде сплошной инфильтрированной поверхности кожи с разной высотой папул (т. н. апельсиновая корка). Одиночные мастоцитомы выглядят как коричневатые или розово-красные отечные папулы, которые при раздражении кожи дают образование волдыря (положительный симптом Дарье). Нередко встречаются несколько мастоцитом на коже ребенка. Более редкие варианты кожного мастоцитоза – диффузный буллезный кожный мастоцитоз (встречается в основном у детей) и макулярная эруптивная персистирующая телеангиэктазия (описана преимущественно у взрослых).
Клиника системного мастоцитоза обусловлена действием медиаторов тучных клеток (повторяющиеся эпизоды синкопе, гипотензивный шок, диарея с абдоминальной болью, пептическая язва, боль в костях и остеопороз, головная боль) и собственно накоплением тучных клеток в тканях (цитопения, нарушение функции печени, гиперспленизм, остеопороз/остеолизис, патологические переломы).
У пациентов с мастоцитозом отмечается высокий риск развития анафилаксии вследствие возможности дегрануляции тучных клеток. Анафилактические реакции регистрируются у 1,6% общей популяции, у 6-9% лиц с кожными формами мастоцитоза и у 22-49% лиц с системным мастоцитозом.
Провоцировать дегрануляцию тучных клеток и анафилаксию могут: рентгеноконтрастные средства, некоторые медикаменты (препараты железа – декстраны, нестероидные противовоспалительные средства, опиоиды, антибиотики, биологические препараты), физические факторы, инфекции, алкоголь, укусы насекомых.
 Эмилио Альварес Куэста (Emilio Alvarez-Cuesta, г. Мадрид, Испания) представил украинским врачам новые возможности иммунотерапии с использованием аллергоидов.
Эмилио Альварес Куэста (Emilio Alvarez-Cuesta, г. Мадрид, Испания) представил украинским врачам новые возможности иммунотерапии с использованием аллергоидов.
– Иммунотерапия (ИТ) – единственный на сегодня метод лечения, который может повлиять на естественное течение аллергических заболеваний и предотвратить трансформацию АР в бронхиальную астму (БА).
Аллергоиды – это протеины или группы протеинов, которые подвергаются модификации для использования их в протоколах ИТ.
Процесс химической модификации аллергенов с использованием глутаральдегида позволяет уменьшить их аллергенность при сохранении иммуногенности, а также дает возможность использовать более высокие дозы аллергена для достижения более выраженного терапевтического эффекта. Использование аллергоидов в отличие от нативных аллергенов не сопровождается повышенным риском IgE-опосредованных побочных реакций.
Аллергоиды можно смешивать для применения у пациентов с полисенсибилизацией к аллергенам, не имеющим перекрестной реактивности (например, к аллергенам клещей и трав). Распространенность полисенсибилизации крайне высока: большинство пациентов сенсибилизированы к ≥2 аллергенам. В нашей клинической практике в Испании большинство пациентов получают в качестве ИТ ≥2 аллергенов.
Клиническая эффективность и безопасность глутаральдегидмодифицированных аллергоидов для ИТ у пациентов с аллергическими заболеваниями была продемонстрирована рядом работ (Alvarez-Cuesta E. et al., 2005; Garcia-Robaina J.C. et al., 2006; Klimek L., Uhlig J. et al., 2014; Guzman-Fulgencio M. et al., 2017). Результаты этих исследований показали, что ИТ аллергоидами безопасна даже в высоких дозах и при смешивании аллергенов как у взрослых, так и у детей.
 Выступление Майкла Эрнда (Michael Ernd, г. Вольфратсхаузен, Германия) было посвящено принципам ведения пациентов с поврежденным кожным барьером (КБ).
Выступление Майкла Эрнда (Michael Ernd, г. Вольфратсхаузен, Германия) было посвящено принципам ведения пациентов с поврежденным кожным барьером (КБ).
– Поврежденный КБ характеризуется грубой, раздраженной, воспаленной, потрескавшейся кожей, дефицитом эпидермальных липидов и филаггрина. Индикатором повреждения КБ является высокий уровень трансэпидермальной потери воды (ТЭПВ). Ключевыми аспектами лечения пациентов с данным нарушением являются предотвращение контакта с аллергенами и раздражающими веществами, а также использование базовых эмолентов.
У 84% лиц с атопическим дерматитом отмечается легкая форма заболевания, они могут использовать для лечения только базовые эмоленты. В случае использования детьми из групп высокого риска базовых эмолентов вероятность проявления у них атопического дерматита может быть снижена на 50% (Simpson et al., 2014). Эксперты Европейской академии дерматологии и венерологии (European Academy of Dermatology and Venerology, EADV) не рекомендуют назначать терапию кортикостероидами без базового эмолента и средства для очищения.
Эмульсии типа «масло в воде» рекомендуют в период обострений, а «вода в масле» – для подострой, хронической фазы атопического дерматита и кожных заболеваний с выраженной сухостью кожи. Эмульсия «вода в масле» эффективно снижает ТЭПВ, восстанавливает КБ и характеризуется длительным защитным свойством. Специалист должен рекомендовать адекватный по вязкости и степени распределения эмолент в зависимости от области применения и состояния кожи. Так, следует выбирать отдельные продукты для нанесения на кожу век, лица и остальных участков тела. В зависимости от локализации патологического процесса могут быть использованы эмульсии в форме шампуней, средства для губ, а также средства для умывания и очищения кожи.
.jpg) Ректор ГУ «Днепропетровская медицинская академия МЗ Украины», член-корреспондент НАМН Украины, доктор медицинских наук, профессор Татьяна Алексеевна Перцева акцентировала внимание слушателей на персонифицированной терапии БА.
Ректор ГУ «Днепропетровская медицинская академия МЗ Украины», член-корреспондент НАМН Украины, доктор медицинских наук, профессор Татьяна Алексеевна Перцева акцентировала внимание слушателей на персонифицированной терапии БА.
– В последние годы происходит переосмысление БА как гетерогенного заболевания с выделением отдельных причин и признаков, которые поддаются лечению. Стало понятным, что патогенез и течение БА у разных людей неодинаковы, существуют различные механизмы формирования заболевания, которые определяют эндотип и тактику лечения.
В зависимости от роли Th2-лимфоцитов в формировании БА выделяют Th2-зависимые (аллергическая, поздняя эозинофильная БА) и Th2-независимые эндотипы (БА, связанная с ожирением, нейтрофильная, а также связанная со спазмом мышц).
Th2-ассоциированная аллергическая БА характеризуется ранним началом, связью симптомов с воздействием аллергенов, наличием других аллергических заболеваний, высоким уровнем общего иммуноглобулина Е (IgЕ). Этот вариант БА хорошо поддается лечению ингаляционными ГК. Тяжелые варианты аллергического эндотипа астмы хорошо отвечают на терапию моноклональными антителами к IgE (омализумаб).
Th2-ассоциированный эозинофильный эндотип БА характеризуется поздним началом, выраженными симптомами и частыми обострениями, эозинофилией в крови и мокроте, отсутствием сопутствующих аллергических заболеваний, наличием назальных полипов или нарушений вкуса. Пациенты с этим эндотипом БА, как правило, хорошо отвечают на терапию ГК и моноклональными антителами к интерлейкину‑5 (ИЛ‑5) или его рецепторам (меполизумаб, реслизумаб, бенрализумаб). У таких пациентов положительный ответ следует ожидать и на лечение моноклональными антителами к ИЛ‑13 (тралокинумаб, лебрикизумаб), к рецепторам ИЛ‑4, -13 (дупилумаб), к тимическому стромальному лимфопоэтину (тезепелумаб).
Th2-ассоциированная астма физического усилия провоцируется физической нагрузкой, обычно имеет легкое течение, ассоциируется с высокой степенью активации тучных клеток и хорошо отвечает на терапию ингаляционными ГК и антилейкотриеновыми препаратами (монтелукаст).
 В настоящее время проводится работа над препаратами – антагонистами простагландина D2 и хемоаттрактантгомологичных молекул, экспрессируемых на Th2-клетках. Таким образом, эти средства в будущем помогут в терапии Th2-ассоциированных эндотипов БА.
В настоящее время проводится работа над препаратами – антагонистами простагландина D2 и хемоаттрактантгомологичных молекул, экспрессируемых на Th2-клетках. Таким образом, эти средства в будущем помогут в терапии Th2-ассоциированных эндотипов БА.
Th2-независимая БА, связанная с ожирением, встречается, как правило, у женщин, характеризуется поздним началом и относительно легким течением. Этот эндотип плохо отвечает на терапию ГКК. Специфические для данного эндотипа биомаркеры в настоящий момент неизвестны.
Th2-независимая астма с нейтрофилией часто ассоциируется с курением, характеризуется высоким уровнем нейтрофилов в мокроте (>61%), относительно плохо реагирует на ГК. У таких пациентов потенциально могут быть эффективны моноклональные антитела к тимическому стромальному лимфопоэтину (тезепелумаб). Моноклональные антитела к ИЛ‑17 и туморонекротическому фактору при этом эндотипе БА неэффективны.
Гранулоцитарный эндотип Th2-независимой астмы (связан со спазмом мышц) характеризуется персистирующими симптомами, контролируемым воспалением даже в период обострения, низкими уровнями эозинофилов (<3%) и нейтрофилов (<65%) в мокроте.
Таргетная терапия при этом эндотипе должна включать максимальную медикаментозную бронходилатацию, бронхиальную термопластику.
Перспективным направлением в лечении различных эндотипов Th2-независимой астмы является использование ДНК-энзимов, воздействующих на внутриклеточные регуляторы, до которых «не достают» моноклональные антитела.
 Заведующий кафедрой внутренней медицины № 3 с фтизиатрией Украинской медицинской стоматологической академии, доктор медицинских наук, профессор Игорь Петрович Кайдашев в своем докладе остановился на современных представлениях о физиологической роли моноцитарно-макрофагальной системы.
Заведующий кафедрой внутренней медицины № 3 с фтизиатрией Украинской медицинской стоматологической академии, доктор медицинских наук, профессор Игорь Петрович Кайдашев в своем докладе остановился на современных представлениях о физиологической роли моноцитарно-макрофагальной системы.
– Моноцитарно-макрофагальная система состоит из клеток-предшественников костного мозга, циркулирующих моноцитов, резидентных макрофагов и дендритных клеток. Источниками макрофагов в ходе эмбрионального развития служат желточный мешок, печень и костный мозг. Интересно, что разные по своему происхождению макрофаги похожи, но не являются идентичными и выполняют различные функции в организме. Так, клетки, происходящие из желточного мешка поступают в кровяное русло и с током крови расселяются в ткани, где превращаются в клетки Лангерганса, микроглии, альвеолярные макрофаги. Клетки, происходящие из костного мозга, оседают в слизистой оболочке желудочно-кишечного, респираторного тракта, коже.
В популяции макрофагов было выделено две субпопуляции, которые отличаются по своим функциям. Так называемые классически активируемые макрофаги (М1-клетки) участвуют в антиинфекционной защите и реализации воспаления. Альтернативно активируемые макрофаги (М2-клетки), по-видимому, имеют совершенно другие функции: репарация, восстановление поврежденных тканей, иммунорегуляция. Отличаются не только функции этих клеток, но и факторы их поляризации: для М1-клеток это γ-интерферон, гипоксия, лиганды толлподобных рецепторов; для М2-клеток – интерлейкины‑4, -13, лиганды рецепторов, активируемых пероксисомными пролифераторами.
Детальное изучение М2-клеток позволило функционально выделить 4 субпопуляционные группы: M2a-, M2b-, M2c- и M2d-клетки, функции которых отличаются в зависимости от патологического процесса. Кроме того, были обнаружены макрофагальные клетки, несущие на своей поверхности Т-клеточные рецепторы, что не позволяет рассматривать макрофаги исключительно в контексте врожденного звена иммунитета. Указанные выше данные позволяют переосмыслить физиологическое значение моноцитарно-макрофагальной системы, которое, несомненно, требует дальнейшего изучения.

– БА является одним из самых распространенных хронических заболеваний в мире и наиболее распространенным неинфекционным заболеванием среди детей. Учитывая различия между фенотипами БА, для лечения данного заболевания необходим дифференцированный подход.
АЛР оказывают противовоспалительное действие, подавляя клеточные и неклеточные компоненты воспаления в бронхах. Эти средства уменьшают выраженность симптомов БА в дневное и ночное время, а также позволяют предупреждать приступы БА, вызванные аспирином, физической нагрузкой, холодным воздухом. АЛР менее эффективны, чем ингаляционные кортикостероиды (ИКС), однако занимают важное место в терапии БА.
АЛР могут применяться:
- у пациентов с впервые выявленной БА, которые не могут или не хотят применять ИКС;
- при непероносимости ИКС;
- при сопутствующем АР.
Назначение АЛР также показано при сочетании БА с ожирением; при бронхоконстрикции, индуцированной физической нагрузкой; при БА у курильщиков и лиц пожилого возраста; при БА, отягощающей течение другого респираторного заболевания.
АР страдает более 85% пациентов с БА. Монтелукаст может быть рекомендован в качестве монотерапии у пациентов с АР и отечной формой аллергического риносинусита. У лиц с БА физического напряжения монтелукаст способствует быстрому восстановлению функции легких после физической нагрузки (Kemp J. P., 2009).
Аспирининдуцированное респираторное заболевание – распространенный фенотип астмы с началом во взрослом возрасте, который ассоциируется с хроническим гиперпластическим риносинуситом, назальными полипами и приступами астмы после приема аспирина и других неселективных ингибиторов циклооксигеназы. Основу терапии этого заболевания составляют АЛР, дополнительное лечение – десенсибилизация к аспирину, которая может значительно улучшить качество жизни пациентов, уменьшить симптомы и образование полипов.
Ответ на терапию БА у лиц с ожирением зачастую недостаточен из-за уменьшения эффекта бронходилататоров и снижения чувствительности к кортикостероидам. У пациентов с БА, страдающих ожирением, формируется трудноконтролируемый фенотип БА.
У лиц с БА на фоне ожирения АЛР имеют преимущество в связи с их общим иммуномодулирующим и противовоспалительным действием, а также влиянием на эозинофильный и нейтрофильный тип воспаления дыхательных путей.
Курение у пациентов с БА ассоциируется с усугублением симптомов, ухудшением контроля над заболеванием, снижением ответа на ИКС. Показано, что у курильщиков с большим стажем монтелукаст превосходит по эффективности ИКС в терапии БА. Так, флутиказон был результативнее монтелукаста у курильщиков со стажем <11 пачко-лет, однако у лиц со стажем курения >11 пачко-лет эффективнее был монтелукаст (Price D. et al., 2013). Монтелукаст также может служить альтернативой у пожилых пациентов с БА, которые испытывают трудности в использовании ингалятора.
На сегодня существует достаточно доказательств того, что определенные фенотипы БА являются особенно чувствительными к монтелукасту. Преимуществом данного препарата является хорошая переносимость и низкая частота побочных реакций, сопоставимая с плацебо.
 Заведующая кафедрой клинической иммунологии и аллергологии Львовского национального медицинского университета им. Данила Галицкого, доктор медицинских наук, профессор Валентина Владимировна Чопьяк осветила проблему выявления и ведения пациентов с общим вариабельным иммунодефицитом.
Заведующая кафедрой клинической иммунологии и аллергологии Львовского национального медицинского университета им. Данила Галицкого, доктор медицинских наук, профессор Валентина Владимировна Чопьяк осветила проблему выявления и ведения пациентов с общим вариабельным иммунодефицитом.
– Общий вариабельный иммунодефицит (ОВИ) – это наследственное заболевание, которое характеризуется снижением уровня всех классов иммуноглобулинов. Приблизительно у половины больных также выявляются расстройства клеточного иммунитета.
Частота ОВИ составляет 4 случая на 100 тыс. среди мужчин и 15 на 100 тыс. – среди женщин. Исходя из из этих данных, в Украине может быть около 2 тыс. лиц, страдающих ОВИ. Однако на сегодня в нашей стране зарегистрировано всего 73 таких больных.
Среди клинических признаков ОВИ на первый план, как правило, выходят рецидивирующие бактериальные инфекции. Так, у пациентов отмечаются рецидивирующие бактериальные инфекции нижних дыхательных путей (бронхиты, пневмонии не менее 2 эпизодов в год) и верхних дыхательных путей (синуситы 1-2 раза в год, резистентные к антибактериальной терапии с длительностью более 1 мес). У лиц с ОВИ наблюдается поражение желудочно-кишечного тракта (неспецифические колиты, синдром мальабсорбции, нодулярная лимфоидная гиперплазия), гранулематозные поражения легких, печени, селезенки, кожи, а также повышенный риск злокачественных новообразований.
Лабораторные критерии ОВИ:
- значительное снижение относительно возрастной нормы как минимум двух из трех основных изотипов общих сыроваточных иммуноглобулинов (IgG, IgM, IgA);
- суммарное количество IgG+IgM+IgA <4 мг/л;
- недостаточный ответ на вакцинальные белковые (дифтерийный и столбнячный анатоксины) и полисахаридные (Haemophilus influenzae, Streptococcus pneumoniae) антигены;
- нормальное или сниженное количество В-лимфоцитов;
- возможны аномалии количества и функций Т-лимфоцитов: снижение функции CD4-лимфоцитов, снижение пролиферативного ответа на один или более митогенов.
Основной метод лечения ОВИ – пожизненная заместительная терапия иммуноглобулином (внутривенно 1 раз в 3-4 нед). В качестве альтернативы можно рассматривать иммуноглобулин человека нормальный (подкожно 1 раз в 2 нед или 1 раз/мес).
 О сложностях в достижении контроля над симптомами БА рассказала заместитель директора Центра аллергических заболеваний верхних дыхательных путей ГУ «Институт отоларингологии им. А. И. Коломийченко НАМН Украины», доктор медицинских наук, профессор Инна Владимировна Гогунская.
О сложностях в достижении контроля над симптомами БА рассказала заместитель директора Центра аллергических заболеваний верхних дыхательных путей ГУ «Институт отоларингологии им. А. И. Коломийченко НАМН Украины», доктор медицинских наук, профессор Инна Владимировна Гогунская.
– Восприятие контроля астмы пациентами зачастую не соответствует действительности. В исследовании INSPIRE (n=3415) более половины пациентов (51%) имели неконтролируемую астму, и тем не менее 55% из них оценивали свой контроль БА как «относительно хороший». Помимо этого, 74% пациентов использовали более 1 ингаляции β2-агониста короткого действия (БАКД) каждый день в предшествующие 7 дней.
Чрезмерная зависимость от БАКД встречается как у детей, так и у взрослых и не связана с тяжестью астмы.
По данным опроса AIRE, приблизительно в 3 раза больше пациентов использовали препараты для купирования симптомов (БАКД) в сравнении с поддерживающей ингаляционной терапией в течение 4 нед (Rabe K. F. et al., 2000).
По данным проведенного в Великобритании обзора NRAD (National Review of Asthma Deaths, 2014), 39% пациентов, использовавших препараты для купирования симптомов, на момент смерти получали более 12 ингаляторов БАКД в течение года, а 4% было назначено более 50 ингаляторов. Что касается базисной терапии БА, чтобы следовать рекомендациям, большинству пациентов требуется по меньшей мере 12 ингаляторов базисной терапии в год. Согласно NRAD, 80% пациентов получали менее 12 требуемых ингаляторов, а 38% – менее 4 ингаляторов базисной терапии в течение года до смерти.
Учитывая эти данные, становится понятным, что назначению базисной противовоспалительной терапии следует уделять большее внимание. Поэтому в руководстве GINA (2018) обозначена целесообразность более раннего назначения ИКС, а именно – с момента установления диагноза в сочетании с БАКД для купирования симптомов.
 Профессор кафедры клинической, лабораторной иммунологии и аллергологии Национальной медицинской академии последипломного образования им. П. Л. Шупика, руководитель городского аллергоцентра г. Киева, доктор медицинских наук Лилия Ивановна Романюк ознакомила присутствующих с новыми международными рекомендациями по диагностике и лечению крапивницы.
Профессор кафедры клинической, лабораторной иммунологии и аллергологии Национальной медицинской академии последипломного образования им. П. Л. Шупика, руководитель городского аллергоцентра г. Киева, доктор медицинских наук Лилия Ивановна Романюк ознакомила присутствующих с новыми международными рекомендациями по диагностике и лечению крапивницы.
– Хроническая крапивница (ХК) является тяжелым бременем, которое мешает пациенту чувствовать себя комфортно. Влияние ХК на жизнь пациента значительно шире, чем только развитие кожных симптомов.
Обновленные европейские рекомендации (2017) указывают на то, что спектр клинических проявлений разных подтипов крапивницы очень широк. При этом у одного и того же пациента могут сосуществовать два или более подтипа заболевания.
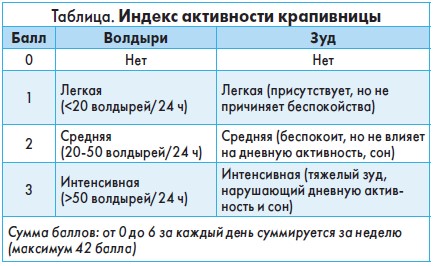
Чтобы оценить активность заболевания, рекомендуется использовать индекс активности крапивницы (urticaria activity score 7, UAS7), приведенный в таблице.
Базовые принципы ведения пациентов с крапивницей включают:
- выявление и устранение основных причин;
- избегание провоцирующих факторов;
- индукцию толерантности и/или использование фармакотерапии.
 В лечении ХК используют АГП 2 поколения, при их неэффективности следует увеличить дозу (до 4 доз). При неэффективности АГП применяют омализумаб, альтернативный препарат – циклоспорин (в случае рефрактерной ХК). Короткие курсы кортикостероидов могут использоваться в случае тяжелого обострения.
В лечении ХК используют АГП 2 поколения, при их неэффективности следует увеличить дозу (до 4 доз). При неэффективности АГП применяют омализумаб, альтернативный препарат – циклоспорин (в случае рефрактерной ХК). Короткие курсы кортикостероидов могут использоваться в случае тяжелого обострения.
Применение АГП 1 поколения не рекомендуется, предпочтение следует отдавать молекулам 2 поколения. Однако не все молекулы АГП дают положительный терапевтический эффект даже после 4-кратного увеличения дозы. Наибольшее число пациентов, ответивших на такое увеличение дозы АГП, наблюдается среди лиц, получающих терапию биластином (60%). В то время как увеличение дозы левоцетиризина в 4 раза дает положительный ответ только у 21,7% пациентов, дезлоратадина – у 27,1% (Sanches-Borges M. et al., 2014).
Биластин характеризуется быстрым началом действия (в течение часа), продолжительностью действия >24 ч, отсутствием седативного эффекта. В клинических исследованиях побочные явления биластина соответствовали уровню плацебо. Эта молекула АГП может быть рекомендована для стартового лечения ХК.
Подготовила Мария Марчук
Медична газета «Здоров’я України 21 сторіччя» № 11-12 (432-433), червень 2018 р.


