27 вересня, 2018
Роль запалення та метаболічних порушень у прогресуванні хронічних захворювань печінки: профілактика та лікування
 В усьому світі захворювання печінки займають значне місце в структурі причин непрацездатності та смерті населення. З кожним роком зростає захворюваність на неалкогольну жирову хворобу печінки (НАЖХП), яка дедалі частіше виявляється в пацієнтів з хронічним гепатитом С (ХГС). Вивчення патогенезу, вдосконалення діагностики і підвищення ефективності терапії коморбідних захворювань печінки є найактуальнішою проблемою сучасної гепатології.
В усьому світі захворювання печінки займають значне місце в структурі причин непрацездатності та смерті населення. З кожним роком зростає захворюваність на неалкогольну жирову хворобу печінки (НАЖХП), яка дедалі частіше виявляється в пацієнтів з хронічним гепатитом С (ХГС). Вивчення патогенезу, вдосконалення діагностики і підвищення ефективності терапії коморбідних захворювань печінки є найактуальнішою проблемою сучасної гепатології.
Особливої уваги потребують ХГС та НАЖХП, що характеризуються суттєвою поширеністю, малосимптомністю клінічних і лабораторних показників, високою імовірністю формування цирозу печінки і гепатоцелюлярної карциноми в різному віці [2, 7, 8, 19, 25, 36]. Лікування ХГС ускладнюється тим, що в значної кількості хворих мають місце кілька факторів ушкоджувального впливу на печінку, серед яких нераціональне, бідне на незамінні нутрієнти харчування, ожиріння, зловживання алкогольними напоями, прийом медикаментів [3, 12, 23, 29, 31, 37].
Серед зазначених чинників важливого значення набувають порушення харчування печінки, розвиток запального процесу, оксидативного ушкодження. В умовах вірусного навантаження гепатоцити повинні виробляти більше енергії для підтримання цілісності клітин і підвищеної їх регенерації [1, 13, 14, 16, 24, 26].
Хронічні гепатити можуть мати різну етіологію і механізми ушкодження тканини печінки, однак кінцевий результат зводиться до прогресуючого фіброзу і цирозу. Цироз характеризується втратою функціональної маси печінки і функціональною недостатністю, що наростає з прогресуванням захворювання. Патогномонічною морфологічною картиною цирозу є дифузна гіперплазія тканини печінки, що виражається в розвитку паренхіматозних вузликів, оточених фіброзними септами, які з’єднують портальний канал з центральним, і супроводжується перебудовою судинної архітектоніки.
Механізмом, що зумовлює розвиток паренхіматозних вузлів, є активація росту гепатоцитів після некротичної загибелі паренхіматозних клітин, поділ часточок фіброзними тяжами на частини, зміна структури часточок унаслідок перебудови судинного русла. На ранніх стадіях захворювання є можливість компенсувати втрату клітинної маси печінки. Потім настає період декомпенсації, який супроводжується зниженням числа клітин на одиницю об’єму печінки, що закінчується загибеллю організму. Цей період може тривати від 1-2 до 20-30 років [1, 7, 11, 13, 16].
Постає логічне запитання: чому при однакових причинах ураження в частини пацієнтів з хронічною патологією печінки перебіг захворювання більш сприятливий, натомість в інших спостерігається швидке формування цирозу? Основним фактором, який визначає перебіг хронічного гепатиту, є вираженість запального процесу в печінці. У реалізації запалення бере участь велика кількість прозапальних цитокінів: інтерферони, інтерлейкіни, фактор некрозу пухлини, трансформуючі фактори росту, колонієстимулюючі фактори і хемокіни.
Пусковим механізмом загибелі гепатоцитів є їх безпосередній контакт з лімфоцитами, які взаємодіють з рецепторами апоптозу на гепатоцитах, що морфологічно проявляється типовими ознаками апоптозу – зморщуванням цитоплазми, ядра, фрагментацією клітини і поглинанням апоптозних частинок макрофагами [1, 13, 16, 18]. При ХГС фіброз виникає паралельно з розвитком запального процесу.
Клітини Купфера – це специфічні макрофаги печінки, які вистилають стінки синусоїд, що є частиною ретикулоендотеліальної системи печінки. Активація клітин Купфера ендотоксинами призводить до передачі сигналу на Toll-подібні рецептори, які, своєю чергою, стимулюють продукцію запальних цитокінів, включно з фактором некрозу пухлини та інтерлейкіном‑6, що ініціюють запалення [1, 7, 11, 34].
У нормі вільний перисинусоїдальний простір дозволяє обмінюватися субстратами між гепатоцитами. Наявність запалення, а також фіброзу і, особливо, цирозу призводить до утворення бар’єру в перисинусоїдальному просторі, що обмежує доступ кисню і нутрієнтів.
Запалення перисинусоїдального простору значно порушує процеси надходження поживних речовин у гепатоцити, що супроводжується зниженням біоенергетики клітин [1, 12, 13, 16, 30, 34]. Відомо, що стійкість будь-якої клітини до ушкоджувальних факторів залежить від її забезпечення енергетичними та пластичними субстратами.
Будь-який клітинний процес є енергетично залежним. Встановлено, що зниження рівня АТФ у печінці корелює з втратою маси гепатоцитів. Інтенсивна проліферація жовчних проток у перипортальній зоні спричиняє найбільш виражене падіння АТФ. На пізніх стадіях цирозу зменшення АТФ пропорційне втраті функціональної маси печінки [30].
Метою дослідження було обґрунтувати доцільність призначення гепатопротекторів із протизапальною дією та дієти з підвищеним вмістом білка у хворих на ХГС та НАЖХП.
Матеріали та методи
Обстежено 38 пацієнтів з хронічним гепатитом, серед яких 16 – з ХГС після противірусного лікування з негативним РНК; 22 хворих на НАЖХП. Учасникам проводили загальноклінічні, антропометричні дослідження, ультразвукове дослідження (УЗД) органів черевної порожнини з модулем еластографії зсувної хвилі (ЕЗХ) з ультразвуковою оцінкою кровотоку печінки.
Характер харчування оцінювали методом 3-денного інтерв’ю про найтиповіші раціони. Для діагностики вірусної етіології гепатиту проводили визначення серологічних маркерів вірусного гепатиту B (HBsAg, HBcAb, HBeAg, anti-HBeAb, anti-HBcАb IgM та Ig G) та ПЛР-ДНК, вірусного гепатиту С (anti-HCV) та ПЛР-РНК.
У сироватці крові визначали вміст загального білірубіну та його фракцій, білкові фракції, активність трансаміназ – аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), гамма-глутамілтранспептидази (ГГТП), лужної фосфатази (ЛФ); також виконували тимолову пробу. Як маркери запалення використовували показники ШОЕ, вміст гамма-глобуліну, фібриногену, С-реактивного білка (СРБ) в сироватці крові.
Залежно від лікування хворі були розподілені на дві групи: основну (n=18, 7 з ХГС і 11 з НАЖХП) та контрольну (n=18, 7 з ХГС і 11 з НАЖХП). В основній групі учасникам призначали високобілкову дієту (1,4-1,6 г/кг/добу), протизапальний препарат Антраль по 200 мг 3 р/добу протягом 4 тиж з повторним призначенням курсу лікування через 3 міс.
Контрольна група хворих отримувала традиційне харчування за типом дієти № 5 та екстракт артишоку (капсули 200 мг) по 2 капсули тричі на добу упродовж 4 тиж з повторним прийомом через 3 міс.
Обробку отриманих даних проводили методом варіаційної статистики з оцінкою вірогідності розбіжності величин, показників кореляційного та регресивного аналізу. Вірогідність розбіжностей при порівнянні середніх арифметичних визначали за допомогою t-критерію Стьюдента.
Результати та обговорення
Серед 38 обстежених хворих жінок було 23 (60,5%), чоловіків – 15 (39,5%), середній вік учасників становив 42,3±5,1 року. У клініці захворювання переважали скарги на підвищену втомлюваність, зниження працездатності та толерантності до фізичних навантажень.
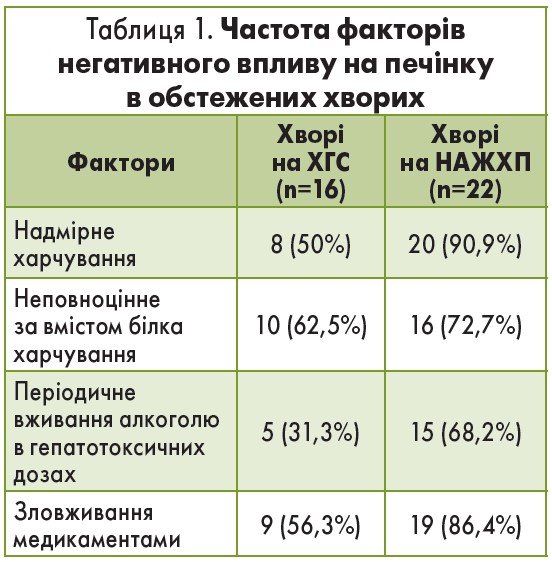 Серед обстежених переважали особи з надмірною масою тіла (індекс маси тіла – ІМТ – 33,1±2,7 кг/м2). Вивчення особливостей способу життя й анамнезу захворювання показало, що в більшості пацієнтів, крім вірусу гепатиту С та надмірної маси тіла, наявні інші фактори, які негативно впливають на печінку (табл. 1).
Серед обстежених переважали особи з надмірною масою тіла (індекс маси тіла – ІМТ – 33,1±2,7 кг/м2). Вивчення особливостей способу життя й анамнезу захворювання показало, що в більшості пацієнтів, крім вірусу гепатиту С та надмірної маси тіла, наявні інші фактори, які негативно впливають на печінку (табл. 1).
У 50% хворих на ХГС, крім вірусного ушкодження, негативний вплив на печінку мало надмірне харчування, яке зумовлює підвищення депонування ліпідів у паренхімі органа. У 62,5% учасників у раціоні відмічено недостатнє вживання продуктів, що є джерелом повноцінного білка, таких як м’ясо, риба, яйця. Відомо також, що ці продукти містять вітаміни групи В, Е, D3, цинк та інші незамінні фактори харчування.
Незбалансована дієта знижує процеси репарації, негативно впливає на ферменти системи антиоксидантного захисту, імунну систему. Порушення харчування найбільшою мірою характерні для хворих на НАЖХП [1, 14, 15]. Аналіз анкет показав, що в 99,9% пацієнтів з НАЖХП мало місце високоенергетичне харчування за рахунок надмірного вживання вуглеводів і жирів, а в 72,2% – спостерігався дефіцит повноцінного білка.
ХГС та НАЖХП є захворюваннями, перебіг яких тривалий час є безсимптомним; часто їх виявляють випадково. До моменту діагностики хворі можуть вести звичний спосіб життя і вживати алкогольні напої. В обстежених не було ознак алкогольної хвороби, проте при опитуванні виявилося, що 31,3% хворих на ХГС і 68,2% осіб з НАЖХП епізодично (на свята, у вихідні та ін.) вживали алкогольні напої в кількостях, які вважаються гепатотоксичними. Крім цього, 56,3% хворих на ХГС і 86,4% пацієнтів із НАЖХП часто приймали медикаментозні засоби з приводу інших захворювань. При цьому часто спостерігалось одночасне вживання 4-5 та більше препаратів.
Отримані дані вказують на те, що хронічні гепатити здебільшого є наслідком несприятливої дії на печінку декількох чинників, серед яких віруси, нераціональне харчування, порушення метаболізму, алкоголь, медикаменти та ін. У веденні пацієнтів з хронічними ураженнями печінки акцент на основну причину захворювання без усунення другорядних чинників може бути причиною низької ефективності лікування.
У прогресуванні хронічних захворювань печінки незалежно від їх етіології центральне місце належить запаленню та метаболічним змінам паренхіми органа. Останні дослідження за участю осіб із хронічними захворюваннями печінки, включно з пацієнтами з цирозом печінки, показали, що ці хворі перебувають у стані тривалого катаболізму. Поява м’язової слабкості при гепатитах, зменшення м’язової маси у хворих на цироз печінки, прогресування фіброзу та цирозу печінки є наслідком підвищеного катаболізму білків, зумовленого зниженням інактивації катехоламінів у печінці.
При переважанні катаболізму над анаболізмом потреби організму в повноцінних білках збільшені. При дефіциті харчового білка для збереження нормального вмісту альбуміну в крові печінка посилює аутоліз власних клітин з метою отримання необхідної кількості амінокислот для синтезу альбуміну, факторів згортання крові, транспортних білків. Останніми роками переглянуто потреби пацієнтів з патологією печінки, в тому числі з цирозом, у білку і визнано хибною традиційну дієтичну тактику зменшувати вживання харчового білка [18, 23, 24, 29, 31]. Добову квоту останнього рекомендовано збільшити до 1,2 г/кг при легких ураженнях і до 1,5 г/кг та вище в разі тяжкого перебігу захворювання.
При виборі джерела харчового білка перевага надається повноцінному тваринному білку. Для покращення транспорту амінокислот із синусоїдального простору в гепатоцити важливим є проведення протизапальної терапії.
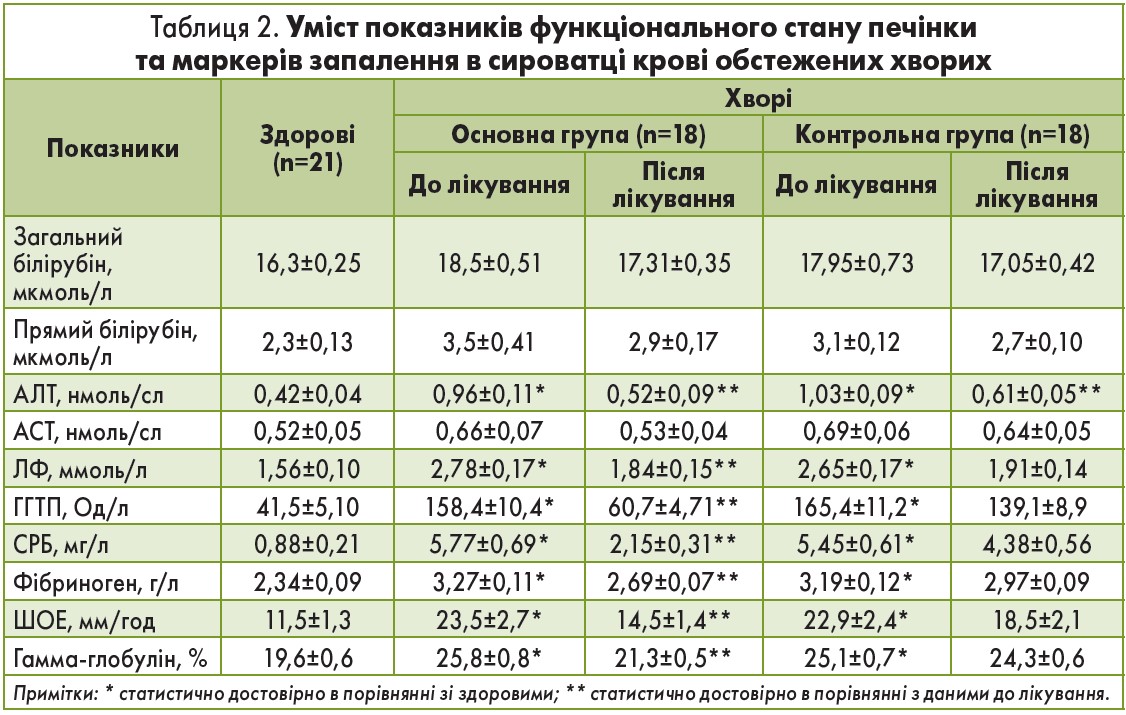
Дані щодо впливу лікування на лабораторні показники обстежених хворих наведені в таблиці 2.
З таблиці 2 видно, що до лікування в обох групах хворих мали місце зміни функції печінки. Виявлено статистично достовірне підвищення рівня АЛТ у 2,3 раза у хворих основної групи і в 2,4 раза – контрольної групи (р<0,05); ЛФ в 1,8 раза у хворих основної групи і в 1,7 раза – контрольної групи (р<0,05). Зміни активності зазначених ферментів були мінімальними, натомість підвищення концентрації ГГТП було більш суттєвим. Порівняно зі здоровими особами активність ГГПТ в крові хворих основної групи була в 3,8 раза, а у хворих контрольної групи в 3,9 раза вищою (р<0,05).
Порівняльний статистичний аналіз біохімічних показників функціонального стану печінки в обстежених групах хворих до лікування відмінностей не виявив (р>0,05). Вивчення функції печінки після лікування виявило позитивну динаміку як в основний, так і в контрольній групі. Однак показники біохімічних проб печінки в учасників основної групи після лікування змінилися більшою мірою в порівнянні з відповідними показниками пацієнтів контрольної групи.
Так, уміст у крові загального білірубіну та прямого білірубіну достовірно зменшився в порівнянні з показниками до лікування (р<0,05), в контрольній групі рівень білірубіну в крові хворих знизився меншою мірою (р>0,05). Визначення активності АЛТ показало, що в крові хворих основної групи цей показник в результаті лікування зменшився більшою мірою (в 1,6 раза), ніж у контрольній групі (в 1,2 раза; відмінність статистично достовірна).
Динаміка активності в крові АСТ виявила статистично достовірне зниження показників після лікування у хворих основної групи (в 1,4 раза), у хворих контрольної групи зменшення рівня АСТ було дещо меншим (в 1,26 раза). Активність ферментів, які характеризують синдром холестазу, – ЛФ та ГГТП – після лікування в пацієнтів основної групи зменшилась у 3 та в 1,9 раза відповідно (р<0,05). У хворих контрольної групи спостерігалося незначне зниження активності ЛФ і ГГТП (р>0,05).
ГГТП – мікросомальний фермент, присутній у багатьох органах. Активність ГГТП зростає при різноманітних захворюваннях і станах, як-от гострий панкреатит, загострення хронічного панкреатиту, лікарська інтоксикація, окисний стрес, неопластичні процеси, червоний вовчак та ін.
Активність ГГТП також підвищується при всіх формах патології печінки, особливо в разі алкогольної хвороби печінки та холестатичних захворювань. Порівняно з іншими печінковими ферментами зростання активності ГГТП спостерігається раніше і зберігається довше. Підвищення активності ГГТП характерне для фіброзу печінки навіть на фоні нормальних показників інших ферментів.
Як видно з наведених у таблиці 2 даних, в обстежених хворих до лікування виявлено помірне збільшення маркерів запалення. Мало місце статистично достовірне підвищення вмісту в крові СРБ в 6,5 разів у хворих основної групи і в 6,2 раза – контрольної (р<0,05); фібриногену в 1,4 раза у хворих основної групи і в 1,3 раза – контрольної (р<0,05); ШОЕ у 2 рази у хворих обох груп (р<0,05); гамма-глобулінів в 1,3 раза у хворих основної групи і в 1,2 раза – контрольної групи (р<0,05).
Отримані дані свідчили про те, що, незважаючи на низьку активність трансаміназ у сироватці крові обстежених груп, яка справляє хибне враження сприятливого перебігу захворювання в осіб з хронічними малоактивними формами ХГС та НАЖХП, насправді має місце хронічне системне запалення, яке призводить до прогресування фіброзу печінки.
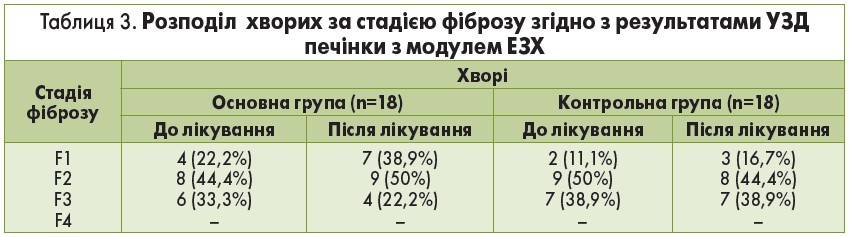
Фіброз печінки – це динамічний процес, який розвивається в результаті ушкодження печінкової тканини і супроводжується мобілізацією клітин запалення, що продукують медіатори міжклітинної взаємодії. Останні зумовлюють активацію зірчастих клітин печінки і їх трансформацію в міофібробласти – головні продуценти фіброзної тканини в позаклітинному матриксі. В усіх обстежених хворих при проведенні УЗД печінки з модулем ЕЗХ виявлено фіброз печінки (табл. 3).
Результати УЗД з модулем ЕЗХ показали, що в усіх обстежених мав місце фіброз печінки різної стадії: в основній та контрольній групах частка хворих з фіброзом F2 становила 44,4 і 50% відповідно, в 33,3% пацієнтів основної групи і 38,9% контрольної діагностований F3. Через 6 міс від початку лікування в основній групі в 1,5 рази зменшилася кількість хворих із стадією F3, натомість із стадією F2 і F1 – зросла в 1,12 та 1,8 раза відповідно, що пояснюється переходом у частини хворих стадії F3 у стадію F2, а F2 – в F1.
В контрольній групі хворих відмічено тільки один випадок зменшення ступеня фіброзу печінки із стадії F2 в стадію F1. Отримані дані свідчать про те, що призначення гепатопротектора з протизапальною дією на фоні високобілкового харчування не тільки сприяє зменшенню запальних процесів та зниженню активності сполучної тканини, а й знижує дистрофічні зміни.
Для виконання своєї функції печінка потребує нутрітивного забезпечення і наявності всіх будівельних блоків. Печінка дуже чутлива до порушень харчування.
Найбільш негативним є харчування з низьким вмістом білка. Встановлено, що при дефіциті білка кількість нейтрального жиру в печінці зростає в 7 разів, розвиваються дрібнокрапельна жирова дистрофія, атрофія клітин, а також мітохондріолізис. Зміни в мітохондріях з’являються вже в перший день неповноцінного харчування. При цьому різко знижується холерез, у жовчі зменшується вміст жовчних кислот, зростає концентрація холестерину, підвищуються її літогенні властивості та ризик розвитку жовчнокам’яної хвороби. Усунення білкового дефіциту може запобігти прогресуванню захворювань печінки навіть на стадії цирозу [18].
Висновки
- Прогресуванню ХВГ С та НАЖХП сприяють збільшення маси тіла, низькобілкове харчування, вживання алкогольних напоїв, надмірний прийом деяких медикаментів.
- Мінімальні зміни традиційних біохімічних показників функціонального стану печінки, таких як білірубін, активність АЛТ, АСТ, ЛФ, на фоні підвищення активності ГГТП та маркерів запалення свідчать про прогресування захворювання.
- Для зменшення фібротичних процесів патогенетично обґрунтованими є усунення запалення шляхом застосування гепатопротектора Антраль з протизапальною дією та високобілкове харчування.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 15-16 (436-437), серпень 2018 р.