30 листопада, 2018
Современные тенденции в лечении гастроэзофагеальной рефлюксной болезни
Согласно определению, приведенному в руководстве Американской коллегии гастроэнтерологов (ACG), гастроэзофагеальная рефлюксная болезнь (ГЭРБ) представляет собой «симптомы или осложнения, возникающие в результате рефлюкса желудочного содержимого в пищевод или за его пределы – в ротовую полость (включая гортань) или легкие» [1]. В настоящее время выделяют три основные клинические формы (так называемые фенотипы) ГЭРБ: эрозивный эзофагит (ЭЭ), неэрозивная рефлюксная болезнь (НЭРБ) и пищевод Барретта [2]. При этом отмечается тенденция к сохранению у пациента определенной фенотипической формы заболевания в течение жизни с незначительным прогрессированием либо регрессированием. ГЭРБ относится к весьма распространенным заболеваниям, ее максимальная распространенность регистрируется в Северной Америке. По данным систематического обзора, распространенность ГЭРБ варьирует в диапазоне от 18,1 до 27,8% в Северной Америке, от 8,8 до 25,9% в Европе, от 2,5 до 7,8% в Восточной Азии и от 8,7 до 33,1% в странах Ближнего Востока; в Австралии и Южной Америке она составляет 11,6 и 23% соответственно [3].
Основными симптомами ГЭРБ являются изжога и регургитация [4]. Однако в клинической картине данного заболевания может отмечаться множество других симптомов, в том числе повышенное слюноотделение, боль или дискомфорт в грудной клетке, дисфагия, отрыжка, эпигастральная боль, тошнота и вздутие живота. Кроме того, у пациентов с ГЭРБ могут возникать внепищеводные симптомы, такие как кашель, охриплость голоса, першение, боль или жжение в горле, эпизоды свистящего дыхания и нарушения сна. Исследования продемонстрировали, что частота и тяжесть симптомов (либо сочетание обеих этих характеристик) не являются прогностическими факторами при любой специфической фенотипической форме ГЭРБ [5]. Однако у пациентов пожилого возраста с ГЭРБ, по-видимому, отмечается тенденция к более выраженному поражению слизистой оболочки пищевода, которое в целом клинически ассоциировано с более легкими и менее типичными симптомами [6].
В настоящее время большинство пациентов с типичными симптомами ГЭРБ получают эмпирическое лечение ингибитором протонной помпы (ИПП) и не проходят углубленное диагностическое обследование. Однако у пациентов с симптомами тревоги (такими как дисфагия, одинофагия, анорексия, уменьшение массы тела и кровотечение из верхних отделов желудочно-кишечного тракта) необходимо проводить лабораторно-инструментальное обследование с обязательным выполнением фиброэзофагогастродуоденоскопии (ФЭГДС). Другие диагностические тесты (такие как катетерная рН-метрия, беспроводная капсульная рН-метрия, рН-импедансометрия и пр.) используются в качестве резервных при специфических клинических сценариях, при которых необходимо решать вопрос о дальнейшем ведении пациентов с частичным или полным отсутствием ответа на терапию ИПП.
В данном обзоре подробно рассматриваются современные подходы к ведению пациентов с ГЭРБ, включая медикаментозные, эндоскопические и хирургические методы лечения (табл. 1).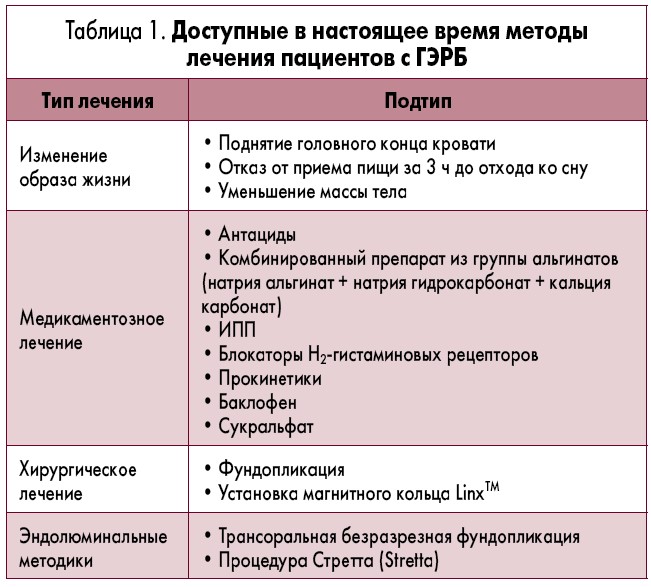
Изменение образа жизни
Изменение образа жизни остается краеугольным камнем любого терапевтического вмешательства по поводу ГЭРБ. К сожалению, оно зачастую упускается из виду лечащими врачами либо сами пациенты не следуют данным им рекомендациям. В то время как согласно многочисленным сообщениям пациентов табак, шоколад, газированные напитки, лук, томатный соус, мята, алкоголь, соки цитрусовых, острая и жирная пища усугубляют связанные с ГЭРБ симптомы, пока по-прежнему отсутствуют высококачественные исследования, которые предоставляли бы четкие доказательства целесообразности отказа от употребления этих пищевых продуктов либо от определенных привычек. Систематический обзор клинических исследований, в которых оценивали влияние модификации образа жизни на течение ГЭРБ на основании динамики симптомов, значений пищеводного рН и базального давления нижнего пищеводного сфинктера (НПС), продемонстрировал отсутствие либо наличие лишь слабых доказательств в пользу того, что после прекращения табакокурения, употребления алкоголя, кофеина или кофе, цитрусовых, мяты или приправленной специями пищи отмечается уменьшение клинических симптомов или улучшение физиологических параметров течения этого заболевания [7].
Было показано, что важным фактором риска развития ГЭРБ или усугубления ее течения является ожирение. Крупное когортное исследование, проведенное в США с участием 10 545 женщин, подтвердило, что любое увеличение индекса массы тела у лиц с нормальной массой тела было ассоциировано с повышенным риском ГЭРБ. Даже умеренная прибавка массы тела может усугублять симптомы ГЭРБ, а женщины, которым удалось снизить индекс массы тела на 3,5 единицы и более, сообщали об уменьшении частоты возникновения симптомов ГЭРБ на 40% в сравнении с контрольной группой [8]. Таким образом, уменьшение массы тела, по-видимому, является эффективной модификацией образа жизни, к которой прибегают с целью улучшения клинического течения ГЭРБ. Было также показано, что изменения образа жизни, связанные со сном, могут уменьшать выраженность ассоциированных с ГЭРБ симптомов и даже приводить к излечению легкого ЭЭ [9]. При ведении пациентов с ночными рефлюксами целесообразно использовать следующие терапевтические подходы:
- избегать приема пищи как минимум за 3 ч до отхода ко сну;
- поднять головной конец кровати;
- избегать сна в положении лежа на правом боку;
- тушить свет, ложась в постель, а также минимизировать влияние факторов, способных нарушать нормальный сон;
- назначить лечение ИПП (если симптомы преимущественно проявляются ночью – принимать их перед обедом);
- разделить дозу ИПП (утром и вечером перед приемом пищи);
- дополнительно применять перед сном блокаторы H2-гистаминовых рецепторов, сукральфат, комбинированный препарат из группы альгинатов (натрия альгинат + натрия гидрокарбонат + кальция карбонат) и др.;
- рассмотреть возможности немедикаментозного лечения.
Помимо поднятия головного конца кровати, пациентам следует избегать приема пищи как минимум за 3 ч до отхода ко сну, а также положения лежа на правом боку во время сна. Более того, пациенты нуждаются в улучшении гигиены сна, поскольку сон уменьшает гастроэзофагеальный рефлюкс посредством подавления транзиторных расслаблений НПС (ТР НПС) [10]. Лечащие врачи должны рекомендовать дополнительные модификации образа жизни на основании сообщаемой больным информации и избегать предоставления стандартного «подробного перечня» рекомендаций, которым вряд ли последует среднестатистический пациент с ГЭРБ.
Медикаментозная терапия
Пациентам, которые несмотря на предпринятые изменения образа жизни продолжают отмечать связанные с ГЭРБ симптомы, обычно назначают медикаментозную терапию. Она включает применение антацидов, комбинированного препарата из группы альгинатов (натрия альгинат + натрия гидрокарбонат + кальция карбонат), блокаторов H2-гистаминовых рецепторов, ИПП, сукральфата, прокинетиков и средств, угнетающих ТР НПС.
В настоящее время именно ИПП рассматриваются как наиболее эффективные средства фармакотерапии при ГЭРБ ввиду их способности вызывать глубокую и стойкую кислотосупрессию (табл. 2).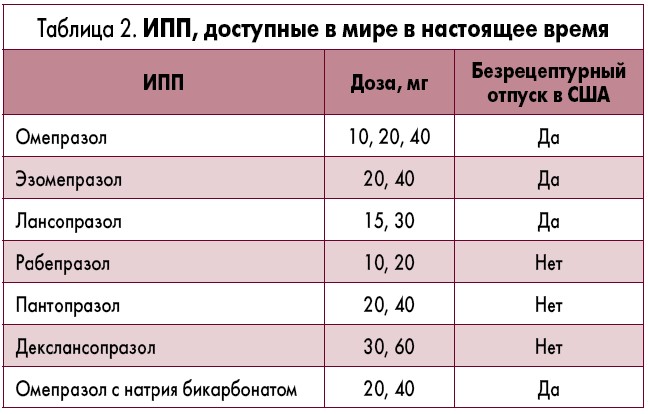
Первый представитель этого класса лекарственных средств – омепразол – был выведен на фармрынок еще в конце 80-х гг. прошлого столетия. В целом ИПП являются безопасными препаратами, а удовлетворенность пациентов лечением этими средствами варьирует от 56 до 100% в сравнении с другими антирефлюксными препаратами [11]. ИПП являются наиболее широко назначаемыми препаратами как при ЭЭ, так и при НЭРБ, хотя, по данным систематических обзоров, у пациентов с НЭРБ ответ на терапию этими препаратами несколько хуже, чем у больных ЭЭ [12].
В нескольких крупномасштабных исследованиях было продемонстрировано, что лечение ИПП превосходит лечение блокаторами Н2-гистаминовых рецепторов в плане эффективности уменьшения выраженности симптоматики как ЭЭ, так и НЭРБ [13]. При этом в исследованиях не отмечалось статистически значимых различий в частоте развития нежелательных явлений между ИПП и блокаторами Н2-гистаминовых рецепторов или между ИПП и плацебо. Было показано, что общая частота достижения уменьшения выраженности симптомов на фоне терапии ИПП у пациентов с НЭРБ достигала 51,4% (95% доверительный интервал – ДИ – от 0,433 до 0,595; p=0,0001) [14]. Терапия ИПП оказалась более эффективна по сравнению с комбинацией блокатора Н2-гистаминовых рецепторов с прокинетиком в заживлении эрозий слизистой оболочки пищевода (относительный риск – ОР – 0,51; 95% ДИ от 0,44 до 0,59). Примечательно, что монотерапия прокинетиками не была более эффективной, чем плацебо, в заживлении поражений при ЭЭ (ОР 0,71; 95% ДИ от 0,46 до 1,10). Вышеупомянутые исследования, а также другие клинические испытания закрепили превосходство ИПП перед любой другой медикаментозной терапией ГЭРБ в контроле симптомов, заживлении эрозий слизистой оболочки пищевода и профилактике рецидивов как клинической симптоматики, так и воспалительных поражений слизистой оболочки пищевода [15].
Применение ИПП является наиболее эффективным видом фармакотерапии по сравнению с другими лекарственными средствами в контролировании симптомов, которыми проявляются различные фенотипы ГЭРБ. В частности, ИПП значимо улучшают частоту ответа со стороны симптоматики в сравнении с блокаторами Н2-гистаминовых рецепторов у пациентов с НЭРБ [16].
После появления омепразола на фармацевтический рынок было выведено еще 6 ИПП. Большинство из них лишь незначительно отличаются друг от друга по своей структуре. Некоторые из этих более современных ИПП (лансопразол, рабепразол и пантопразол) сравнивали с омепразолом по способности обеспечивать контроль изжоги и заживление эрозий слизистой оболочки пищевода. Метаанализ этих исследований позволил сделать вывод о том, что более современные ИПП обладают аналогичной с омепразолом эффективностью в плане контроля изжоги, заживления эрозий и показателей частоты рецидивирования заболевания. Было выявлено, что все ИПП превосходят ранитидин и плацебо в заживлении эрозий слизистой оболочки пищевода и снижении частоты рецидивов ЭЭ.
В настоящее время в США к отпуску без рецепта доступны 4 препарата из класса ИПП (омепразол, лансопразол, эзомепразол и омепразол в комбинации с натрия бикарбонатом), а 3 ИПП могут отпускаться только по рецепту (декслансопразол, пантопразол и рабепразол). Эзомепразол представляет собой S-энантиомер омепразола, который был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) США в 2001 г. В 2006 г. был выполнен метаанализ по оценке эффективности эзомепразола в сравнении с другими ИПП (омепразолом, лансопразолом и пантопразолом) в заживлении эрозий слизистой оболочки пищевода. Через 4 и 8 недель лечения отмечалось относительное увеличение достоверности заживления на 10 и 5% (ОР 1,05; 95% ДИ от 1,02 до 1,08). Через 8 недель было констатировано снижение абсолютного риска на 4%, а показатель числа пролеченных больных на одного излеченного (NNT) составил 25. По сравнению с омепразолом, лансопразолом и пантопразолом эзомепразол обеспечивал статистически значимое улучшение, но клинически – лишь умеренное общее преимущество в заживлении эрозий слизистой оболочки пищевода и уменьшении выраженности симптоматики. Кроме того, клиническое преимущество эзомепразола оказалось крайне незначительным при легкой ГЭРБ (NNT=50), но более выраженным при тяжелом ЭЭ (NNT=8). По-видимому, ИПП обладают в целом аналогичной эффективностью [18]. Однако декслансопразол – ИПП, созданный с использованием технологии двойного замедленного высвобождения и обеспечивающий пролонгированный профиль «концентрация – время» и увеличенную длительность кислотосупрессии, – продемонстрировал свою эффективность и преимущество в качестве средства монотерапии у пациентов, которые нуждаются в приеме стандартной дозы ИПП 2 раза в сутки с целью контроля симптоматики [19].
Возможные преимущества постоянного лечения ИПП в сравнении с терапией по требованию или интермиттирующей терапией по-прежнему остаются дискуссионным вопросом. В нескольких исследованиях сообщалось, что постоянная терапия позволяет достичь большей удовлетворенности пациентов лечением, чем терапия по требованию. Однако другие исследования показали, что терапия по требованию превосходит постоянную терапию у пациентов с легкой ГЭРБ, поскольку она менее затратна финансово, устраняет обеспокоенность пациентов в отношении потенциальной опасности постоянного приема ИПП и в целом характеризуется высоким уровнем удовлетворенности лечением [20, 21].
В заключение следует отметить, что на основании имеющихся в настоящее время доказательств ИПП могут обеспечить уменьшение выраженности симптоматики примерно у 57-80% пациентов с ЭЭ и у около 50% пациентов с НЭРБ. Кроме того, заживление эрозий слизистой оболочки пищевода (все степени) может быть достигнуто более чем у 85% пациентов с ГЭРБ, которые получают лечение ИПП в стандартных дозах. Однако необходимо помнить, что рандомизированные контролируемые испытания (РКИ) представляют собой исследования по оценке эффективности, сообщающие данные о благоприятном эффекте лекарственного препарата при его применении в тщательно контролируемых условиях [22]. В реальных условиях на ответ на лечение (эффективность препарата) могут влиять многие факторы, такие как доступ к лечению, правильность установленного диагноза, приемлемость вмешательства для пациента и его приверженность к терапии [23]. Таким образом, ответ на лечение ИПП в клинической практике вряд ли будет соответствовать тем же показателям частоты достижения успеха, о которых сообщалось в ходе РКИ.
Неудовлетворительный комплайенс, отсутствие приверженности к соблюдению рекомендуемого времени приема ИПП и неверно установленный диагноз – вот лишь некоторые важные барьеры, которые оказывают отрицательное воздействие на успешность лечения пациентов с ГЭРБ в клинической практике [24].
Оптимизация терапии ИПП
В соответствии с рекомендациями ACG, первым этапом в лечении пациентов с рефрактерной ГЭРБ является оптимизация терапии ИПП, которая включает следующие практические шаги [1]:
- изменение образа жизни;
- улучшение комплайенса;
- обеспечение соблюдения надлежащего времени приема препарата;
- разделение дозы ИПП;
- переход на прием другого ИПП.
Таким образом, очевидно, что важнейшим первоначальным шагом на пути к оптимизации лечения ИПП является улучшение комплайенса. Врачи, назначающие ИПП, должны обучать пациентов, рассказывая им о важности ежедневного приема ИПП с целью достижения максимального эффекта. Недавнее исследование показало, что комплайенс при терапии ИПП был максимальным в том случае, когда препарат был назначен гастроэнтерологом, и самым низким в случае, если пациенты приобретали ИПП по собственной инициативе (без рецепта) [25]. Обеспечение приверженности к соблюдению надлежащего времени приема ИПП также представляет собой ключевой этап в оптимизации терапии ИПП. Одно из исследований продемонстрировало, что 100% пациентов, которые были рефрактерны к ИПП при их приеме 1 раз в сутки, в реальности не принимали ИПП оптимальным образом (за 30 мин до еды) [26]. Вместо этого они принимали ИПП более чем за 1 ч до приема пищи, во время еды и перед сном. Таким образом, крайне важно объяснять пациентам значимость соблюдения надлежащего времени и условий приема ИПП для достижения максимального эффекта лечения.
Другим важным шагом на пути к оптимизации лечения ИПП является необходимость постоянно придерживаться образа жизни, рекомендуемого при ГЭРБ [7]. Независимо от приема ИПП пациенты должны избегать употребления больших объемов пищи, приправленных специями и жирных блюд, уменьшать массу тела и прибегать к мерам предосторожности в ночное время (поднятие головного конца кровати, отказ от приема пищи как минимум за 3 ч до отхода ко сну, следование рекомендациям по гигиене сна).
Примечательно, что, согласно данным недавних исследований, распределение дозы ИПП в течение дня улучшает контроль интрагастрального рН. Сообщалось, что медиана значений интрагастрального рН составляла 4,8; 5,7 и 6,6 на фоне приема рабепразола в дозе 40 мг 1 раз в сутки, 20 мг 2 раза в сутки или 10 мг 4 раза в сутки соответственно [27]. Однако распределение дозы ИПП в течение дня может ухудшать комплайенс.
Доказательства ценности удвоения дозы ИПП в улучшении контроля симптомов у пациентов, у которых оказалось неэффективным применение ИПП 1 раз в сутки, ограничиваются очень незначительным количеством исследований. В группе из 96 пациентов с ГЭРБ, у которых прием омепразола в дозе 20 мг 1 раз в сутки оказался неэффективным, лишь у 26,1% был продемонстрирован определенный тип ответа на применение омепразола в дозе 40 мг в сутки в сравнении с 22,7% при приеме лансопразола в дозе 30 мг 2 раза в сутки (p=НД) [28]. Однако другое исследование показало, что частота заживления эрозий слизистой оболочки пищевода (и в особенности – раннего заживления) была достоверно выше у пациентов, получавших 40 мг пантопразола в сравнении с 20 или 10 мг в сутки – независимо от тяжести ЭЭ [29]. Сравнение эффективности омепразола в дозах 40 и 20 мг продемонстрировало статистически значимое различие в заживлении эрозий при эзофагите (p=0,05) через 4 недели, однако это различие было нивелировано спустя 8 недель (p=0,10). Кроме того, на заживление влияла степень тяжести ЭЭ на момент включения – менее чем у половины пациентов с ЭЭ степени D согласно Лос-Анджелесской классификации удалось достичь заживления на фоне приема омепразола в дозе 20 или 40 мг [30].
Ведение пациентов с рефрактерной изжогой
Рефрактерная изжога определяется как сохранение симптомов, связанных с рефлюксом желудочного содержимого, несмотря на прием двойной дозы ИПП на протяжении как минимум 8 недель [31]. Успешное лечение рефрактерной изжоги зависит от возможности устранения механизма, лежащего в основе ее развития. На рисунке отображен алгоритм ведения и различные варианты лечения пациентов с изжогой, у которых оказалась неэффективной терапия ИПП.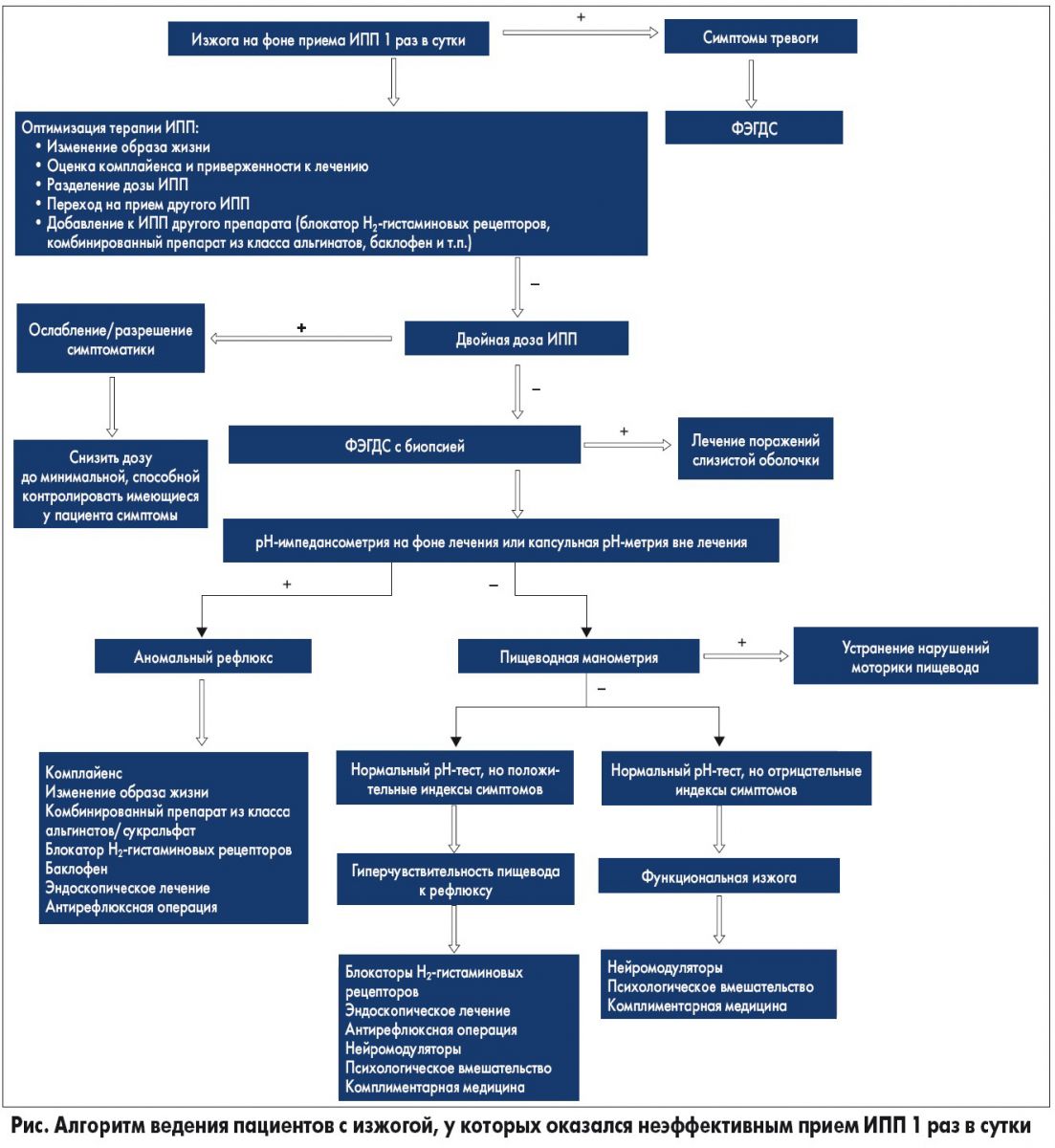
Недавние исследования показали, что большинство пациентов с рефрактерной изжогой или другими типичными для ГЭРБ симптомами часто не имеют ГЭРБ как таковой в качестве фоновой причины развития симптомов [32]. Чаще всего задействованные механизмы включают функциональную изжогу и гиперчувствительность пищевода к рефлюксу. Показано, что сопутствующие психологические нарушения (тревожность, сверхнастороженность, депрессия и соматизация) действительно играют важную роль у пациентов с рефрактерной изжогой. Кроме того, при рефрактерной изжоге также могут играть свою роль несколько других механизмов (в том числе неудовлетворительный комплайенс, неправильное время приема, сопутствующее функциональное расстройство кишечника, замедленная эвакуация желудочного содержимого, эозинофильный эзофагит, желчный рефлюкс, резидуальный кислотный и некислотный рефлюкс, быстрый метаболизм ИПП, резистентность к ИПП). При этом перекрест этих механизмов может еще больше усугублять рефрактерную изжогу [33]. Важно отметить, что пациенты, у которых оказался неэффективным прием ИПП 1 раз в сутки, имели большую вероятность наличия прогрессирующих степеней ЭЭ, НЭРБ, гиперчувствительности пищевода к рефлюксу или функциональной изжоги в сравнении с пациентами, у которых был неэффективным прием ИПП 2 раза в сутки – у них с большей степенью вероятности имела место гиперчувствительность пищевода к рефлюксу и функциональная изжога [34].
Возможности медикаментозного лечения пациентов, у которых заболевание неудовлетворительно контролируется приемом ИПП 2 раза в сутки, весьма ограничены. У пациентов, у которых на фоне применения ИПП 2 раза в сутки сохраняется аномальное воздействие кислотного фактора на слизистую оболочку пищевода, дополнительный прием блокатора Н2-гистаминовых рецепторов перед сном продемонстрировал способность улучшать контроль интрагастрального рН в течение всей ночи. Однако этот эффект, по-видимому, является краткосрочным, поскольку при ежедневном применении блокаторов Н2-гистаминовых рецепторов очень быстро развивается тахифилаксия [35].
Агонист Б-рецепторов гамма-аминомасляной кислоты баклофен продемонстрировал многообещающие результаты в лечении пациентов с рефрактерной ГЭРБ, при которой отмечается остаточный кислотный либо слабокислый рефлюкс, посредством снижения частоты ТР НПС и таким образом – уменьшения гастроэзофагеального рефлюкса [36, 37]. Хотя этот препарат пока не одобрен FDA для лечения пациентов с ГЭРБ, попытка применения от 5 до 20 мг баклофена 3 раза в сутки может быть рассмотрена у тех пациентов с ГЭРБ, у которых течение заболевания не поддается эффективному контролю с помощью приема ИПП 2 раза в сутки и сохраняется резидуальный гастроэзофагеальный рефлюкс.
Поскольку гиперчувствительность пищевода к рефлюксу и функциональная изжога на сегодняшний день являются ведущими причинами развития рефрактерной изжоги, диагностику и лечение этих расстройств следует рассматривать изначально. Пациенты с такими расстройствами часто получают лечение нейромодуляторами, которые включают трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норэпинефрина, а также тразодон. Лечение рефрактерной изжоги сфокусировано на оценке времени приема ИПП и улучшении комплайенса; допускается дополнительное назначение блокатора Н2-гистаминовых рецепторов перед сном (если симптомы коррелируют с кислотным рефлюксом) и оценка возможности назначения препарата, уменьшающего частоту ТР НПС (например, баклофена) [39]. Могут быть также рассмотрены немедикаментозные варианты лечения, такие как эндоскопическое лечение или антирефлюксная операция. У пациентов с функциональной изжогой или гиперчувствительностью пищевода к рефлюксу основой лечения является применение нейромодуляторов.
Хирургическое лечение ГЭРБ
В настоящее время доступны несколько хирургических методик, которые могут применяться в лечении ГЭРБ. Вместе с тем, в недавнем исследовании продемонстрировано быстрое снижение частоты использования хирургической фундопликации в США с 2004 по 2013 г. Частота выполнения хирургической фундопликации в 2013 г. составила 0,047%. Кроме того, в течение последних 4 лет стабильно возрастала частота использования после хирургической фундопликации ИПП и блокаторов Н2-гистаминовых рецепторов (ИПП – 80% пациентов; блокаторы Н2-гистаминовых рецепторов – 52%). В целом, частота использования ИПП после хирургической фундопликации возросла с 45% в 2010 г. до 80% в 2013 г. [42].
Пациентам, являющимся кандидатами на проведение антирефлюксной операции, до вмешательства обязательно должна быть выполнена рН-метрия (если они имеют нормальную эндоскопическую картину и им ранее не проводилось данное исследование). Кроме того, всем пациентам перед выполнением операции должна быть проведена пищеводная манометрия высокого разрешения с целью исключения ахалазии или других нарушений моторики пищевода. У пациентов с типичной изжогой, которая полностью контролируется приемом ИПП, или у пациентов с отклоняющимися от нормы результатами амбулаторного рН-мониторинга (при их позитивной корреляции с симптомами) исход хирургического вмешательства, по-видимому, будет наиболее оптимальным. При этом отмечается тенденция к тому, что в случае атипичных или внепищеводных симптомов ГЭРБ ответ на хирургическое лечение оказывается несколько хуже.
Кандидатами на выполнение хирургической фундопликации являются пациенты, у которых имеют место следующие факторы:
- побочные эффекты медикаментозной терапии;
- неудовлетворительный комплайенс при медикаментозном лечении;
- обеспокоенность в отношении постоянной медикаментозной терапии или желание ее прервать;
- симптомы при наличии крупной грыжи пищеводного отверстия диафрагмы (>5 см);
- регургитация;
- отсутствие заинтересованности в проведении медикаментозной терапии;
- отклонение от нормы результатов рН-метрии на фоне приема максимальной дозы ИПП;
- корреляция симптомов с некислотным рефлюксом, в то время как пациент получает максимальную дозу ИПП.
В настоящее время наиболее часто выполняемой операцией у пациентов с ГЭРБ является лапароскопическая хирургическая фундопликация. Доказательства уровня 1а указывают на целесообразность использования при ее проведении лапароскопического заднего доступа. Показано, что распространенность изжоги, частота назначения ИПП и выполнения повторного оперативного вмешательства оказываются выше после использования лапароскопического переднего доступа [43, 44].
Сравнительные исследования по оценке эффективности у пациентов с ГЭРБ антирефлюксных хирургических операций и медикаментозной терапии продемонстрировали противоречивые результаты. Крупный метаанализ, включавший 7 клинических исследований, показал, что хирургическое лечение ГЭРБ более эффективно, чем медикаментозная терапия, с учетом значимых для пациента исходов как в краткосрочной, так и в среднесрочной перспективе. После хирургического вмешательства реже отмечались изжога и регургитация. Однако значительная часть пациентов все еще нуждалась в приеме антирефлюксных препаратов после хирургической фундопликации. Пациенты, которым была выполнена операция, достоверно с большей вероятностью были удовлетворены контролем симптоматики и также демонстрировали более высокий уровень удовлетворенности проведенным лечением [45]. Однако недавно опубликованный обзор Кокрановской базы данных, который включал в целом данные 1160 участников 4 РКИ, рандомизированных для выполнения лапароскопической фундопликации (589 пациентов) или для получения медикаментозного лечения ИПП (571 пациент), продемонстрировал наличие существенной неопределенности в вопросе о балансе преимуществ и рисков лапароскопической фундопликации в сравнении с длительной медикаментозной терапией ИПП. Для получения более убедительных рекомендаций авторы предложили провести дальнейшие РКИ с целью сравнения эффективности лапароскопической фундопликации и медикаментозного лечения у пациентов с ГЭРБ (со слепой оценкой исхода). Такие исследования должны включать долгосрочные пациенториентированные исходы, в частности связанные с лечением нежелательные явления (включая их степень тяжести), качество жизни и социально-экономические аспекты влияния нежелательных явлений и симптомов [46, 47].
Недавно арсенал методик хирургического лечения при ГЭРБ пополнился системой контроля рефлюкса LinxTM. Это устройство состоит из нескольких титановых шариков с магнитным сердечником, которые соединяются между собой титановыми проводами, образуя кольцо. При лапароскопии это кольцо располагают вокруг нижнего конца дистального отдела пищевода, оно помогает укрепить НПС и таким образом предотвратить гастроэзофагеальный рефлюкс. Первоначальный опыт использования системы LinxTM в небольшой группе тщательно отобранных пациентов (n=100) продемонстрировал нормализацию воздействия кислотного фактора на слизистую оболочку пищевода или снижение его более чем на 50% через 1 год у 64% пациентов (95% ДИ от 54 до 73). О снижении частоты использования ИПП и общем улучшении качества жизни сообщалось более чем у 90% пациентов. Наиболее частым нежелательным явлением была дисфагия (у 68% пациентов) [48]. При сравнении с классической фундопликацией по Ниссену система LinxTM продемонстрировала аналогичное улучшение качества жизни и достижение уменьшения выраженности симптоматики – с меньшей частотой побочных эффектов, но и меньшей частотой отказа от приема ИПП [49]. Хотя первоначальные результаты использования LinxTM являются весьма многообещающими, долгосрочную эффективность, устойчивость и безопасность данного устройства еще предстоит доказать в более крупной группе пациентов.
Эндолюминальная хирургия в лечении ГЭРБ
В течение последних 20 лет внимание многих исследователей было сфокусировано на развитии эндолюминальных методов лечения ГЭРБ. Эндоскопические техники менее инвазивны и более безопасны, чем хирургическая фундопликация, и обеспечивают достижение аналогичных показателей эффективности. Кроме того, при их использовании отмечается снижение зависимости от ИПП или других пероральных препаратов, применяемых при ГЭРБ. Оригинальные методы эндолюминального лечения можно в целом классифицировать на 4 типа: 1 – фиксация; 2 – абляция; 3 – инъекции; 4 – иссечение слизистой оболочки и наложение швов. Сегодня для лечения пацинетов с ГЭРБ доступны только 2 эндолюминальные методики – процедура Stretta и трансоральная безразрезная фундопликация (TIF) с использованием устройства EsophyX®, которое обеспечивает восстановление угла Гиса посредством создания клапана на уровне пищеводно-желудочного перехода. С момента первого использования в 2005 г. было выполнено уже около 17 тыс. процедур TIF. В результатах рандомизированного многоцентрового исследования RESPECT (The Randomized EsophyX versus Sham Placebo-Controlled Trial), проведенного на базе 8 центров в США, сообщалось, что TIF обеспечивала лучший контроль изжоги, чем процедура-плацебо [50]. Результаты в дальнейшем были подтверждены при проведении исследования TEMPO (TIF EsophyX versus Medical PPI Open Label), в котором зафиксировано устранение вызывающей дискомфорт регургитации у 97 и 93% перенесших TIF пациентов через 6 и 12 мес периода последующего наблюдения соответственно [51, 52]. Долгосрочная эффективность TIF оценивалась в небольшой группе из 50 тщательно отобранных пациентов с симптомами ГЭРБ, за которыми осуществлялось последующее наблюдение на протяжении вплоть до 6 лет. Процедура TIF обеспечивала достижение длительного устранения зависимости от ежедневного приема ИПП у 75-80% пациентов [53]. Идеальными кандидатами для выполнения процедуры TIF являются пациенты с хронической ГЭРБ (аномальный результат рН-метрии или ЭЭ низкой степени), у которых отсутствует грыжа пищеводного отверстия диафрагмы либо она имеет незначительный размер (≤2 см).
В ходе другого рандомизированного многоцентрового исследования пациентов с ГЭРБ и грыжей пищеводного отверстия диафрагмы размером ≤2 см распределяли в группу, в которой была выполнена TIF и затем на протяжении 6 мес назначался прием плацебо (n=87), или в группу, где проводилась плацебо-процедура и затем на 6 мес назначался омепразол 1 или 2 раза в сутки (контрольная, n=42). В соответствии с результатом анализа данных всех включенных в исследование пациентов TIF обеспечивала полное устранение регургитации у большей части пациентов (67%), чем лечение ИПП (45%; p=0,023). У участников обеих групп, которые завершили протокол, отмечалось аналогичное снижение показателей балльной оценки симптомов ГЭРБ, и при этом редко возникали тяжелые осложнения [54]. Недавнее РКИ, сравнивавшее эффективность TIF и плацебо-вмешательства, также показало эффективность TIF у пациентов с хронической ИПП-зависимой ГЭРБ, что подтверждено при последующем наблюдении за ними на протяжении вплоть до 6 мес [50].
Другой эндоскопической техникой, использующейся дольше, чем TIF, является процедура Стретта (Stretta). Устройство Stretta представляет собой четырехигольный катетер с баллонами на концах, который обеспечивает доставку радиочастотной энергии в гладкие мышцы пищеводно-желудочного перехода. Первый опубликованный в 2001 г. отчет продемонстрировал обнадеживающие результаты использования процедуры Стретта у 25 пациентов с ГЭРБ [55]. В течение последних 16 лет эта терапевтическая методика была существенно усовершенствована и использована более чем у 20 тыс. пациентов.
Авторы недавнего систематического обзора, который включал все 4 РКИ, сравнивавших процедуру Стретта с плацебо-процедурой, пришли к выводу о том, что первая более эффективна [56]. Данные длительного последующего наблюдения за пациентами, которым была выполнена процедура Стретта, недавно были опубликованы Noar и соавт. [57]. Ученые провели 10-летнее открытое проспективное исследование с участием пациентов с рефрактерной ГЭРБ, которым была выполнена процедура Стретта. Из 217 пациентов, которые достигли 10-летнего срока последующего наблюдения, у 72% отмечалась нормализация связанного со здоровьем качества жизни, а у 64% удалось снизить исходный объем использования ИПП более чем на 50%; при этом у 41% пациентов было зафиксировано прекращение их приема по достижению 10 лет. Таким образом, имеющиеся в настоящее время доказательства свидетельствуют о том, что процедура Стретта является эффективной терапевтической методикой для пациентов с ГЭРБ.
Выводы
ГЭРБ представляет собой очень распространенное заболевание, которое удается эффективно контролировать у значительного количества пациентов с помощью сочетания мер по изменению образа жизни и адекватной фармакотерапии. Однако контроль рефрактерной ГЭРБ, которая может наблюдаться почти у 40% пациентов, получающих ИПП 1 раз в сутки, может быть достаточно проблематичным. Наиболее оптимальным первоначальным подходом к ведению пациентов с рефрактерной ГЭРБ является оптимизация терапии ИПП. Тщательный анализ анамнеза и проведение дополнительных исследований могут помочь идентифицировать те факторы, которые вносят свой вклад в неэффективность терапии ИПП у конкретного пациента с рефрактерной ГЭРБ. У пациентов с резидуальным рефлюксом могут быть назначены такие лекарственные препараты, как блокаторы Н2-гистаминовых рецепторов, прокинетики и баклофен. У пациентов с функциональной изжогой или гиперчувствительностью к рефлюксу неотъемлемой частью любого терапевтического подхода является применение нейромодуляторов. Хотя части пациентов с ГЭРБ все еще выполняют хирургическую фундопликацию, частота ее проведения в последние годы значительно снижается. Современные эндолюминальные методики терапии при ГЭРБ обеспечивают эффективный контроль симптоматики и у ряда пациентов могут рассматриваться в качестве альтернативы медикаментозному либо хирургическому лечению.
Статья печатается в сокращении.
Список литературы, включающий 57 источников, находится в редакции.
Sandhu D.S., Fass R. Current Trends in the Management of Gastroesophageal Reflux Disease. Gut and Liver. 2018, January; 12(1): 7-16.
Перевела с англ. Елена Терещенко
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (49), жовтень 2018 р.


