19 грудня, 2018
Антиоксидантна терапія: нові відкриття в лікуванні гіпертензії
Оксидативний та нітрозативний стрес
Реактивні форми кисню (РФК) виробляються кількома компонентами клітини: плазматичною мембраною, цитозолем, пероксисомами, мітохондріями, лізосомами, ендоплазматичною сіткою (Di Meo et al., 2016). Ферменти, що беруть участь у продукції РФК, включають NO-синтазу, пероксидази, НАДФН-оксидазу та її ізоформи, ксантиноксидазу, ліпооксигенази, глюкозооксидазу, циклооксигенази, мієлопероксидазу (Bhattacharyya et al., 2014). Екзогенними джерелами РФК є забруднене повітря, куріння, іонізуюче випромінювання, їжа та ліки, хімікати, важкі метали, органічні розчинники, пестициди (Bhattacharyya et al., 2014). РФК утворюються під час редукції кисню, коли поступово вивільняються супероксидний аніон, перекис водню, гідроксильний радикал. Супероксидний аніон, що виробляється в мітохондріях, є найпоширенішою РФК (Bolisetty, Jaimes, 2013). З цього аніону під дією супероксиддисмутази утворюється перекис водню, який у присутності іонів металів та супероксидного аніону може продукувати гідроксильний радикал – найбільш реактивну та небезпечну РФК (Quinlan et al., 2013; Ogun, 2015).
Реактивні форми азоту (РФА) походять з оксиду азоту (NO), що виробляється під час руйнування аргініну до цитруліну під дією НАДФН-залежного ферменту NO-синтази (Drew, Leeuwenburgh, 2002). NO – це нейротрансмітер та регулятор артеріального тиску (АТ); це також вільний радикал, однак не дуже активний. NO здатний утворювати інші реактивні форми азоту (нітрат, пероксинітрит, 3-нітротирозин), що впливають на функціонування клітин (Ramchandra et al., 2005; Ogun, 2015). NO конкурує з киснем за зв’язування з бінуклеарним центром молекули цитохром С-оксидредуктази, що призводить до зменшення активності цитохром С-оксидази (Cleeter et al., 1994). У мітохондріях NO збільшує утворення РФК та РФА, впливаючи на біогенез цих органел, дихання та оксидативний стрес (Bolisetty, Jaimes, 2013; Ogun, 2015). NO реагує із супероксидним аніоном з утворенням пероксинітриту (OONO-), який може спонтанно розпадатися на діоксид азоту (NO2) та гідроксильний радикал. Пероксинітрит є цитотоксичним, окислює ліпопротеїни низької щільності та пригнічує функціонування мітохондрій (Radi et al., 2002; Halliwell, 2007). NO2 є тригером перекисного окиснення ліпідів, а також окислює аскорбінову кислоту (Patel et al., 1999).
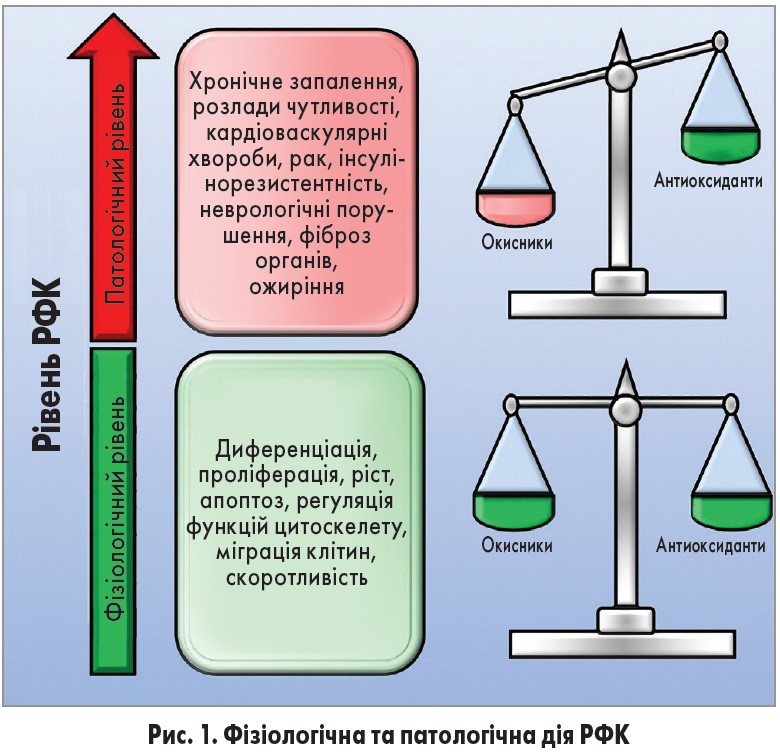 РФК та РФА відіграють важливу роль як сигнальні молекули (Di Meo et al., 2016). Ці сполуки беруть участь у багатьох фізіологічних процесах (проліферація, ріст, диференціація, апоптоз, міграція, скорочення, регуляція функцій цитоскелету), але їх надлишок запускає розвиток патологічних станів (хронічне запалення, аутоімунні захворювання, розлади чутливості та інші неврологічні порушення, кардіоваскулярні хвороби, рак, фіброз органів, ожиріння, інсулінорезистентність) (Mittler et al., 2011; Sena, Chandel, 2012; Brown, Griendling, 2015). У фізіологічних умовах існує тонкий баланс між окисниками та антиоксидантами, який дозволяє клітинам виконувати свої функції та реалізувати механізми системного захисту (Ristow, Schmeisser, 2014; Ogun, 2015; рис. 1). При порушенні цього балансу надмірна продукція РФК та РФА спричиняє оксидативний та нітрозативний стрес і екстенсивне ушкодження клітин. Ця подвійна дія РФК має назву мітогормезис і характеризується нелінійним зв’язком між рівнями РФК та смертності (Ristow, Schmeisser, 2014).
РФК та РФА відіграють важливу роль як сигнальні молекули (Di Meo et al., 2016). Ці сполуки беруть участь у багатьох фізіологічних процесах (проліферація, ріст, диференціація, апоптоз, міграція, скорочення, регуляція функцій цитоскелету), але їх надлишок запускає розвиток патологічних станів (хронічне запалення, аутоімунні захворювання, розлади чутливості та інші неврологічні порушення, кардіоваскулярні хвороби, рак, фіброз органів, ожиріння, інсулінорезистентність) (Mittler et al., 2011; Sena, Chandel, 2012; Brown, Griendling, 2015). У фізіологічних умовах існує тонкий баланс між окисниками та антиоксидантами, який дозволяє клітинам виконувати свої функції та реалізувати механізми системного захисту (Ristow, Schmeisser, 2014; Ogun, 2015; рис. 1). При порушенні цього балансу надмірна продукція РФК та РФА спричиняє оксидативний та нітрозативний стрес і екстенсивне ушкодження клітин. Ця подвійна дія РФК має назву мітогормезис і характеризується нелінійним зв’язком між рівнями РФК та смертності (Ristow, Schmeisser, 2014).
Участь РФК/РФА в розвитку артеріальної гіпертензії
Артеріальна гіпертензія (АГ) є складним патологічним станом, що виникає внаслідок дії кількох факторів (куріння, дієта, генетична схильність, сімейний анамнез, фонові захворювання), і здебільшого неможливо встановити її первинну причину (есенціальна гіпертензія). Незважаючи на складну етіологію АГ, оксидативний та нітрозативний стрес – це спільна ознака гіпертензивних розладів (Harrison et al., 2007; Harrison, Gongora, 2009; Baradaran et al., 2014). Хоча досі тривають дискусії, чи надмірна продукція РФК/РФА є причиною або наслідком АГ, кілька досліджень in vitro та in vivo дозволяють стверджувати, що РФК/РФА активують специфічні молекулярні механізми, які спричиняють підвищення АТ (Ward, Croft, 2006).
Докази in vitro на культивованих клітинах
Різні типи клітин, що входять до складу судинної стінки (ендотеліальні клітини, лейоміоцити, адвентиційні фібробласти, периваскулярні адипоцити), можуть продукувати РФК унаслідок дії відповідних ферментів (Touyz, Briones, 2011; Kim, Byzova, 2014). Головними т. зв. виробниками РФК у судинній стінці є мітохондріальні ферменти та НАДФН-оксидаза. Показано, що ангіотензин II індукує продукцію РФК у мітохондріях шляхом активації НАДФН-оксидази (Doughan et al., 2008). Продукція РФК/РФА у судинах призводить до значного зниження синтезу NO та падіння активності ендотеліальної NO-синтази (Rodrigo et al., 2011). Отже, коли рівень супероксидного аніону зростає, концентрація NO швидко падає, що спричиняє ендотеліальну дисфункцію (McIntyre et al., 1999; Touyz, Schiffrin, 2004). Пероксинітрит окиснює тетрагідробіоптерин – важливий кофактор NO-синтази та індукує продукцію супероксиду, що призводить до оксидативного стресу (Laursen et al., 2001). Шляхом перекисного окиснення ліпідів РФК спричиняють утворення вторинних продуктів (альдегідів ліпідного походження), які також поглиблюють ендотеліальну дисфункцію та зумовлюють підвищення АТ (Cracowski et al., 2002).
При АГ РФК беруть участь у кількох процесах, що, у свою чергу, призводять до розвитку ендотеліальної дисфункції (апоптоз, ангіогенез, запалення). В ендотеліальних клітинах зростання продукції РФК у відповідь на прозапальні та проатеросклеротичні фактори (ангіотензин II, окиснені ліпопротеїни низької щільності, фактор некрозу пухлин) активує апоптоз, запобігти якому можна за допомогою лікування антиоксидантами (Dimmeler, Zeiher, 2000). Проапоптотичні ефекти РФК в ендотеліальних клітинах є наслідком порушення проникності мітохондріальних мембран з подальшим вивільненням цитохрому С та активацією каспаз (Breitschopf et al., 2000; Lee et al., 2009).
Крім того, експресія в ендотелії деяких молекул адгезії (молекула адгезії судинних клітин‑1 та молекула внутрішньоклітинної адгезії‑1) є РФК-залежною; це свідчить про те, що РФК стимулюють адгезію запальних клітин (Marui et al., 1993; Khan et al., 1996).
Виявлено, що РФК-залежний ангіогенез пов’язаний з експресією фактора росту ендотелію судин (vascular endothelial growth factor, VEGF; Kim, Byzova, 2014). Зокрема, перекис водню збільшує експресію VEGF у лейоміоцитах та ендотеліальних клітинах судин, зумовлюючи ангіогенез (Ruef et al., 1997; Chua et al., 1998). Нещодавні дослідження виявили також відмінні від активації VEGF механізми РФК-залежного ангіогенезу (Kim et al., 2013; Kim, Byzova, 2014). Наприклад, РФК задіяні в утворенні продуктів окиснення ліпідів, які мають проангіогенні властивості, та в індукції експресії прозапальних генів (Malinin et al., 2011; Kim et al., 2013; Kim, Byzova, 2014).
Докази in vivo на тваринних моделях АГ
Участь РФК у розвитку АГ була продемонстрована на кількох тваринних моделях гіпертензії: щурах зі спонтанною АГ (Kerr et al., 1999); щурах, яким проведено інфузію ангіотензину II (Haugen et al., 2000); моделі реноваскулярної гіпертензії (Lerman et al., 2001); моделі АГ, що була індукована дезоксикортикостероном ацетатом (Wu et al., 2001); моделі АГ, пов’язаній з ожирінням (Dobrian et al., 2001). Ці дослідження вказують на зв’язок оксидативного стресу з АГ, у т. ч. з ушкодженням судин та органів-мішеней. Подальшим підтвердженням ролі РФК у розвитку АГ є той факт, що в експериментах на тваринах з АГ збільшена продукція РФК спричиняє розвиток ендотеліальної дисфункції, яка регресує під впливом супероксиддисмутази (Laursen et al., 1997; Bauersachs et al., 1999; Somers et al., 2000).
Докази in vivo з використанням тканин людини
На лейоміоцитах артерій осіб з АГ було показано, що ангіотензин ІІ підвищує продукцію РФК (Touyz, Schiffrin, 2001; Ahmad et al., 2017). У гіпертоніків існує тісний зв’язок між зростанням АТ та підвищенням біомаркерів оксидативного стресу (малоновий діальдегід, F2-ізопростани, дисульфід глутатіону тощо) (Rodrigo et al., 2007; Ahmad et al., 2017).
Антиоксидантна терапія при АГ
Враховуючи зазначену вище роль оксидативного та нітрозативного стресу в етіології АГ, антиоксидантна терапія може бути корисною стратегією для відновлення порушеного балансу між окисниками та антиоксидантами. Лікування антиоксидантами показало високу ефективність в експериментах на тваринах з гіпертензією. Застосування антиоксиданту в щурів зі спонтанною АГ збільшувало життєздатність молекули NO та зменшувало АТ (Vaziri et al., 2000). При цьому лікування антиоксидантом N-ацетилцистеїном призводило до гальмування продукції РФК, збільшення активності NO-синтази та знижувало показники АТ (Ahmad et al., 2017). Подібні результати були отримані в щурів зі спонтанною АГ, що потребували лікування інгібітором ксантиноксидази алопуринолом (Mazzali
et al., 2001). Спеціально синтезовані антиоксидантні пептиди здатні знижувати судинний опір та зменшувати АТ. Наприклад, пептид gp91ds впливає на збірку молекули НАДФН-оксидази та знижує продукцію супероксидного аніону (Greig et al., 2010). Цей пептид був спеціально створений з метою впливу на судинне русло і вивчався на тваринних моделях ендотеліальної дисфункцїї та тяжкої гіпертензії. Лікування достовірно покращувало біодоступність NO та зменшувало прогресування зростання систолічного АТ (Greig et al., 2010).
На противагу преклінічним дослідженням антиоксидантна терапія АГ у клінічних умовах не досягла очікуваного успіху. У літературі можна знайти абсолютно суперечливі дані щодо подібного лікування (Kizhakekuttu, Widlansky, 2010). Зазначене може бути наслідком складності етіопатогенезу АГ. Хоча ми називаємо гіпертоніками усіх осіб з АТ вище встановленого порогу (Mancia et al., 2013; Whelton et al., 2017), це визначення включає низку різноманітних фенотипів (АГ у молодих осіб, у людей з ожирінням, у жінок після менопаузи, в осіб старечого віку). Для кожного з таких фенотипів існує власна етіологія АГ залежно від факторів ризику (генетична схильність, сімейний анамнез), способу життя (куріння, особливості харчування, сидячий спосіб життя), супутніх захворювань (хронічні хвороби нирок, цукровий діабет). Тому для кожного фенотипу роль окисних процесів може бути різною, а поєднання різних фенотипів у межах одного клінічного дослідження може призвести до викривлення результатів.
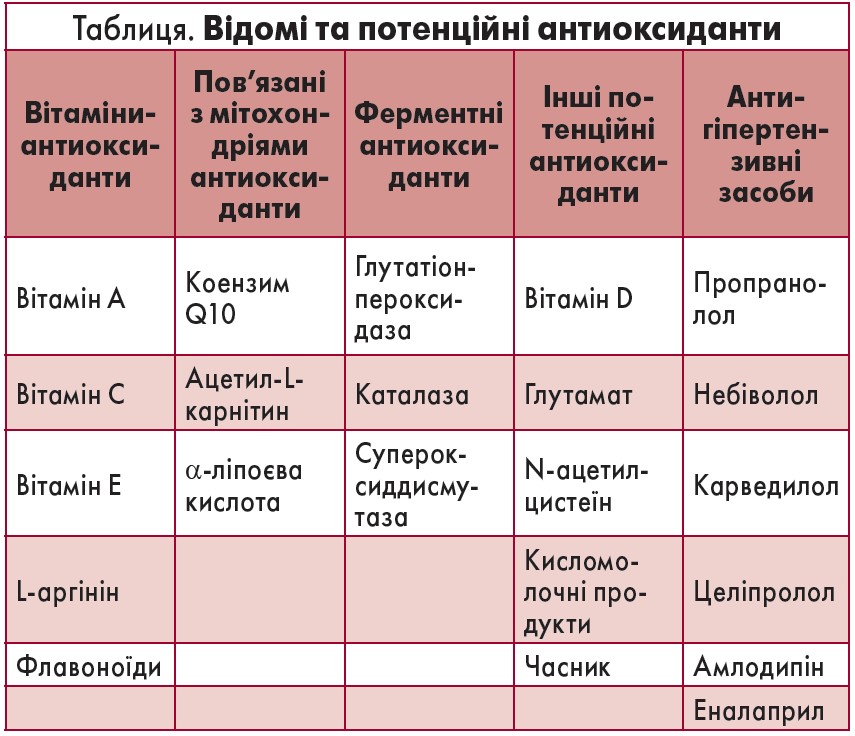
Слід також врахувати, що ефективність антиоксидантів може бути знижена через взаємодію з іншими речовинами. Наприклад, було показано, що вітамін C знижував і систолічний, і діастолічний тиск у порівнянні з плацебо (Ward et al., 2005) шляхом гальмування НАДФН-оксидази та активації ендотеліальної NO-синтази (Briones, Touyz, 2010; Juraschek et al., 2012). Разом з тим цей вітамін у поєднанні з поліфенолами підвищував АТ, а в сполученні з іншими антиоксидантами (вітамін E, бета-каротин, цинк) помірно знижував систолічний АТ, не впливаючи на діастолічний (Ardalan, Rafieian-Kopaei, 2014). Крім того, на ефективність лікування можуть мати вплив режим прийому та дозування, підбір учасників дослідження тощо. У таблиці представлені найбільш поширені природні антиоксиданти (вітаміни та пов’язані з мітохондріями антиоксиданти), інші потенційні антиоксиданти та антигіпертензивні засоби, що реалізують антиоксидантний ефект.
З природних антиоксидантів слід звернути увагу на вітамін D, зв’язок концентрації якого з АГ нещодавно було встановлено, оскільки ця речовина має великий потенціал для використання в лікуванні підвищеного тиску. Серед інших антиоксидантів у таблиці наведено деякі антигіпертензивні препарати зі схожими властивостями.
Вітамін D
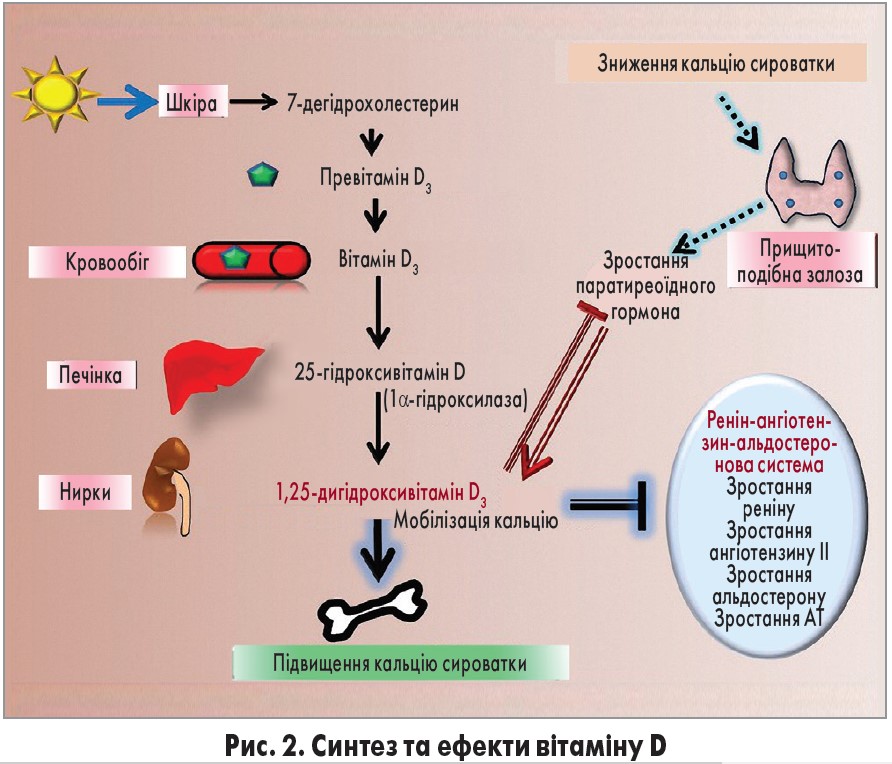
Останнім часом виявили, що вітамін D має антигіпертензивну дію, яку реалізує через активацію антиоксидантних механізмів. У людей більшість вітаміну D (приблизно 80%) природним шляхом синтезується в шкірі з 7-дегідроксихолестерину у відповідь на ультрафіолетове випромінювання; іншим джерелом є продукти харчування. У печінці вітамін D метаболізується до 25-гідроксивітаміну D (25(OH)D), який під дією 1α-гідроксилази перетворюється на 1,25-дигідроксивітамін D3 – біологічно активний агоніст рецептора вітаміну D (Chen et al., 2015; рис. 2). Сироваткові рівні вітаміну D регулюються гомеостазом кальцію та рівнем паратиреоїдного гормона: низька концентрація першого та високі показники другого індукують синтез вітаміну D шляхом підвищення активності 1α-гідроксилази (Chen et al., 2015).
У значної частини популяції західних країн відзначається дефіцит вітаміну D, що асоціюється з підвищеним ризиком кардіоваскулярних хвороб (McGreevy, Williams, 2011; Tamez et al., 2013). Імовірно, однією з причин дефіциту є уникнення сонячного опромінення з метою запобігання розвитку меланоми (Holick, 2007), хоча слід врахувати й особливості харчування, які за потреби можна коригувати за допомогою замісної терапії.
Нещодавно було повідомлено про зв’язок між низьким сироватковим рівнем вітаміну D та АГ (Ullah et al., 2010; Kota et al., 2011). В експериментах було показано, що в мишей з відсутністю 1α-гідроксилази, які не можуть синтезувати вітамін D3, підвищується АТ та розвивається гіпертрофія лівого шлуночка (Zhou et al., 2008). Вітамін D може впливати на АТ кількома шляхами. І у тварин, і в людей ця речовина знижує активність ренін-ангіотензин-альдостеронової системи (Li et al., 2002; Tomaschitz et al., 2010), модулює ендотеліальну функцію (Wong et al., 2010; Pittarella et al., 2015; Molinari et al., 2018), зменшує судинний оксидативний стрес (Argacha et al., 2011).
Клінічні дослідження продемонстрували зворотний дозозалежний зв’язок між плазмовою концентрацією вітаміну D3 та АТ і активністю реніну як у нормотензивних, так і в гіпертензивних осіб (Nigwekar, Thadhani, 2013; Grubler et al., 2017). При цьому високі рівні вітаміну D у людей асоціюються з нижчим АТ (Vimaleswaran et al., 2014). Враховуючи велику кількість подібних повідомлень, імовірно, харчові добавки на основі вітаміну D можуть бути ефективними при АГ. Цю гіпотезу було підтверджено на тваринних моделях АГ. Добавка вітаміну D знижувала патологічну гіпертрофію правого шлуночка в щурів з легеневою гіпертензією (Tanaka et al., 2017) і АТ у щурів зі спонтанною АГ (Wong et al., 2010). Кілька клінічних досліджень продемонстрували дієвість природного вітаміну D, вітаміну D3 чи його аналогів у зниженні АТ в осіб із есенціальною АГ, асоційованою з дефіцитом цього вітаміну (Kimura et al., 1999; Pfeifer et al., 2001; Judd et al., 2010; Goel, Lal, 2011; Bernini et al., 2013; Forman et al., 2013; Carrara et al., 2014; Mozaffari-Khosravi et al., 2015). Включення вітаміну D у план ведення вагітних здатне зменшити частоту гестаційної гіпертензії та прееклампсії (Behjat Sasan et al., 2017). Крім того, вітамін D сприятливо впливає на АТ і в осіб із супутньою патологією, зокрема з цукровим діабетом 2 типу (de Paula et al., 2017).
Однак деякі інші рандомізовані контрольовані дослідження показують, що добавки на основі вітаміну D не є ефективним антигіпертензивним засобом (Li et al., 2004; Michos, Melamed, 2008; Beveridge et al., 2015; Grubler et al., 2017; Wu, Sun, 2017), тобто в сучасній літературі можна знайти суперечливі дані з цього питання. Таку розбіжність можна пояснити відмінностями популяцій різних досліджень (рівень дефіциту вітаміну D, стать, етнічна приналежність, вихідний рівень АТ, вік, концентрація паратгормона). Недавнє дослідження продемонструвало, що зв’язок між вмістом вітаміну D у сироватці та АТ відрізняється залежно від етнічної приналежності та статі. Автори вважають, що існує нелінійний зв’язок між рівнем вітаміну D та АГ з істотним зниженням АТ лише в разі підтримання концентрації вітаміну в межах фізіологічної норми, яка відрізняється залежно від статі та раси (Vishnu, Ahuja, 2017).
У ролі механізмів зв’язку дефіциту вітаміну D та підвищення АТ розглядаються антиоксидантні ефекти вітаміну. Також слід звернути увагу, що рівень вітаміну D зворотно корелює з концентрацією головного кальцієвого модулятора – паратгормона. Судинні ефекти цього гормона та погіршення функції нирок є ймовірними механізмами підвищення судинного опору та об’єму циркулюючої крові – двох головних детермінант гіпертензії. У великому південноіталійському дослідженні продемонстровано, що підвищений рівень паратиреоїдного гормона тісніше, ніж дефіцит вітаміну D, корелює з АТ та кардіоваскулярним ризиком (Pascale et al., 2018). Це свідчить, що рівень паратгормона може бути визначальним параметром для відбору пацієнтів, АГ яких може бути чутливою до дії вітаміну D. Подальші дослідження в цій галузі мають врахувати зазначені параметри та визначити оптимальний контингент для подібного лікування.
Антигіпертензивні ліки з антиоксидантними властивостями
На сьогодні відомо кілька молекул, які є ефективними антигіпертензивними засобами з антиоксидантними властивостями. Зокрема, деякі бета-блокатори (ББ), окрім здатності пригнічувати адреналін-/норадреналін-залежну активацію бета-адренергічних рецепторів (Iaccarino et al., 2006; Sorriento et al., 2011; Galasso et al., 2013), можуть також знижувати оксидативний стрес. Серед таких ББ найбільш вивченими є пропранолол, небіволол, карведилол та целіпролол (Yao et al., 2008). Пропранолол пригнічує оксидативний стрес та знижує перекисне окиснення ліпідів у тканинах організму (Mak, Weglicki, 1988; Yao et al., 2008). Карведилол зменшує інтенсивність перекисного окиснення ліпідів у пацієнтів із серцевою недостатністю, поглинаючи вільні радикали (Kukin et al., 1999; Yao et al., 2008). Целіпролол знижує продукцію супероксид-аніонів у пацієнтів з есенціальною АГ та покращує функцію ендотелію (Mehta et al., 1994; Kobayashi et al., 2001; Yao et al., 2008). Однак антиоксидантні ефекти не є класовими для ББ, наприклад атенолол не впливає на продукцію РФК в ендотеліоцитах (Fratta Pasini et al., 2005).
На молекулярному рівні бета-блокуючий вплив є важливим у зниженні продукції РФК, оскільки відомо, що катехоламіни зумовлюють оксидативний стрес у міокарді. Крім того, деякі ББ мають безпосередні антиоксидантні ефекти, які в різних препаратів різні у зв’язку з відмінностями внутрішньоклітинних сигнальних механізмів. Зокрема, небіволол впливає шляхом збільшення рівня NO та активності NO-синтази на тлі зниження продукції РФК та експресії НАДФН-оксидази (Wang et al., 2017). Карведилол гальмує 4-гідрокси‑2-ноненал-індуковане внутрішньоклітинне перевантаження іонами Ca2+ (Nakamura et al., 2011). Целіпролол достовірно знижує АТ та мінімізує індуковане гіпоксією ремоделювання лівого шлуночка в дослідах на мишах, відновлюючи експресію ендотеліальної NO-синтази шляхом активації сигнального шляху PI3K-AKT (Kobayashi et al., 2003; Nishioka et al., 2013).
Поєднання антигіпертензивних та антиоксидантних властивостей, крім перерахованих вище ББ, притаманне амлодипіну – блокатору кальцієвих каналів. Амлодипін знижує і АТ, і оксидативний стрес, що підтверджується зниженням рівня малонового діальдегіду та зростанням концентрацій Na+ K+-АТФази та супероксиддисмутази в пацієнтів з есенціальною гіпертензією (Mahajan et al., 2007). Цей ефект посилюється в разі додавання вітаміну C (Mahajan et al., 2007).
Інгібітор ангіотензин-перетворювального ферменту (ІАПФ) еналаприл знижує експресію маркерів оксидативного стресу в серці та нирках щурів зі спонтанною АГ (Chandran et al., 2014; Yusoff et al., 2017) та з цукровим діабетом (de Cavanagh et al., 2001). Три місяці лікування АГ еналаприлом запобігають оксидативному стресу більш виражено, ніж аналогічний курс атенололу (Deoghare, Kantharia, 2013). Сприятливі антиоксидантні впливи на судини, у т. ч. покращення біодоступності NO, були продемонстровані для ІАПФ, що містять сульфгідрильну групу (каптоприл, лізиноприл, зофеноприл), у зв’язку зі здатністю тіолових залишків знищувати вільні радикали (Chopra et al., 1990; Buikema et al., 2000; Donnarumma et al., 2016).
Висновки та напрями подальших досліджень
Деякі захворювання асоціюються з оксидативним стресом, а отже, антиоксидантна терапія може бути ефективним напрямом лікування. Хоча експериментальні та преклінічні дослідження підтверджують таку точку зору, результати клінічних випробувань є суперечливими. Це може бути наслідком патофізіологічної складності сигнальних систем, опосередкованих РФК/РФА, особливо в осіб з коморбідними станами (Pagliaro, Penna, 2015, 2017; Egea et al., 2017). Але навіть якщо гіпотеза стосовно ефективності антиоксидантної терапії в лікуванні АГ ще не підтверджена, роль оксидативного стресу в розвитку та прогресуванні гіпертензивних станів беззаперечна. Відмінність багатообіцяючих результатів вивчення експериментальних моделей від висновків клінічних досліджень можна пояснити численними причинами: по-перше, період піврозпаду певних антиоксидантів може впливати на їхню ефективність при довготерміновому призначенні; по-друге, взаємодія з іншими речовинами може знижувати антигіпертензивні ефекти; по-третє, відмінності в характеристиках популяцій пацієнтів різних досліджень можуть призводити до різних результатів. На сьогодні застосування антигіпертензивних засобів з антиоксидантними властивостями вважається найбільш ефективним способом лікування АГ, оскільки такі препарати здатні не тільки знижувати АТ, а й впливати на молекулярні механізми, що задіяні в регуляції функції судин та оксидативного статусу. Незважаючи на певні суперечності в результатах досліджень, перспективним методом лікування АГ може бути застосування нутрієнтів вітаміну D. Ці результати потребують подальших досліджень з врахуванням ступеня дефіциту вітаміну D та рівня паратиреоїдного гормона як визначальних факторів при відборі пацієнтів для такого лікування. Існує також потреба в проведенні подальших досліджень для вивчення джерел та клітинних мішеней РФК/РФА, їхніх сприятливих та шкідливих ефектів, специфічних молекулярних механізмів, взаємодій, а також визначення пацієнтів, які можуть бути чутливими до антиоксидантної терапії АГ.
Sorriento D., De Luca N., Trimarco B., Iaccarino G. The Antioxidant Therapy: New Insights in the Treatment of Hypertension. Front Physiol. 2018; 9: 258
Переклала з англ. Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 18 (439), вересень 2018 р.