20 грудня, 2018
Всеукраинская научно-практическая конференция офтальмологов: новости, проблемы и перспективы лечения глазных болезней
12-13 сентября в г. Виннице состоялась Всеукраинская научно-практическая конференция офтальмологов, посвященная 80-летию основания Общества офтальмологов Украины. Мероприятие было организовано ГУ «Институт глазных болезней и тканевой терапии им. В. П. Филатова НАМН Украины» (г. Одесса) на базе Винницкой областной клинической больницы при поддержке Национальной академии медицинских наук Украины, Министерства здравоохранения Украины и Винницкого национального медицинского университета им. Н. И. Пирогова.
Программа конференции включала пленарные заседания с докладами и лекционным курсом ведущих специалистов в области офтальмологии, стендовые доклады, выставку современных лекарственных средств, изделий медицинского назначения и тематических изданий. Главные научно-практические направления охватывали организацию офтальмологической помощи, а также новые методы диагностики, лечения и профилактики глазной патологии детского и взрослого населения.
 Значительный интерес аудитории вызвала секция, посвященная глаукоме. Заведующая отделением микрохирургии глаза Винницкой областной клинической больницы им. Н. И. Пирогова, кандидат медицинских наук Н. И. Капшук поделилась опытом проведения трабэктомии ab interno в рамках ведения больных с глаукомой. Данное патологическое состояние диагностируется примерно у 80 млн жителей нашей планеты. К сожалению, из них лишь около половины осведомлены о своем заболевании, при этом не все из них в полной мере осознают возможные последствия глаукомы. Часто пациенты обращаются за медицинской помощью слишком поздно, когда зрительную функцию восстановить уже невозможно. Согласно европейским рекомендациям, основным моментом в лечении глаукомы является достижение целевого внутриглазного давления (ВГД). На более поздних стадиях патологического процесса целевые показатели ВГД должны быть ниже, чем на начальных, поэтому на старте терапии в фокусе внимания ее безопасность. По мере усугубления симптомов заболевания ведущую роль приобретает максимальная эффективность лечения, что требует хирургического вмешательства. Однако пациенты зачастую не заинтересованы в операции, особенно учитывая тот факт, что полного восстановления зрения хирург обещать не в состоянии. Эти факты обусловливают потребность во внедрении нового высокоэффективного малоинвазивного метода лечения глаукомы.
Значительный интерес аудитории вызвала секция, посвященная глаукоме. Заведующая отделением микрохирургии глаза Винницкой областной клинической больницы им. Н. И. Пирогова, кандидат медицинских наук Н. И. Капшук поделилась опытом проведения трабэктомии ab interno в рамках ведения больных с глаукомой. Данное патологическое состояние диагностируется примерно у 80 млн жителей нашей планеты. К сожалению, из них лишь около половины осведомлены о своем заболевании, при этом не все из них в полной мере осознают возможные последствия глаукомы. Часто пациенты обращаются за медицинской помощью слишком поздно, когда зрительную функцию восстановить уже невозможно. Согласно европейским рекомендациям, основным моментом в лечении глаукомы является достижение целевого внутриглазного давления (ВГД). На более поздних стадиях патологического процесса целевые показатели ВГД должны быть ниже, чем на начальных, поэтому на старте терапии в фокусе внимания ее безопасность. По мере усугубления симптомов заболевания ведущую роль приобретает максимальная эффективность лечения, что требует хирургического вмешательства. Однако пациенты зачастую не заинтересованы в операции, особенно учитывая тот факт, что полного восстановления зрения хирург обещать не в состоянии. Эти факты обусловливают потребность во внедрении нового высокоэффективного малоинвазивного метода лечения глаукомы.
В последние годы отмечается значительный прогресс в хирургии катаракты от открытой операции до факоэмульсификации, сделавшей лечение амбулаторной процедурой. Сегодня подобные тенденции – внедрение MIGS (minimally invasive glaucoma surgery) – имеют место и в хирургии глаукомы. Суть данных операций состоит в улучшении природных путей оттока слезной жидкости. Осуществить эту задачу возможно с помощью таких подходов, как стентирование шлеммова канала, его дилатация, операции на трабекуле (гониотомия, эндотрабекулэктомия, трабэктомия ab interno путем абляции). Целью авторского исследования стала оценка эффективности последнего метода у больных открытоугольной глаукомой (ОУГ). В исследовании приняли участие 30 пациентов с ОУГ (у большинства 2-3 стадия), средний возраст которых составил 65,17 года. В анамнезе у некоторых больных были зафиксированы селективная лазерная трабекулопластика и трабекулэктомия. В 19 случаях авторы применили трабэктомию, в 11 – трабэктомию с факоэмульсификацией катаракты. Методы обследования включали рефрактометрию, визиометрию, биомикроскопию, тонометрию, статическую периметрию, офтальмоскопию, гониоскопию (для подтверждения показаний к операции), оптическую биометрию, оптическую когерентную томографию (ОКТ). В качестве предоперационной подготовки применялись комбинированные препараты, снижающие ВГД. Преимуществами исследуемого метода лечения являются естественный способ восстановления оттока слезной жидкости, снижение ВГД на 30-40%, прогнозируемость результата, безопасность и малотравматичность, отсутствие гипотонии, быстрая реабилитация, интактная конъюнктива, отсутствие потребности в применении имплантатов или антиметаболитов, возможность комбинации с факоэмульсификацией.
 Член-корреспондент НАМН Украины, заведующая кафедрой хирургических болезней ЧВУЗ «Киевский медицинский университет УАНМ», доктор медицинских наук, профессор З. Ф. Веселовская посвятила свое выступление европейским стандартам медикаментозной терапии глауком, отметив, что алгоритм ведения первичной ОУГ (ПОУГ) эволюционировал и в современном варианте предусматривает продвижение от монотерапии до принятия решения о лазерном/хирургическом лечении. Глаукома – многофакторная хроническая пожизненная патология, характеризующаяся оптической нейропатией с типичными изменениями диска зрительного нерва и полей зрения. Глаукома лидирует в структуре причин слепоты. Не вызывает сомнений, что единственный модифицируемый фактор риска данной патологии – повышенное ВГД. Именно суточные флуктуации ВГД (преимущественно ночное повышение) приводят к нарушениям глазной перфузии. Глазное перфузионное давление (ГПД) – это давление тока крови в сосудистой системе глаз, которое можно рассчитать по формуле:
Член-корреспондент НАМН Украины, заведующая кафедрой хирургических болезней ЧВУЗ «Киевский медицинский университет УАНМ», доктор медицинских наук, профессор З. Ф. Веселовская посвятила свое выступление европейским стандартам медикаментозной терапии глауком, отметив, что алгоритм ведения первичной ОУГ (ПОУГ) эволюционировал и в современном варианте предусматривает продвижение от монотерапии до принятия решения о лазерном/хирургическом лечении. Глаукома – многофакторная хроническая пожизненная патология, характеризующаяся оптической нейропатией с типичными изменениями диска зрительного нерва и полей зрения. Глаукома лидирует в структуре причин слепоты. Не вызывает сомнений, что единственный модифицируемый фактор риска данной патологии – повышенное ВГД. Именно суточные флуктуации ВГД (преимущественно ночное повышение) приводят к нарушениям глазной перфузии. Глазное перфузионное давление (ГПД) – это давление тока крови в сосудистой системе глаз, которое можно рассчитать по формуле:
ГПД = 2/3 [ДАД + 1/3 (САД – ДАД)] – ВГД,
где ДАД – диастолическое артериальное давление, САД – систолическое артериальное давление.
Из приведенной формулы ясно, что ГПД более чувствительно к изменениям ДАД, а повышение ВГД сопровождается падением ГПД. Исходя из этого можно констатировать, что неадекватная терапия гипертонической болезни также способна ухудшить перфузию глаза.
Пациентам с глаукомой необходим жесткий суточный контроль ВГД. С этой целью были исследованы все группы офтальмотропных медикаментов. Оказалось, что наиболее выраженным действием в ночной период обладают аналоги простагландинов (АПГ). В частности, тафлупрост (Тафлотан, компания «Сантен») обладает очень высоким сродством и селективностью к рецепторам простагландина F, чем другие АПГ. Сравнение бесконсервантной формы тафлупроста с латанопростом показало, что на фоне сопоставимой эффективности и безопасности тафлупрост более действенно корригирует флуктуации ВГД (Konstans et al., 2012).
С установлением диагноза глаукомы резко ухудшается качество жизни пациента, поскольку это то заболевание, которое необходимо контролировать непрерывно. При недостаточном контроле ВГД с помощью монотерапии следует перейти на прием двух активных веществ в виде фиксированной комбинации (ФК) или сочетания двух препаратов. Однако в последнем случае нужно иметь в виду, что, поскольку режим дозирования влияет на приверженность пациента к лечению, увеличение количества лекарственных средств снижает вероятность выполнения рекомендаций врача. ФК дорзоламида и тимолола (Косопт, «Сантен») является крайне удачным сочетанием компонентов. Дорзоламиду свойственно более выраженное ночное действие, а тимололу – дневное. Механизмы влияния составляющих Косопта также отличаются: дорзоламид угнетает карбоангидразу ІІ, снижая секрецию внутриглазной жидкости и обеспечивая противоотечный и противовоспалительный эффекты, а β-блокатор тимолол, кроме уменьшения секреции внутриглазной жидкости, несколько увеличивает ее отток. Синергизм действия этих веществ обеспечивает достаточно стойкий суточный контроль ВГД с достаточным уровнем безопасности, улучшая приверженность к лечению и качество жизни пациента. При недостаточном снижении ВГД с помощью Косопта следует обратить внимание на β-блокатор в сочетании с тафлупростом. ФК тафлупроста и тимолола (Таптиком, компания «Сантен») обеспечивает достижение ВГД ≤18 мм рт. ст. у 80% пациентов, а у половины больных позволяет достичь уровня ≤16 мм рт. ст.
Не следует также забывать о состоянии передней поверхности глаза, которое может влиять на эффективность лечения. В наше время преимущество следует отдавать бесконсервантным формам топических офтальмопрепаратов.
 В рамках состоявшегося в ходе конференции сателлитного симпозиума, генеральным спонсором которого выступила компания «Сантен», приняли участие известные европейские эксперты в сфере офтальмологии. Профессор M. Calonge (Институт прикладной офтальмобиологии, Университет Вальядолида, Испания) представила доклад о новом подходе к эффективному лечению синдрома сухого глаза (ССГ), который предполагает применение циклоспорина А 0,1%. ССГ – это многофакторное заболевание слезной функциональной единицы. Основу патогенеза ССГ составляют иммуноопосредованное воспаление и нейросенсорные нарушения. Дисфункция слезной пленки ведет к появлению и прогрессированию признаков и симптомов ССГ. По разным данным, распространенность ССГ в мире варьирует от 5 до 34%. Это состояние не только негативно влияет на качество жизни, но и сопровождается значительными экономическими затратами, как прямыми, так и опосредованными, связанными со снижением трудоспособности. Важно, что ССГ может приводить к тяжелым осложнениям, например к язве роговицы с возможными инфекционными процессами и перфорациями, а также выступать противопоказанием к трансплантации роговицы.
В рамках состоявшегося в ходе конференции сателлитного симпозиума, генеральным спонсором которого выступила компания «Сантен», приняли участие известные европейские эксперты в сфере офтальмологии. Профессор M. Calonge (Институт прикладной офтальмобиологии, Университет Вальядолида, Испания) представила доклад о новом подходе к эффективному лечению синдрома сухого глаза (ССГ), который предполагает применение циклоспорина А 0,1%. ССГ – это многофакторное заболевание слезной функциональной единицы. Основу патогенеза ССГ составляют иммуноопосредованное воспаление и нейросенсорные нарушения. Дисфункция слезной пленки ведет к появлению и прогрессированию признаков и симптомов ССГ. По разным данным, распространенность ССГ в мире варьирует от 5 до 34%. Это состояние не только негативно влияет на качество жизни, но и сопровождается значительными экономическими затратами, как прямыми, так и опосредованными, связанными со снижением трудоспособности. Важно, что ССГ может приводить к тяжелым осложнениям, например к язве роговицы с возможными инфекционными процессами и перфорациями, а также выступать противопоказанием к трансплантации роговицы.
Существует множество факторов риска развития ССГ (постменопауза / низкий уровень андрогенов, аутоиммунные заболевания, применение некоторых системных или топических препаратов, длительное ношение контактных линз, изменения роговичной иннервации). Важен также соответствующий генетический фон, на котором развивается заболевание. Базовым патогенетическим механизмом ССГ является хроническое воспаление, ведущее к нарушению продукции и состава слезной пленки. Вследствие этого повреждается эпителий поверхности глаза, а нервные рецепторы оказываются во враждебной воспаленной среде.
В модели на животных было установлено, что ССГ опосредован аутоиммунным ответом, обусловленным в первую очередь Т-лимфоцитами, а также другими воспалительными клетками. Исследования с участием людей показали, что противовоспалительное лечение может смягчить проявления ССГ и даже способствовать обратному развитию патологической симптоматики. Это подтвердили исследования in vitro, проведенные на культурах клеток роговицы и конъюнктивы.
Наличием воспаления характеризуются как вододефицитный, так и испарительный подтипы ССГ, что свидетельствует о необходимости восстановления гомеостаза у всех больных с этим состоянием. Существует много методов, направленных на разные этапы порочного круга развития и прогрессирования ССГ. Среди них – использование различных окклюдеров для поддержания уровня влаги, климатотерапия (пребывание на побережье моря), стабилизация липидного слоя, прием омега‑3 жирных кислот и осмопротекторов, применение препаратов искусственных слез, противовоспалительных средств и т. д. Препараты искусственных слез крайне популярны в Европе и выступают базисным компонентом лечения ССГ у многих пациентов. При отсутствии эффекта от подобной тактики следует переходить на противовоспалительную терапию.
Топический циклоспорин, одобренный для применения при ССГ, является одновременно противовоспалительным и иммуномодулирующим препаратом. Подытоживая результаты проведенных на данный момент клинических исследований, стоит отметить, что топический циклоспорин снижает лимфоцитарную инфильтрацию и активацию лимфоцитов, уменьшает уровни маркеров апоптоза и провоспалительных цитокинов, увеличивает плотность бокаловидных клеток, повышает высоту и объем слезного мениска, улучшает чувствительность роговицы, увеличивает продукцию природной слезной жидкости, тем самым снижая потребность в искусственных слезах. Одобренный Управлением по контролю продуктов питания и лекарственных средств США (FDA) 0,05% циклоспорин не получил разрешения к использованию в Евросоюзе, а вот катионная эмульсия 0,1% циклоспорина недавно появилась в большинстве европейских стран.
Многоцентровое двойное слепое рандомизированное плацебо-контролированное исследование SANSIKA подтвердило преимущество 0,01% циклоспорина над плацебо в лечении ССГ, выявив более выраженное улучшение по шкале OSDI (Ocular Surface Disease Index, индекс заболеваний поверхности глаза) и по результатам окрашивания роговицы флуоресцеином в группе циклоспорина. У пациентов группы лечения наблюдалось также снижение HLA-DR, что свидетельствует об избавлении от воспалительных клеток.
Подобные результаты были получены в многоцентровом двойном слепом рандомизированном плацебо-контролированном исследовании SICCANOVE (n=496), где применение циклоспорина позволяло устранить все проявления кератита и ССГ. Таким образом, клинические доказательства, полученные в этих двух значимых исследованиях, свидетельствуют об эффективности циклоспорина в лечении ССГ умеренной/тяжелой степени. Действие препарата проявлялось в снижении воспаления поверхности глаза, уменьшении выраженности поверхностного точечного кератита и полной ликвидации кератита у некоторых пациентов. В реальной практике офтальмологи обладают многолетним опытом работы с циклоспорином и знают, что лечение кератита в контексте ССГ следует начинать как можно раньше во избежание прогрессирования патологии.
Таким образом, понимание воспалительной природы ССГ открыло новые возможности для терапевтических вмешательств. Лечение ССГ прошло долгий путь от слезозамещения до сложного алгоритма, базирующегося на тяжести и подтипе ССГ, наличии сопутствующих заболеваний. Основой терапии ССГ выступают противовоспалительные и иммуномодулирующие медикаменты. Топический циклоспорин является первым препаратом, продемонстрировавшим терапевтическую эффективность в лечении ССГ и имеющим данную патологию среди показаний к приему. При этом 0,1% катионная эмульсия циклоспорина характеризуется хорошей переносимостью и высокой результативностью как в клинических исследованиях, так и в реальной практике.
 Профессор A. Hommer (кафедра клинической фармакологии Венского медицинского университета, Австрия) сделал акцент на важности круглосуточного контроля ВГД в медикаментозном лечении глаукомы. Согласно определению, ПОУГ – это хроническая прогрессирующая нейропатия зрительного нерва с характерными морфологическими изменениями в его диске и слое нервных волокон сетчатки при отсутствии других глазных заболеваний или врожденных аномалий. С ПОУГ ассоциируются отмирание ганглионарных клеток сетчатки и потеря полей зрения. Таким образом, ПОУГ – не болезнь, которую можно окончательно излечить, а патологический процесс, который следует пожизненно контролировать. Важным фактором, модулирующим течение ПОУГ, является ВГД: чем выше этот показатель, тем больше риск возникновения/прогрессирования глаукомы. Впрочем, существуют формы глаукомы с нормальным ВГД.
Профессор A. Hommer (кафедра клинической фармакологии Венского медицинского университета, Австрия) сделал акцент на важности круглосуточного контроля ВГД в медикаментозном лечении глаукомы. Согласно определению, ПОУГ – это хроническая прогрессирующая нейропатия зрительного нерва с характерными морфологическими изменениями в его диске и слое нервных волокон сетчатки при отсутствии других глазных заболеваний или врожденных аномалий. С ПОУГ ассоциируются отмирание ганглионарных клеток сетчатки и потеря полей зрения. Таким образом, ПОУГ – не болезнь, которую можно окончательно излечить, а патологический процесс, который следует пожизненно контролировать. Важным фактором, модулирующим течение ПОУГ, является ВГД: чем выше этот показатель, тем больше риск возникновения/прогрессирования глаукомы. Впрочем, существуют формы глаукомы с нормальным ВГД.
Золотой стандарт измерения ВГД – аппланационная тонометрия по Гольдману. Физиологические суточные колебания ВГД лежат в границах 3-5 мм рт. ст.; максимальные показатели наблюдаются в утренний период. При глаукоме флуктуации ВГД превышают уровень нормы, достигая 20-40 мм рт. ст. Хотя глаукома чаще развивается у женщин, показатели ВГД не имеют гендерных различий. Перепады ВГД на протяжении рабочего дня меньше, чем перепады, фиксируемые за сутки. Для улучшения измерений ВГД применяются самомониторинг, временный длительный мониторинг и постоянный длительный мониторинг. Многих пациентов довольно сложно обучить самостоятельному измерению ВГД, и не все устройства могут применяться в клинических условиях.
Глаукома – лидирующая причина необратимой слепоты и вторая по частоте причина слепоты в целом. В 2013 г. распространенность этого состояния была на уровне 3,1%, прогнозируемая частота ПОУГ в 2020 г. составляет 18,3%, а к 2040 г. этот показатель достигнет 70,4%. Единственным подходом к лечению глаукомы, эффективным в сохранении зрительной функции, является снижение ВГД. При ранней и среднетяжелой глаукоме показатели следует снижать на 20-40%, при тяжелой – на 40-50%. Показано, что с каждым уменьшением ВГД на 1 мм рт. ст. риск прогрессирования глаукомы падает на 10%.
В настоящее время существует множество препаратов для терапии ПОУГ, наиболее мощными из которых являются АПГ, уменьшающие ВГД на 25-35%. Преимущества АПГ включают однократное применение, хорошую переносимость, лучший контроль флуктуаций ВГД. Вторыми по эффективности являются β-блокаторы, способные снижать ВГД на 20-25%.
В исследовании A. G. Konstas и соавт. (2017) сравнивались суточный контроль ВГД и состояние поверхности глаза на фоне приема тафлупроста в виде монотерапии и в сочетании с фиксированной комбинацией дорзоламид/тимолол у пациентов с ОУГ, недостаточно контролированной с помощью монотерапии препаратом латанопроста, содержащим консерванты. Тафлупрост достоверно более выраженно снижал ВГД, чем латанопрост, а тройная терапия (тафлупрост + дорзоламид/тимолол) оказывала еще лучшее действие. По сравнению с латанопростом тафлупрост обладал более высокой ночной активностью и характеризовался меньшим количеством побочных эффектов. Параметры поверхности глаза (время разрыва слезной пленки, морфология роговицы, рефлекторное слезоотделение) были лучшими у пациентов, принимавших не содержащий консервантов тафлупрост.
Сочетание АГП тафлупроста и β-блокатора тимолола (Таптиком, компания «Сантен») обеспечивает кумулятивную эффективность этих двух препаратов в контроле ВГД. Тафлупрост улучшает увеосклеральный отток, а тимолол угнетает выработку водянистой влаги реснитчатым эпителием. Тафлупрост в сочетании с тимололом применяется при отсутствии результата на фоне монотерапии или в случае необходимости мощного уменьшения ВГД. Несомненно, ФК обладают многими преимуществами над одновременным применением двух отдельных препаратов. Важно, что бесконсервантные формы топических офтальмологических средств характеризуются меньшим количеством всех побочных эффектов (боль или дискомфорт во время инстилляции, ощущение инородного тела, жжение, ощущение сухости, слезотечение, зуд век), чем содержащие консервант. Не имеющая в своем составе консервантов ФК тафлупроста (15 мкг/мл) и тимолола (5 мг/мл) (Таптиком, «Сантен») применяется всего один раз в день, что значительно повышает приверженность пациентов к лечению.
В исследованиях показано, что ФК характеризуется такой же эффективностью, как совместное применение двух препаратов, при более удобном режиме терапии. В частности, проведенное в Германии масштабное (n=1157) проспективное обсервационное исследование, оценивавшее эффективность, переносимость и безопасность ФК тафлупроста (0,0015%) и тимолола (0,5%) в реальной клинической практике, установило, что данная ФК снижала ВГД более выраженно, чем любая разновидность монотерапии или другие фиксированные либо нефиксированные комбинации (АПГ/β-блокатор, ингибитор карбоангидразы / β-блокатор и т. п.). Кроме того, ФК тафлупрост/тимолол уменьшала выраженность гиперемии конъюнктивы, зуда, боли, ощущения сухости и инородного тела в глазу.
Таким образом, глаукома как хроническое прогрессирующее заболевание требует пожизненного круглосуточного контроля. АПГ и β-блокаторы наиболее действенно снижают ВГД. У пациентов, не отвечающих на монотерапию, оптимальным решением является применение ФК, желательно не содержащей консервантов. Сочетание тафлупроста и тимолола в одном препарате (Таптиком, «Сантен») показало высокую эффективность и отличный профиль безопасности.
Выступление профессора А. Hommer вызвало активную дискуссию в зале. Одним из участников был задан вопрос, какой диапазон колебаний ВГД на протяжении дня следует считать приемлемым при глаукоме. Докладчик ответил, что для пациента с тяжелой ПОУГ даже незначительные флуктуации могут быть опасными. Хотя считается, что норма находится в границах 5-6 мм рт. ст., следует комплексно относиться к оценке ВГД и учитывать сопутствующие факторы риска. Отсутствие лечения может вызывать у пациента тревогу, в связи с чем иногда лучше принять решение о начале соответствующей терапии. Что касается оптимального времени измерения ВГД, то следует установить индивидуальные пики подъема давления и далее измерять его в эти временные промежутки, соответственно адаптируя лечение для оптимального контроля ВГД.
.jpg) Состоявшееся в ходе конференции заседание дискуссионного клуба «Закрытоугольная глаукома» запомнилось присутствующим обсуждением наиболее актуальных вопросов в данной сфере офтальмологической практики. Заведующий кафедрой офтальмологии Харьковского национального медицинского университета, доктор медицинских наук, профессор П. А. Бездетко в своем докладе ответил на вопрос, чем является первичная ЗУГ (ПЗУГ) – собственно глаукомой или офтальмогипертензией. По оценкам экспертов, в 2010 г. двусторонняя слепота отмечалась у 4,5 млн пациентов с ПОУГ и у 3,9 млн больных ПЗУГ. Демографические исследования показывают, что ПЗУГ сопровождается по крайней мере втрое большим риском серьезных двусторонних нарушений зрения, чем ОУГ. Распространенность ЗУГ варьирует между разными этническими и расовыми группами. Согласно статистическим данным, в США все формы ЗУГ составляют около 10% случаев глаукомы. Острые приступы глаукомы наиболее распространены в возрасте 55-65 лет. Факторами риска выступают женский пол, гиперопия, мелкая передняя камера, закрытие угла в парном глазу, принадлежность к инуитам или монголоидной расе.
Состоявшееся в ходе конференции заседание дискуссионного клуба «Закрытоугольная глаукома» запомнилось присутствующим обсуждением наиболее актуальных вопросов в данной сфере офтальмологической практики. Заведующий кафедрой офтальмологии Харьковского национального медицинского университета, доктор медицинских наук, профессор П. А. Бездетко в своем докладе ответил на вопрос, чем является первичная ЗУГ (ПЗУГ) – собственно глаукомой или офтальмогипертензией. По оценкам экспертов, в 2010 г. двусторонняя слепота отмечалась у 4,5 млн пациентов с ПОУГ и у 3,9 млн больных ПЗУГ. Демографические исследования показывают, что ПЗУГ сопровождается по крайней мере втрое большим риском серьезных двусторонних нарушений зрения, чем ОУГ. Распространенность ЗУГ варьирует между разными этническими и расовыми группами. Согласно статистическим данным, в США все формы ЗУГ составляют около 10% случаев глаукомы. Острые приступы глаукомы наиболее распространены в возрасте 55-65 лет. Факторами риска выступают женский пол, гиперопия, мелкая передняя камера, закрытие угла в парном глазу, принадлежность к инуитам или монголоидной расе.
ЗУГ представляет собой группу заболеваний, при которых происходит обратимое (аппозиционное) или адгезионное (синехиальное) закрытие угла передней камеры (УПК), то есть в основе ЗУГ лежит блокада УПК, возникающая в случае иридотрабекулярного контакта. Закрытие может проходить в острой или хронической форме. При острой форме ВГД быстро возрастает в результате относительно внезапной блокады трабекулярной сети радужной оболочкой вследствие зрачкового блока. Хроническая форма ЗУГ может развиваться после острой блокады УПК сохранившимися синехиями. ЗУГ также может развиваться с течением времени, когда угол закрывается от длительного или повторяющегося контакта между периферической радужкой и трабекулой, что часто приводит к периферическим передним синехиям и повреждению УПК.
Механизмы блокады УПК подразделяются на 4 типа, однако следует помнить, что независимо от типа каждая блокада приводит к формированию гониосинехий. Это переводит аппозиционный тип в синехиальный, что влечет за собой развитие хронической формы ЗУГ с полным глаукомным синдромом, включая нейропатию. Чаще всего после острой блокады УПК диск зрительного нерва становится плоским и белым вследствие ишемической нейропатии; при хронической же глаукоме развиваются более типичные изменения.
Европейское глаукомное общество подразделяет ПЗУГ на несколько видов: подозрение на первичную блокаду УПК; подозрение на острую блокаду УПК; подозрение на интермиттирующую блокаду УПК; хроническая ЗУГ; состояние после острой блокады УПК. При подозрении на первичную блокаду УПК особенности включают иридотрабекулярный контакт не менее 2 квадрантов, нормальное ВГД, отсутствие передних синехий, оптической нейропатии и глаукомного нарушения функций глаза. Для определения наличия синехий применяется проба Форбса, в том числе методом ультразвуковой биомикроскопии (УБМ). Врачебная тактика зависит от уровня блокады УПК и офтальмотонуса. Критерии блокады, при которой необходимо лечение, на данный момент не установлены, поэтому решение принимается на усмотрение офтальмолога.
Этиология острой блокады УПК – блокада трабекулы периферической радужкой без спонтанного разрешения. Особенности этого варианта ЗУГ – ВГД >21 мм рт. ст., часто 50-80 мм рт. ст.; снижение остроты зрения, отек роговицы, плоская периферия передней камеры, венозная гиперемия и цилиарная инъекция, отек головки зрительного нерва и др. Гониоскопическая картина в больном глазу отличается от таковой парного глаза.
Острый приступ глаукомы (ОПГ) – циклическое состояние, включающее такие фазы, как пусковая, фаза компрессии прикорневой зоны радужки, реактивная фаза, фаза странгуляции сосудов и воспаления, фаза обратного развития. В результате ОПГ в глазу остаются гониосинехии, наблюдаются сегментарная дистрофия радужки, смещение и деформация зрачка. Что касается лечения ОПГ, то возможны такие опции, как медикаментозная терапия, лазерная иридэктомия или иридопластика, экстракция хрусталика, трабекулэктомия, парацентез передней камеры, гониосинехиолизис. Медикаментозное лечение может проводиться перед инвазивным вмешательством с целью снижения ВГД и уменьшения выраженности симптомов раздражения. Для уменьшения продукции камерной влаги применяется ацетазоламид 10 мг/кг внутривенно или перорально, для дегидратации стекловидного тела – глицерин, маннитол. Чтобы открыть УПК, необходимо сузить зрачок, для чего используются пилокарпин или ацеклидин. Однако при ишемизированном сфинктере, если зрачок не реагирует на свет, местные аппликации парасимпатомиметиков неэффективны. Более того, они могут привести к спазму цилиарного тела и усилить блок УПК, поэтому сегодня мощные парасимпатомиметики с данной целью не применяются. Сужение зрачка возможно лишь после достаточного снижения ВГД. С помощью топических гипотензивных препаратов не всегда удается достичь деблокады УПК, но их применение в комплексном лечении необходимо. Подобные средства назначаются до нормализации ВГД, а затем отменяются. С данной целью используются β-блокаторы, бримонидин, дорзоламид, АПГ, хотя использование последних несколько ограничено при острой блокаде вследствие наличия в препаратах примеси провоспалительных простагландинов Е1 и Е2. Удачным выбором для лечения ОПГ являются ФК, например тимолол/пилокарпин (Фотил, Фотил Форте, «Сантен»), дорзоламид/тимолол (Косопт, «Сантен»). Последняя способна повышать ПГД и улучшать кровообращение в области головки зрительного нерва. Сочетание дорзоламида и тимолола понижает офтальмотонус в среднем на 33% от базового, а максимальное снижение достигает 45%. В соответствии с современными рекомендациями для уменьшения воспаления при ОПГ также назначаются местные кортикостероиды 3 раза с интервалом 5 мин, затем 4-6 р/сут в зависимости от длительности повышения ВГД и тяжести воспаления.
Интермиттирующая блокада УПК может варьировать в зависимости от степени иридотрабекулярного контакта и имитировать острую блокаду. Данная форма часто приводит к хронической ЗУГ. В качестве лечения рассматриваются миотики, иридотомия, иридопластика или экстракция хрусталика.
При наличии хронической ЗУГ изолированное медикаментозное лечение противопоказано, поскольку пациенты нуждаются в ослаблении зрачкового блока иридэктомией или экстракцией хрусталика. В дополнение может назначаться фармакотерапия: бримонидин, дорзоламид или их ФК.
 Выступление руководителя Львовского городского медицинского центра «Микрохирургия глаза», доктора медицинских наук, профессора И. Я. Новицкого касалось хирургических подходов к лечению ЗУГ. В отличие от патофизиологической классификации, представленной предыдущим докладчиком, клиническая классификация предусматривает подразделение ЗУГ на ОПГ, подострые приступы и хроническую ЗУГ. Целью хирургического лечения ЗУГ являются открытие УПК, предупреждение формирования гониосинехий или их устранение, компенсация ВГД.
Выступление руководителя Львовского городского медицинского центра «Микрохирургия глаза», доктора медицинских наук, профессора И. Я. Новицкого касалось хирургических подходов к лечению ЗУГ. В отличие от патофизиологической классификации, представленной предыдущим докладчиком, клиническая классификация предусматривает подразделение ЗУГ на ОПГ, подострые приступы и хроническую ЗУГ. Целью хирургического лечения ЗУГ являются открытие УПК, предупреждение формирования гониосинехий или их устранение, компенсация ВГД.
Со времени внедрения лазерной периферической иридотомии хирургическая иридэктомия проводится редко. Однако если прозрачность роговицы или толщина радужки не позволяют выполнить лазерное вмешательство, возникает потребность в хирургической операции.
Удаление хрусталика показано, если толстый хрусталик или его переднее положение выступают основным механизмом закрытия УПК. Данное вмешательство приводит к расширению УПК и предупреждению формирования гониосинехий, поэтому особенно актуально тогда, когда синехии еще не сформировались. Факоэмульсификация более оправданна в случае помутнения хрусталика, снижающего остроту зрения. При хронической ЗУГ рекомендуется проводить факоэмульсификацию катаракты в комбинации с синехиолизисом. Важно отметить, что факоэмульсификация сопровождается значительным снижением ВГД (по данным некоторых авторов, на 56-79%).
При ЗУГ также возможно проведение трабекулэктомии или имплантации дренажей. Обязательным элементом операции является периферическая иридэктомия, желательным – интраоперационное применение антиметаболитов (митомицин С, 5-фторурацил). Проблемой послеоперационного периода может быть мелкая передняя камера, что создает условия для формирования гониосинехий. Чтобы избежать этого, в переднюю камеру вводят вискоэластик. Трабекулэктомия проводится в случае ЗУГ с некомпенсированным ВГД; после ОПГ, особенно при наличии гониосинехий, часто в комбинации с факоэмульсификацией катаракты (более эффективный вариант, чем только трабекулэктомия).
Передняя закрытая витрэктомия проводится в случае злокачественной глаукомы, вызванной цилиохрусталиковым блоком. Важным элементом является разрушение передней гиалоидной мембраны, что позволяет жидкости из полостей стекловидного тела проникать в переднюю камеру глаза. В целом выбор хирургического метода лечения зависит от формы ЗУГ, стадии и тяжести процесса, уровня ВГД, сопутствующих заболеваний.
 Руководитель медицинского центра «Офтальмологическая клиника профессора Сергиенко», доктор медицинских наук, профессор А. Н. Сергиенко охарактеризовал преимущества циклофотокоагуляции (ЦФК) цилиарного тела в ведении пациентов с вторичной неоваскулярной глаукомой. Классические показания к ЦФК включают рефрактерную к медикаментозному лечению и хирургическим методам вторичную глаукому у взрослых и детей, а также глаза с остаточными функциями, то есть отсутствие успеха других методов лечения. Существует несколько разновидностей лазеров, применяемых для ЦФК (неконтактный, транссклеральный, диодный транссклеральный или эндоскопический, микропульс). Осложнения ЦФК включают боль, увеиты (у 20% больных), дисперсию пигмента, атопию зрачка, кровоизлияния в стекловидное тело, прогрессирование катаракты, некроз склеры, подвывихи хрусталиков, ухудшение зрительных функций (в 22% случаев), гипотонию, симпатическую офтальмию. Эти осложнения являются дозозависимыми, что обусловливает важность правильного подбора дозы.
Руководитель медицинского центра «Офтальмологическая клиника профессора Сергиенко», доктор медицинских наук, профессор А. Н. Сергиенко охарактеризовал преимущества циклофотокоагуляции (ЦФК) цилиарного тела в ведении пациентов с вторичной неоваскулярной глаукомой. Классические показания к ЦФК включают рефрактерную к медикаментозному лечению и хирургическим методам вторичную глаукому у взрослых и детей, а также глаза с остаточными функциями, то есть отсутствие успеха других методов лечения. Существует несколько разновидностей лазеров, применяемых для ЦФК (неконтактный, транссклеральный, диодный транссклеральный или эндоскопический, микропульс). Осложнения ЦФК включают боль, увеиты (у 20% больных), дисперсию пигмента, атопию зрачка, кровоизлияния в стекловидное тело, прогрессирование катаракты, некроз склеры, подвывихи хрусталиков, ухудшение зрительных функций (в 22% случаев), гипотонию, симпатическую офтальмию. Эти осложнения являются дозозависимыми, что обусловливает важность правильного подбора дозы.
Критерий эффективности ЦФК при вторичной глаукоме – достижение и удержание ВГД в пределах ≤21 мм рт. ст. на протяжении 6 мес. Согласно литературным данным, этого критерия удается достичь в 48-94,4% случаев, в среднем в 80%. Около 21% пациентов нуждаются в повторных процедурах. Показано, что транссклеральная ЦФК эффективнее, чем имплантация клапана Ахмеда. Что касается комбинированного лечения, то A. Fong и соавт. (2010) установили, что в случае сочетания ЦФК с бевацизумабом снижение ВГД несколько менее выражено, чем при проведении ЦФК без сопутствующей фармакотерапии, однако количество осложнений при этом в 2,7 раза меньше.
На данный момент наблюдается расширение показаний к ЦФК. В 2015 г. FDA одобрило микропульс-ЦФК для лечения глаукомы у пациентов с разными степенями и типами заболевания. Известно, что 60% британских офтальмологов, выполняющих ЦФК, проводят ее при любой остроте зрения, а 22% – комбинируют с хирургией катаракты.
Авторское исследование включало 28 проведенных ЦФК (из них 6 – повторно). Предоперационное ВГД составляло 40-60 мм рт. ст. В результате вмешательства болевой синдром был снят у 20 пациентов, ВГД снизилось в 22 случаях. Гипотония с увеитом наблюдались у 1 пациента; еще у 1 больного боль сохранялась. По мнению докладчика, за неделю до транссклеральной ЦФК необходимо проводить анти-VEGF терапию; избегать проведения процедуры у пациентов с выраженной декомпенсацией роговицы; индивидуально подбирать дозу энергии коагуляции; еженедельно контролировать состояние прооперированных пациентов и проводить противовоспалительную терапию на протяжении первого месяца после вмешательства.
 Заведующая кафедрой глазных болезней ГУ «Запорожская медицинская академия последипломного образования МЗ Украины», доктор медицинских наук, профессор Н. С. Луценко ознакомила аудиторию с ролью ОКТ переднего отрезка (ОКТПО) в диагностике и мониторинге разных видов глаукомы. Для подбора оптимального лечения необходимо понимание морфологии УПК и причин развития ЗУГ, что подчеркивает роль точной диагностики. Основными методами исследования УПК выступают гониоскопия, УБМ и ОКТ (с использованием сменных насадок для диагностики изменений переднего отрезка). Широко распространенная гониоскопия доступна и малозатратна, вместе с тем она имеет ряд недостатков. Это контактный субъективный метод, не позволяющий задокументировать полученные результаты. УБМ дает возможность получить количественно оцениваемые поперечные изображения с высокой разделительной способностью. К ограничениям метода относятся инвазивность, значительные временные и финансовые затраты, а также необходимость высокой квалификации специалиста.
Заведующая кафедрой глазных болезней ГУ «Запорожская медицинская академия последипломного образования МЗ Украины», доктор медицинских наук, профессор Н. С. Луценко ознакомила аудиторию с ролью ОКТ переднего отрезка (ОКТПО) в диагностике и мониторинге разных видов глаукомы. Для подбора оптимального лечения необходимо понимание морфологии УПК и причин развития ЗУГ, что подчеркивает роль точной диагностики. Основными методами исследования УПК выступают гониоскопия, УБМ и ОКТ (с использованием сменных насадок для диагностики изменений переднего отрезка). Широко распространенная гониоскопия доступна и малозатратна, вместе с тем она имеет ряд недостатков. Это контактный субъективный метод, не позволяющий задокументировать полученные результаты. УБМ дает возможность получить количественно оцениваемые поперечные изображения с высокой разделительной способностью. К ограничениям метода относятся инвазивность, значительные временные и финансовые затраты, а также необходимость высокой квалификации специалиста.
ОКТ впервые была описана в 1991 г., ОКТПО – в 1994 г. В 2006 г. ОКТПО была одобрена FDA как основной диагностический метод для этой области. ОКТПО обеспечивает следующие возможности: для роговицы – измерение толщины стромы (для перерасчета истинного ВГД), оценку толщины эпителия; для передней камеры – определение истинной глубины и внутреннего диаметра; для УПК – определение формы, ширины, степени закрытия; для радужки – установление толщины и однородности ткани, анатомического положения относительно цилиарного тела; для хрусталика – оценку толщины, формы, степени прозрачности, положения; для установленных в ходе лечения фильтрационной подушки и имплантов – контроль функциональной состоятельности.
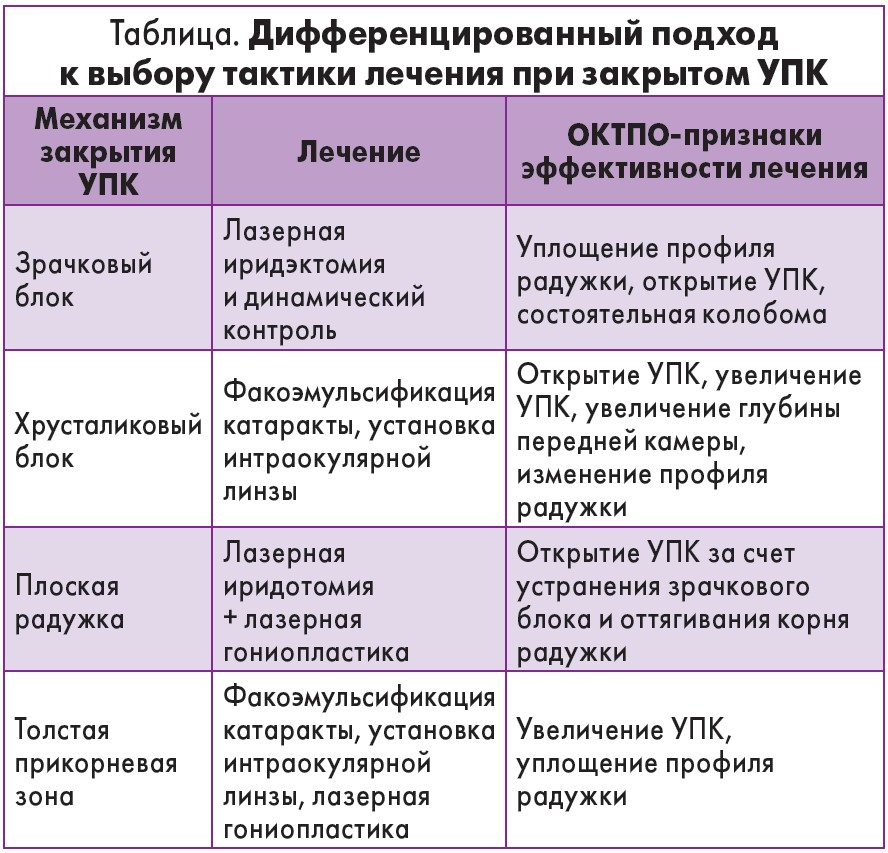
В авторском исследовании была проведена ОКТПО у 64 пациентов с разными видами глаукомы. ЗУГ была выявлена у 21 больного, из них у 19 – зрачковый блок (у 16 – относительный зрачковый блок, у 3 – увеличенный свод радужки), у одного участника имела место плоская радужка, еще у одного – толстый корень радужки. Полученные в исследовании данные дают возможность оптимизировать врачебную тактику (табл.).
Таким образом, ОКТПО является высокоинформативным бесконтактным методом визуализации УПК, позволяющим определить анатомо-морфологические особенности этой области, уточнить механизмы развития ЗУГ, провести дифференцированный выбор метода лечения. Важно, что ОКТПО позволяет проводить мониторинг в раннем послеоперационном периоде для оценки эффективности всех видов лечения (лазерного, хирургического, медикаментозного).
В целом оргкомитет Всеукраинской научно-практической конференции сделал все, чтобы мероприятие запомнилось не только содержательной научной программой, но и особой атмосферой заинтересованного общения, что также способствовало профессиональному росту участников.
Подготовила Лариса Стрильчук
Медична газета «Здоров’я України 21 сторіччя» № 18 (439), вересень 2018 р.