6 січня, 2019
Применение микафунгина в гематологии
Инвазивные грибковые инфекции (ИГИ) повышают заболеваемость, смертность, длительность госпитализации и связанные с ней затраты у онкогематологических больных с тяжелым иммунодефицитом. У этих пациентов имеется большое количество взаимосвязанных факторов риска развития ИГИ, таких как нарушенные анатомические барьеры, супрессия иммунного ответа, индуцированная химиотерапией нейтропения, почечная или печеночная недостаточность, гипергликемия и реакция трансплантата против хозяина, а также лечение антибиотиками широкого спектра действия или кортикостероидами, установка центральных венозных катетеров.
Сегодня доступно несколько классов противогрибковых препаратов: полиены, триазолы и самые новые – эхинокандины. У всех этих препаратов особый механизм действия. Они активны против Candida spp., Aspergillus spp. и Pneumocystis jirovecii (только против цист, но не против трофозоитов) и показали отличную эффективность в лечении и профилактике ИГИ в хорошо организованных проспективных исследованиях.
In vitro и в доклинических исследованиях in vivo (в экспериментах на мышах) показана активность против Candida и Aspergillus spp. препарата из класса эхинокандинов микафунгина. Цель настоящего обзора – обобщить накопленные клинические данные об эффективности микафунгина для профилактики и лечения подтвержденных или предполагаемых ИГИ у пациентов с гематологическими злокачественными новообразованиями.
Фармакокинетика и безопасность микафунгина у пациентов с гемобластозами
Результаты крупных клинических исследований свидетельствуют о благоприятном профиле безопасности и фармакокинетики микафунгина у пациентов с гемобластозами. В проведенном Yamada и соавт. исследовании с участием 7 гематологических больных с ИГИ было продемонстрировано хорошее распределение микафунгина в тканевой жидкости при введении препарата 1 раз в сутки в виде одночасовой в/в инфузии. В недавно выполненном обзоре оценивали безопасность применения микафунгина у 296 детей (младше 16 лет), участвовавших в разных исследованиях. У 40% из них имелись гемобластозы, трансплантация костного мозга (ТКМ) и/или нейтропения. Исследователи заключили, что микафунгин хорошо переносится детьми всех возрастов, в том числе больными гемобластозами, так как нежелательные явления, повлекшие за собой отмену препарата, возникли только у 7 (2,4%) пациентов. Примечательно, что оценка фармакокинетики микафунгина у 6 пациентов, у которых проведена аллогенная ТКМ, показала отсутствие лекарственных взаимодействий с такролимусом, несмотря на то что оба препарата являются субстратами цитохрома P450 3A4.
Микафунгин для профилактики ИГИ у пациентов с гемобластозами из групп высокого риска
Учитывая значительную смертность при ИГИ у пациентов с гемобластозами и отсутствие чувствительных диагностических тестов, практически универсальной стратегией снижения риска развития ИГИ служит профилактическое назначение специальных средств всем пациентам группы высокого риска (перенесшим ТКМ или индукционную химиотерапию).
Длительная профилактика новейшими пероральными триазолами (позаконазолом и вориконазолом) – самая привлекательная стратегия в связи с удобством приема и широким спектром активности этих препаратов. Однако некоторым пациентам пероральный прием лекарственных средств не подходит из-за мукозита, лекарственных взаимодействий или нарушения функции печени. Этим пациентам целесообразно вводить лекарственные препараты парентерально. Это особенно важно у госпитализированных больных после индукционной химиотерапии по поводу острого лейкоза или при подготовке к ТКМ. В связи с потенциальной нефротоксичностью полиенов удачным решением может быть парентеральное профилактическое введение эхинокандинов.
Большинство данных о профилактическом применении эхинокандинов у гематологических больных из группы риска получены в исследованиях микафунгина (табл. 1). В большом проспективном двойном слепом многоцентровом исследовании сравнивали эффективность микафунгина в дозе 50 мг/сут и флуконазола 400 мг/сут у 882 взрослых и детей с нейтропенией на фоне гемобластоза, подвергшихся ауто- или аллогенной ТКМ. Профилактику грибковой инфекции продолжали до 5 дней после приживления трансплантата, 42 суток после ТКМ либо развития подтвержденной, вероятной или предполагаемой ИГИ, неприемлемой токсичности препарата, смерти или выбывания из исследования. Лечение считали успешным при отсутствии подтвержденной, вероятной или предполагаемой ИГИ в период профилактики и еще в течение 4 недель последующего наблюдения. У пациентов из группы микафунгина общая частота успеха (80%) была существенно выше, чем в группе флуконазола (73,5%). Эмпирическая противогрибковая терапия в группе микафунгина требовалась значительно меньшему количеству пациентов (64 из 425, 15%), чем в группе флуконазола (98 из 457, 21%). Оба препарата эффективно предотвращали развитие инвазивного кандидоза, но в группе микафунгина было меньше случаев инвазивного аспергиллеза. В группе микафунгина зарегистрирован один случай вероятного аспергиллеза, а в группе флуконазола – 7 (4 подтвержденных и 3 вероятных) случаев (р=0,071). За время профилактического введения микафунгина возникло по одному случаю инфекций, вызванных Candida albicans, Candida parapsilosis и Candida lusitaniae, один случай фузариоза и один случай зигомикоза. Хотя смертность в группе микафунгина снизилась (5,7 против 4,2%), статистически значимого снижения общей смертности и смертности, связанной с ИГИ, не наблюдалось. Однако исследование имело несколько ограничений: оно включало пациентов как после аутогенной, так и аллогенной ТКМ, у которых риск развития ИГИ разный; кроме того, участников обследовали только в нейтропенической фазе.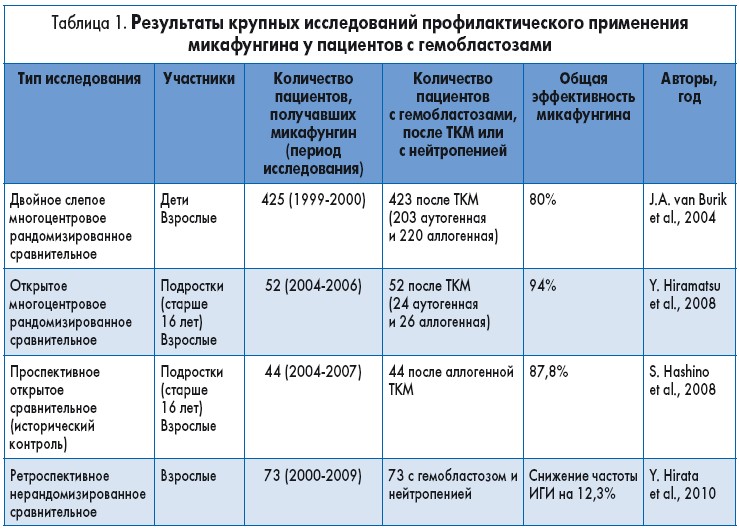
В проспективном клиническом исследовании принимали участие 106 взрослых пациентов с гемобластозами, подвергшихся ТКМ. Участники были рандомизированы на группы с целью профилактического применения микафунгина (150 мг) или флуконазола (400 мг). У 48% пациентов проведена аутогенная ТКМ, связанная с низким риском развития ИГИ. Общая эффективность микафунгина была примерно такой же, как флуконазола (94 против 88%). У 1 пациента на фоне профилактического введения микафунгина развился трихоспороноз.
В другом небольшом проспективном несравнительном исследовании профилактический курс микафунгина (100‑150 мг) получали 44 пациента с гемобластозами, подвергшиеся аллогенной ТКМ. Данные 29 пациентов, получавших в целях профилактики флуконазол после аллогенной ТКМ, использованы в качестве исторического контроля. Эффективность микафунгина составила 87,8% по сравнению с 65,5% у флуконазола.
В ретроспективном исследовании с участием больных гемобластозами и нейтропенией сравнивали результаты у пациентов, которым не проводили системную профилактику грибковых инфекций, и пациентов, получавших микафунгин в дозе 150 мг/сут. Профилактическое введение микафунгина способствовало существенному снижению частоты развития ИГИ с 12,3 до 1,5% (p=0,001). Примечательно, что у 15 подвергшихся ТКМ детей с гематологическими, метаболическими и иммунными нарушениями микафунгин в дозе 3 мг/кг в/в в течение 1 ч 1 раз в 2 суток хорошо переносился и имел сходную фармакокинетику со стандартным режимом дозирования.
В корейском исследовании проанализирована экономическая эффективность микафунгина и флуконазола для профилактики ИГИ у пациентов после ТКМ. Анализ показал, что применение микафунгина коррелирует с меньшими затратами на лечение, меньшей заболеваемостью ИГИ и увеличением выживаемости на 4,8 года на 100 пациентов. В японском исследовании, в котором сравнивали эффективность итраконазола, флуконазола, амфотерицина B и микафунгина для профилактики грибковых инфекций у пациентов с гемобластозами и нейтропенией, все препараты показали сходную эффективность, хотя итраконазол был дешевле.
ИГИ могут быть серьезной проблемой у пациентов, получающих микафунгин в профилактических целях. Развитие таких случаев кандидоза описано у 12 реципиентов внутренних органов с тяжелой иммуносупрессией, которым проводили активную профилактику микафунгином. Большинство случаев ИГИ были вызваны Candida glabrata с мутацией FKS или C. parapsilosis дикого типа с повышенной минимальной подавляющей концентрацией микафунгина.
Что касается применения микафунгина для вторичной профилактики, данные клинических сообщений указывают на то, что хирургическое удаление аспергилломы легкого до трансплантации и профилактика микафунгином после трансплантации позволяют предотвратить рецидив инфекции.
В целом данные о профилактическом применении микафунгина в нейтропенической фазе ТКМ хотя и обнадеживают, но малочисленны. Однако следует подчеркнуть, что опыта применения микафунгина в период после трансплантации, в котором высок риск развития реакции трансплантата против хозяина, нет. Кроме того, профилактическое применение микафунгина у амбулаторных пациентов не удобно, так как требуется ежедневное в/в введение. Однако доклинические исследования у мышей с нейтропенией, инфицированных C. glabrata и Aspergillus fumigatus, показали, что менее частое введение эхинокандинов может быть столь же эффективным, поэтому у амбулаторных пациентов приемлемой стратегией может быть введение препарата через день.
На конференции по инфекционным болезням, проведенной Германским обществом по гематологии и онкологии, и Европейской конференции по инфекциям у больных лейкозом рекомендации по профилактическому применению микафунгина при нейтропении присвоен уровень CI. В рекомендациях Американского общества по инфекционным болезням (IDSA) 2009 г. такое назначение не было поддержано.
Эмпирическое лечение микафунгином онкогематологических больных с лихорадкой и нейтропенией
Задержка начала лечения в связи с ожиданием результата посева крови оказывает существенное влияние на смертность при ИГИ. Следовательно, из-за несовершенства методов диагностики грибковых инфекций у пациентов из группы высокого риска, к которым относятся онкогематологические больные с лихорадкой, не поддающейся терапии антибиотиками широкого спектра действия, не имеющие других причин лихорадки (например, инфекции, вызванной устойчивыми бактериями, цитомегаловирусом, паранеопластических синдромов или лекарственной лихорадки), целесообразно назначение эмпирической противогрибковой терапии.
Данные по эффективности и безопасности микафунгина в качестве эмпирической терапии у онкогематологических больных с фебрильной нейтропенией ограничены и представлены результатами небольших одноцентровых исследований, в которых микафунгин применяли в разных дозах и в разные моменты времени (табл. 2).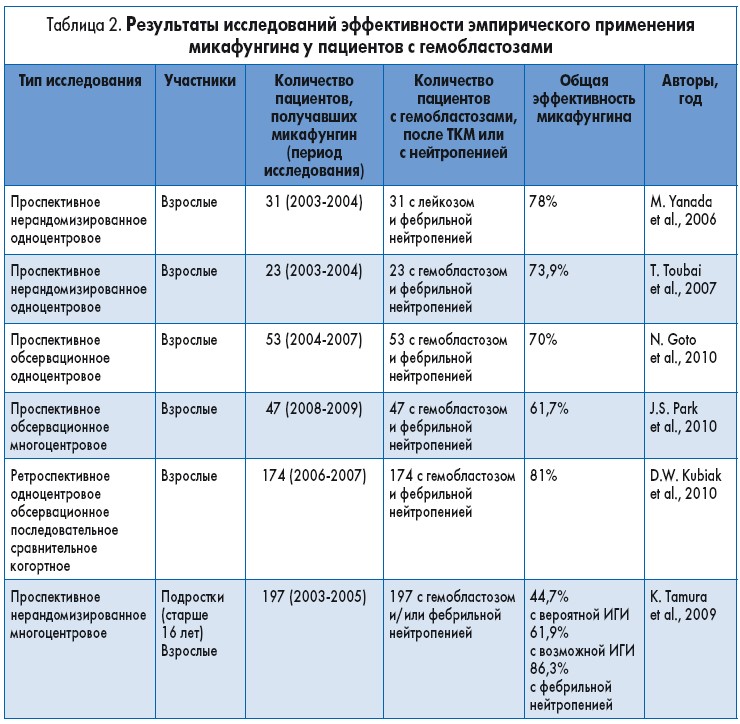
В первом проспективном нерандомизированном одноцентровом исследовании в Японии в 2005 г. участвовал 31 взрослый пациент с острым лейкозом, нейтропенией и лихорадкой, не поддающейся лечению антибиотиками. Микафунгин назначали эмпирически в дозе 50-150 мг/сут в виде одночасовой в/в инфузии в течение (медиана) 9,5 суток. Лечение было успешным у 14 (78%) пациентов. Неблагоприятный исход наблюдался у 4 пациентов. В другом проспективном нерандомизированном исследовании в Японии принимали участие 16 мужчин и 7 женщин с онкогематологическими заболеваниями и фебрильной нейтропенией, не поддающейся лечению антибиотиками широкого спектра действия. Участникам была назначена эмпирическая монотерапия микафунгином в дозе 50 или 300 мг/сут. Лечение было успешным в 73,9% (17 из 23) случаев. Грибковых инфекций на фоне лечения не возникло ни у одного пациента, случаев отмены лечения из-за неэффективности, а также летальных исходов за исследуемый период также не было. Микафунгин в дозе >100 мг был более эффективен, чем в дозе <100 мг, нежелательные явления (в основном нарушения функции печени) наблюдались в 27,7% случаев. Примечательно, что микафунгин был эффективен и у пациентов, у которых ранее проводилось лечение другими противогрибковыми препаратами.
Результаты двух недавних проспективных исследований подтвердили, что микафунгин – безопасное и эффективное средство эмпирической терапии фебрильной нейтропении у онкогематологических больных. Так, у 70% из 53 и 61,7% из 47 участников этих исследований достигнут благоприятный исход при применении микафунгина в дозе 150 и 100 мг/сут соответственно.
Безопасность и эффективность каспофунгина и микафунгина в качестве эмпирической противогрибковой терапии при фебрильной нейтропении оценивали также в одноцентровом ретроспективном обсервационном когортном исследовании. В нем принимали участие 323 пациента (группа каспофунгина n=149; группа микафунгина n=174). Благоприятный результат наблюдался у 141 (81%) пациента в группе микафунгина и у 122 (81,9%) пациентов в группе каспофунгина. Грибковые инфекции были диагностированы у 16 (10,7%) пациентов в группе каспофунгина и 21 (12,1%) пациента в группе микафунгина (p=NS). Нежелательные явления, требовавшие отмены эхинокандинов, наблюдались редко. Исследователи сделали вывод, что микафунгин в качестве эмпирической противогрибковой терапии при фебрильной нейтропении имеет сходный с каспофунгином профиль эффективности и безопасности.
В Японии проведено проспективное многоцентровое исследование эффективности и безопасности микафунгина в качестве эмпирической терапии у онкологических больных с предполагаемыми ИГИ. В исследование были включены 277 пациентов, данные для анализа получены у 197 из них. Лечение было эффективным у 44,7% (17 из 38) пациентов с вероятной ИГИ, у 61,9% (39 из 63) с возможной ИГИ и у 80,7% (71 из 88) у пациентов без ответа на лечение антибактериальными препаратами. В подгруппе пациентов с персистирующей фебрильной нейтропенией ответ на введение микафунгина получен у 86,3% (44 из 51) больных.
В целом несмотря на то, что эмпирическое применение микафунгина у пациентов с нейтропенией и персистирующей или рецидивирующей лихорадкой имеет степень обоснованности BII и широко распространено в ряде стран, например в Японии, у онкогематологических больных с фебрильной нейтропенией такая терапия пока не имеет достаточных клинических подтверждений.
Микафунгин в лечении подтвержденных ИГИ у онкогематологических больных
Инвазивный кандидоз
Инвазивный кандидоз (ИК) обусловливает повышение заболеваемости и смертности, увеличение длительности госпитализации и связанных с ней расходов. В рандомизированные клинические исследования кандидемии обычно не включают пациентов с нейтропенией и онкогематологических больных с тяжелым иммунодефицитом. Кроме того, по данным крупных эпидемиологических исследований кандидемии в США, нейтропения имеется лишь примерно у 10% пациентов с кандидемией. В связи с этим проведение проспективных рандомизированных исследований, посвященных лечению кандидемии только у пациентов с нейтропенией, признано неосуществимым.
In vitro микафунгин проявляет активность против C. albicans и других видов Candida, рост 100% штаммов подавляется при концентрации препарата менее 2 мг/л. Эффективность микафунгина в лечении ИК оценивалась в нескольких крупных клинических исследованиях (табл. 3). Ostrosky-Zeichner и соавт. провели многоцентровое проспективное исследование с участием 126 пациентов разного возраста, включая новорожденных, с впервые установленным диагнозом рефрактерной кандидемии. Начальная доза микафунгина составляла 50 мг/сут при инфекции, вызванной C. albicans, и 100 мг/сут при инфекциях, обусловленных другими видами Candida. Допускалось повышение дозы до 200 мг/сут. Длительность лечения составляла от 5 дней до 6 недель. Полный или частичный ответ наблюдался у 83,3% пациентов, полный ответ – у 75,4%. Серьезные нежелательные явления зафиксированы редко. Однако большинство пациентов получали сопутствующее лечение другими противогрибковыми препаратами, что затрудняет оценку эффективности микафунгина. Экстраполяция этих результатов на онкогематологических больных затруднена, так как исследуемая когорта была неоднородной, и исходная нейтропения наблюдалась лишь у 23% участников.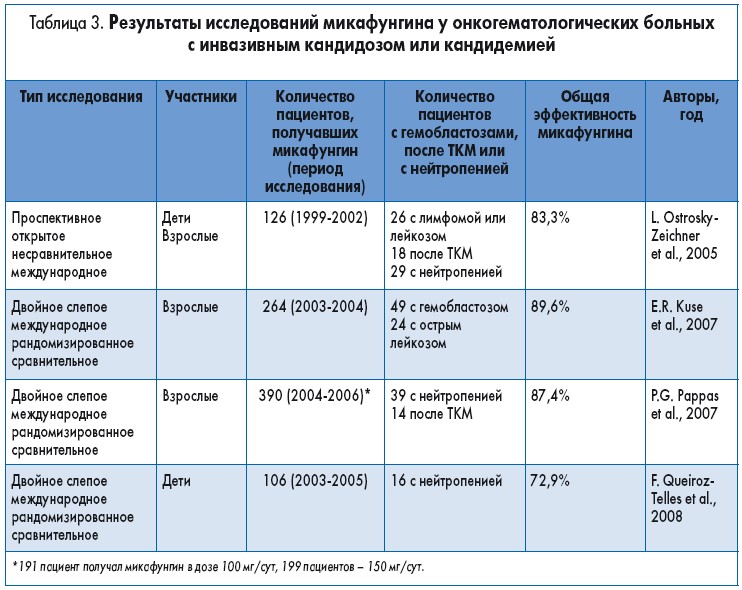
В следующем двойном слепом исследовании сравнивали эффективность применения микафунгина (100 мг/сут в/в) и липосомального амфотерицина B (Л-АМB; 3 мг/кг массы тела в сутки) в течение 2-4 недель у пациентов с кандидемией, преимущественно без нейтропении. Лечение микафунгином способствовало достижению клинического и микологического ответа у 89,6% (181 из 202) пациентов, Л-AMB – у 89,5% (170 из 190). У 49 из 264 пациентов в группе микафунгина были гематологические нарушения и у 24 (9%) – острый лейкоз.
Pappas и соавт. первыми сравнили два препарата из группы эхинокандинов. В этом двойном слепом сравнительном исследовании 595 пациентов были рандомизированы (1:1:1) на группы с целью применения микафунгина в дозе 100 или 150 мг/сут и каспофунгина (насыщающая доза 70 мг, затем 50 мг/сут). Лечение было успешным у 76,4% пациентов, получавших 100 мг микафунгина, у 71,4% пациентов, получавших 150 мг микафунгина, и 72,3% получавших каспофунгин. Не наблюдалось существенных различий в сравниваемых группах по уровню смертности, рецидивов, развития новых инфекций и нежелательных явлений. Из 390 пациентов, включенных в две группы микафунгина, нейтропения исходно зафиксирована у 39 (10%), у 14 больных проведена ТКМ.
В другом исследовании сравнивали эффективность введения микафунгина (2 мг/кг в сутки) и Л-AMB (3 мг/кг в сутки) для лечения детей до 16 лет с ИК. Общая частота клинического и микологического успеха у принимавших оба препарата была сходной: у 35 из 48 (72,9%) пациентов, получавших микафунгин, и 38 из 50 (76%) пациентов, получавших Л-АМВ. У 6 (12,5%) из 48 пациентов, включенных в группу микафунгина, была нейтропения.
Анализ данных двух клинических исследований, в которых сравнивали эффективность микафунгина и Л-АМВ или каспофунгина при ИК, показал, что у пациентов с персистирующей нейтропенией выживаемость и частота ответа на лечение были ниже. Это свидетельствует об ограниченной применимости данных клинических исследований, посвященных использованию микафунгина, к онкогематологическим больным, поскольку нейтропения исходно наблюдалась лишь у небольшого числа участников этих исследований (табл. 3). Поэтому делать выводы об эффективности микафунгина у онкогематологических больных затруднительно. В действительности внедрение новых противогрибковых препаратов в клиническую практику не снизило заболеваемость ИК и частоту кандидемии у онкогематологических больных группы риска, как и не снизило частоту кандидоза, вызванного Candida не‑albicans.
Инвазивный аспергиллез
In vitro микафунгин проявляет фунгистатическую активность против Aspergillus spp. Однако его эффективность в лечении инвазивного аспергиллеза (ИА) в рандомизированных контролируемых исследованиях не оценивалась. Большинство имеющихся данных получены в открытых исследованиях, в которых микафунгин применялся в качестве терапии спасения при рефрактерном аспергиллезе (табл. 4). Японские ученые в проспективном открытом многоцентровом исследовании оценивали эффективность микафунгина у взрослых пациентов с глубокими микозами, в частности легочным аспергиллезом. Пациенты получали микафунгин в дозе 25-150 мг/сут в/в в течение 13-56 дней. Согласно анализу эффективности, включавшему данные 41 пациента, получившего не менее 7 доз микафунгина, общая частота ответа составила 60% (6 из 10) при легочном аспергиллезе, 67% (6 из 9) – при хроническом некротизирующем легочном аспергиллезе и 55% (12 из 22) – при легочной аспергиллеме.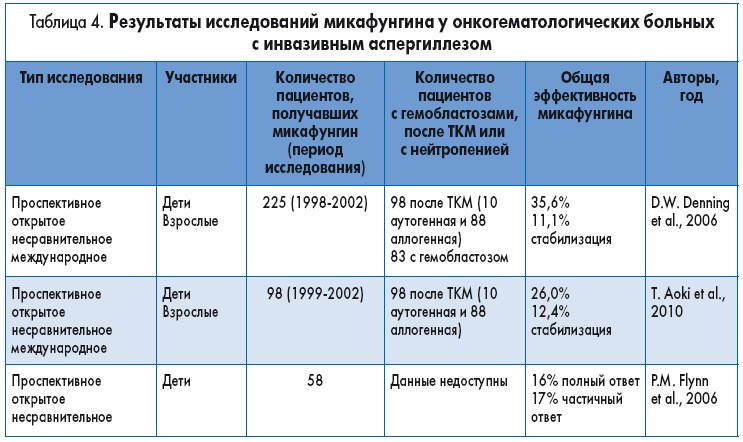
Эффективность микафунгина против ИА в качестве монотерапии и в комбинации с другими противогрибковыми препаратами также оценивалась в проспективном открытом международном несравнительном исследовании с участием 225 детей и взрослых. Большинство пациентов подверглись ТКМ и химиотерапии по поводу онкогематологического заболевания и имели нейтропению. Микафунгин был назначен в качестве первичной терапии у 29 (13%) пациентов, а в качестве терапии спасения – у 192 (85%) пациентов с неэффективностью или непереносимостью других противогрибковых средств. У 191 пациента проводилась комбинированная терапия (микафунгин добавлен к ранее назначенному препарату). Ответ на лечение достигнут у 80 (36%) пациентов, еще у 25 (11%) пациентов предотвращено прогрессирование инфекции. Ответ на лечение получен у 45% пациентов в группе монотерапии и у 35% в группе комбинированной терапии. Среди пациентов, получавших микафунгин и амфотерицин В, ответ получен у 37,2%. Среди принимавших микафунгин в виде монотерапии ответ достигнут у 50% (6 из 12) пациентов, получавших первичное лечение, и у 41% (9 из 22) получавших терапию спасения. Частота успеха в группе комбинированной терапии составила 29% (5 из 17) у получавших первичное лечение и 35% (60 из 174) у получавших терапию спасения. Нормализация количества нейтрофилов коррелировала с достижением ответа на терапию. Достаточно высокая частота ответа (49,4%) также наблюдалась у получавших химиотерапию больных с лейкозом или солидными опухолями. Нежелательные явления зафиксированы у 31,9% пациентов и привели к отмене лечения у 26,1% пациентов. Результаты этого исследования показали, что микафунгин, особенно в комбинации с амфотерицином В, эффективен в лечении острого ИА у взрослых и детей с онкогематологическими заболеваниями или нейтропенией, у которых предыдущее лечение было неэффективным или характеризовалось непереносимостью. О комбинации микафунгина с другими противогрибковыми препаратами (помимо Л-AMB) известно меньше. Недавно сообщалось о двух пациентах с острым лейкозом и ИА, у которых было эффективным лечение микафунгином в сочетании с вориконазолом.
Применение микафунгина в виде монотерапии или в комбинации с другими противогрибковыми препаратами также прицельно изучалось у 98 реципиентов костного мозга с ИА (у 81 выявлен легочный ИА). Общая частота ответа была низкой, всего 26%, поскольку в большинстве случаев микафунгин назначали в качестве терапии спасения при отсутствии ответа на длительное лечение другим препаратом, преимущественно Л-AMB. Еще у 12 пациентов удалось стабилизировать течение заболевания. Частота ответа составила 38% (3 из 8) в группе монотерапии и 24% (22 из 90) в группе комбинированной терапии. Ответ наблюдался у 22% (2 из 9) пациентов с ИА de novo, у 24% (21 из 87) пациентов с неэффективностью предыдущего лечения и у 100% (2 из 2) – с отменой предыдущего лечения из-за токсичности. Меньшая частота ответа у этой подгруппы ТКМ связана, по-видимому, с высокой частотой развития реакции трансплантата против хозяина, длительной нейтропенией и более упорным течением инфекции.
Изучали также эффективность применения микафунгина у детей до 16 лет (средний возраст 9 лет) с подтвержденным или предполагаемым ИА. В несравнительном исследовании 58 пациентов (4 с первичным диагнозом, 54 с неэффективностью предыдущего лечения) получали микафунгин в дозе 1,5 мг/кг в сутки; у 30 пациентов доза была повышена, средняя доза составила 2,0±1,2 мг/кг в сутки. Только 2 пациента получали монотерапию микафунгином, остальные – сопутствующее лечение другими противогрибковыми препаратами, в основном Л-AMB. Ответ на лечение (частичный или полный) наблюдался у 26 (45%) из 58 пациентов: у 9 (16%) – полный и у 17 (29%) – частичный.
В нескольких сообщениях описано успешное применение микафунгина у гематологических больных с тяжелым иммунодефицитом и рефрактерным аспергиллезом. Препарат также был эффективным в качестве терапии спасения у пациентов с ИА, устойчивым к Л-AMB, однако эти данные следует трактовать с осторожностью из-за систематической ошибки, связанной с публикацией. Не удивительно, что у двоих детей с гемобластозами и аспергиллезом ЦНС лечение микафунгином и другими противогрибковыми препаратами оказалось безуспешным.
Подводя итог, отметим, что данные в основном получены в неконтролируемых исследованиях у пациентов с рефрактерным аспергиллезом, у которых микафунгин применяли в качестве препарата спасения в комбинации с другими противогрибковыми средствами. Данных об эффективности микафунгина в качестве монотерапии для первичного лечения ИА недостаточно. Эффективность микафунгина в сравнении с каспофунгином не известна.
Мукороз и другие редкие микозы
Эпидемиология ИГИ у больных лейкозом продолжает изменяться, при этом возрастает заболеваемость редкими микозами, в частности вызываемыми Mucorales spp., Fusarium spp., эндемическими грибами и условно-патогенными дрожжевыми грибами не из рода Candida, такими как Trichosporon spp. In vitro микафунгин активен только против мицелиевых форм диморфных грибов, таких как Histoplasma capsulatum, Blastomyces dermatitidis, Coccidioides immitis, Paracoccidioides brasiliensis, Penicillium marneffei и Sporothrix schenckii, а в отношении дрожжеподобных форм его активность является более низкой. Как и остальные препараты группы эхинокандинов, клинически он не активен против Trichosporon и Cryptococcus spp.
Кроме того, отсутствуют данные об активности микафунгина in vitro против других клинически значимых условно-патогенных плесневых грибов, не относящихся к Aspergillus spp., таких как Fusarium и Zygomycetes spp. Поэтому не удивительно, что вызванные ими инфекции наблюдались у онкогематологических пациентов, получавших микафунгин с профилактической или лечебной целью. Matsue и соавт. сообщили о 4 случаях диссеминированного трихоспороноза у онкогематологических больных, получавших микафунгин. Только у одного пациента выявлен ответ на лечение вориконазолом с последующей нормализацией количества нейтрофилов. Из 33 пациентов с гемобластозами в 5 клиниках Японии с 1992 по 2007 г. трихоспороноз развился на фоне противогрибковой терапии у 30 (91%), 18 из которых получали микафунгин. Сообщалось также о развитии инфекций, вызванных зигомицетами, Fusarium spp./Blastoschizomyces capitatus и Rhodotorula mucilaginosa, на фоне лечения микафунгином у онкогематологических пациентов после аллогенной ТКМ. При этом комбинация микафунгина и флуконазола была эффективной при диссеминированном бластомикозе. У 58-летнего пациента с подкожной инфекцией, вызванной Alternaria alternate, на фоне фебрильной нейтропении и рефрактерного хронического лимфолейкоза комбинированная терапия микафунгином и вориконазолом оказалась неэффективной.
Летальный исход наступил у 8 онкогематологических больных с подтвержденным мукорозом, несмотря на лечение микафунгином, амфотерицином B или вориконазолом. Однако Jacobs соавт. сообщали об излечении гистологически подтвержденного мукороза, развившегося через два года после аутогенной ТКМ у пациента с лейкозом. У этого больного инфекция локализовалась в верхнечелюстной пазухе и была резистентна к лечению Л-AMB, однако после добавления микафунгина удалось добиться излечения инфекции.
Следует отметить, что помимо ингибиторного и фунгицидного эффекта in vitro препараты группы эхинокандинов оказывают иммуномодулирующее действие при всех плесневых инфекциях, кроме Scedosporium prolificans. Эхинокандины увеличивают содержание бета-глюкана в клеточной стенке и усиливают повреждение гиф, индуцированное нейтрофилами. Микафунгин, как и другие изучавшиеся препараты этой группы, также оказывал аддитивный эффект с индуцированным нейтрофилами повреждением гиф A. fumigatus.
Обобщая вышесказанное, можно заключить, что у онкогематологических больных с тяжелым иммунодефицитом важную роль играют редкие инфекции, вызываемые условно-патогенными грибами. Нужно помнить о возможности развития ИГИ на фоне лечения микафунгином, поскольку он имеет узкий спектр действия. Не следует забывать и о том, что эмпирическое назначение микафунгина или другого препарата группы эхинокандинов может быть ошибочным у пациента с положительным результатом посева крови с целью выявления дрожжевых грибов. Профилактическое назначение эхинокандинов в целом и микафунгина в частности может быть нецелесообразным в клиниках, в которых наблюдается сложная эпидемиология оппортунистических ИГИ.
Выводы и перспективы
Микафунгин – ценное дополнение к арсеналу средств для лечения ИГИ у онкогематологических больных с тяжелым иммунодефицитом. Препарат активен против самых частых у таких пациентов возбудителей грибковых инфекций (Candida и Aspergillus spp.), но не активен против многих других устойчивых грибов, включая эндемические виды, плесневые грибы (помимо Aspergillus spp.) и дрожжевые грибы (за исключением Candida spp.), такие как Cryptococcus и Trichosporon spp. Наиболее убедительные данные касаются его применения для профилактики в период подготовки пациента к ТКМ. Однако может ли микафунгин обеспечить этой группе пациентов столь же хорошее увеличение выживаемости, как флуконазол, пока неизвестно. Имеющиеся данные клинических исследований свидетельствуют в пользу применения микафунгина для лечения кандидемии и ИК. Однако относятся ли они к пациентам с гемобластозами, неизвестно, так как среди участников этих исследований количество пациентов с гемобластозами было небольшим. Результаты открытых несравнительных клинических исследований показали, что микафунгин эффективен в качестве резервной терапии при рефрактерном ИА, в основном в комбинации с другими противогрибковыми препаратами. Необходимы хорошо организованные проспективные исследования эффективности микафунгина в качестве монотерапии и в комбинации с другими препаратами для лечения ИГИ, особенно вызванных плесневыми грибами, у пациентов с гемобластозами.
Статья печатается в сокращении.
Список литературы находится в редакции.
Gamaletsou M.N. et al. Micafungin in haematology. Mycoses. 2012; 55 (suppl. 1): 13-23. doi: 10.1111/j.1439-0507.2011.02113.x
Подготовила Елена Терещенко
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (56), грудень 2018 р


