6 січня, 2019
Можливості впливу пробіотиків на бар’єрну функцію кишечнику
.jpg) Кишковий бар’єр виконує важливі функції – забезпечує захист слизової оболонки (СО) кишечнику і, відповідно, усього організму від патогенних мікроорганізмів та інших шкідливих факторів, абсорбцію харчових речовин із хімусу, їх подальший транспорт та інші. Він має 3-компонентну структуру, яка включає: слизовий, епітеліальний та судинний бар’єр. Структурні та функціональні порушення кишкового бар’єра можуть призвести до розвитку низки патологічних станів травної та інших систем організму – від запальних і функціональних захворювань кишечнику до цукрового діабету та ожиріння.
Кишковий бар’єр виконує важливі функції – забезпечує захист слизової оболонки (СО) кишечнику і, відповідно, усього організму від патогенних мікроорганізмів та інших шкідливих факторів, абсорбцію харчових речовин із хімусу, їх подальший транспорт та інші. Він має 3-компонентну структуру, яка включає: слизовий, епітеліальний та судинний бар’єр. Структурні та функціональні порушення кишкового бар’єра можуть призвести до розвитку низки патологічних станів травної та інших систем організму – від запальних і функціональних захворювань кишечнику до цукрового діабету та ожиріння.
Причини та наслідки підвищеної проникності кишкового бар’єра
Проникність кишкової стінки може змінюватись під дією одного або кількох факторів, які наведено на рис. 1.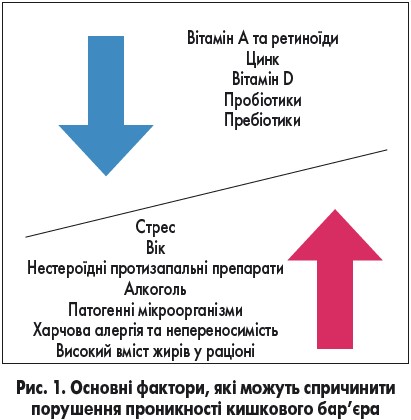
Харчування чинить постійний та істотний вплив на усі рівні кишкового бар’єра, зумовлюючи його структурні та функціональні зміни. Регулярне вживання технологічно оброблених харчових продуктів через наявність в їх складі шкідливих харчових добавок може призвести до порушення бар’єрної функції кишечнику.
Встановлено, що вживання певних емульгаторів (полісорбату 80, карбоксиметилцелюлози), які містять кількасот найменувань харчової продукції, погіршує перебіг коліту внаслідок збільшення кількості Bilophila spp. у складі кишкової мікробіоти, підвищення кишкової проникності, зменшення шару слизу та активізації бактеріальної пенетрації [1].
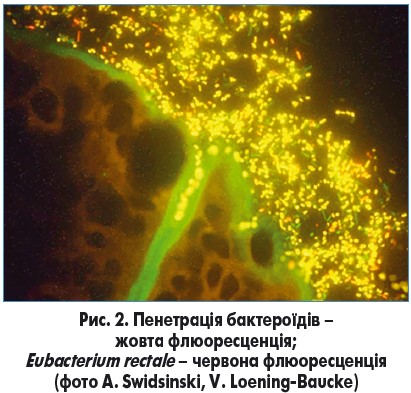
Сучасні методи молекулярних досліджень дають можливість візуально оцінити нормальний/патологічний стан слизового шару, мікробіоти та епітелію кишечнику. На рис. 2 проілюстровано пенетрацію бактероїдів внаслідок порушення проникності слизового бар’єра.
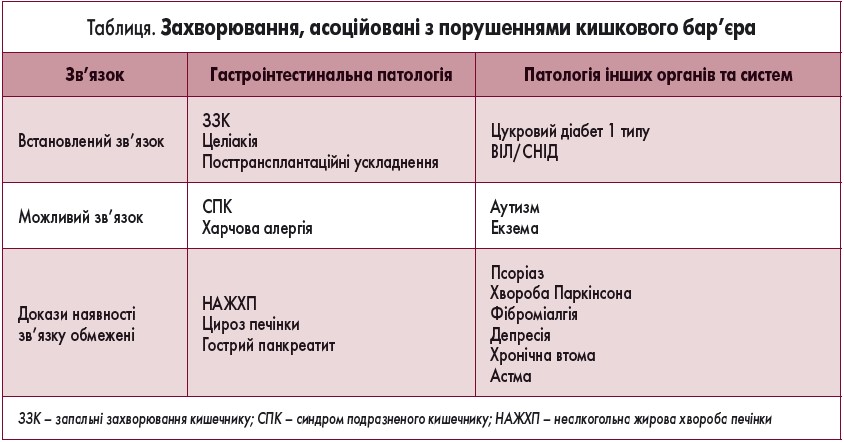
 Структурні та функціональні порушення кишкового бар’єра мають серйозні наслідки, які не обмежуються органами травної системи і можуть бути асоційовані з розвитком хронічних екстрагастроінтестинальних захворювань [2]. У таблиці представлено дані про зв’язок патології органів різних систем організму із структурними та функціональними порушеннями кишкового бар’єра.
Структурні та функціональні порушення кишкового бар’єра мають серйозні наслідки, які не обмежуються органами травної системи і можуть бути асоційовані з розвитком хронічних екстрагастроінтестинальних захворювань [2]. У таблиці представлено дані про зв’язок патології органів різних систем організму із структурними та функціональними порушеннями кишкового бар’єра.
Значення мікробіоти для підтримання бар’єрної функції кишечнику
У структурі епітеліального бар’єра умовно можна виділити кілька рівнів. Анатомічний рівень представлений одноклітинним шаром клітин, який являє собою фізичну межу між просвітом кишки, lamina propria та лімфатичною тканиною СО кишечнику. Слиз, який продукують келихоподібні клітини, поряд з реалізацією інших функцій просторово відокремлює бактерії від СО кишечнику, запобігаючи їх колонізації.
Кишкові мікроорганізми одночасно беруть участь у створенні кишкового бар’єра та взаємодіють з іншими структурними компонентами.
Коменсальні бактерії успішно конкурують із патогенами за місця адгезії, оскільки вони більш пристосовані до екологічних умов кишечнику. Вони продукують бактеріоцини та коротколанцюгові жирні кислоти, завдяки цьому зменшується рН, що запобігає проліферації патогенних мікроорганізмів.
Внаслідок впливу несприятливих факторів відбуваються важливі зміни у композиції кишкової мікробіоти та порушення її бар’єрної функції. Наприклад, антибактеріальна терапія може призвести до зменшення щільності власних мікроорганізмів і, відповідно, до звільнення певних ніш у кишковому бар’єрі. Як наслідок, відсутність належної конкуренції мікроорганізмів за місця адгезії та поживні речовини створює сприятливі умови для колонізації екзогенними мікроорганізмами [3].
Саме такою є закономірність розвитку інфекції Clostridium difficile, яка часто асоціюється з порушеннями кишкової мікробіоти на тлі лікування антибіотиками. Можна припустити, що терапевтичний ефект трансплантації фекальної мікробіоти зумовлений заповненням утворених ніш коменсальними бактеріями донора [4].
Дія пробіотиків на функціональний стан кишкового бар’єра у здорових осіб
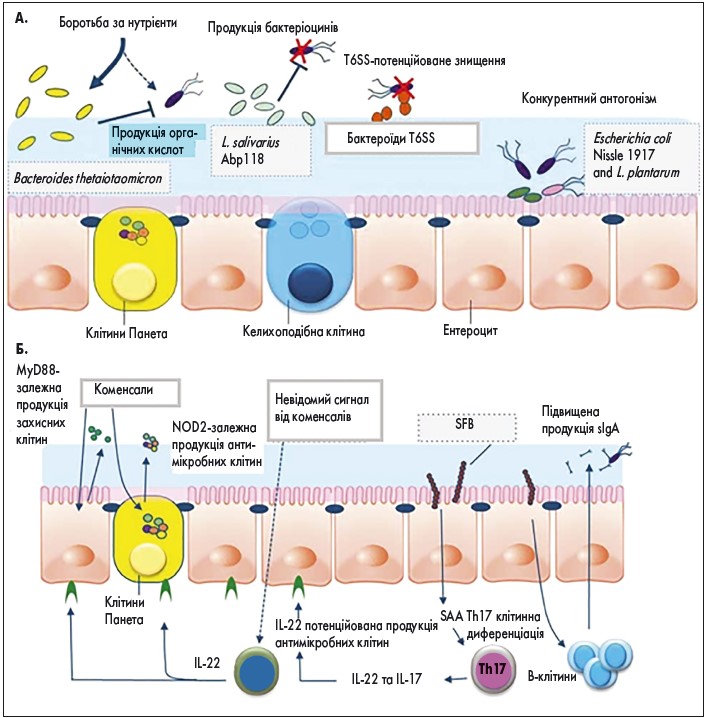
Кількість досліджень, які присвячені вивченню впливу пробіотиків на регуляцію кишкової проникності в осіб без патологічних проявів, досить обмежена. Коменсальні та пробіотичні бактерії мають кілька прямих і опосередкованих механізмів антагоністичної активності відносно патогенів, завдяки яким вони беруть участь у регуляції бар’єрної функції кишечнику (рис. 3).Прямі механізми схематично зображено на верхній (a), опосередковані механізми – на нижній (b) частині рисунка.
Рис. 3. Механізми антагоністичної активності коменсальних і пробіотичних бактерій відносно патогенів
Прямі механізми антагоністичної активності коменсальних і пробіотичних бактерій відносно патогенів
Мікроорганізми жорстко конкурують між собою за поживні речовини, переважно за вуглеводи залежно від особливостей харчування людини [5].
Пробіотичний штам Lactobacillus salivarius UCC118 продукує бактеріоцини, які захищають лабораторних мишей від агресивного патогену харчового походження Listeria monocytogenes [6].
Багато штамів Bacteroides мають секреторну систему потенційованого знищення (T6SS), яка регулює контактно-клітинні механізми міжбактеріального антагонізму шляхом експорту антибактеріальних протеїнів [7].
Встановлено, що пробіотики здатні запобігати колонізації патогенів завдяки конкуренції за вільні місця адгезії [8].
Опосередковані механізми антагоністичної активності коменсальних і пробіотичних бактерій відносно патогенів
Розпізнавання організмом-хазяїном молекулярних структур, асоційованих із бактеріями, відбувається за участі рецепторів TLR та NLR. Вони активують імунний захист для знешкодження інфекційних агентів.
Сигнали, отримані за участі TLR, стимулюють секрецію дефенсинів в ентероцитах та антибактеріальних факторів у клітинах Панета через первинну відповідь мієлоїдної диференціації 88 (MyD88) з активацією ядерного фактора κB (NF-κB) та продукцією антимікробних пептидів.
Нуклеотидзв’язуючий олігомеризуючий домен 2 (NOD2) також бере участь у розпізнаванні пептидогліканів бактерій з подальшою експресією криптидину клітинами Панета.
Отримання нерозпізнаного сигналу від коменсальних мікроорганізмів стимулює власні лімфоїдні клітини 3 типу (ILC3) із подальшою секрецією інтерлейкіну (IL) 22, який через рецептори IL‑22R кишкових епітеліальних клітин підвищує експресію фукозілтрансферази (FUT), продукцію слизу та секрецію антибактеріальних протеїнів сімейства Reg3.
Сегментовані нитчасті бактерії (SFB), які локалізуються в епітелії здухвинної кишки, здатні стимулювати В- і Т-лімфоцити, що зумовлює підвищення секреції IgA В-клітинами. Субпопуляція Т-хелперів Th17 продукує запальні цитокіни та IL‑22, який стимулює імунний захист.
Пробіотичні бактерії, які потрапляють до організму людини у складі харчових продуктів, дієтичних добавок або лікарських засобів, аналогічно коменсальним мікроорганізмам, можуть здійснювати вплив на функціональний стан кишкового бар’єра шляхом модулювання ендогенної мікробіоти.Такий вплив пробіотичних бактерій реалізується за рахунок конкуренції за мікронутрієнти та/або через утворення певних метаболічних речовин, здатних впливати на композицію та/або активність власної мікробіоти, запобігаючи колонізації патогенами [9].
Пробіотики здатні синтезувати власні антимікробні агенти, які впливають на патогенні бактерії безпосередньо або опосередковано через ендогенну мікробіоту. Наприклад, L. reuteri можуть продукувати рейтерин – вторинний метаболіт із широким спектром антибактеріальної активності [10].
Важливим механізмом патогенної дії мікроорганізмів є пошкодження цитоскелета клітин кишкового епітелію внаслідок колонізації та інвазії ентеропатогенів. Певні штами Lactobacillus здатні зменшувати порушення цілісності епітеліального шару.
У дослідженні in vitro продемонстровано, що застосування пробіотичних штамів L. acidophilus, L. casei та L. helveticus дозволяє запобігти зниженню трансепітеліальної електричної резистентності (один із механізмів формування міжклітинних зв’язків), яке спричинене адгезією ЕРЕС (Еnteropathogenic Escherichia coli) [11,12].
В останні роки також отримано дані про взаємодію пробіотичних бактерій з імунними клітинами СО кишечнику, які відповідають за синтез IL‑22 та IL‑8 [13,14]. Останні здатні підвищувати експресію генів, які кодують секрецію специфічних муцинів. Так, певні штами Lactobacillus spp. можуть стимулювати експресію MUC3 в епітеліальних клітинах кишечнику, запобігаючи адгезії ЕРЕС [15,16].
Можливості пребіотиків та пробіотиків у відновленні кишкового бар’єра
Порушення цілісності епітеліального бар’єра кишечнику та його функціонального стану є основним патогенетичним механізмом, який спричиняє істотне послаблення захисту від агресивної дії хімічних та інфекційних агентів, а також обмежує абсорбційну здатність, що погіршує засвоєння необхідних нутрієнтів.
Кишкова мікробіота відіграє винятково важливу роль у підтриманні гомеостазу функції кишкового бар’єра. Вочевидь, і відновлення цієї функції неможливе без ефективного впливу на композицію та активність кишкової мікробіоти.
Продукція бутирату завдяки ферментативній активності кишкової мікробіоти забезпечує підвищення секреції слизу та підтримання регуляторної функції Т-лімфоцитів у ШКТ [17]. Враховуючи це, застосування харчових волокон (пребіотиків) з метою стимулювання росту бутиратпродукуючих штамів кишечних бактерій є ефективною та безпечною стратегією дієтичних інтервенцій, спрямованою на покращення бар’єрної функції кишечнику.
Вражаючим прикладом того, як можна досягнути відмінного терапевтичного ефекту шляхом впливу на кишкову мікробіоту, є використання методу трансплантації фекальної мікробіоти (ТФМ) у лікуванні патології, асоційованої з C. difficile. Такий підхід є надзвичайно ефективним навіть після невдалих курсів антибактеріальної терапії [18].
Тривають дослідження, в яких здійснюють вивчення довгострокових ефектів ТФМ при цілій низці інших патологічних станів – від ЗЗК до цукрового діабету. Одночасно вчені продовжують пошук шляхів вирішення складних завдань щодо гарантування безпеки цієї процедури. Існує припущення, що у майбутньому фекальні трансплантати будуть замінені «коктейлем» мікроорганізмів, які чинитимуть прогнозований вплив на композицію власної мікробіоти і функціональний стан кишкового бар’єра.
Вже зараз можна визначити спектр патологічних станів, які асоційовані з запальними змінами та порушенням бар’єрної функції кишечнику, щодо лікування яких отримано докази ефективності пребіотиків, пробіотиків та синбіотиків у дослідженнях in vitro, на тваринних моделях та спостереженнях за обмеженою кількістю людей. Серед них – некротизуючий ентероколіт, ЗЗК, постінфекційний варіант СПК та низка алергічних захворювань [19, 20].
При трансполяції даних, отриманих у дослідженнях in vitro та на тваринних моделях, на людську популяцію виникають певні складнощі. Попри це у низці досліджень продемонстровано, що за допомогою пробіотиків можна покращити бар’єрну функцію кишечнику. Це має бути відправною точкою для планування наукових досліджень, у тому числі тих, у яких використовуватимуть високоефективні молекулярні технології з подальшим призначенням пробіотичних бактерій.
Терапевтичні можливості застосування синбіотиків
Перспективним напрямом терапевтичного впливу на композицію кишкової мікробіоти та функціональний стан кишкового бар’єра є застосування синбіотиків – засобів комбінованого складу, які містять штами пробіотичних бактерій та пребіотичні компоненти (неперетравлювані полісахариди).
У вітчизняній клінічній практиці вже тривалий час широко використовують синбіотик Лактіалє®, до складу якого входять 7 штамів пробіотичних мікроорганізмів: Lactobacillus casei, Lactobacillus rhamnosus, Streptococcus thermophylus, Bifidobacterium breve, Lactobacillus acidophylus, Bifidobacterium longum, Lactobacillus bulgaricus (сумарно 1,00×108 в 1 капсулі), а також пребіотичні фруктоолігосахариди.
У результаті застосування Лактіалє® реалізується синергічний ефект пробіотиків, кишкової мікробіоти та її метаболітів, зокрема, стимулюється продукція лактату та бутирату. Ці механізми дії синбіотичних засобів може бути покладено в основу створення нових схем лікування низки захворювань, які перебігають за фенотипом порушення бар’єрної функції кишечнику.
Наприклад, існують дані про ефективність застосування комбінацій синбіотиків у дорослих та педіатричних пацієнтів із постінфекційним варіантом СПК [21, 22]. У цьому аспекті особливо важливу роль відіграє бутират, який має властивість послаблювати аферентні вісцеральні сигнали і, відповідно, полегшувати симптоми СПК.
Синбіотик Лактіалє® відповідає найвищим стандартам якості та безпеки, що підтверджують сертифікати GMP, RPSGB, FEMAS, ISO 9001. Ретельний відбір та виробництво бактеріальних штамів, які входять до його складу, здійснює британський інститут Probiotics International Association. На фармацевтичному ринку України представлено три лікарські форми Лактіалє®:
· Лактіалє® Малюк Формула – саше: для дітей віком від 6 місяців до 2 років 1 саше 0,5 г 1 р/добу; для дітей від 2 до 12 років 2 саше (1 г) після основного прийому їжі, розчинивши у воді, молоці або соку 1 р/добу;
· Лактіалє® у формі капсул: для дітей старше 12 років та дорослих по 2 капсули 1 р/добу після основного прийому їжі протягом 6-8 тижнів у складі комплексної терапії, яка має включати також дієтичні інтервенції та корекцію способу життя;
· Лактіалє GG – розчин оральний: дітям від народження до 2 років 1 крапля розчину 1 р/добу; дітям віком від 2 до 12 років – 2 краплі розчину 1 р/добу; дітям віком від 12 років та дорослим – 3 краплі розчину 1 р/добу.
Література
1. Statovci D., Aguilera M., MacSharry J., Melgar S. The Impact of Western Diet and Nutrients on the Microbiota and Immune Response at Mucosal Interfaces. Front Immunol. 2017; 8: 838.
2. Odenwald M.A., Turner J.R. Intestinal permeability defects: is it time to treat? Clin Gastroenterol Hepatol. 2013; 11(9): 1075-1083.
3. Lee S.M., Donaldson G.P., Mikulski Z., Boyajian S., Ley K., Mazmanian S.K. Bacterial colonization factors control specificity and stability of the gut microbiota. Nature. 2013; 501(7467): 426-429.
4. Van Nood E., Vrieze A., Nieuwdorp M. et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med. 2013; 368: 407.
5. McNaught C.E., Woodcock N.P., Anderson A.D.G. et al. A prospective randomised trial of probiotics in critically ill patients. Clin Nutr. 24, 2005; 211-219.
6. Corr S.C., Li Y., Riedel C.U. et al. Bacteriocin production as a mechanism for the antiinfective activity of Lactobacillus salivarius UCC118. Proc Natl Acad Sci. 2007; 104: 7617-7621.
7. Klaenhammer T.R., Kleerebezem M., Kopp M.V. et al. The impact of probiotics and prebiotics on the immune system. Nat Rev Immunol. 2012; 728-734.
8. Adlerberth I., Ahrne S.I.V., Johansson M.L. et al. A mannose-specific adherence mechanism in Lactobacillus plantarum conferring binding to the human colonic cell line HT‑29. Appl Environ Microbiol. 1996; 62: 2244-2251.
9. Derrien M., van Hylckama Vlieg. JET Fate, activity, and impact of ingested bacteria within the human gut microbiota. Trends Microbiol. 2015; 23: 354-366.
10. Cleusix V., Lacroix C., Vollenweider S, et al. Inhibitory activity spectrum of reuterin produced by Lactobacillus reuteri against intestinal bacteria. BMC Microbiol. 2007; 7: 101.
11. Sherman P.M., Johnson-Henry K.C., Yeung H.P. et al. Probiotics reduce enterohemorrhagic Escherichia coli O157: H7-and enteropathogenic E. coli O127: H6-induced changes in polarized T84 epithelial cell monolayers by reducing bacterial adhesion and cytoskeletal rearrangements. Infect Immun. 2005; 73: 5183-5188.
12. Parassol N., Freitas M., Thoreux K. et al. Lactobacillus casei DN‑114 001 inhibits the increase in paracellular permeability of enteropathogenic Escherichia coli-infected T84 cells. Res Microbiol. 2005; 156: 256-262.
13. Rossi G.A., van Baarlen P., Wells J.M. Host-recognition of pathogens and commensals in the mammalian intestine. Curr Top Microbiol Immunol. 2013; 358: 291-321.
14. McGuckin M.A., Linden S.K., Sutton P. et al. Mucin dynamics and enteric pathogens. Nat Rev Microbiol. 2011; 9: 265-278.
15. Mack D.R., Ahrne S., Hyde L. et al. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut. 2003; 52: 827-833.
16. Mack D.R., Michail S., Wei S. et al. Probiotics inhibit enteropathogenic E. coli adherence in vitro by inducing intestinal mucin gene expression. Am J Physiol. 1999; 276: 941-950.
17. Furusawa Y., Obata Y., Fukuda S. et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature. 2014; 504: 446-450.
18. Borody T.J., Khoruts A. Fecal microbiota transplantation and emerging applications. Nat Rev Gastroenterol Hepatol. 2012; 9: 88-96.
19. Spiller R.C., Jenkins D., Thornley J.P. et al. Increased rectal mucosal enteroendocrine cells, T-lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut. 2000; 47: 804-811.
20. Panzer A.R., Lynch S.V. Influence and effect of the human microbiome in allergy and asthma. Curr Opin Rheumatol. 2015; 27: 373-380.
21. Rajilic-Stojanovic M., Biagi E., Heilig H.G.H.J. et al. Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology. 2011; 141: 1792-1801.
22. Saulnier D.M., Riehle K., Mistretta T. et al. Gastrointestinal microbiome signatures of pediatric patients with irritable bowel syndrome. Gastroenterology. 2011; 141: 1782-1791.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (50), грудень 2018 р.