9 березня, 2019
Спазмолітична терапія в корекції синдрому подразненого кишечнику
Синдром подразненого кишечнику (СПК) належить до функціональних захворювань, при яких механізми розвитку симптомів не можуть бути пояснені структурними змінами шлунково-кишкового тракту (ШКТ). Відповідно до сучасних уявлень, СПК є психосоціальним розладом з порушенням вісцеральної чутливості та моторної активності кишечнику, зумовлених або зниженням порога сприйняття болю, або збільшенням відчуття больових імпульсів при нормальному порозі їх сприйняття [4]. Однак при багатьох органічних захворюваннях ШКТ, таких як пептична виразка, гастроезофагеальна рефлюксна хвороба, жовчнокам’яна хвороба, хронічний панкреатит тощо, відзначаються симптоми, властиві СПК [8].
Поширеність СПК-подібних симптомів серед дорослого населення сягає 10‑20%. За даними більшості досліджень, у жінок це захворювання зустрічається приблизно в 2 рази частіше, ніж у чоловіків, причому пік захворюваності припадає на молодий вік, у середньому 27±7 років [7].
У патогенезі СПК можуть брати участь такі фактори: порушення моторики ШКТ, вісцеральна гіперчутливість, розлади взаємодії в системі «головний мозок – кишечник», вегетативні та гормональні зрушення, генетичні фактори та фактори навколишнього середовища, психосоціальні розлади [3]. В останні роки велике значення в формуванні СПК надається порушенням кишкового мікробіому після перенесених кишкових інфекцій [2, 9].
Абдомінальний больовий синдром вісцерального типу є провідним у клінічній картині як СПК, так і органічних захворювань кишечнику. Вісцеральний біль виникає при наявності патологічних стимулів у внутрішніх органах і проводиться симпатичними волокнами. Больові рецептори порожнистих органів ШКТ розташовані в м’язовій і серозній оболонках. Основними подразниками, що зумовлюють виникнення вісцерального болю, є підвищення тиску в порожнистому органі та розтягнення його стінки, рідше – розтягнення капсули паренхіматозного органа, натяг брижі і судинні порушення.
Моторна функція ШКТ визначається активністю гладеньком’язових клітин, яка перебуває у прямій пропорційній залежності від концентрації в них цитозольного Са2+. Іони кальцію шляхом активації внутрішньоклітинних біоенергетичних процесів (фосфорилювання білків, перетворення АТФ у цАМФ та ін.) сприяють з’єднанню ниток актину і міозину та забезпечують скорочення м’язового волокна. Необхідною умовою для скорочення м’язового волокна є висока активність фосфодіестерази, яка бере участь у розщепленні цАМФ і забезпечує енергією процес з’єднання актину з міозином. Транспорт іонів кальцію в клітину здійснюється через спеціальні потенціалзалежні або повільні кальцієві канали. Сьогодні виділяють декілька типів кальцієвих каналів, які відрізняються за біофізичними властивостями, локалізацією в тканинах і вмістом дискретних рецепторів для різних груп лікарських препаратів – блокаторів кальцієвих каналів.
У регуляції транспорту іонів кальцію бере участь низка нейрогенних медіаторів: ацетилхолін, катехоламіни (норадреналін), серотонін, холецистокінін, мотилін та ін. Скорочення м’язового волокна стимулює ацетилхолін, який виділяється при активації вагуса, а його розслаблення опосередковує медіатор симпатичної нервової системи – норадреналін. Ендогенні опіоїдні пептиди та серотонін відіграють подвійну роль у скорочувальній активності міоцитів ШКТ. При стимуляції m- і d-опіоїдних рецепторів, а також 5МТ4-серотонінових рецепторів міоцитів відбувається посилення, а при стимуляції k-опіоїдних і 5МТ3-серотонінових рецепторів – уповільнення моторики ШКТ. Водночас точні механізми дії серотоніну на м’язові волокна ШКТ не встановлені. Є припущення про залучення в ці процеси ацетилхоліну.
Порушення моторної функції органів травлення відіграють значну роль у формуванні не тільки больового синдрому, а й більшості диспепсичних розладів (відчуття переповнення в шлунку, відрижка, печія, нудота, блювання, метеоризм, пронос, запор). Більшість із вищезазначених симптомів можуть спостерігатися як при гіпокінетичному, так і при гіперкінетичному типі дискінезії. Потрібне ретельне обстеження пацієнтів для уточнення характеру цих розладів і вибору адекватної терапії. Одним із найчастіших функціональних порушень кишечнику, в тому числі і при наявності органічної патології органів травлення, є гіперкінетична дискінезія. Вона включає підвищення тонусу і/або перистальтики гладеньких м’язів кишечнику. При спастичній дискінезії будь-якого відділу ШКТ спостерігається підвищення внутрішнього тиску та порушення просування вмісту порожнім органом, що створює передумови для виникнення болю, запору і метеоризму. Спастична дискінезія м’язової оболонки стінки порожнистого органа або сфінктерів найчастіше зумовлює розвиток больового синдрому при езофагоспазмі, дисфункції сфінктера Одді та міхурової протоки, СПК. При цьому швидкість підвищення тиску в просвіті порожнистого органа пропорційна інтенсивності больового синдрому. При гіпермоторній дискінезії збільшується швидкість транзиту хімусу кишечником, порушуються процеси всмоктування води й осмотично активних субстанцій, збільшується об’єм вмісту, що призводить до розвитку больового синдрому та діареї.
У Римських критеріях IV постулюється, що основним симптомом СПК є біль у животі, пов’язаний з дефекацією, в асоціації з порушенням спорожнювання кишечнику, а не дискомфорт, здуття, розтягнення або інші відчуття пацієнта. Для верифікації діагнозу необхідна наявність абдомінального болю хоча б 1 день на тиждень за останні 3 міс протягом 6 міс.
Класифікація СПК за Римськими критеріями IV:
С. Розлади кишечнику
С1. СПК:
– СПК із переважанням запорів (СПК-З);
– СПК з переважанням діареї (СПК-Д);
– СПК зі змішаними ритмами дефекації (СПК-ЗМ);
– СПК без класифікації.
У новій редакції Римських критеріїв при розподілі на субтипи рекомендується враховувати пропорцію зміненого калу за Бристольською шкалою (грудкуватий/твердий або неоформлений/рідкий) тільки в дні з щонайменше одним ненормальним кишковим випорожненням. Дослідники та клініцисти при встановленні діагнозу CПК і визначенні його клінічного варіанта мають керуватися Бристольською шкалою форми випорожнень (рис.). Запор слід ідентифікувати у разі виділення калу типів 1 і 2, діарею – типів 6 і 7.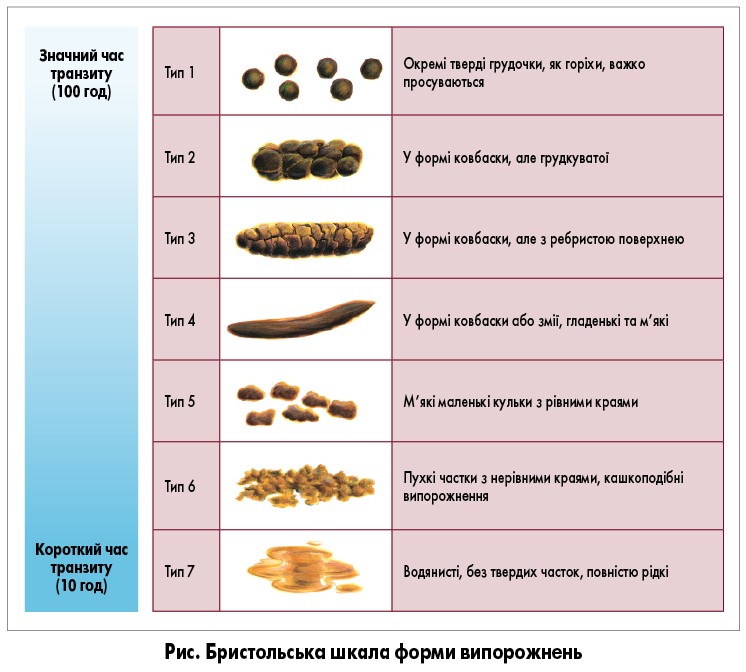
Необхідно відзначити, що протягом хвороби у одного і того самого хворого різні підтипи СПК можуть варіювати [5]. При будь-якому з варіантів СПК провідним симптомом є абдомінальний біль. Клінічні варіанти абдомінального синдрому при СПК відрізняються варіабельністю та різноманітністю. Біль у животі може бути тупим, ниючим, таким, що розпирає, невизначеним, гострим, ріжучим, кинджальним, переймоподібним, пекучим, різної локалізації та інтенсивності. Найбільш частою локалізацією болю є нижня частина живота. При вираженій інтенсивності болю можлива його іррадіація в спину. Нерідко біль посилюється у вертикальному положенні або з’являється у лівому підребер’ї чи лівій половині грудної клітки. Це пов’язане з підняттям і накопиченням кишкових газів у найвище розташованому відділі товстої кишки – селезінковому куті (згині). Купірування або зниження інтенсивності цього типу болю відбувається після відходження газу, яке полегшується в колінно-ліктьовому положенні хворого, що позначається терміном «синдром селезінкового згину». Наявність останнього потребує виключення кардіальної, васкулярної та легеневої патології, а також захворювання підшлункової залози як причини больового синдрому [1].
Головні механізми розвитку абдомінального болю зумовлені порушенням моторики кишечнику та вісцеральною гіперчутливістю. Моторна функція кишечнику перебуває під контролем численних регулювальних впливів (центральної, периферичної, ентеральної нервової системи та шлунково-кишкових пептидів), які визначають нормальний тонус і скоротливу активність гладеньких м’язів кишкової стінки.
При СПК залежно від тонусу та перистальтики циркулярного і поздовжнього шарів гладеньких м’язів формуються два типи моторних порушень: 1) прискорений транзит хімусу кишечником, зумовлений підвищенням активності пропульсивного поздовжнього м’язового шару з розвитком діареї; 2) уповільнений транзит кишкового вмісту за рахунок гіпертонусу циркулярних м’язів (спастична дискінезія) товстої кишки з формуванням запору.
Вісцеральна гіперчутливість розглядається як первинний патофізіологічний механізм, який зумовлює виникнення й інтенсивність абдомінального болю при СПК [1, 6]. З вісцеральною гіперчутливістю пов’язана поява больових відчуттів, моторних і секреторних порушень у відповідь на допорогові механічні, термічні, хімічні та інші стимули. Цей феномен часто формується в результаті впливу сенсибілізуючих факторів, таких як перенесена кишкова інфекція, психоемоційний стрес, хронічні фізичні перевантаження, порушення нормального складу кишкової мікрофлори. Частими і нерідко болісними для пацієнта симптомами СПК є здуття живота або відчуття абдомінального розтягування, а також відрижка і надлишкове віходження газу через пряму кишку (флатуленція). Ці симптоми мають мінімальну вираженість у ранкові години і посилюються у вечірній час. Основними причинами надлишкового вмісту газу є збільшення його продукції кишковою мікрофлорою, уповільнення транзиту в результаті спастичної дискінезії, а також порушення всмоктування кишковою стінкою, зокрема при швидкому транзиті у разі діареї. Оскільки гіпермоторні порушення, що призводять до підвищення тиску в кишечнику, найчастіше стають причиною виникнення абдомінального болю та диспепсичних симптомів при СПК і СПК-подібних розладах, для їх купірування традиційно використовують релаксанти гладеньких м’язів і за необхідності додатково призначають препарати для нормалізації консистенції калу, складу кишкового мікробіому, функції центральної нервової системи.
Провідна роль у терапії пацієнтів з СПК належить спазмолітикам, що об’єднують кілька груп препаратів:
- Препарати, які діють на етапі проведення нервового імпульсу/гуморального сигналу (холіноблокувальна дія): нейротропні спазмолітики.
- Препарати, що діють безпосередньо на клітини гладеньких м’язів (міотропні спазмолітики): блокатори натрієвих і кальцієвих каналів, донатори оксиду азоту (нітрати), інгібітори фосфодіестерази (похідні ізохіноліну).
- Препарати, які впливають на механізми регуляції моторної активності кишечнику: агоністи або антагоністи серотонінових рецепторів, агоністи опіатних рецепторів.
Здебільшого при лікуванні пацієнтів з СПК перевагу віддають міотропним спазмолітикам із селективною дією на гладенькі м’язи ШКТ: мебеверину і пінаверію броміду. Одним із найдокладніше вивчених селективних міотропних спазмолітиків є мебеверин. З 1965 року, після впровадження мебеверину в клінічну практику, були проведені численні дослідження з оцінювання його ефективності та безпеки при лікуванні пацієнтів з СПК. Так, у подвійних сліпих дослідженнях ефективність мебеверину в купіруванні абдомінального больового синдрому та порушень дефекації виявилася вищою порівняно з плацебо [4]. Проведено також порівняльні дослідження ефективності застосування мебеверину й інших міотропних спазмолітиків з метою купірування симптомів СПК [3, 9]. Результати експериментальних досліджень показали, що мебеверин справляє два ефекти. Перший з них включає блокаду швидких натрієвих каналів клітинної мембрани міоцитів, що порушує процеси надходження натрію в клітину, уповільнює процеси деполяризації та припиняє вхід кальцію в клітину через повільні канали. Унаслідок цього знижується фосфорилювання міозину і швидко усувається спазм м’язового волокна. Другий ефект зумовлений зменшенням поповнення внутрішньоклітинних кальцієвих депо, що призводить лише до короткочасного виходу іонів калію з клітини і її гіперполяризації; це запобігає розвитку гіпотонії м’язового волокна після купірування спазму. Цей ефект мебеверину вигідно відрізняє його від інших міотропних спазмолітиків, що спричиняють тривалу гіпотонію.
Хоча препарат застосовується вже багато років, деякі його властивості були вивчені порівняно недавно. У 1996 р. P.R. Evans і співавт. виявили, що крім спазмолітичної дії мебеверин проявляє і прокінетичну активність [6].
Мета дослідження – оцінити клінічну ефективність мебеверину (Спарк®, ПАТ «Фармак») у корекції абдомінального больового синдрому та порушень дефекації при СПК.
Матеріали та методи
У дослідження було включено 38 хворих (20 жінок і 18 чоловіків) віком від 18 до 57 років (середній вік – 38,6 року). Учасників розподілили на 2 групи: до 1-ї групи увійшли 19 пацієнтів з СПК та діареєю, до 2-ї – 19 пацієнтів з СПК і запорами.
Критерії включення пацієнтів у дослідження: вік старше 18 років; наявність у хворих встановленого діагнозу СПК. Критерії виключення пацієнтів з дослідження: вагітність або період грудного вигодовування; наявність органічної патології ШКТ у фазі загострення, а також декомпесованих захворювань інших органів і систем.
Усім хворим було рекомендовано дотримуватися дієти відповідно до типу CПК. Усі пацієнти приймали Спарк® по 200 мг 2 рази на добу за 20 хв до їди протягом 4 тижнів. Хворим з діареєю додатково призначали кишкові сорбенти (в загальноприйнятих дозах) через 1 год після вживання їжі до нормалізації випорожнень. Хворі із запорами додатково отримували псиліум, або лактулозу, або макрогол в індивідуально підібраних дозах до нормалізації частоти та форми випорожнень.
Разом із загальноприйнятими клініко-лабораторними тестами пацієнтам проводили колоноскопію, ультразвукове дослідження органів черевної порожнини, за показаннями – езофагогастроскопію. Ступінь вираженості симптомів оцінювали з використанням бальної системи: 1 бал – легкий ступінь – симптом не порушує активності хворого і прийом ліків не потрібен; 2 бали – середній ступінь – симптом не порушує активності хворого, але необхідна терапія «за вимогою» (прийом ліків, зміна частоти вживання і якості їжі та ін.); 3 бали – тяжкий ступінь – симптом порушує активність хворого, і для його купірування потрібне лікарське втручання. Вираженість симптомів оцінювали до лікування, щодня під час терапії і після її закінчення. При оцінюванні ефективності лікування виділяли: хороший результат – повне зникннення симптомів і збереження ремісії протягом не менше 1 тижня після закінчення лікування; задовільний результат – зменшення вираженості симптомів на 1 бал; незадовільний результат – наявність симптомів без істотної динаміки.
Результати дослідження та їх обговорення
До лікування у всіх включених у дослідження пацієнтів мав місце больовий синдром різного ступеня вираженості (сумарно – 2,5 бала). У 17 (89,5%) хворих 2-ї групи біль асоціювався з запорами, вираженість яких становила 2,7 бала, а у 12 (63,1%) пацієнтів 1-ї групи – з діареєю з вираженістю 2,2 бала. Після 4-тижневої комплексної терапії з включенням міотропного спазмолітика мебеверину (Спарк®) у більшості пацієнтів відзначена позитивна динаміка. Больовий синдром повністю купірувано у 30 (78,9%) хворих і зберігався тільки у 8 (21,1%). При цьому ступінь його вираженості значно зменшився (з 2,5 до 1,5 бала; р<0,05), і більшості пацієнтів не потрібне було подальше застосування препарату. Нормалізація випорожнень відзначена у 73,6% хворих, у решти пацієнтів (як із запорами, так і з діареєю) вираженість порушення випорожнень знизилася більш ніж на 1,2 бала. Оцінка ефективності курсового лікування препаратом Спарк® представлена в таблиці 1.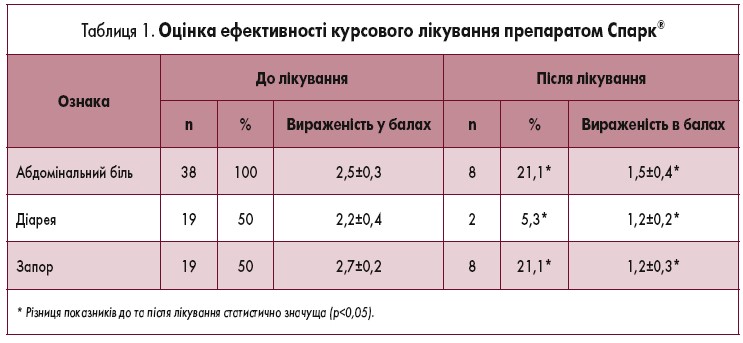
Хороший і задовільний результати курсового лікування із включенням препарату Спарк® отримано у більшості – 30 (78,9%) – хворих, незалежно від характеру порушень моторики кишечнику. Незадовільний результат лікування відзначено у 8 (21,1%) пацієнтів (табл. 2). Слід відзначити хорошу переносимість і безпеку препарату. Побічних ефектів під час лікування не зафіксовано. Загальні та біохімічні показники крові до і після лікування зберігалися в межах фізіологічної норми.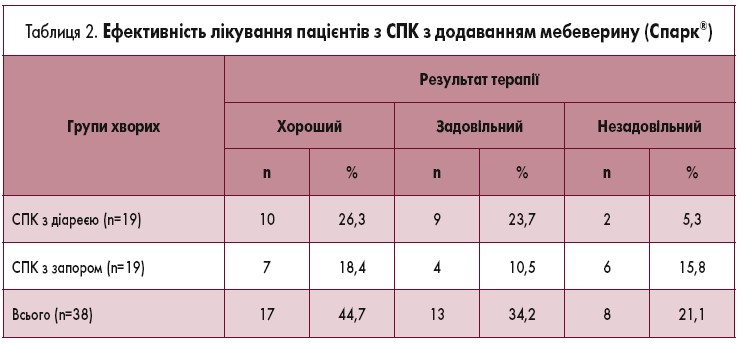
При функціональних та органічних захворюваннях кишечнику важливе значення надають симптоматичній терапії, спрямованій, насамперед, на відновлення моторної функції кишечнику. З порушеннями останньої пов’язується розвиток таких симптомів, як абдомінальний біль, порушення випорожнень і метеоризм. З метою купірування цих симптомів традиційно використовують спазмолітики, включаючи мебеверин [6]. Тому вважаємо актуальним проведене нами вивчення ефективності спазмолітика Спарк® у купіруванні больового синдрому та диспепсичних розладів при СПК.
Прийом мебеверину (Спарк®) у дозі 200 мг 2 рази на добу протягом 4 тижнів забезпечував ефективну корекцію больового синдрому, метеоризму та нормалізацію випорожнень при СПК. Одним із важливих завдань лікування хворих із патологією органів травлення є нормалізація випорожнень. Остання досягається застосуванням препаратів, що відновлюють нормальний транзит і консистенцію кишкового хімусу. Мебеверин (Спарк®) ми призначали пацієнтам із запорами та діареєю. Відмінності у веденні хворих цих груп полягали у призначенні препаратів, що нормалізують консистенцію калу. Нормалізація моторної функції кишечнику і пов’язаних із нею порушень дефекації (за клінічними ознаками) спостерігалися у 28 хворих, включених у дослідження. Отримані нами результати узгоджуються з даними P.R. Ewans та співавт., які також показали, що пероральний прийом мебеверину справляв регуляторний ефект на моторну функцію кишечнику у пацієнтів з СПК (із запорами та діареєю) і не впливав на моторику кишечнику у здорових осіб [6].
Капсули Спарк® пролонгованої дії містять полімерну матрицю, у якій рівномірно розподілена лікарська речовина. Після прийому капсули на поверхні матриці утворюється гелевий шар, який регулює вивільнення мебеверину із заданою швидкістю. Це забезпечує необхідну концентрацію активної речовини в різних відділах ШКТ протягом не менше 12 год, що дає змогу зменшити частоту прийому та уникнути подразливої дії лікарської речовини на ШКТ, знизити ймовірність виникнення побічних ефектів.
У проведеному нами дослідженні при застосуванні мебеверину (Спарк®) як у монотерапії, так і в поєднанні з препаратами, що нормалізують консистенцію калу, побічних ефектів не відзначено. Аналогічні дані щодо безпеки та переносимості мебеверину були отримані в клінічних дослідженнях за участю понад 3500 пацієнтів. Майже у всіх дослідженнях доведена хороша переносимість і безпека препаратів мебеверину незалежно від дози (до 800 мг/добу) і тривалості застосування (до 12 тижнів безперервно). А.М. Connell зазначив, що відсутність побічних ефектів при прийомі мебеверину забезпечує переваги препарату перед стандартними антихолінергічними засобами, які впливають не тільки на орган-мішень, а й на інші системи організму [6]. У метааналізі досліджень 8 препаратів, які найчастіше використовують при лікуванні пацієнтів з СПК, мебеверин посідає перше місце за відсутністю побічних ефектів [6]. У рідкісних випадках повідомлялося про алергічні шкірні реакції та слабкість.
Висновки
Отримані нами результати дослідження ефективності мебеверину (капсули пролонгової дії Спарк®), а також аналіз даних літератури дозволяють зробити висновок про наявність у цього препарату не тільки вираженої спазмолітичної дії, здатності швидко й ефективно купірувати больовий синдром, зумовлений спазмом гладеньких м’язів кишечнику, а й еукінетичної дії (нормалізація транзиту хімусу кишечником). Це є обґрунтуванням для застосування мебеверину (Спарк®) як ефективного та безпечного препарату в лікуванні хворих з СПК як з переважанням запорів, так і діареї.
Література
- Yakovenko E.P., Agafonova N.A., Yakovenko A.V., Ivanov A.N., Pryanishnikova A.S., Krasnolobova L.P. The role of motor disorders in the formation of clinical manifestations of irritable bowel syndrome (IBS) and IBS-like disorders. Therapy issues. Consilium Medicum. 2011; 1: 69-73.
- Andresen V., Lowe B., Broicher W., Riegel B., Fraedrich K., von Wulffen M. et al. Post-infectious irritable bowel syndrome (PI-IBS) after infection with Shiga-like toxin-producing Escherichia coli (STEC) O104: H4: A cohort study with prospective follow-up. United European Gastroenterology Journal. 2016; 4(1): 121-31.
- Camilleri M., Lasch K., Zhou W. Irritable bowel syndrome: Methods, mechanisms, and pathophysiology. The confluence of increased permeability, inflammation, and pain in irritable bowel syndrome. Am. J. Physiol. Gastrointest. Liver Physiol. 2012; 303: 775-85.
- Drossman D.A., Camilleri M., Mayer E.A., Whitehead W.E. AGA technical review on irritable bowel syndrome. Gastroenterology. 2002; 123: 2108-31.
- Drossman D.A. The Functional Gastrointestinal Disorders and the Rome III Process. Gastroenterology. 2006; 130(5).
- Dumitrascu D.L., Chira A., Bataga S., Diculescu M., Drug V., Gheorghe C., Goldis A., Nedelcu L., Porr P.J., Sporea I. Romanian The use of mebeverine in irritable bowel syndrome. A Position paper of the Romanian Society of Neurogastroenterology based on evidence. Society of Neurogastroenterology. J. Gastrointestin. Liver Dis. 2014 Dec; 23(4): 431-5.
- Esposito I., de Leone A., Di Gregorio G., Giaquinto S., de Magistris L., Ferrieri A., Riegler G. Breath test for differential diagnosis between small intestinal bacterial overgrowth and irritable bowel disease: An observation on nonabsorbable antibiotics. World J. Gastroenterol. 2007; 13(45): 6016-21.
- Farrokhyar F., Marshall J.K., Easterbrook B. et al. Functional Gastrointestinal Disorders and Mood Disorders in Patients with Inactive Inflammatory Bowel Disease: Prevalence and Impact on Health. Inflamm. Bowel Dis. 2006; 12(1): 38-45.
- Spiller R., Lam C. An update on post-infectious irritable bowel syndrome: Role of genetics, immune activation, serotonin and altered microbiome. J. Neurogastroenterol. Motil. 2012; 18: 258-68.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (51), лютий 2019 р.



