25 березня, 2019
Топічні нестероїдні протизапальні препарати в лікуванні остеоартриту
Остеоартрит (ОА) є найчастішим показанням для застосування топічних нестероїдних протизапальних препаратів (НПЗП). Топічні лікарські форми НПЗП забезпечують такий самий знеболювальний ефект, як і пероральні, проте асоціюються з меншою системною експозицією і, відповідно, з нижчим ризиком розвитку тяжких побічних ефектів. Як зазначено в останніх британських рекомендаціях з ведення ОА (NICE, 2019), топічні НПЗП є першою лінією фармакотерапії для полегшення болю при ОА колінного суглоба або суглобів кисті. У нещодавно оновлених європейських рекомендаціях з ведення ОА суглобів кисті (EULAR, 2018) топічні НПЗП, з огляду на їх кращу безпеку, мають перевагу перед системним лікуванням і є початковою фармакотерапією вибору.
Механізми терапевтичної дії топічних НПЗП
НПЗП інгібують циклооксигеназу (ЦОГ), яка опосередковує синтез прозапальних простагландинів і тромбоксану А2 (FitzGerald G.A. et al., 2001). Терапевтична ефективність різних топічних НПЗП залежить від їх фізико-хімічних властивостей, розміру активної молекули, а також від складу лікарської форми та концентрації в ній діючої речовини. Усі ці характеристики впливають на фармакодинамічні властивості препарату (Galer B. S., 2008).
Для кращої абсорбції через усі шари шкіри до вогнища болю та запалення оптимальна атомна одиниця маси препарату не повинна перевищувати 500 Да (Brown М. В. et al., 2006). Наприклад, розмір молекули диклофенаку – 294 Да, кетопрофену – 253 Да (Kokki Н. et al., 2008). Порівняльні дослідження, проведені зі штучними мембранами та людським епідермісом, продемонстрували, що гель є більш ефективною лікарською формою, ніж крем чи мазь.
У разі ОА топічні НПЗП виявляють свою терапевтичну дію шляхом локального зменшення запалення і больового синдрому. Це досягається через створення високої концентрації діючої речовини в тканинах суглоба (Haroutiunian S. et al., 2010; Moore R. A. et al., 2008). Водночас плазмові концентрації після місцевого застосування НПЗП значно нижчі (зазвичай до 5%) порівняно з такими при системному призначенні. Мінімізація плазмових концентрацій топічних НПЗП дає змогу обмежити розвиток несприятливих системних подій, особливо в пацієнтів з факторами ризику (Evans J. M. et al., 1995; Zimmerman J. et al., 1995).
Яку доказову базу мають топічні НПЗП при ОА?
У систематичному огляді, що включив 86 рандомізованих контрольованих досліджень (РКД) за участю 10 160 пацієнтів, було доведено, що топічні НПЗП є ефективними в лікуванні гострого і хронічного болю, зокрема, в пацієнтів з ОА. Місцеві та системні побічні ефекти на тлі застосування цих засобів виникали вкрай рідко (частота зіставна з такою для плацебо) (Moore R. A. et al., 1998).
Для полегшення болю при ОА, крім топічних НПЗП, часто застосовується капсаїцин. Нещодавно були опубліковані результати великого мережевого метааналізу, в якому порівняли ефективність цих двох підходів (Persson M. et al., 2018). У базах даних Medline, Embase, AMED, CINAHL, Web of Science та Cochrane Library автори виконали пошук РКД топічних НПЗП або капсаїцину порівняно з плацебо в пацієнтів з ОА. Первинною кінцевою точкою була зміна болю після 4 тиж лікування. Біль оцінювали за допомогою візуальної аналогової шкали, підшкали болю індексу WOMAC, опитувальників Макгіла, SF‑36, HAQ та інших клінічних інструментів.
Загалом у метааналіз включили 23 РКД (6957 пацієнтів) топічних НПЗП і 6 РКД (415 пацієнтів), у яких вивчався капсаїцин. Усі дослідження були подвійними сліпими плацебо-контрольованими.
Метааналіз показав, що топічні НПЗП були значно ефективніші за плацебо в полегшенні болю, причому вираженість їх ефекту була стабільною в різних дослідженнях. Натомість профіль ефекту капсаїцину порівняно з плацебо відрізнявся великою варіабельністю і не досяг достовірності. Регресійний аналіз, проведений за двома методами (класичним і баєсовим), показав, що топічні НПЗП мали найвищу вірогідність бути «кращим лікуванням болю при ОА» (рис.).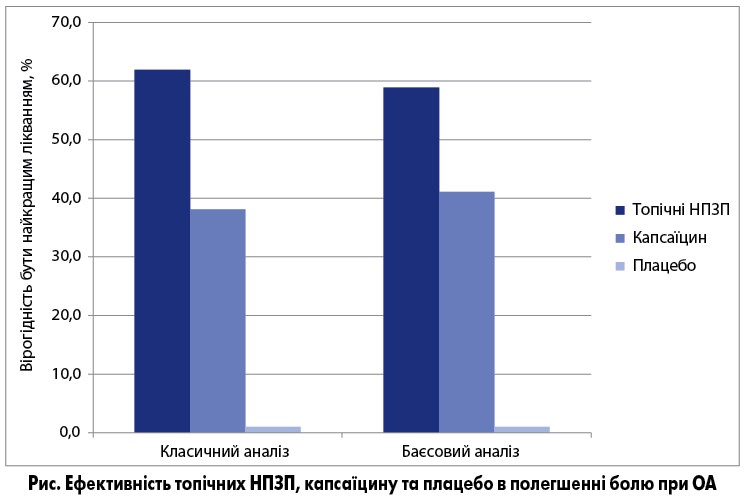
Якому топічному НПЗП віддати перевагу?
Топічні НПЗП у лікуванні ОА порівнювались у декількох метааналізах, у яких для оцінювання протибольової ефективності застосовували індекс NNT (number needed to treat – кількість пацієнтів, яким необхідно призначити лікування, щоб досягти достатнього терапевтичного ефекту в одного хворого). Що менший індекс NNT, то вища ефективність лікування.
Результати метааналізів показали, що найвищу протибольову ефективність має кетопрофен у формі гелю (NNT=2,6). Цей показник для кетопрофену на 58% кращий, ніж в ібупрофену, на 80% кращий – ніж у піроксикаму (NNT=4,7), і майже вдвічі кращий (на 92%), ніж у диклофенаку (NNT=5,0).
У Кокранівському огляді РКД топічних НПЗП у лікуванні при ОА (39 досліджень, 10 631 пацієнт) показано, що лише диклофенак і кетопрофен для місцевого застосування мають достатню доказову базу щодо ефективності та безпеки в довгостроковому веденні больового синдрому при ОА. Обидва препарати продемонстрували зіставну ефективність, проте відрізнялися безпекою: побічні ефекти розвивалися значно частіше при застосуванні топічного диклофенаку порівняно з топічним плацебо (20 vs 5% відповідно), натомість топічний кетопрофен за частотою побічних ефектів був подібним до плацебо (Derry S. et al., 2016).
Чому кетопрофен гель є оптимальним топічним НПЗП?
Кетопрофен – один із найпотужніших інгібіторів ЦОГ (Carabaza et al., 1996). Пригнічення цього ферменту, а отже, й синтезу простагландинів забезпечує протизапальний і знеболювальний вплив препарату. Крім того, кетопрофен діє як потужний інгібітор брадикініну, важливого медіатора болю й запалення. Також препарат стабілізує мембрани лізосом і тим самим запобігає їх осмотичному ушкодженню, що перешкоджає вивільненню лізосомальних ферментів, які опосередковують руйнування суглобових тканин при ОА.
Є докази того, що переваги кетопрофену місцевої дії забезпечуються не тільки силою активної молекули, а й кращою здатністю до проникнення в тканини суглобів і навколосуглобові тканини. Так, у дослідженні C. M. Vincent і співавт. (1999) порівнювали декілька топічних НПЗП щодо швидкості дифузії через шкірні покриви. Дифузія активної речовини, достатня для проявлення терапевтичного ефекту, для кетопрофену 2,5% гелю (Фастум® гель) досягалася через 4 год після нанесення на шкіру, для піроксикаму – через 11 год, для диклофенаку – через 23 год. Відповідно, швидкість пенетрації кетопрофену гелю майже в 6 разів вища, ніж у диклофенаку гелю.
В іншому дослідженні, виконаному японськими вченими, отримані аналогічні дані (Komatsu T., Sakurada T., 2012). Автори порівнювали протизапальну ефективність і шкірну проникність 9 НПЗП для місцевого застосування: кетопрофену, диклофенаку, флурбіпрофену і піроксикаму у формі пластиру, а також кетопрофену, диклофенаку, піроксикаму та ібупрофену у формі гелю. За результатами дослідження, кетопрофен гель продемонстрував найпотужніший протизапальний ефект і високу проникність крізь шкіру порівняно з іншими НПЗП у формі пластиру та гелю.
Безпека НПЗП при ОА
Від дифузії локальної форми препарату крізь шкіру може залежати його концентрація в плазмі крові, що, своєю чергою, може вплинути на ймовірність системних побічних ефектів. Фармакокінетичне дослідження R. Ballerini і співавт. (1986) показало, що кетопрофен, застосований у формі гелю, переважно накопичується в тканинах суглобів, де його концентрація до 258 разів перевищує таку в сироватці. Висока тропність кетопрофену до запалених суглобових тканин також підтверджується в дослідженні J. Parier (1994).
Ще одним важливим питанням є безпека топічних НПЗП для суглобового хряща. Деякі НПЗП мають хондротоксичні властивості (зокрема, ібупрофен, індометацин), тому їх застосування при ОА є небажаним. Хондробезпеку кетопрофену детально вивчали нідерландські вчені (Wilbrink B. et al. 1991); було встановлено, що в зміненому ОА суглобовому хрящі кетопрофен не порушує синтез суглобового матриксу (протеогліканів), а в молодому хрящі препарат здатний підвищувати синтез протеогліканів. Тому поряд із високою протизапальною й протибольовою ефективністю топічна форма кетопрофену є принаймні хондронейтральною, що дуже важливо при лікуванні ОА.
При застосуванні топічних НПЗП системні побічні ефекти малоймовірні, нечастими небажаними явищами можуть бути легке свербіння та почервоніння в ділянці нанесення. Для зменшення ризику фотосенсибілізації пацієнтів потрібно заздалегідь проінструктувати, що не можна піддавати оброблені ділянки шкіри впливу сонячного світла протягом періоду лікування та двох наступних тижнів. Важливо відзначити, що топічні НПЗП необхідно наносити тільки на неушкоджену шкіру, щоб уникнути будь-якої подразнювальної дії на слизові оболонки.
* * *
З огляду на результати метааналізів і численних клінічних досліджень топічні НПЗП є ефективними і безпечними засобами для лікування болю при ОА, і саме з цих препаратів сучасні міжнародні настанови рекомендують розпочинати фармакотерапію ОА. Оптимальним топічним НПЗП можна вважати кетопрофен у формі 2,5% гелю, який забезпечує швидкий і надійний знеболювальний ефект при низькій частоті побічних явищ. Важливо, що практично всі дослідження, в яких оцінювали ступінь трансдермального проникнення, фармакокінетичні властивості, ефективність та безпеку топічного кетопрофену, проводилися з використанням оригінального препарату Фастум® гель (виробник – А. Менаріні Мануфактурінг Логістікс енд Сервісес С.р.Л., Італія). За 20 років присутності на фармацевтичному ринку України Фастум® гель завоював довіру лікарів і пацієнтів як ефективний, безпечний, доступний і зручний у застосуванні засіб для місцевого лікування болю в суглобах і м’язах.
Підготував Андрій Буряк
Медична газета «Здоров’я України 21 сторіччя» № 4 (449), лютий 2019 р.


