2 квітня, 2019
Пертузумаб в ад’ювантній терапії HER2-позитивного раку грудної залози ранніх стадій
Надлишкова експресія рецептора людського епідермального фактора росту 2 (HER2) виявляється приблизно у 20% пацієнток з раком грудної залози (РГЗ) та асоціюється з агресивністю пухлини, зниженою відповіддю на стандартну терапію та низькою виживаністю. Це зумовлено тим, що активація HER2‑рецепторів призводить до утворення гомо- та гетеродимерів (HER2/HER2, HER2/HER3), які активують низку молекулярних шляхів з подальшим підвищенням проліферації та виживання пухлинних клітин.
Впровадження у клінічну практику трастузумабу, препарату моноклональних антитіл проти HER2, здійснило революцію у веденні пацієнток з HER2-позитивним РГЗ. У перших дослідженнях додавання трастузумабу до хіміотерапії (ХТ) значно збільшувало виживаність без прогресування і загальну виживаність у пацієнток з РГЗ пізніх стадій. Сьогодні трастузумаб застосовується як стандартний препарат також в ад’ювантній і неоад’ювантній терапії.
Попри високу ефективність трастузумабу при HER-позитивному РГЗ, у деяких пацієнток не досягалася відповідь на лікування або в них розвивався рецидив, що потребувало розробки нових методів терапії, спрямованих проти HER2. Пертузумаб – препарат моноклональних антитіл, перший представник класу інгібіторів димеризації рецепторів HER2, який порушує здатність HER2 зв’язуватися з іншими рецепторами родини HER. Цей унікальний механізм дає змогу доповнити дію трастузумабу, забезпечуючи більш повну блокаду сигнального шляху HER. У разі призначення в комбінації з доцетакселом і трастузумабом у 1-й лінії терапії при метастатичному HER2-позитивному РГЗ пертузумаб покращував загальну виживаність, на підставі чого був схвалений Управлінням з контролю якості харчових продуктів і лікарських препаратів США (FDA) і сьогодні застосовується як стандартна терапія за цим показанням. Пертузумаб також став першим онкологічним препаратом, який отримав прискорене схвалення FDA для застосування з метою неоад’ювантної терапії.
За результатами рандомізованих досліджень було встановлено, що додавання пертузумабу до терапії трастузумабом підвищує частоту повної патологічної відповіді при HER2-позитивному РГЗ ранніх стадій. Нещодавно було завершено рандомізоване клінічне дослідження III фази APHINITY, у якому оцінювали ефективність і безпеку пертузумабу як ад’ювантної терапії в комбінації з ХТ при РГЗ ранніх стадій (von Minckwitz G. et al. APHINITY Steering Committee and Investigators. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med. 2017 Jul 13; 377(2): 122-131).
Рак грудної залози ранніх стадій – це пухлини, обмежені грудною залозою та регіонарними лімфатичними вузлами за відсутності віддалених метастазів (протокова карцинома in situ – DCIS, а також РГЗ I, IIA, IIB та IIIA стадій). РГЗ ранніх стадій виділяють тому, що за належного лікування він може бути повністю виліковним.
Для участі у дослідженні APHINITY у 549 клінічних центрах 43 країн (зокрема 7 центрах України) відбирали пацієнток з гістологічно верифікованим інвазивним HER2-позитивним РГЗ з метастазами у регіонарних лімфатичних вузлах (або з неураженими лімфатичними вузлами при розмірі пухлини >1,0 см). Позитивність за HER2 визначали як імуногістохімічну оцінку 3+ у >10% імунореактивних клітин або ампліфікацію ERBB2 (гена, який кодує HER2) у тесті з гібридизацією in situ. Пацієнток із синхронним двобічним інвазивним захворюванням включали у дослідження за умови HER2-позитивності обох вогнищ. Пацієнтки з N0 і пухлинами 0,5-1,0 см повинні були мати принаймні одну ознаку високого ризику з таких: гістологічний або ядерний ступінь 3, негативний статус за рецепторами естрогенів і прогестерону (ER/PR), вік молодше 35 років. Інтервал між радикальним хірургічним втручанням і введенням першої дози хіміопрепарату мав становити не більше 8 тижнів. Критерії виключення з дослідження: фракція викиду лівого шлуночка <55%; рак іншої локалізації протягом останніх 5 років (крім карциноми in situ шийки матки або товстої кишки, меланоми in situ, базально- або плоскоклітинного раку шкіри); будь-яка ХТ, променева, анти-HER2-, біологічна або імунотерапія раку в анамнезі; супутні хвороби, наявність яких може вплинути на досліджуване лікування, зокрема тяжкі кардіоваскулярні або легеневі захворювання.
Пацієнток рандомізували 1:1 для лікування пертузумабом або плацебо (навантажувальна доза 840 мг внутрішньовенно – в/в, потім 420 мг в/в через кожні 3 тижні) в комбінації з трастузумабом (навантажувальна доза 8 мг/кг маси тіла в/в, потім 6 мг/кг в/в через кожні 3 тижні). Пертузумаб і трастузумаб призначали з першого циклу таксанвмісної ХТ і продовжували максимум 18 циклів протягом 1 року. Анти-HER2-терапію застосовували у комбінації з ХТ за однією з таких схем:
- 3 або 4 цикли (через кожні 3 тижні) 5-фторурацилу + епірубіцин або доксорубіцин + циклофосфамід, потім 3 або 4 цикли (через кожні 3 тижні) доцетакселу або 12 однотижневих циклів паклітакселу;
- 4 цикли (через кожні 2 або 3 тижні) циклофосфаміду + доксорубіцин або епірубіцин, потім 4 цикли доцетакселу або 12 циклів паклітакселу;
- 6 циклів (через кожні 3 тижні) доцетакселу + карбоплатин.
Пацієнтки з ER/PR-позитивними пухлинами після завершення ХТ отримували стандартну гормонотерапію з плановою тривалістю 5 років. Променеву терапію призначали за клінічними показаннями наприкінці ХТ одночасно з анти-HER2-терапією.
Первинною кінцевою точкою була виживаність без інвазивної хвороби (ВБХ), яку визначали як час від рандомізації до фіксування першої події з зазначених: рецидив іпсилатеральної інвазивної пухлини грудної залози, рецидив іпсилатеральної локорегіонарної інвазивної хвороби, віддалений рецидив, контралатеральний інвазивний РГЗ, смерть від будь-якої причини. Як вторинні кінцеві точки оцінювали загальну виживаність, час до розвитку віддаленого рецидиву, безпеку, якість життя та ін.
Загалом 4805 пацієнток рандомізували для отримання ХТ і трастузумабу в комбінації з пертузумабом (n=2400) або плацебо (n=2405). За початковими клініко-демографічними характеристиками групи були добре збалансованими. Метастази в регіонарних лімфатичних вузлах мали 63% пацієнток, ER/PR-негативний статус пухлини – 36%. Медіана спостереження становила 45,4 міс.
Один рік терапії завершили 84,5% пацієнток групи пертузумабу та 87,4% хворих групи плацебо. З міркувань безпеки лікування припинили 7,8 та 6,4% пацієнток відповідно.
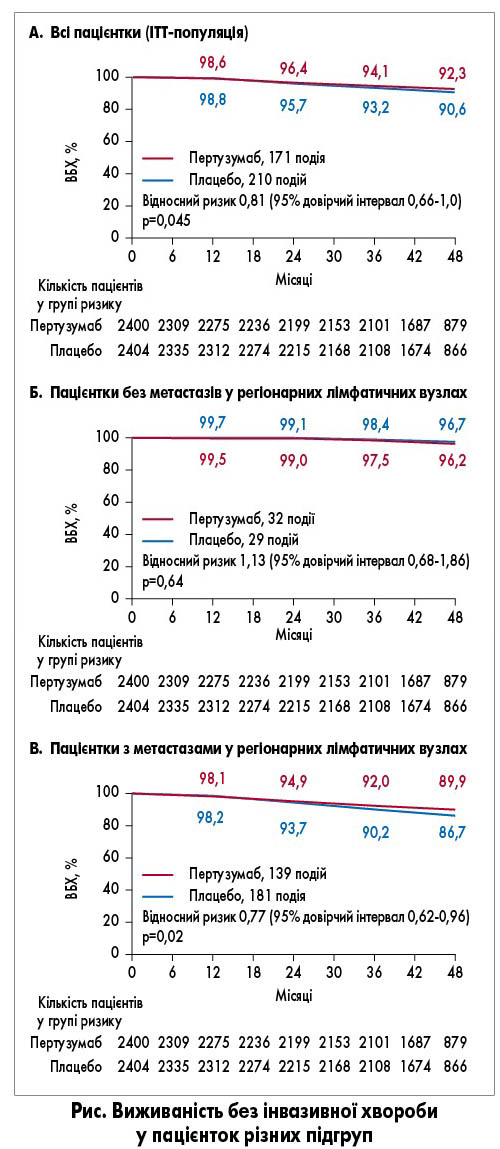 Аналіз первинної точки показав, що додавання пертузумабу асоціювалося зі значно вищим показником ВБХ порівняно з плацебо (рис. А). Трирічна ВБХ становила 94,1% у групі пертузумабу та 93,2% у групі плацебо (зниження ризику розвитку інвазивного рецидиву або смерті на 19% на користь пертузумабу; р=0,045). Віддалені метастази розвинулись у 112 (4,7%) пацієнток групи пертузумабу та 139 (5,8%) хворих групи плацебо, локорегіонарний рецидив – у 26 (1,1%) та 34 (1,4%) відповідно.
Аналіз первинної точки показав, що додавання пертузумабу асоціювалося зі значно вищим показником ВБХ порівняно з плацебо (рис. А). Трирічна ВБХ становила 94,1% у групі пертузумабу та 93,2% у групі плацебо (зниження ризику розвитку інвазивного рецидиву або смерті на 19% на користь пертузумабу; р=0,045). Віддалені метастази розвинулись у 112 (4,7%) пацієнток групи пертузумабу та 139 (5,8%) хворих групи плацебо, локорегіонарний рецидив – у 26 (1,1%) та 34 (1,4%) відповідно.
Позитивний вплив пертузумабу на ВБХ був подібним в усіх підгрупах пацієнток. У підгрупі із РГЗ N0 кількість подій була надто малою, щоб продемонструвати статистично значимий ефект терапії (рис. Б). Натомість у підгрупі з метастазами у регіонарних лімфатичних вузлах перевага пертузумабу була ще помітнішою (зниження ризику інвазивного рецидиву або смерті на 23%; р=0,02; рис. В). Загальну виживаність поки оцінювати рано, проте вже спостерігається тенденція до збільшення цього показника у групі пертузумабу.
Частота небажаних подій ≥3 ступеня становила 64,2% у групі пертузумабу та 57,3% у групі плацебо. Найбільша абсолютна різниця між групами терапії спостерігалась щодо частоти діареї будь-якого ступеня (71,2 vs 45% відповідно). Показники якості життя у пацієнток різних груп не відрізнялися й залишалися стабільними протягом лікування, окрім тимчасового клінічно значимого зниження в кінці терапії таксанами.
Отже, у дослідженні APHINITY додавання до ХТ і трастузумабу пертузумабу як ад’ювантної терапії значно покращило результати лікування. Терапевтичний ефект помітніше проявлявся у пацієнток з вищим ризиком рецидиву (з ураженням регіонарних лімфатичних вузлів або ER/PR-негативними пухлинами), проте статистично був подібним у пацієнток усіх підгруп. Лікування з включенням пертузумабу характеризувалося хорошою переносимістю, жодних нових повідомлень стосовно безпеки не зафіксовано.
На підставі результатів дослідження APHINITY у грудні 2017 р. FDA схвалило пертузумаб як ад’ювантну терапію у комбінації з трастузумабом і ХТ у пацієнток з HER2-позитивним РГЗ ранніх стадій з високим ризиком рецидиву. У квітні 2018 р. Комітет з медичних продуктів для застосування людиною (CHMP) Європейського агентства з лікарських засобів (ЕМА) також рекомендував розширити показання до застосування пертузумабу.
Відповідно до рекомендацій Американського товариства клінічної онкології (ASCO, 2018), клініцисти можуть призначати ад’ювантну терапію пертузумабом протягом 1 року додатково до трастузумабу та ХТ у пацієнток з HER2-позитивним РГЗ ранніх стадій з високим ризиком рецидиву. У настановах Національної онкологічної мережі США (NCCN; версія за 8 лютого 2019 р.) ад’ювантна терапія пертузумабом із трастузумабом і ХТ рекомендована пацієнткам з HER2-позитивним РГЗ ранніх стадій у разі позитивного статусу лімфатичних вузлів (≥1 іпсилатерального метастазу діаметром >2 мм).
Таким чином, подвійна анти-HER2-блокада із застосуванням пертузумабу й трастузумабу в комбінації з ХТ стала стандартною опцією ад’ювантної терапії при РГЗ ранніх стадій з позитивним HER2-статусом. Крім усунення високого ризику (метастази в регіонарних лімфатичних вузлах, негативний статус гормональних рецепторів), предиктором користі від додавання пертузумабу може бути інфільтрація пухлини лімфоцитами. У дослідженні TRYPHAENA за участю пацієнток з РГЗ ранніх стадій, які отримували пертузумаб/трастузумаб + ХТ, було встановлено, що з кожним збільшенням на 10% початкової кількості лімфоцитів, які інфільтрують пухлину, ризик прогресування або смерті зменшувався на 25% протягом 5 років спостереження (M. Ignatiadis et al., 2019).
Підготував Олексій Терещенко
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 1 (57), лютий 2019


