25 квітня, 2019
Сучасний менеджмент активного псоріатичного артриту: рекомендації Американського коледжу ревматологів та Національної фундації з псоріазу (2018)
Псоріатичний артрит (ПсА) – хронічне запальне скелетно-м’язове захворювання, асоційоване із псоріазом, яке маніфестує зазвичай із периферичного артриту, дактиліту, ентезиту та спондиліту. Крім того, у 80-90% пацієнтів із ПсА зустрічається ураження нігтів, включно з точковими поглибленнями та оніхолізисом [1]. Частота ПсА становить приблизно 6 випадків на 100 тис. протягом року, а поширеність – 1-2 випадки на 1 тис. у загальній популяції [2]. Щорічна захворюваність на ПсА в осіб із псоріазом становить 2,7% [3], а зареєстрована поширеність ПсА серед пацієнтів із псоріазом варіює від 6 до 41% [2]. Частота виникнення ПсА у чоловіків і жінок однакова. ПсА асоціюється з негативним впливом на якість життя та чималими витратами на лікування [4, 5]. Значна активність захворювання пов’язана із прогресуючим деструктивним артритом, функціональною недостатністю, інвалідизацією, коморбідністю та вищою смертністю [6].
Симптоми ураження шкіри є здебільшого первинно маніфестними; артрити зазвичай розвиваються через деякий проміжок часу. Однак у певної частки хворих симптоми ураження шкіри та суглобів проявляються одночасно, а в 10-15% артрит є першою клінічною ознакою захворювання [3]. Саме ці випадки є найскладнішими для ранньої діагностики ПсА.
Клінічні форми
Клінічні варіанти периферичного артриту варіюють від асиметричного олігоартриту (за участю ≤4 суглобів) до симетричного поліартриту (≥5 суглобів). Залучення дистальних міжфалангових суглобів (ДМФС) є найбільш патогномонічним клінічним симптомом, у деяких випадках це єдині уражені суглоби. Аксіальний спондилоартрит переважно виникає разом із периферичним артритом. У певних пацієнтів можна спостерігати швидко прогресуючий та деструктивний ПсА – мутилюючу форму.
У таблиці 1 представлені клінічні форми ПсА.
Критерії діагностики
Діагноз ПсА встановлюють на підставі діагностичних критеріїв ПсА (CASPAR), розроблених у 2006 р. W. Taylor et al. [7]. Вони мають високу чутливість і специфічність як на ранній, так і при розгорнутій стадії хвороби. Ці критерії дозволяють діагностувати ПсА незважаючи на позитивний ревматоїдний фактор (РФ) і відсутність псоріазу, за наявності типових ознак.
Відповідно до критеріїв СASPAR, пацієнти повинні мати ознаки запального захворювання суглобів (артрит, спондиліт або ентезит) і ≥3 балів із наступних п’яти, що представлені в таблиці 2.
Клінічна картина ПсА є достатньо гетерогенною, і лікарі досить часто стикаються із проблемами при розгляді різних варіантів терапії. Мета нашого огляду – інтерпретація та представлення рекомендацій Американського коледжу ревматологів (ACR) 2018 р. з лікування активного ПсА у дорослих із використанням фармакологічних та нефармакологічних підходів. Ці керівні принципи можуть допомогти як клініцистам, так і пацієнтам досягти оптимальних рішень у менеджменті хвороби.
Визначення активності, тяжкості ПсА та ефективності лікування
Рекомендації з лікування здебільшого представлені для активної форми ПсА. При встановленні активності ПсА слід враховувати наявність принаймні одного з наступних симптомів: артриту, дактиліту, ентезиту, ураження осьового скелету, активне пошкодження шкіри та/або нігтів, екстраартикулярних проявів, як-то увеїт або запальне захворювання кишечника (ЗЗК). Необхідно також брати до уваги такі маркери запалення, як С-реактивний білок (СРБ) або швидкість осідання еритроцитів (ШОЕ) та результати зображень суглобів і кісток [8].
Для оцінки ефективності лікування, головним чином у рандомізованих контрольованих дослідженнях, використовують наступні критерії, рекомендовані ACR [9]:
- Число болючих суглобів (із 68).
- Число припухлих суглобів (із 66).
- Загальна оцінка активності захворювання лікарем за візуальною аналоговою шкалою (ВАШ), мм.
- Загальна оцінка активності захворювання пацієнтом за шкалою ВАШ, мм.
- Оцінка болю в суглобах пацієнтом за шкалою ВАШ, мм.
- Визначення порушень функціональних здібностей за опитувальником оцінки здоров’я хворого (HAQ);
- Гострофазові показники (ШОЕ або СРБ).
Критерій ACR20 означає поліпшення на 20% порівняно з вихідним рівнем принаймні 5 із 7 перерахованих вище показників (покращення перших двох параметрів є обов’язковим), що відповідає задовільному ефекту терапії, ACR50 – на 50%, хороший ефект і ACR70 – на 70%, відмінний ефект. Якщо критерії оцінки ефективності лікування EULAR застосовуються в щоденній практиці лікаря, то ACR – переважно у наукових роботах і клінічних дослідженнях [10]. Індекс DAS дозволяє встановити ступінь активності захворювання, а його зміна в ході терапії – виразність її ефекту, тоді як критерії ACR – лише наявність або відсутність позитивної динаміки на тлі лікування [11].
Медичні працівники та пацієнти повинні судити про тяжкість ПcА та псоріазу в кожному конкретному випадку. Для таких цілей треба визначати не тільки рівень активності хвороби у певний момент часу, але й наявність або відсутність поганих прогностичних факторів і довгостроковий прогноз. Прикладами тяжкого захворювання є наявність одного або більше з наступних прогнознегативних факторів:
- ерозивний процес;
- дактиліт;
- підвищені рівні запальних маркерів, таких як ШОЕ та СРБ, що пов’язані з ПсА;
- незворотне ураження суглобів;
- деформації суглобів, які знижують їхню функцію;
- висока активність захворювання, що викликає серйозні порушення якості життя (наприклад, активне запалення на багатьох ділянках, зокрема дактиліт, ентезит або обмеження функції декількох суглобових груп);
- довгостроковий збиток (наприклад, втрата зору);
- швидке прогресування хвороби;
- активна інфільтрація псоріазу на багатьох ділянках.
Оскільки на даний час немає остаточно узгоджених визначень тяжкості псоріазу, її мають встановлювати медичний працівник та пацієнт у кожному окремому випадку. У клінічних дослідженнях цей показник був визначений за індексом тяжкості та поширеності ураження псоріазом (PASI) ≥12 та оцінкою площі ураженої поверхні тіла (BSA) ≥10 [12]. Приклади визначень тяжких ПсА і псоріазу наведені в таблиці 3. Нарешті, оскільки Національна фундація псоріазу (NFP) та Американська академія дерматології (AAD) одночасно розробляють керівні принципи лікування псоріазу, терапію псоріазу шкіри окремо від запального артриту не включали у поточне керівництво ACR із ПсА.
Перехід від рекомендацій до практики
Рекомендації ACR/NFP‑2018 розроблені на допомогу медичним працівникам у виборі терапії для пацієнта із ПсА. Наявність або відсутність коморбідних станів, таких як ЗЗК, увеїт, діабет або серйозні інфекції, а також знання препаратів, що використовувалися на попередніх етапах, впливають на рішення щодо визначення оптимального менеджменту хворого на ПсА. У контексті ПсА для вибору лікування необхідно провести об’єктивне обстеження, яке включає оцінку стану периферичних суглобів (зокрема для виявлення дактиліту), хребта, шкіри і нігтів, встановити ентезити. Лікар та пацієнт повинні враховувати супутні захворювання та функціональний стан хворого при виборі оптимальної терапії у даний момент часу.
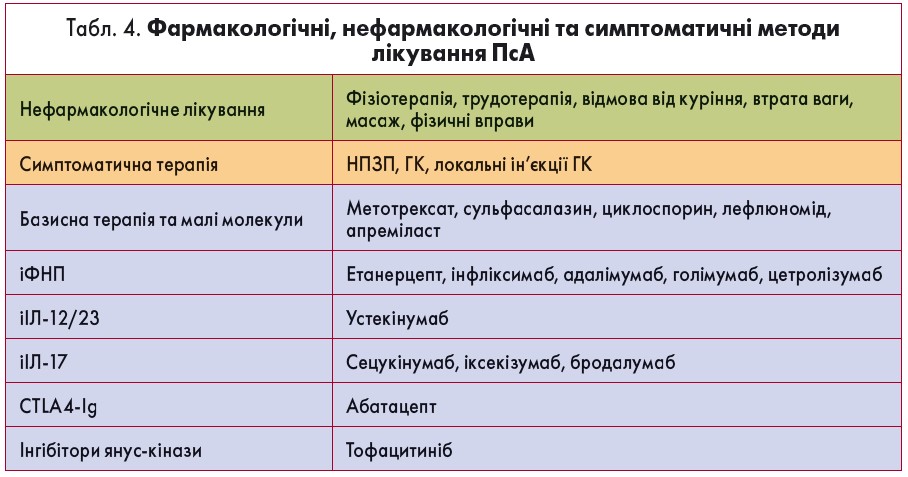
Рання ідентифікація та діагностика ПсА і, відповідно, своєчасний початок терапії надважливі для покращання довгострокових наслідків хвороби [13]. Як нефармакологічне, так і фармакологічне лікування здатне зменшити симптоми та прояви ПсА і привести до ремісії захворювання (табл. 4) [14]. Наразі клініцисти та пацієнти можуть вибирати з широкого спектра медикаментозних методів терапії, зокрема симптоматичних, які включають нестероїдні протизапальні препарати (НПЗП), системні глюкокортикоїди (ГК), локальні (внутрішньосуглобові) ін’єкції ГК, а також імуномодулююче лікування оральними препаратами малих молекул (ОПММ), інгібіторами фактора некрозу пухлин (іФНП), інгібіторами інтерлейкінів (iІЛ), імуноглобуліном та інгібіторами янус-кінази.
Фармакологічні методи лікування виділені у таблиці 4 синім кольором і включають базисну терапію та малі молекули, іФНА, іІЛ‑17, іІЛ‑12/23, CTLA4-імуноглобуліни та інгібітор янус-кінази. Незважаючи на наявність численних немедикаментозних методів лікування, тільки 6 із них розглядаються як найефективніші: фізіо-/трудотерапія, відмова від куріння, втрата ваги, масаж, фізичні вправи.
Лікування ПсА згідно з рекомендаціями ACR/NFP‑2018
Активний ПсА у пацієнтів, які не отримували лікування
У пацієнтів із ПсА, які не отримували лікування на попередніх етапах (наївні), біологічні агенти, а саме іФНП, рекомендуються як препарати першої лінії терапії (рис. 1) [15-28]. Базисні лікарські засоби: метотрексат (МТХ), сульфасалазин (ССЗ), лефлуномід (ЛЕФ), циклоспорин (ЦСА) слід використовувати замість іФНП в осіб без тяжких ПсА та псоріазу (як зазначено у методах оцінки тяжкості та таблиці 3, остаточне визначення ступеня тяжкості має оцінюватися пацієнтом та лікарем). Хворі повинні віддавати перевагу оральній формі препарату замість парентеральної або мати протипоказання до лікування іФНП, зокрема застійну серцеву недостатність, попередні серйозні або рецидивуючі інфекції чи демієлінізуючу хворобу, а також занепокоєння щодо початку терапії біологічними медикаментами.
У пацієнтів з активним ПсА, які не отримували лікування із приводу хвороби, слід надавати перевагу біологічним препаратам іФНП або базисній терапії та малим молекулам над іІЛ‑17 чи іІЛ‑12/23. іІЛ‑17 або іІЛ‑12/23 потрібно використовувати замість іФНП в осіб із тяжким псоріазом та протипоказаннями до призначення іФНП. При порівнянні ефективності застосування таких біологічних засобів, як іІЛ‑17 та іІЛ‑12/23 рекомендовані іІЛ‑17, а біологічну терапію іІЛ‑12/23 слід розглянути у разі супутнього ЗЗК та/або тяжкого псоріазу та/або тяжкого ПсА або при бажанні пацієнта рідше вводити препарат.
З-поміж НПЗП і МТХ рекомендовано надати перевагу саме МТХ в осіб з активним ПсА або псоріазом. НПЗП можна використовувати замість МТХ після розгляду вірогідних протипоказань та оцінки профілів побічних реакцій у хворих без ознак тяжких ПсА або псоріазу, а також у пацієнтів без ризику розвитку кардіо- та нефротоксичних ефектів НПЗП.
Активний ПсА незважаючи на лікування оральними препаратами базисної терапії
У пацієнтів, в яких зберігається активність ПсА незважаючи на терапію препаратами базисного ряду (МТХ, ССЗ, ЛЕФ, ЦСА), необхідно розглянути перехід на іФНП або іІЛ‑17, або іІЛ‑12/23, а не зміну базисного медикаменту на інший (рис. 2). Але для хворих, що віддають перевагу оральному лікуванню, або тих, хто не має ознак тяжких ПсА чи псоріазу, можна використовувати інший базисний препарат, а не іФНП, іІЛ‑17 або іІЛ‑12/23. Також слід зауважити, що інший базисний засіб (МТХ, ССЗ, ЛЕФ, ЦСА) застосовують у разі наявності протипоказань до біологічних препаратів.
Як вказувалося вище, серед біологічних медикаментів насамперед слід надавати перевагу іФНП на противагу іІЛ‑17, іІЛ‑12/23, абатацепту чи тофацитинібу [30]. Але у пацієнтів із протипоказаннями до іФНП або тяжким псоріазом можна застосовувати іІЛ‑12/23, іІЛ‑17, абатацепт чи тофацитиніб. При порівнянні ефективність іІЛ‑17 виявилася вищою, ніж іІЛ‑12/23, абатацепту або тофацитинібу, а іІЛ‑12/23 продемонстрували кращий результат лікування, ніж абатацепт або тофацитиніб [31]. Тофацитиніб можна використовувати замість іФНП у пацієнтів, що віддають перевагу оральній формі лікувального засобу, та тих, хто не має тжкого псоріазу [32].
Перехід на інший базисний препарат є кращою стратегією, ніж додавання медикаменту тієї самої групи до поточної терапії (за винятком апреміласту). Додавання іншого базисного засобу до поточного лікування можна розглядати тоді, коли пацієнт виявив часткову відповідь на дану терапію оральним базисним агентом. Рекомендується додати апреміласт до поточного лікування базисними засобами, ніж перейти тільки на прийом апреміласту, оскільки більшість доказів переваг терапії апреміласту стосується його комбінованого застосування із препаратами базисного ряду (МТХ, ССЗ, ЛЕФ) [33]. Перехід на апреміласт можна розглядати на противагу комбінованому лікуванню, лише коли пацієнт має значні побічні ефекти внаслідок поточної терапії базисними ліками (МТХ, ССЗ, ЛЕФ, ЦСА).
Цікаво, що біологічна монотерапія вважається ефективнішою, ніж комбіноване використання MTХ та біологічних агентів. При переході лише на біологічний препарат слід зупинити прийом базисних засобів, що є обґрунтованим варіантом лікування і залежить від уподобань пацієнтів та медичних працівників [34]. Біологічний агент у комбінації з MTХ можна застосовувати замість біологічної монотерапії, якщо пацієнт має тяжкий псоріаз, часткову відповідь на поточне лікування MTХ чи супутній увеїт (оскільки він добре реагує саме на MTХ), або у хворих, які отримують лікування іФНП, особливо інфліксимабом і адалімумабом, для потенційної затримки або запобігання утворенню антитіл.
Активний ПсА незважаючи на застосування іФНП у режимі монотерапії або в комбінованому лікуванні
У пацієнтів з активним ПсА, незважаючи на монотерапію біологічним агентом іФНП, слід розглянути перехід на інший іФНП, а не на іІЛ‑12/23, іІЛ‑17, абатацепт або тофацитиніб, додавання МТХ до поточного іФНП (рис. 3). У разі повної відсутності клінічного ефекту від попереднього іФНП або наявності значних побічних реакцій рекомендоване лікування іІЛ‑12/23, іІЛ‑17, абатацептом або тофацитинібом замість монотерапії іншим іФНП [35]. Абатацепт можна використовувати замість іФНП у пацієнтів із рецидивуючою або серйозною інфекцією за відсутності тяжкого псоріазу, виходячи з даних зменшення кількості інфекцій на тлі прийому абатацепту порівняно з іФНП у популяції хворих на ревматоїдний артрит [36]. Якщо пацієнт надає перевагу оральній терапії, лікар може призначати тофацитиніб.
В осіб з активним ПсА, незважаючи на терапію іФНП, другою лінією терапії є насамперед іІЛ‑17, а не іІЛ‑12/23, абатацепт або тофацитиніб. Серед перелічених груп препаратів іІЛ‑12/23, своєю чергою, ефективніші, ніж абатацепт або тофацитиніб. іІЛ‑12/23 можна розглядати замість іІЛ‑17, якщо пацієнт має ЗЗК або бажає рідше вводити лікарський засіб. Можливе застосування абатацепту замість іІЛ‑17 або іІЛ‑12/23 в осіб із рецидивуючою чи серйозною інфекцією. Тофацитиніб можна розглядати замість біологічного препарату іІЛ‑17 або іІЛ‑12/23 у хворих, які віддають перевагу оральному лікуванню або мають історію рецидивуючих чи тяжких інфекцій, спричинених Candida [37]. Для кожного біологічного агента (іФНП, іІЛ‑12/23i або іІЛ‑17) монотерапія вважається доцільнішою, аніж поєднання з МТХ. Комбіноване використання біологічного агента з МТХ можливе замість біологічної монотерапії за наявності тяжкого псоріазу, часткової відповіді на поточне лікування MTХ, увеїту, а також якщо застосовуваним біологічним іФНП є інфліксимаб або адалімумаб (для запобігання імуногенності) [38].
За обставин, якщо для лікування ПсА використовують комбінацію іФНП і МТХ, але зберігається активний ПсА, рекомендується перехід на інший іФНП із МТХ, аніж монотерапія іншим іФНП. Продовження лікування MTХ під час прийому іФНП було визнане корисним, оскільки біологічні препарати можуть мати стійкішу ефективність при застосуванні в комбінації з MTХ [39]. Стратегія монотерапії іншим біологічним засобом іФНП можлива тоді, коли пацієнт має побічні ефекти, пов’язані з MTХ, якщо він вважає за краще отримувати меншу кількість ліків або сприймає лікування МТХ як тягар. Комбіноване лікування iІЛ‑12/23 або iІЛ‑17 із МТХ не рекомендується, бо монотерапія цими агентами вважається більш дієвою. Натомість, якщо на тлі терапії іІЛ‑17 або іІЛ‑12/23 спостерігається частковий ефект, або пацієнт має супутній увеїт, можливо розглянути комбіноване застосування цих препаратів з МТХ [40].
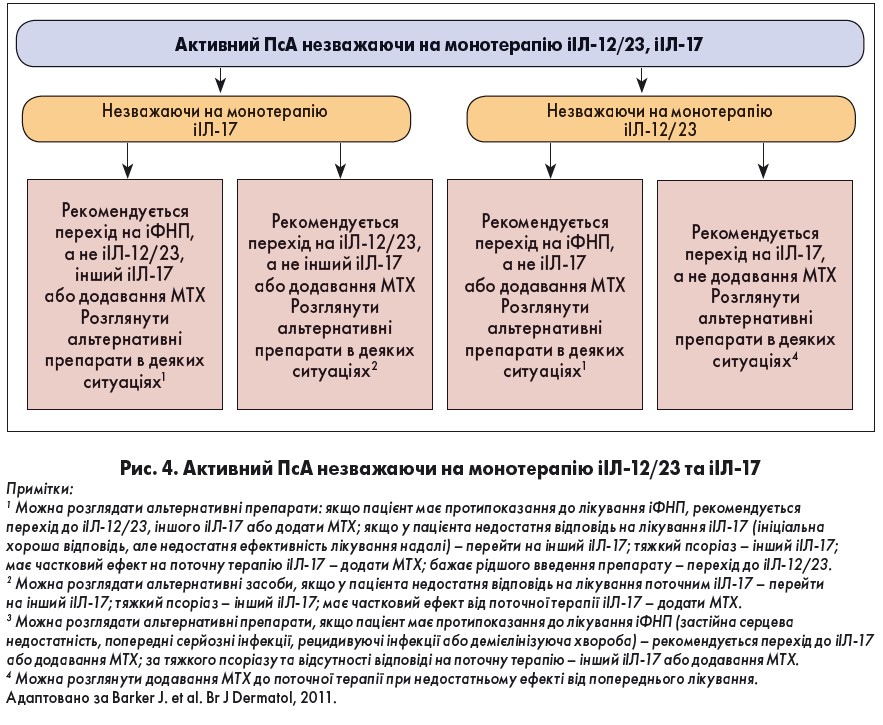
У пацієнтів із ПсА, в яких зберігається активність незважаючи на лікування іІЛ‑17, рекомендується перейти на іФНП (рис. 4). При цьому недоречно призначати іІЛ‑12/23, додавати MTХ до використовуваного іІЛ‑17 або застосувати інший іІЛ‑17 [40]. Перехід на іІЛ‑12/23 вважається ефективнішим, ніж додавання MTХ до іІЛ‑17 чи перехід на інший іІЛ‑17. Якщо пацієнт має тяжкий псоріаз і протипоказання до терапії іФНП, іІЛ‑17 слід замінити на іІЛ‑12/23 [41].
Інший біологічний іІЛ‑17 можна призначати замість переходу на іФНП або іІЛ‑12/23, якщо пацієнт має вторинну неефективність при використанні сучасного біологічного лікування, тяжкий псоріаз чи протипоказання до прийому іФНП [42]. MTХ може бути доданий до поточної терапії іІЛ‑17 замість переходу на іФНП або іІЛ‑12/23 у пацієнтів, що мали часткову реакцію на іІЛ‑17, яким вже лікувалися [42].
Активний ПсА незважаючи на монотерапію іІЛ‑12/23
У пацієнтів із активним ПсА, незважаючи на лікування іІЛ‑12/23, рекомендується перейти на iФНП (рис. 4). Додавання MTХ до поточного режиму або перехід на іІЛ‑17 вважається менш ефективним. Переведення на іІЛ‑17 є кращою стратегією, ніж додавання MTХ до існуючої терапії [43]. Лікування може бути замінене на іІЛ‑17 замість іФНП, якщо хворий має тяжкий псоріаз або протипоказання до іФНП [42].
Ймовірне додавання MTХ до поточної біологічної терапії iІЛ‑12/23 замість переходу на iФНП або iІЛ‑17 у пацієнтів із частковою реакцією на це лікування; MTХ також можна додати до сучасної біологічної терапії iІЛ‑12/23 замість переведення на іФНП за наявності протипоказань [20].
Терапія treat-to-target
У пацієнтів з активним ПсА рекомендується застосовувати відому стратегію treat-to-target (Т2Т) – лікування до досягнення мети. Відмова від даної стратегії можлива у хворих, в яких виникають занепокоєння, пов’язані з посиленням та виникненням несприятливих і побічних подій, витратами на терапію, а також за неможливості контролю використання біологічних агентів.
Активний ПсА зі спондилітом/осьовим ураженням незважаючи на лікування НПЗП
Базисні пероральні препарати, на жаль, є неефективними при аксіальній формі ПсА [44]. У пацієнтів з активним осьовим ПсА, незважаючи на лікування НПЗП, рекомендується проводити терапію iФНП, препаратами наступної лінії є iІЛ‑17, а далі – iІЛ‑12/23. iІЛ‑17 можна використовувати замість іФНП, якщо пацієнт має тяжкий псоріаз або протипоказання до лікування іФНП. іІЛ‑12/23 є найменш ефективними медикаментами у цій клінічній ситуації, оскільки результати трьох рандомізованих досліджень із застосуванням устекінумабу демонструють відсутність досягнення первинних та вторинних кінцевих точок [45-47].
Активний ПсА з переважанням ентезитів у хворих, які не отримували лікування або застосовували базисні пероральні препарати без ефекту
У пацієнтів з ентезитами, що не отримували лікування, як препарати першої лінії рекомендується використовувати біологічні агенти іФНП [48]. В осіб з активним ПсА з ентезитами, незважаючи на лікування базисними пероральними препаратами (які застосовували у клінічних ситуаціях для інших проявів ПсА), доцільно перейти на іФНП, iІЛ‑17 або iІЛ‑12/23, а не інший медикамент даної групи. Зазвичай іФНП є препаратами першої лінії, iІЛ‑17 – другої, iІЛ‑12/23 – третьої [48]. Якщо пацієнт має тяжкий псоріаз і протипоказання до використання іФНП, слід почати лікування іІЛ‑17. Якщо хворий надає перевагу менш частому введенню препарату та має ЗЗК, засобом вибору є iІЛ‑12/23. Апреміласт можна застосовувати замість іФНП, якщо пацієнт віддає перевагу оральній терапії або має протипоказання до іФНП [33]. Пероральні НПЗП за своєю ефективністю при ентезитах в осіб із ПсА превалюють над базисними пероральними агентами і можуть бути призначені, якщо у пацієнта немає серцево-судинних патологій, виразкової хвороби, захворювання нирок (чи порушення функції) або ж тяжких псоріазу та ПсА. Тофацитиніб ефективніший для лікування ПсА з переважанням ентезитів, ніж апреміласт [37]. Останній може мати переваги у пацієнтів із рецидивуючими інфекціями.
Активний ПсА у пацієнтів із супутнім активним ЗЗК
В осіб з активним ПсА із супутнім активним ЗЗК, що не отримували лікування на попередніх етапах, препаратами вибору є іФНП (за виключенням етанерцепту, який є біологічною молекулою розчинних рецепторів та не виявляє ефективності в даній клінічній ситуації). Базисні пероральні препарати можна використовувати у пацієнтів без тяжкого ПсА, які надають перевагу оральній терапії або мають протипоказання до біологічного лікування іФНП [49].
У пацієнтів з активним ПсА із коморбідним активним ЗЗК, незважаючи на застосування базисних препаратів, засобами вибору є моноклональні антитіла до ФНП або іІЛ‑12/23. Причому перевагу слід віддавати моноклональним антитілам до ФНП-α, а не розчинному рецептору ФНП-α (етанерцепту). Моноклональні антитіла до ФНП-α вважаються ефективнішими, аніж iІЛ‑12/23. Останні можна використовувати замість моноклональних антитіл до ФНП у хворих із протипоказаннями до іФНП або тих, хто надає перевагу менш частому введенню препарату [50].
Активний ПсА із супутніми захворюваннями
Активний ПсА у хворих на цукровий діабет, які не отримували базисну пероральну терапію або біологічні агенти. В осіб з активним ПсА із супутнім цукровим діабетом, які не отримували базисне пероральне (МТХ, ЛЕФ, ССЗ, ЦСА) або біологічне лікування, рекомендується стартове призначення препаратів базисного ряду, за виключенням МТХ, а не біологічні агенти. Це через занепокоєння щодо вищої поширеності жирової хвороби печінки та високої гепатотоксичності МТХ і біологічних агентів у цієї групи пацієнтів [51, 52]. іФНП може бути використаний замість базисної пероральної терапії при тяжких ПсА чи псоріазі або добре контрольованому цукровому діабеті (тобто з потенційно меншим ризиком інфекцій).
Активний ПсА в осіб із тяжкими інфекціями, які не отримували терапію базисними пероральними або біологічними агентами. Препаратами першої лінії у пацієнтів з активним ПсА та тяжкими інфекціями, які не застосовували попередню терапію базисними пероральними або біологічними засобами, є базисні медикаменти, а не іФНП, оскільки серйозні інфекції є абсолютним протипоказанням для використання іФНП. Можна розглянути такі біологічні агенти, як іІЛ‑12/23 або іІЛ‑17.
Проведення щеплень живими або інактивованими вакцинами пацієнтам з активним ПсА під час біологічного лікування
За рекомендаціями Центрів із контролю та профілактики захворювань в осіб з активним ПсА, доцільно розпочати застосування біологічних агентів і вакцинувати вбитими інактивованими вакцинами, як зазначено на підставі віку хворого, статі та історії імунізації, і не затримувати лікування. За необхідності щеплення живою ослабленою вакциною рекомендовано відстрочити початок біологічної терапії у пацієнтів з активним ПсА. Якщо прояви ПсА є тяжкими, і затримка початку біологічного лікування є небажаною, можна розглянути початок терапії та введення живих ослаблених вакцин одночасно.
Рекомендації щодо немедикаментозних інтервенцій у пацієнтів з активним ПсА незалежно від фармакотерапії
Пацієнтам з активним ПсА рекомендуються певні фізичні вправи або їхня комбінація, фізіотерапія, професійна терапія, масаж та акупунктура. Вправи з малим (наприклад, тай-чи, йога, плавання) та високим ударним навантаженням (наприклад, біг) треба обмежити. Останні можна виконувати замість вправ із низьким ударним навантаженням хворим, які надають перевагу першим і не мають до них протипоказань. Клініцисти повинні заохочувати хворих кинути курити, пропонуючи різні засоби, через продемонстровану ефективність позбавлення цієї звички в рандомізованих дослідженнях [53, 54]. В осіб із ПсА, які мають надлишкову вагу або ожиріння, рекомендується зменшити масу тіла, щоб потенційно збільшити фармакологічну реакцію лікарських засобів.
Висновки
Метою рекомендацій ACR/NFP‑2018 стосовно лікування ПсА є надання медичним працівникам допомоги в менеджменті та оптимізації терапії у своїх пацієнтів. ПсА є гетерогенним і багатогранним запальним захворюванням, яке має різні клінічні особливості (периферичний артрит, псоріаз, ураження нігтів, ентезит, дактиліт, аксіальна хвороба), котрі потребують певного диференційного та поетапного підходу до лікування. Незважаючи на збільшення кількості нових методів терапії для ПсА, показник доказової ефективності для прийняття рішень щодо лікування залишається обмеженим. Рекомендації оновлюватимуться, коли з’являться нові дані порівняльних досліджень.
Література
- Menter A. Psoriasis and psoriatic arthritis overview // Am J Manag Care. – 2016. – 22 (8 Suppl): s216-224.
- Ogdie A., Weiss P. The epidemiology of psoriatic arthritis // Rheum Dis Clin North Am. – 2015. – 41. – Р. 545-568.
- Ritchlin C.T., Colbert R.A., Gladman D.D. Psoriatic arthritis // N Engl J Med. – 2017. – 376. – Р. 2095-2096.
- Adams R., Walsh C., Veale D., Bresnihan B., FitzGerald O., Barry M. Understanding the relationship between the EQ‑5D, SF‑6D, HAQ and disease activity in inflammatory arthritis // Pharmacoeconomics. – 2010. – 28 (6). – Р. 477-487.
- Singh J.A., Strand V. Health care utilization in patients with spondyloarthropathies // Rheumatology (Oxford). – 2009. – 48 (3). – Р. 27.
- Cresswell L., Chandran V., Farewell V.T., Gladman D.D. Inflammation in an individual joint predicts damage to that joint in psoriatic arthritis // Ann Rheum Dis. – 2011. – 70 (2). – Р. 305-308.
- Taylor W., Gladman D., Helliwell P. et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study // Arthritis Rheum. – 2006. – 54 (8). – Р. 2665-2673.
- Яременко О.Б., Федьков Д.Л., Яременко К.М. Можливості об’єктивізації активності запально-деструктивного процесу при псоріатичному артриті // Український ревматологічний журнал. – 2011. – 46 (4). – С. 1-7.
- Felson D.T., Andersen J.J., Boers M. et al. American College of Rheumatology preliminary definition of improvement in rheumatoid arthritis // Arthritis Rheum. – 1995. – 38 (6). – Р. 727-735.
- Coates L.C., Kavanaugh A., Mease P.J., Soriano E.R., Acosta-Felquer M.L., Armstrong A.W. et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment recommendations for psoriatic arthritis // Arthritis Rheumatol. – 2016. – 68 (5). – Р. 1060-1071.
- Gossec L. Smolen J.S., Ramiro S., de Wit M., Cutolo M., Dougados M. et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update // Ann Rheum Dis. – 2016. – 75 (3). – Р. 499-510.
- Feldman S.R. A quantitative definition of severe psoriasis for use in clinical trials // J Dermatolog Treat. – 2004. – 15 (1). – Р. 27-29.
- Gladman D.D. Early psoriatic arthritis // Rheum Dis Clin North Am. – 2012. – 38 (2). – Р. 373-386.
- Яременко О.Б., Федьков Д.Л. Ефективність і переносимість базисної терапії псоріатичного артриту із застосуванням лефлуноміду // Український ревматологічний журнал. – 2011. – 45 (3). – С. 21-26.
- Baranauskaite A., Raffayova H., Kungurov N.V., Kubanova A., Venalis A., Helmle L. et al. Infliximab plus methotrexate is superior to methotrexate alone in the treatment of psoriatic arthritis in methotrexate- naive patients: the RESPOND study // Ann Rheum Dis. – 2012. – 71 (4). – Р. 541-548.
- Heiberg M.S., Kaufmann C., Rodevand E., Mikkelsen K., Koldingsnes W., Mowinckel P. et al. The comparative effectiveness of anti-TNF therapy and methotrexate in patients with psoriatic arthritis: 6 month results from a longitudinal, observational, multicentre study // Ann Rheum Dis. – 2007. – 66. – Р. 1038-1042.
- Eder L., Thavaneswaran A., Chandran V., Gladman D.D. Tumour necrosis factor α blockers are more effective than methotrexate in the inhibition of radiographic joint damage progression among patients with psoriatic arthritis // Ann Rheum Dis. – 2014. – 73 (6). – Р. 1007-1011.
- Barker J., Hoffmann M., Wozel G. et al. Efficacy and safety of infliximab vs. methotrexate in patients with moderate-to-severe plaque psoriasis: results of an open-label, active-controlled, randomized trial (RESTORE1) // Br J Dermatol. – 2011. – 165. – Р. 1109-1117.
- Saurat J.H., Stingl G., Dubertret L. et al. Efficacy and safety results from the randomized controlled comparative study of adalimumab vs. methotrexate vs. placebo in patients with psoriasis (CHAMPION) //Br J Dermatol. – 2008. – 158 (3). – Р. 558-566.
- Kingsley G.H., Kowalczyk A., Taylor H. et al. A randomized placebo-controlled trial of methotrexate in psoriatic arthritis // Rheumatology (Oxford). – 2012. – 51 (8). – Р. 1368-1377.
- Gupta A.K., Grober J.S., Hamilton T.A. et al. Sulfasalazine therapy for psoriatic arthritis: a double blind, placebo controlled trial // J Rheumatol. – 1995. – 22. – Р. 894-898.
- Combe B., Goupille P., Kuntz J.L., Tebib J., Liote F., Bregeon C. Sulphasalazine in psoriatic arthritis: a randomized, multicentre, placebo-controlled study // Br J Rheumatol. – 1996. – 35. – Р. 664-668.
- Farr M., Kitas G.D., Waterhouse L., Jubb R., Felix-Davies D, Bacon PA. Sulphasalazine in psoriatic arthritis: a double-blind placebo-controlled study // Br J Rheumatol. – 1990. – 29. – Р. 46-49.
- Mease P.J., Gladman D.D., Ritchlin C.T. et al. Adalimumab for the treatment of patients with moderately to severely active psoriatic arthritis: results of a double-blind, randomized, placebo-controlled trial // Arthritis Rheum. – 2005. – 52. – Р.3279-3289.
- Gladman D.D., Mease P.J., Cifaldi M.A., Perdok R.J., Sasso E., Medich J. Adalimumab improves joint-related and skin-related functional impairment in patients with psoriatic arthritis: patient-reported outcomes of the Adalimumab Effectiveness in Psoriatic Arthritis Trial // Ann Rheum Dis. – 2007. – 66 (2). – Р. 163-168.
- Mease P.J., Kivitz A.J., Burch F.X. et al. Etanercept treatment of psoriatic arthritis: safety, efficacy, and effect on disease progression // Arthritis Rheum. – 2004. – 50. – Р. 2264-2272.
- Mease P.J., Woolley J.M., Singh A., Tsuji W., Dunn M., Chiou C.F. Patient-reported outcomes in a randomized trial of etanercept in psoriatic arthritis // J Rheumatol. 2010. – 37 (6). – Р. 1221-1227.
- Mease P.J., Goffe B.S., Metz J., VanderSoep A., Finck B., Burge D.J. Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomised trial // Lancet. – 2000. – 356 (9227). – Р. 385-390.
- Singh J.A., Guyatt G., Ogdie A. et al. 2018 American College of Rheumatology / National Psoriasis Foundation Guideline for the Treatment of Psoriatic Arthritis // Arthritis & Rheumatology, 2018. – Р. 1-28.
- Lubrano E., Scriffignano S., Perrotta F.M. Abatacept for the treatment of psoriatic arthritis // Expert Rev Clin Immunol. – 201. – 14 (11). – Р. 899-905.
- Lubrano E., Perrotta F.M. The role of IL‑17 in the treatment of psoriatic arthritis. Exper // Rev Clin Immunol. – 2017. – 13 (8). – Р. 815-821.
- Gladman D., Rigby W. Azevedo V.F. et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors // N Engl J Med. – 2017. – 377 (16). – Р. 1525-1536.
- Metyas S., Tomassian C., Messiah R., Gettas T., Chen C., Quismorio A. Combination Therapy of Apremilast and Biologic Agent as a Safe Option of Psoriatic Arthritis and Psoriasis // Curr Rheumatol Rev, 2018 [Epub ahead of print].
- Krajewska-Wlodarczyk M., Owczarczyk-Saczonek A., Placek W., Wojtkiewicz M., Wojtkiewicz J. Effect of Methotrexate in the Treatment of Distal Interphalangeal Joint Extensor Tendon Enthesopathy in Patients with Nail Psoriasis // J Clin Med. – 2018. – 7 (12). – pii: E546.
- D’Angelo S., Tramontano G., Gilio M., Leccese P., Olivieri I. Review of the treatment of psoriatic arthritis with biological agents: choice of drug for initial therapy and switch therapy for non-responders // Open Access Rheumatol. – 2017. – 9. – Р. 21-28.
- Yun H., Xie F., Delzell E. et al. Comparative risk of hospitalized infection associated with biologic agents in rheumatoid arthritis patients enrolled in Medicare // Arthritis Rheumatol. – 2016. – 68 (1). – Р. 56-66.
- Berekmeri A., Mahmood F., Wittmann M., Helliwell P. Tofacitinib for the treatment of psoriasis and psoriatic arthritis // Expert Rev Clin Immunol. – 2018. – 14 (9). – Р. 719-730.
- Elmamoun M., Chandran V. Role of Methotrexate in the Management of Psoriatic Arthritis // Drugs. – 2018. – 78 (6). – Р. 611-619.
- Favalli E.G., Selmi C., Becciolini A. et al. Eight-year retention rate of first-line tumor necrosis factor inhibitors in spondyloarthritis: a multicenter retrospective analysis // Arthritis Care Res (Hoboken) – 2017. – 69. – Р. 867-874.
- Ritchlin C.T., Krueger J.G. New Therapies for Psoriasis and Psoriatic Arthritis // Curr Opin Rheumatol. – 2016. – 28 (3). – Р. 204-210.
- Boutet M.A., Nerviani A., Afflitto G.G., Pitzalis C. Role of the IL‑23/IL‑17 Axis in Psoriasis and Psoriatic Arthritis: The Clinical Importance of Its Divergence in Skin and Joints // Int J Mol Sci. – 2018. – 19 (2). –Р. 530.
- Wang E.A., Suzuki E., Maverakis E., Adamopoulos I.E. Targeting IL‑17 in psoriatic arthritis // Eur J Rheumatol. – 2017. – 4 (4). – Р. 272-277.
- Ritchlin C., Rahman P., Kavanaugh A. et al. Efficacy and safety of the anti-IL‑12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumour necrosis factor therapy: 6-month and 1-year results of the phase 3, multicentre, double-blind, placebo-controlled, randomised PSUMMIT 2 trial // Ann Rheum Dis. – 2014. – 73 (6). – Р. 990-999.
- Ward M.M., Deodhar A., Akl E.A. et al. American College of Rheumatology / Spondylitis Association of America / Spondyloarthritis Research and Treatment Network 2015 recommendations for the treatment of ankylosing spondylitis and nonradiographic axial spondyloarthritis // Arthritis Rheumatol. – 2016. – 68 (2). – Р. 282-298.
- Janssen Research & Development, LLC, sponsor. An efficacy and safety study of ustekinumab in participants with active nonradiographic axial spondyloarthritis. ClinicalTrials.govidentifier: NCT02407223; 2017.
- Janssen Research & Development, LLC, sponsor. A study to evaluate the efficacy and safety of ustekinumab in the treatment of anti-TNF-α naive participants with active radiographic axial spondyloarthritis. ClinicalTrials.gov identifier: NCT02437162; 2018.
- Janssen Research & Development, LLC, sponsor. A study to evaluate the efficacy and safety of ustekinumab in the treatment of anti-TNF refractory participants with active radiographic axial spondyloarthritis. ClinicalTrials.gov identifier: NCT02438787; 2018.
- Sakkas L.I., Alexiou I., Simopoulou T., Vlychou M. Enthesitis in psoriatic arthritis // Semin Arthritis Rheum. – 2013. – 43 (3). – Р. 325-334.
- Cohen B.L., Sachar D.B. Update on anti-tumor necrosis factor agents and other new drugs for inflammatory bowel disease // BMJ. – 2017. – 357: j2505.
- Hueber W., Sands B.E., Lewitzky S. et al. Secukinumab, a human anti-IL‑17A monoclonal antibody, for moderate to severe Crohn’s disease: unexpected results of a randomised, double-blind placebo-controlled trial // Gut. – 2012. – 61 (12). – Р. 1693-700.
- Maybury C.M., Jabbar-Lopez Z.K., Wong T., Dhillion A.P., Barker J.N., Smith C.H. Methotrexate and liver fibrosis in people with psoriasis: a systematic review of observational studies // Br J Dermatol. – 2014. – 171 (1). – Р. 17-29.
- Miele L., Vallone S., Cefalo C., La Torre G., Di Stasi C., Vecchio F.M. et al. Prevalence, characteristics and severity of non-alcoholic fatty liver disease in patients with chronic plaque psoriasis // J Hepatol 2009. – 51 (4). – Р. 778-786.
- Головач И.Ю. Значение курения в развитии псориатического артрита и псориаза // Боль. Суставы. Позвоночник. – 2016. – 3 (23). – С. 42-48.
- Taylor G., McNeill A., Girling A., Farley A., Lindson-Hawley N., Aveyard P. Change in mental health after smoking cessation: systematic review and meta-analysis // BMJ. – 2014. – 348: g1151.
- Coates L.C., Fransen J., Helliwell P.S. Defining minimal disease activity in psoriatic arthritis: a proposed objective target for treatment // Ann Rheum Dis. – 2010. – 69 (1). – Р. 48-53.
- Schoels M.M., Aletaha D., Alasti F., Smolen J.S. Disease activity in psoriatic arthritis (PsA): defining remission and treatment success using the DAPSA score // Ann Rheum Dis. – 2016. – 75 (5): 811-818. doi: 10.1136/annrheumdis‑2015-207507.
- Coates L.C., Kavanaugh A., Mease P.J. et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment recommendations for psoriatic arthritis // Arthritis Rheumatol. – 2016. – 68 (5). – Р. 1060-1071.