10 грудня, 2016
Неалкогольная жировая болезнь печени и сахарный диабет: от патофизиологии к лечению эссенциальными фосфолипидами
Неалкогольная жировая болезнь печени (НАЖБП) объединяет спектр клинико-морфологических изменений печени от «простого» стеатоза, неалкогольного стеатогепатита (НАСГ) до терминального заболевания печени с декомпенсированным циррозом, печеночной недостаточностью и гепатоцеллюлярной карциномой, развивающихся у пациентов, не употребляющих алкоголь в гепатотоксических дозах (не более 40 г этанола в сутки для мужчин и не более 20 г – для женщин). Относительно недавно были получены убедительные доказательства, подтверждающие, что НАЖБП увеличивает риск развития внепеченочных заболеваний, в том числе кишечного дисбиоза, сердечно-сосудистой патологии, хронических заболеваний почек и сахарного диабета (СД) 2 типа (Е. Scorletti и соавт., 2016). Выявлена интересная взаимосвязь: с одной стороны, НАЖБП признана фактором риска возникновения СД, с другой стороны, СД 2 типа является фактором риска прогрессирования НАЖБП.
СД представляет собой угрозу для здоровья общества: в настоящее время во всем мире около 347 млн человек страдают этим заболеванием, а, по прогнозам ВОЗ, в 2030 г. СД займет 7-е место среди самых распространенных причин смерти. Данное метаболическое заболевание характеризуется гипертриглицеридемией, приводящей к дефекту секреции и/или нарушению действия инсулина. Течение СД как 1, так и 2 типа ассоциировано с развитием микро- и макрососудистых дегенеративных осложнений, а также сопутствующей патологии печени и гепатоцеллюлярной карциномы. Среди множества различных заболеваний печени у больных СД чаще всего диагностируют НАЖБП.
Эпидемиология и экономическое бремя
НАЖБП – это одно из самых распространенных заболеваний печени в западных странах, его выявляют у 30% представителей общей популяции. Распространенность НАЖБП (оцененная по данным ультразвукового исследования – УЗИ) в общей популяции составляет 25-30%, причем у лиц мужского пола она несколько выше, чем у женщин – 40 и 20% соответственно (S. Ballestri и соавт., 2016). В настоящее время в США более 64 млн человек страдают НАЖБП, а ежегодные медицинские затраты на лечение этой патологии составляют 103 млрд долларов (1613 долларов на одного пациента). Несмотря на меньшее количество больных НАЖБП в Германии, Франции, Италии и Великобритании (52 млн человек) и более низкий уровень ежегодных затрат на лечение данной патологии (35 млрд евро), стоимость лечения одного пациента в этих четырех европейских странах может превышать таковую в США: 354-1163 евро (Z.M. Younossi и соавт., 2016).
В 2010 г. распространенность СД на земном шаре оценивалась в 6,4%, в настоящее время высказываются предположения, что к 2030 г. этот показатель возрастет до 7,7%. По данным эпидемиологических исследований, распространенность СД в пяти основных европейских странах (Франция, Германия, Италия, Испания и Великобритания) колеблется от 4,8% в Италии до 8,9% в Германии и продолжает неуклонно расти. В 2010 г. прямые медицинские затраты на лечение больных СД в Испании составили 5,45 млрд евро, а в Германии превысили 43,2 млрд евро. В США СД 2 типа страдают 8-10% взрослого населения; в 2007 г. стоимость лечения таких больных обошлась американскому обществу в 147 млрд долларов (S. Ballestri и соавт., 2016).
По сравнению с представителями общей популяции больные СД 2 типа значительно чаще страдают НАЖБП: распространенность этого заболевания у пациентов с нарушенным углеводным обменом превышает 75% (S. Ballestri и соавт., 2016). По данным исследований, проведенных в условиях стационара, распространенность ультрасонографически подтвержденной НАЖБП у больных СД колеблется в пределах 45-75%, а по результатам популяционных исследований – составляет 30-70% (выявленные различия объясняются различной этнической принадлежностью пациентов, отличными популяционными характеристиками и неодинаковыми критериями, использованными для диагностики СД). Распространенность гистологически верифицированного НАСГ в общей популяции оценивается в 2-3%; у больных СД этот показатель гораздо выше: по данным стационарных и популяционных исследований, НАСГ выявляют у 56-76 и 22-83% пациентов с нарушенным метаболизмом глюкозы соответственно (S. Ballestri и соавт., 2016). В настоящее время точные данные об экономическом бремени сочетанного течения НАЖБП и СД отсутствуют; медицинские затраты на лечение этих двух коморбидных патологий оценивают косвенно, основываясь на расходах, связанных с лечением каждого заболевания в отдельности.
НАЖБП – предиктор СД 2 типа
На протяжении последних нескольких лет опубликовано большое количество исследований, доказывающих способность НАЖБП провоцировать развитие СД 2 типа и метаболического синдрома. Эти данные были подтверждены результатами двух метаанализов. В первом метаанализе, представленном G. Musso и соавт. (2011), зафиксировано 2-кратное возрастание риска развития СД у больных НАЖБП. В другом метаанализе, основанном на результатах данных 20 проспективных исследований (n=117 020) и выполненном под руководством S. Ballestri (2016), были получены подобные данные: отмечено увеличение вероятности возникновения СД у больных НАЖБП в течение 5 лет (обобщенный относительный риск (ОР) для аланинаминотрансферазы (АЛТ): 1,97 (95% ДИ 1,8-2,15); для аспартатаминотрансферазы (АСТ): ОР 1,58 (95% ДИ 1,43-1,74); для γ-глутамил-транспептидазы (γ-ГТП): ОР 1,86 (95% ДИ 1,71-2,03); для УЗИ: ОР 1,86 (95% ДИ 1,76-1,95).
Необходимо подчеркнуть, что способ верификации диагноза НАЖБП (с помощью ультрасонографических критериев или гистологических маркеров) не влияет на способность НАЖБП провоцировать развитие СД. Например, в одном ретроспективном крупномасштабном когортном исследовании (n=13 218) анализировался риск возникновения СД в зависимости от наличия/отсутствия НАЖБП (К. Sung и соавт., 2013). По истечению 5-летнего срока наблюдения СД был диагностирован у 244 пациентов, выявлено 1640 новых случаев НАЖБП, у 828 больных зафиксировано полное нивелирование лабораторно-инструментальных признаков стеатоза печени, а у 324 участников отмечено прогрессирование НАЖБП от легкой степени тяжести в среднетяжелую/тяжелую. При этом оказалось, что разрешение НАЖБП не сопряжено с увеличением риска развития СД (скорректированное отношение шансов (сОШ) 0,95 (95% ДИ 0,46-1,96); р=0,89); тогда как возникновение новых случаев НАЖБП ассоциировано с 2-кратным возрастанием вероятности нарушения углеводного обмена (сОШ 2,49 (95% ДИ 1,49-4,14); р<0,001). Если же течение стеатоза печени носило прогрессирующий характер, то риск развития СД у таких пациентов увеличивался еще более значимо (сОШ 6,13 (95% ДИ 2,56-14,68); р<0,001) по сравнению с больными, у которых имело место обратное развитие НАЖБП.
В другом ретроспективном когортном исследовании, в котором приняли участие больные с гистологически верифицированной НАЖБП и повышенными печеночными ферментами (n=129), исходная распространенность СД 2 типа составила 8,5%, а через 14 лет динамического наблюдения она достигла 80% (М. Ekstedt и соавт., 2006).
Не менее интересны результаты исследования, выполненного под руководством N.K. Seetlani (2016). Исследователи сформировали когорту больных СД 2 типа (n=262), страдавших этим заболеванием более 5 лет (средняя продолжительность заболевания – 9 лет), у которых в ходе лабораторно-инструментального обследования выявлены высокие уровни АЛТ и сонографические признаки НАЖБП. Впоследствии всем больным была выполнена биопсия печени. Оказалось, что на фоне нарушенного углеводного обмена стеатоз печени быстро прогрессирует: уже через 5 лет после начала СД у 56,49% пациентов обнаруживаются гистологические признаки НАСГ.
Основы патогенеза
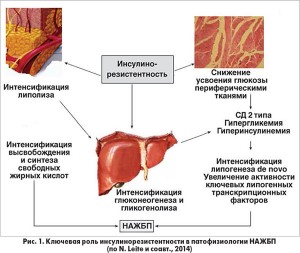
В настоящее время ключевая роль в возникновении НАЖБП отводится инсулинорезистентности (ИР) (рис. 1).
Первичным дефектом при НАЖБП является синдром ИР, развивающийся на уровне адипоцита и приводящий к увеличению липолиза. Любая степень дефицита секреции инсулина, ассоциированная с СД, способствует повышению активности липазы в жировой ткани и росту концентрации жирных кислот, циркулирующих в общем и портальном кровотоке, а также увеличению их высвобождения, накоплению в скелетной мускулатуре и печени, обусловливая тем самым снижение действия инсулина в этих тканях. ИР в мышцах скелета и печени приводит к увеличению глюконеогенеза и гликогенолиза в печени, а также уменьшению утилизации глюкозы в периферических тканях, провоцируя развитие гипергликемии. Панкреатические β-клетки адаптируются к гипергликемии посредством увеличения секреции инсулина, однако этот защитный механизм приводит к возникновению гиперинсулинемии. Гиперинсулинемия и гипергликемия также регулируются несколькими ключевыми липогенными транскрипционными факторами, включая белок, связывающий стерол-регулирующие элементы (SREBP1c), белок, связывающий углеводчувствительный элемент (ChREBP), стимулирующими синтез липидов в печени или липогенез de novo.
Стеатоз печени развивается в том случае, когда баланс между доставкой и синтезом свободных жирных кислот (СЖК) превышает способность печени к их окислению или транспортировке. Накопление липидов может оказать токсическое воздействие на гепатоциты вследствие их неэффективного окисления или активации воспаления. Несмотря на то что печеночные триглицериды (триацилглицерин), как полагают, являются протективными в отношении прогрессирования НАЖБП, некоторые метаболиты липидов (диацилтриглицерин, керамиды) могут самостоятельно вызывать повреждение клетки или даже ее гибель, а также способствовать развитию НАСГ.
СЖК окисляются в митохондриях, пероксисомах и микросомальной системе. Увеличение окисления СЖК вызывает окислительный стресс, что приводит к дальнейшему разобщению процессов митохондриального окисления и фосфорилирования и образованию большого количества активных форм кислорода. У больных НАСГ часто обнаруживаются патологически измененные митохондрии; эти нарушения делают гепатоциты более чувствительными к окислительному повреждению. Окислительный стресс, вызываемый активными формами кислорода, ускоряет перекисное окисление липидов и усиливает активность воспалительного процесса за счет увеличения регуляции основных факторов и сигнальных путей NF-κB и толл-подобных рецепторов (N. Leite и соавт., 2014).
Субклиническое системное воспаление также имеет место в патогенезе НАЖБП и НАСГ. Доказано, что больным СД с сопутствующей НАЖБП свойственен более высокий уровень циркулирующих биомаркеров воспаления, чем пациентам, страдающим СД, но не имеющим НАЖБП. Известно, что при ожирении происходит увеличение инфильтрации жировой ткани макрофагами. Эти активированные макрофаги секретируют воспалительные цитокины (фактор некроза опухоли-α, интерлейкин‑6), которые усиливают явления инсулинорезистентности посредством снижения сигнализации инсулина. Зафиксировано снижение концентрации адипонектина в сыворотке крови (гормона, секретируемого адипоцитами и обладающего гепатопротективными и противовоспалительными свойствами) у больных НАЖБП, а также более значимое падение уровня этого адипокина у пациентов с НАСГ. Снижение уровня адипонектина также свойственно лицам с СД 2 типа; гипоадипонектинемия, вероятно, является связующим звеном между дисфункцией адипоцитов и развитием НАСГ, СД.
Таким образом, современная теория развития НАЖБП и прогрессирования НАСГ базируется на сложном взаимодействии между ИР, гиперинсулинемией, оксидативным стрессом, системным и локальным воспалением в печени.
НАЖБП и СД: особенности сочетанного течения
Первоначально роль СД в развитии НАСГ/фиброза печени изучалась у пациентов, перенесших бариатрическое хирургическое вмешательство. В этих работах распространенность СД 2 типа колебалась от 14 до 28%; авторы указанных исследований признали СД предиктором развития НАСГ/фиброза печени у больных морбидным ожирением. По данным одного ретроспективного когортного исследования, в котором приняли участие пациенты с гистологически верифицированной НАЖБП (n=132), цирроз печени чаще развивался у больных СД и НАЖБП по сравнению с пациентами, страдавшими НАЖБП и не имевшими сопутствующих метаболических нарушений (Z.M. Younossi и соавт., 2004). Распространенность НАЖБП и НАСГ в обследованной когорте больных составила 46 и 12% соответственно; при этом у больных СД НАЖБП и НАСГ диагностировали значительно чаще: в 74 и 22% случаев соответственно.
Многие авторы пытались установить факторы риска развития НАЖБП у больных СД. По данным Т. Olusany и соавт. (2016), независимыми предикторами развития стеатоза печени у таких пациентов являются центральное ожирение (окружность талии >102 см; р=0,03) и дислипидемия (холестерин липопротеинов высокой плотности (ХС ЛПВП) <40 мг/дл; р=0,04). Интересно, что в нескольких небольших исследованиях, посвященных определению факторов, влияющих на гистологическую прогрессию НАЖБП, не было выявлено ни одной переменной, связанной с нарушением углеводного обмена (степень контроля гликемии, длительность СД, наличие микро-/макрососудистых осложнений) и прогрессирующим течением НАЖБП. С другой стороны, высокий уровень АЛТ, низкая концентрация ХС ЛПВП признаны предикторами НАСГ; а мужской пол, пожилой возраст, высокое содержание γ-ГТП – факторами риска развития умеренно-выраженного фиброза печени.
В одном исследовании было доказано, что не только наличие СД, но даже отягощенный наследственный анамнез по этому заболеванию является фактором риска развития НАСГ/фиброза печени у пациентов, еще не имеющих признаков нарушения углеводного обмена.
Несмотря на отсутствие очевидной связи между параметрами, характеризующими течение СД, и прогрессированием НАЖБП в вышеперечисленных исследованиях, в последнее время увеличивается количество публикаций, свидетельствующих о наличии тесной взаимосвязи между наличием НАЖБП и развитием микро- и макрососудистых осложнений у больных СД. Доказано, что выявление НАЖБП у пациентов с СД 1 и 2 типа ассоциировано с высоким уровнем микроальбуминурии, снижением скорости клубочковой фильтрации и появлением ретинопатии. В ряде проспективных исследований зафиксирована высокая распространенность хронической болезни почек у больных НАЖБП и СД 2 типа. Более того, у пациентов с СД 1 и 2 типа в сочетании с НАЖБП чаще обнаруживают маркеры субклинического атеросклероза (увеличение толщины комплекса интима-медиа сонных артерий и плотности аорты) и клинически значимую сердечно-сосудистую патологию по сравнению с больными, страдающими СД, но не имеющими НАЖБП.
Есть еще несколько важных вопросов, ответы на которые пока точно не известны: уcкоряет ли СД прогрессирование НАЖБП и затрудняет ли НАЖБП достижение контроля над гликемией у больных СД 2 типа. Результаты некоторых перекрестных исследований свидетельствуют, что наличие СД ассоциировано с быстрым развитием фиброза печени. Мнения относительно контроля гликемии противоречивы: с одной стороны, опубликованы данные, подтверждающие усиление гипергликемии вследствие уменьшения количества эндогенного инсулина, с другой стороны, имеются сведения, опровергающие эти факты.
Клиника и диагностика
Для НАЖБП характерно бессимптомное течение, поэтому наиболее часто это заболевание диагностируется при выявлении синдрома цитолиза у пациентов с такими сопутствующими заболеваниями, как ожирение, СД 2 типа, метаболический синдром. Наиболее распространенными субъективными и объективными симптомами являются слабость, усталость, дискомфорт в правом верхнем квандранте живота, гепатомегалия; наличие кожного зуда, диспепсического синдрома наряду с развитием желтухи и портальной гипертензии свидетельствует о далеко зашедшей стадии НAЖБП. В большинстве случаев НАЖБП выявляется при случайном лабораторно-инструментальном обследовании по увеличению уровня печеночных ферментов и ультрасонографическим признакам стеатоза.
В соответствии с существующей дефиницией диагноз НАЖБП устанавливается пациентам, употребляющим небольшое количество алкоголя/не принимающим спиртные напитки, у которых при гистологическом исследовании биоптатов выявляются признаки, характерные для алкогольной болезни печени. В большинстве исследований чрезмерное потребление алкоголя определяется как прием спиртных напитков в дозе >20 г/сут для женщин и >30 г/сут для мужчин (N. Leite и соавт., 2014). В руководстве, подготовленном экспертами Азиатско-Тихоокеанской рабочей группы по лечению НАЖБП, прием спиртных напитков в дозе 20 г/сут (140 г/нед) для мужчин и 10 г/сут (70 г/нед) для женщин считается допустимым «неалкогольным» уровнем потребления алкоголя.
Ранее постулировалось, что характерной особенностью НАЖБП у больных СД 2 типа являются более выраженные биохимические изменения по сравнению с пациентами, страдающими дислипидемией. Например, результаты исследования Potsdam Study (2008) продемонстрировали, что концентрации γ-ГТП и АЛТ могут считаться специфическими предикторами развития патологии печени у больных СД. Однако на протяжении последних лет появились противоположные мнения. S. Ballestri и соавт. (2016) утверждают, что повышение уровня АЛТ у больных с сочетанным течением НАЖБП и СД имеет место в клинических исследованиях, тогда как в реальной клинической практике большинству больных СД не свойственно значительное увеличение концентрации АЛТ. Поэтому эти ученые полагают, что уровень АЛТ не имеет значимого прогностического значения и не может использоваться в качестве лабораторного маркера НАСГ у больных СД.
Ряд авторов считают, что синдром обструктивного апноэ во время сна, постуральное головокружение и синкопе могут быть ранними проявлениями НАЖБП у больных СД. Обнаружение у пациентов с СД 2 типа гипоальбуминемии, повышенного уровня билирубина, тромбоцитопении, увеличения протромбинового времени может являться косвенным доказательством прогрессирования НАЖБП, вплоть до развития фиброза печени.
Инструментальная диагностика НАЖБП у больных СД такая же, как у пациентов, не имеющих нарушения углеводного обмена: для уточнения диагноза НАЖБП могут использоваться инструментальные методы (УЗИ, компьютерная томография, магнитно-резонансная томография, эластометрия), которые помогают верифицировать гепатомегалию, оценить степень стеатоза/фиброза печени и зарегистрировать формирование портальной гипертензии, цирроза.
Окончательный диагноз НАЖБП требует исключения вторичных причин развития стеатоза печени, таких как прием медикаментов (преднизолон, тамоксифен, амиодарон, метотрексат), воздействие токсинов (винилхлорид), полное парентеральное питание, кахексия, шунтирование тонкого кишечника, вирусные инфекции (вирусы гепатита С и В, вирус иммунодефицита человека).
Лечение
Современные подходы к терапии заболеваний печени и СД 2 типа базируются на принципах, предусматривающих снижение массы тела, коррекцию гипергликемии и гиперлипидемии, а также обязательную отмену гепатотоксичных препаратов. Уменьшение веса может достигаться посредством применения мер, способствующих увеличению чувствительности к инсулину: ограничения калорийности рациона и повышения физической активности. Доказано, что снижение массы тела на 5% способствует улучшению биохимических показателей и уменьшению степени стеатоза печени; а уменьшение веса на 10% ассоциировано со значительным снижением активности воспалительного процесса, уменьшением степени баллонной дистрофии гепатоцитов.
В соответствии с недавно опубликованными рекомендациями ЕASL (Европейской ассоциации по изучению печени) по лечению НАЖБП (2016) фармакотерапия этой патологии должна начинаться только при обнаружении выраженного фиброза (стадия F2 и выше). Однако эксперты EASL сделали следующую оговорку: «При условии высокой вероятности прогрессирования заболевания (наличии сопутствующего СД, метаболического синдрома, периодическом повышении уровня АЛТ, высокой активности воспалительного процесса) необходимо предусмотреть возможность более раннего начала медикаментозной терапии». Для лечения НАЖБП представители ЕASL рекомендуют использовать пиоглитазон, витамин Е или их комбинацию, а также статины, n‑3-полиненасыщенные жирные кислоты.
Роль эссенциальных фосфолипидов
Несмотря на то что современные рекомендации EASL не предусматривают назначение гепатопротекторов для лечения НАЖБП, многие ученые считают целесообразным применение препаратов с цитопротективным и антиоксидантным действием, так как коррекция функционального состояния гепатоцитов может способствовать увеличению эффективности терапии за счет косвенного воздействия на степень ИР. К такому выводу пришли K. Gundermann и соавт. (2016), представившие обзор данных литературы, раскрывающих преимущества применения эссенциальных фосфолипидов (ЭФЛ) в терапии НАЖБП.
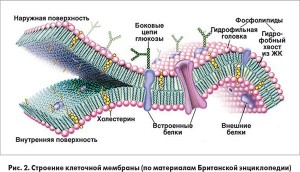
Рассматривая физико-химические свойства фосфолипидов, ученые подчеркивают, что главная функция этих сложных липидов – структурная; они являются важнейшим элементом клеточных мембран (рис. 2).
Фосфолипиды клеточных мембран представлены преимущественно фосфатидилхолинами. Благодаря поддержанию структурной целостности, пластичности и «текучести» мембран различных органелл фосфатидилхолин не только обеспечивает целостность последних, но и поддерживает нормальную работу белков-транспортеров, ферментов, катализирующих процессы окисления, клеточного дыхания, окислительного фосфорилирования, поддержания клеточного градиента.
K. Gundermann подчеркивает, что фосфатидилхолин, применяемый в медицинской практике, содержит большое количество полиненасыщенных жирных кислот, его также могут называть полиенилфосфатидилхолином (ПВХ) (применение этого термина подчеркивает, что в препарате содержится высокоочищенный экстракт семян сои со стандартизированным содержанием (72-96%) 3-sn-фосфатидилхолина). В организм человека полиненасыщенные жирные кислоты поступают главным образом в составе растительных масел. Для создания лекарственных средств ПВХ экстрагируют из соевых бобов; в составе препаратов 50% ПВХ приходится на 1,2-дилинолеоилфосфатидилхолин (ДЛФХ): именно это вещество обладает наиболее высокой биодоступностью и выступает в качестве активного ингредиента лекарств, созданных на основе ЭФЛ. Такая высокая концентрация ДЛФХ является основным различием между оригинальными ЭФЛ, ПФХ и типичными фосфолипидами, а также фосфатидилхолином, поступившим с едой или синтезированным в организме.
Известно, что фосфолипиды формируют двухслойную клеточную мембрану благодаря своей текучести и биологической активности. По мнению K. Gundermann и соавт. (2016), эффективность ЭФЛ в терапии различных заболеваний печени подтверждается не только способностью ДЛФХ встраиваться в поврежденные участки мембраны, улучшая тем самым регенерацию печени, и заменять эндогенные, менее ненасыщенные молекулы фосфатидилхолина, но и свойством ДЛФХ увеличивать текучесть мембраны и ее функционирование. В ходе клинических и экспериментальных исследований доказано, что ЭФЛ улучшают мембранно-зависимые функции клетки, обладают противовоспалительными, антифибротическими, апоптоз-модулирующими, регенеративными, протективными свойствами.
Клиническая эффективность ЭФЛ при НАЖБП
Начиная с 1968 г. и по настоящее время было проведено 53 исследования, посвященных изучению эффективности ЭФЛ в лечении НАЖБП, из них 45 были опубликованы после 2000 г.; 28 исследований являлись рандомизированными открытыми контролированными, 3 – двойными слепыми. В этих исследованиях дозировка пероральных ЭФЛ варьировала от 1,05 до 1,8 г/сут, длительность лечения колебалась от 4 нед до 24 мес (в большинстве случаев курс лечения составлял 3-6 мес).
В рассматриваемом обзоре K.Gundermann и соавт. (2016) приводят результаты рандомизированного плацебо-контролированного двойного слепого исследования, в котором принимали участие больные СД и НАЖБП. В соответствии с дизайном этого исследования пациентам, вошедшим в состав основной группы, рекомендовали ЭФЛ, больным контрольной группы назначали плацебо на протяжении 6 мес. Кроме того, 5 пациентов из группы плацебо и 7 участников основной группы получали толбутамин. По завершении 6-месячного срока терапии исследователи зафиксировали уменьшение размеров печени в обеих группах, но только в основной группе эти изменения носили достоверный характер. Гистологическое исследование биоптатов печени дало следующие результаты: значимое улучшение наблюдалось у 4 пациентов, получавших ЭФЛ, и только у 1 больного, принимавшего плацебо. Несмотря на то что у этого пациента в образцах биопсии, полученных после завершения лечения, не отмечались явления жировой инфильтрации, впоследствии у него развился цирроз печени. Еще у одного больного, получавшего ЭФЛ, у которого по результатам повторной биопсии отмечено прогрессирование жировой инфильтрации, выявлены морфологические признаки фиброза в портальном тракте. Проводимая терапия способствовала уменьшению выраженности гистологических признаков стеатоза печени у 7 пациентов, принимавших ЭФЛ, и 4 больных из группы плацебо, включая пациента с развившимся впоследствии циррозом. Прием ЭФЛ способствовал достоверному снижению уровня γ-ГТП через 1, 3 и 6 мес терапии; в контрольной группе динамика этого показателя была статистически недостоверной. На протяжении всего исследования сывороточные концентрации трансаминаз и общего билирубина находились в пределах нормативных значений.
Кроме этого исследования, 7 других клинических испытаний подтвердили благотворное влияние ЭФЛ на течение НАЖБП у больных СД. Yin и Kong рекомендовали 185 пациентам соблюдать стандартные диетические рекомендации, принимать пероральные гипогликемические препараты и выполнять умеренную физическую нагрузку. Одним больным (n=125) дополнительно назначили ЭФЛ, другим пациентам – плацебо. По завершении 3-месячного курса лечения в группе ЭФЛ отмечены достоверное улучшение/нормализация ряда биохимических показателей (АЛТ, общего холестерина, триглицеридов, холестерина липопротеинов низкой и высокой плотности): указанная динамика зарегистрирована у 90,2% больных из группы ЭФЛ и 51% пациентов контрольной группы (р<0,05). На фоне проводимой терапии в обеих группах отмечено улучшение уровня гликемии натощак, но межгрупповые различия оказались статистически недостоверными.
В исследовании, проведенном Poongothai и соавт., приняли участие 22 больных НАЖБП и СД. Кроме соблюдения стандартных диетических рекомендаций, 22,7% больных получали метформин, 22,7% пациентов дополнительно принимали производные сульфонилмочевины, 45,5% участникам назначали два вышеуказанных препарата, 9% больных находились на инсулинотерапии. В качестве гепатопротектора больным назначали ЭФЛ на протяжении 6 мес. УЗИ, проведенное после окончания лечения, зафиксировало улучшение состояния печени у 54,5% больных, у 40,9% пациентов не было зарегистрировано каких-либо сонографических изменений, в 1 случае отмечено ухудшение состояния больного. Уровни трансаминаз и γ-ГТП под влиянием терапии ЭФЛ значительно улучшились.
Ohbayashi и соавт. назначали пациенткам, страдавшим НАСГ, 7-месячный курс лечения стимулятором секреции инсулина (натеглинидом), по завершении которого больным рекомендовали дополнительный прием ЭФЛ на протяжении 2 лет. Исследователи зафиксировали улучшение значений индекса НОМА, сонографической картины печени и почек, нормализацию уровня трансаминаз, γ-ГТП, ферритина. Анализ биоптатов печени, выполненный с использованием критериев Brunt, доказал значимое улучшение состояния органа после 9 мес терапии ЭФЛ: уменьшилась выраженность стеатоза и баллонной дистрофии гепатоцитов, нивелированы явления воспаления.
В одном двойном слепом исследовании эффективность 3-месячной терапии ЭФЛ сравнивалась с результативностью приема урсодезоксихолевой кислоты (УДХК). Пациенты, вошедшие в состав основной группы, страдали СД и НАЖБП (n=10), группу сравнения составили больные НАЖБП и морбидным ожирением (ИМТ=30 кг/м2). В исследовании не принимали участие пациенты с сердечно-сосудистой патологией, заболеваниями печени, отличными от стеатоза, осложнениями СД (включая кетоацидоз), беременные и кормящие женщины, пациенты, злоупотреблявшие алкоголем. Прием других медикаментов во время проведения исследования прекращался. ЭФЛ оказались более эффективными, чем УДХК: 45% пациентов, получавших ЭФЛ, были удовлетворены результатами проведенной терапии (уменьшилась выраженность таких клинических симптомов, как тошнота, общее недомогание, абдоминальное вздутие), тогда как в группе сравнения результатами лечения были довольны всего 30% больных. По результатам УЗИ, проведенного через 12 нед, у 20% пациентов, получавших ЭФЛ, и 10% больных, принимавших УДХК, зафиксировано улучшение состояния печени. Терапия ЭФЛ позволила добиться более значимого снижения уровня АЛТ и щелочной фосфатазы, тогда как прием УДХК был ассоциирован только со снижением концентрации АЛТ, но не АСТ, щелочной фосфатазы.
Следует отметить результаты еще одного исследования, выполненного под руководством А. Dajani (2016). Исследователи сформировали три группы больных: в состав 1-й группы вошли пациенты с изолированной НАЖБП (n=113), 2-я группа была представлена пациентами с НАЖБП и СД 2 типа (n=107), пациенты со смешанной гиперлипидемией составили 3 группу (n=104). Всем пациентам рекомендовали придерживаться стандартных диетических рекомендаций и увеличить физическую активность. ЭФЛ назначали в дозе по 2 капсулы 3 раза в день на протяжении 24 нед, затем дозу уменьшали до 1 капсулы 3 раза в день в течение 48 нед. Впоследствии оказалось, что назначение ЭФЛ способствует значительному уменьшению клинической симптоматики и снижению средних значений АЛТ до 50,8 МЕ/пациент, АСТ – до 46,1 МЕ/пациент (р<0,01). Контрольное УЗИ органов брюшной полости подтвердило нормализацию размеров печени (4,6% случаев) и трансформацию заболевания со II стадии в I (24% больных). Терапия ЭФЛ способствовала уменьшению жесткости печени у 21,1% больных (среднее значение этого показателя составило 3,1 кПа/пациент). Исследователи подчеркнули, что уменьшение дозировки ЭФЛ после завершения 6-месячного курса терапии привело к рецидиву заболевания у 43,8-63,2% больных с изолированным и сочетанным течением НАЖБП.
Выводы
НАЖБП имеет высокую распространенность среди больных СД 2 типа. Наличие НАЖБП у пациента с СД 2 типа может не диагностироваться, а прогноз заболевания – недооцениваться. Доказано, что у больных СД 2 типа течение НАЖБП более агрессивное, чем у лиц, не страдающих СД. Важным аспектом терапии сочетанной патологии является применение препаратов, способных улучшать функцию печени и воздействовать на патогенетические механизмы формирования НАЖБП при СД. В этом отношении перспективным является назначение препаратов, содержащих оригинальные ЭФЛ.
Литература
1. Scorletti E. Extrahepatic Diseases and NAFLD: The Triangular Relationship between NAFLD, Type 2-Diabetes and Dysbiosis. Dig Dis. 2016; 34 Suppl 1: 11-8. doi: 10.1159/000447276. Epub 2016 Aug 22.
2. Younossi Z.M. The economic and clinical burden of nonalcoholic fatty liver disease in the United States and Europe. Hepatology. 2016 Aug 20. doi: 10.1002/hep.28785. [Epub ahead of print].
3. Ballestri S. Type 2 Diabetes in Non-Alcoholic Fatty Liver Disease and Hepatitis C Virus Infection-Liver: The «Musketeer» in the Spotlight. Int. J. Mol. Sci. 2016, 17, 355; doi: 10.3390/ijms17030355.
4. Nathalie C. Leite. Non-alcoholic fatty liver disease and diabetes: From physiopathological interplay to diagnosis and treatment. World J Gastroenterol 2014 July 14; 20 (26): 8377-8392.
5. Musso G. Meta-analysis: natural history of non-alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non-invasive tests for liver disease severity. Ann Med. 2011 Dec; 43 (8): 617-49. doi: 10.3109/07853890.2010.518623. Epub 2010 Nov 2.
6. Ballestri S. Nonalcoholic fatty liver disease is associated with an almost twofold increased risk of incident type 2 diabetes and metabolic syndrome. Evidence from a systematic review and meta-analysis. J Gastroenterol Hepatol. 2016 May; 31(5): 936-44. doi: 10.1111/jgh.13264.
7. Sung K.C. Resolution of fatty liver and risk of incident diabetes. J Clin Endocrinol Metab. 2013 Sep; 98(9): 3637-43. doi: 10.1210/jc.2013-1519. Epub 2013 Jul 19.
8. Ekstedt M. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology. 2006 Oct; 44 (4): 865-73.
9. Olusany Т. Non alcoholic fatty liver disease in a Nigerian population with type II diabetes mellitus. Pan African Medical Journal. 2016; 24:20 doi: 10.11604/pamj.2016.24.20.8181.
10. Seetlani N.K. Frequency of Non-Alcoholic Steatohepatitis on Histopathology in Patients of Type 2 Diabetes Mellitus with Duration of More than 5 Years. J Coll Physicians Surg Pak. 2016 Aug; 26 (8): 643-6. doi: 2395.
11. Targher G. Prevalence of non-alcoholic fatty liver disease and its association with cardiovascular disease in patients with type 1 diabetes. J Hepatol 2010; 53: 713-718 [PMID: 20619918 DOI: 10.1016/j.jhep.2010.04.030].
12. Younossi Z.M. Nonalcoholic fatty liver disease in patients with type 2 diabetes. Clin Gastroenterol Hepatol 2004; 2: 262-265 [PMID: 15017611 DOI: 10.1053/S1542-3565(04)00014-X].
13. Gundermann K.-J. Essential phospholipids in fatty liver: a scientific update. Clinical and Experimental Gastroenterology 2016: 9 105-117.
14. Dajani A. Essential phospholipids as a supportive adjunct in the management of patients with NAFLD. Arab Journal of Gastroenterology. Volume 16, Issues 3-4, September-December 2015, pages 99-104.