6 грудня, 2016
Первичный склерозирующий холангит
Эпидемиология
Около 60% больных первичным склерозирующим холангитом (ПСХ) – лица мужского пола (средний возраст – 41 год). Заболеваемость ПСХ составляет 0-1,3 случая на 100 тыс. населения, распространенность варьирует в пределах от 0 до 16,2 случая на 100 тыс. Результаты исследований, проведенных в Северной Европе, свидетельствуют о неуклонном росте показателей распространенности и заболеваемости ПСХ. В настоящее время окончательно не ясно, с чем связано это повышение: с увеличением грамотности врачей, с улучшением качества диагностики либо с применением современных методов обследования (эндоскопическая ретроградная холангиопанкреатография, ЭРХПГ, магнитно-резонансная холангиопанкреатография, МРХПГ).
Клиника
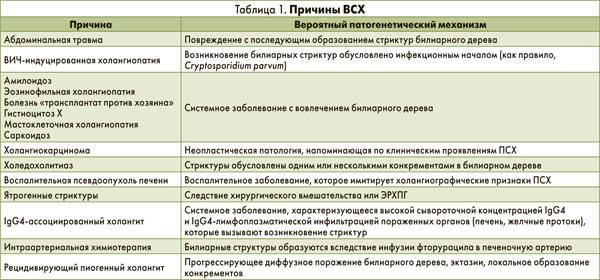
ПСХ – коварное заболевание: более половины пациентов с указанной патологией не предъявляют никаких жалоб, а подтвердить диагноз даже после получения результатов печеночных проб бывает непросто. Наиболее часто при объективном осмотре обнаруживают гепато- (44% случаев) и спленомегалию (39%). Если течение заболевания сопровождается появлением жалоб, то среди них доминируют абдоминальная боль (20% случаев), зуд (10%), желтуха (6%), усталость (6%). Диагностические критерии ПСХ включают увеличение сывороточной концентрации щелочной фосфатазы (ЩФ), персистирующее более 6 мес, а также холангиографические признаки стриктур билиарного дерева. В случаях, когда течение заболевания сопровождается возникновением стриктур желчных протоков, подтверждаемых данными МРХПГ или ЭРХПГ, необходимо исключить вторичный склерозирующий холангит (ВСХ; табл. 1).
Проведение биопсии печени не является обязательным, за исключением тех случаев, когда существует подозрение на поражение мелких желчных протоков или имеет место сочетанное течение ПСХ и аутоиммунного гепатита (АИГ). Магнитно-резонансная или транзиторная эластография печени – перспективные неинвазивные методы исследования, в ходе которых оцениваются механические свойства ткани (фиброз), однако их специфическая роль в оценке степени фиброза печени у больных ПСХ еще окончательно не определена.
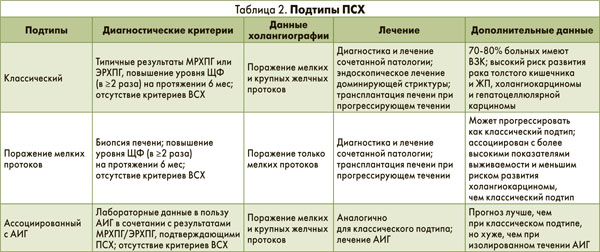
Выделяют несколько подтипов ПСХ. Классический подтип, при котором в патологический процесс вовлекается все билиарное дерево, диагностируют у 90% больных ПСХ; у 5% пациентов патологический процесс локализуется только в мелких внутрипеченочных желчных протоках. Перекрестный синдром ПСХ и АИГ выявляют у 35% детей с ПСХ и у 5% взрослых с данной патологией.
Клиническая манифестация и характер прогрессирования ПСХ могут отличаться в зависимости от подтипа заболевания (табл. 2). Так, у пациентов с преимущественным поражением мелких внутрипеченочных желчных протоков течение заболевания более благоприятное, чем у лиц с классическим вариантом ПСХ. В то же время в отличие от больных с сочетанием ПСХ и воспалительных заболеваний кишечника (ВЗК) пациенты, у которых ПСХ не сопровождается развитием ВЗК, могут иметь различные подтипы заболевания. Является ли указанная комбинация случайным совпадением или нет, в настоящее время окончательно не ясно, поскольку ВЗК может развиться спустя несколько лет после подтверждения ПСХ или трансплантации печени.
Примерно у 10% больных ПСХ выявляют высокие сывороточные концентрации IgG4; прогноз для жизни у таких пациентов хуже, чем у лиц с нормальным содержанием этого иммуноглобулина. Таких пациентов не стоить путать с больными, страдающими IgG4-ассоциированным холангитом (системное заболевание, характеризующееся высоким уровнем IgG4 в сыворотке крови и IgG4-положительной лимфоплазматической инфильтрацией различных органов – поджелудочной железы, желчных протоков, резким началом (с появления желтухи), возникновением билиарных стриктур, отвечающих на лечение глюкокортикоидами (преднизолон 40 мг/сут), отсутствием ВЗК). В настоящее время не существует биомаркеров, с помощью которых можно было бы точно прогнозировать характер прогрессирования какого-либо подтипа ПСХ. Однако уровень сывороточной ЩФ в 1,5 раза меньше верхней границы нормы ассоциирован с лучшим прогнозом, чем уровень ЩФ, превышающий эту границу в ≥1,5 раза. В настоящее время до конца не ясно, является ли концентрация ЩФ надежной суррогатной конечной точкой для клинических исследований или же предиктором долгосрочного прогноза при ПСХ.
Как правило, ПСХ прогрессирует медленно, с переменными результатами. По данным одного популяционного исследования, выживаемость пациентов с ПСХ, находившихся на стационарном лечении в 44 нидерландских больницах, была выше, чем средняя выживаемость больных, терапия которых осуществлялась в 3 трансплантационных центрах этой страны (21,3 vs 13,2 года соответственно; р<0,001). Эти данные, вероятно, объясняются направлением в высокоспециализированные учреждения тяжелобольных пациентов, нуждающихся в трансплантации печени.
Бактериальный холангит, являющийся первым клиническим проявлением ПСХ у 6% пациентов, может иметь рецидивирующее течение и плохо поддаваться терапии, в большинстве случаев необходима трансплантация печени. В исследовании, в котором приняли участие 273 пациента (средняя длительность наблюдения составила 76 мес), доминирующая стриктура (сужение внепеченочного протока <1,5 мм) имела место у 40% больных и, по всей видимости, была ассоциирована с развитием неоплазии у 15 из 20% пациентов. Таким образом, обнаружение доминирующей стриктуры должно насторожить медицинский персонал и рассматриваться как повод для дальнейшего углубленного обследования. Дифференцировать доброкачественный и злокачественный характер доминирующей стриктуры достаточно сложно, несмотря на внедрение метода флуоресцентной гибридизации in situ.
ПСХ часто сопровождается появлением различных сопутствующих заболеваний. Принимая во внимание тот факт, что ВЗК (чаще диагностируют неспецифический язвенный колит – НЯК, а не болезнь Крона) развиваются у большинства пациентов с ПСХ, колоноскопия является оправданным методом диагностики для всех больных, которым впервые установлен диагноз ПСХ. По данным одного исследования, практически у всех лиц с сочетанным течением ПСХ и ВЗК (НЯК или болезнь Крона) имеет место тотальное поражение толстого кишечника, в единичных случаях диагностируются ретроградный илеит (язвенно-воспалительные изменения в терминальном отделе подвздошной кишки у больных НЯК) и незначительное поражение прямой кишки. Риск развития рака толстого кишечника у пациентов с ПСХ и сопутствующим ВЗК в 4 раза выше, чем у лиц с изолированным течением ВЗК, и в 10 раз превышает таковой в общей популяции.
Патология желчного пузыря (ЖП; конкременты, полипы, рак) часто диагностируется у больных ПСХ. Конкременты ЖП обнаруживают у 25% больных, новообразования – у 6-14% пациентов. Около 60% опухолей ЖП являются аденокарциномами; в одном исследовании показано, что при гистологическом исследовании ЖП, удаленных у больных ПСХ до или во время трансплантации печени, в 37% случаев выявили признаки дисплазии, а в 14% случаев – аденокарциномы. В экономически развитых странах ПСХ является основным фактором риска развития холангиокарциномы: вероятность возникновения этой патологии у пациентов с ПСХ в 400 раз выше, чем в общей популяции. Ежегодный риск развития холангиокарциномы у больных ПСХ составляет 2%, 30-летняя кумулятивная заболеваемость – 20%. Внезапное изменение клинической симптоматики (неожиданное появление желтухи, лихорадки, снижение массы тела) или биохимических показателей (ранее не отмечавшийся рост ЩФ и/или билирубина с прогрессирующим повышением сывороточной концентрации опухолевого маркера СА 19-9 или без такового) является показанием для дополнительного углубленного исследования.
Дополнительные исследования включают ультразвуковое исследование (УЗИ), магнитно-резонансную томографию печени в сочетании с ЭРХПГ. Несмотря на то что достоверные биомаркеры вероятного развития холангиокарциномы у больных ПСХ пока не установлены, многие клиницисты рекомендуют ежегодно проводить УЗИ печени и определять СА 19-9.
Больные ПСХ могут страдать остеопорозом. В одном масштабном исследовании (n=237) примерно 15% пациентов страдали остеопорозом (значения Т-показателя <-2,5). Возраст >54 лет, индекс массы тела ≤24 кг/м2, длительный анамнез ВЗК (≥19 лет) коррелировали с развитием остеопороза.
Патогенез
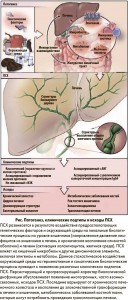
Наследственность, а также воздействие окружающей среды являются основными этиологическими факторами ПСХ, вовлеченными в патогенез заболевания (рис.).
Согласно существующей гипотезе после воздействия неопределенного фактора внешней среды при наличии генетической предрасположенности создаются условия для персистирующего поражения холангиоцитов (клеток, выстилающих желчные протоки), что приводит к воспалению желчных протоков и инициации фиброзных изменений.
Лечение
Ведение больных ПСХ является сложной задачей: необходимо назначить терапию как для первичной патологии печени, так и для сопутствующих заболеваний, а также предусмотреть последующее лечение вероятных осложнений на терминальной стадии болезни. Пациентов с прогрессирующим течением ПСХ (в том числе больных с рефрактерными симптомами или холангиокарциномой) целесообразнее лечить в условиях высокоспециализированных центров, где используется интегрированный, мультидисциплинарный подход с участием команды специалистов (гепатологов, гастроэнтерологов, эндоскопистов, рентгенологов, хирургов-трансплантологов).
До настоящего времени эффективная медикаментозная терапия ПСХ не разработана, несмотря на большое количество клинических исследований, которые проводились на протяжении нескольких десятилетий. С учетом того, что патогенез ПСХ продолжает изучаться, определить терапевтические цели и подобрать эффективные схемы лечения непросто. Кроме того, ПСХ – достаточно редкое заболевание, гетерогенное по своему характеру, характеризующееся отсутствием надежных биомаркеров. Все это затрудняет проведение должной стратификации пациентов и определение конечных точек, необходимых для адекватного проведения клинических исследований.
Эффективность урсодезоксихолевой кислоты (УДХК) в лечении ПСХ изучалась во многих испытаниях. В одном рандомизированном двойном слепом плацебо-контролированном исследовании у пациентов, получавших УДХК, зафиксировано снижение уровня печеночных ферментов, при этом показатели выживаемости практически не отличались от таковых у больных, принимавших плацебо. По данным другого рандомизированного двойного слепого плацебо-контролированного исследования, риск достижения первичной конечной точки (летальный исход, трансплантация печени, минимальные критерии для трансплантации печени, цирроз, варикозно расширенные вены (ВРВ) пищевода или желудка, холангиокарцинома), был в 2,3 раза выше у пациентов, получавших высокие дозы УДХК (25 мг/кг/сут) по сравнению с соответствующим показателем у больных, принимавших плацебо (р<0,01). Поэтому существующие рекомендации по лечению ПСХ являются противоречивыми: Американская ассоциация по изучению болезней печени (AASLD) не поддерживает применение УДХК, Американская коллегия гастроэнтерологов (ACG) допускает возможность назначения УДХК при условии использования стандартных суточных доз, а Европейская ассоциация по изучению печени (EASL) поощряет применение УДХК в умеренной дозировке (13-15 мг/кг/сут). Учитывая противоречивость рекомендаций, по нашему мнению, следует назначать УДХК в дозе 13-15 мг/кг/сут на протяжении 6 мес под контролем активности печеночных ферментов. Если на протяжении указанного отрезка времени не происходит снижения концентрации ЩФ, предлагаем прекратить терапию и наблюдать за состоянием пациента либо включить больного в клиническое исследование.
В настоящее время продолжает изучаться эффективность новых препаратов в лечении ПСХ. Так, обетихолевая кислота, которая представляет собой полусинтетический аналог хенодезоксихолевой кислоты и является потенциальным лигандом для фарнезоидного Х-рецептора, оказывает выраженное антифибротическое действие. В данный момент проводится клиническое исследование, в котором этот препарат назначается больным ПСХ. Дизайн другого испытания предполагает применение симтузумаба, моноклонального антитела против одного из профибротических белков – лизилоксидазоподобному ферменту (Loxl2). Изучается также эффективность 24-нор-УДХК – синтетической желчной кислоты, способствующей возникновению бикарбонатного холереза, индуцированного желчными кислотами; предполагается, что она может быть полезна пациентам с фиброзом печени.
Уменьшение чувствительности холангиоцитов к потенциально токсичным желчным кислотам может быть достигнуто посредством ингибирования апикального натрийзависимого транспортера желчных кислот в подвздошной кишке. В экспериментальной модели с участием лабораторных животных было показано, что снижение экспрессии печеночного профибротического гена, увеличение экспрессии противовоспалительного и антифибротического генов, а также снижение размеров пула и изменение состава желчных кислот приводят к улучшению гистологической картины печени.
В другом исследовании изучается ВТТ1023 – человеческое моноклональное антитело, которое нацелено на белок сосудистой адгезии 1 типа (молекула адгезии, необходимая для осуществления эффекта возвращения Т-клеток в кишечник). Тестируется гипотеза относительно целесообразности назначения пероральных антибиотиков в качестве дополнительного метода лечения: предполагается, что воздействие на кишечную микробиоту позволит уменьшить интенсивность врожденных иммунных реакций, играющих решающее значение в развитии билиарного воспаления и фиброза. По данным одного небольшого испытания, прием ванкомицина способствовал уменьшению уровня ЩФ к 12-й неделе терапии; в настоящее время продолжается исследование, в рамках которого изучается эффективность этого препарата у детей, больных ПСХ. В стадии планирования находится работа, предполагающая трансплантацию фекальной микробиоты больным ПСХ (интестинальный микробиом может быть вовлечен в патогенез этого заболевания).
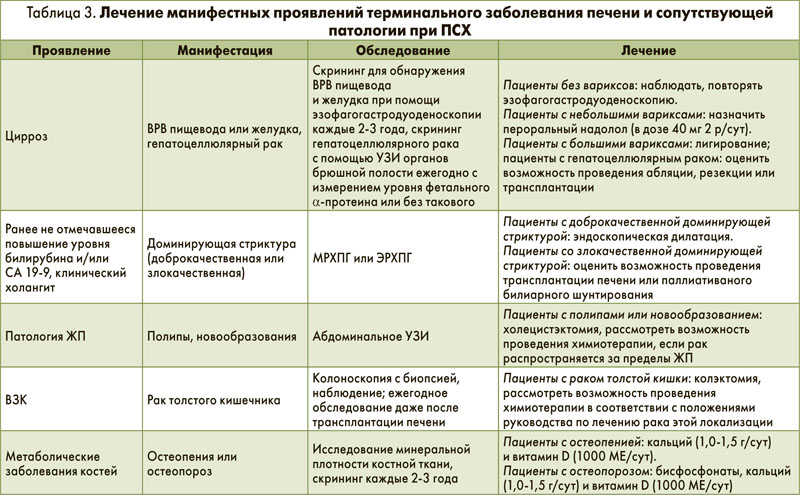
Лечение осложнений, возникающих на терминальной стадии ПСХ, а также терапия ассоциированных и сопутствующих заболеваний описаны в таблице 3.
Лечение больных с сочетанным течением ПСХ и ВЗК должно назначаться в соответствии с положениями существующих руководств.
Пациентам с ВЗК, перенесшим трансплантацию печени, следует ежегодно проводить колоноскопию с биопсией, учитывая высокий риск развития колоректального рака. Больным, не имеющим сопутствующего ВЗК, колоноскопию необходимо проводить 1 раз в 5 лет, учитывая риск развития поражения кишечника. Рекомендуется ежегодное УЗИ ЖП для обнаружения полипов или других опухолевых образований. С учетом риска возникновения неоплазий пациентам с опухолевым образованием ЖП любого размера должна быть рекомендована холецистэктомия. Показатель 5-летней выживаемости без рецидивов заболевания у лиц с ПСХ и перипортальной холангиокарциномой, перенесших трансплантацию печени после неоадъювантной химио- и лучевой терапии, составляет 65%.
В связи с прогрессирующим течением ПСХ около 40% пациентов будут нуждаться в трансплантации печени. Примечательно, что 6% трансплантаций, проведенных в США с 1988 по 2015 год, были выполнены по такому показанию, как ПСХ. Эти статистические данные заслуживают пристального внимания: с учетом редкости заболевания (1 случай на 10 тыс. населения) они подчеркивают экономическое бремя ПСХ (ежегодно на проведение трансплантации печени при ПСХ в США расходуется 125 млн долларов) и ургентную потребность в назначении эффективной медикаментозной терапии.
Показатели годичной выживаемости после трансплантации печени при ПСХ составляют примерно 85%, 5-летней выживаемости – 72%.
К сожалению, в 25% случаев заболевание может рецидивировать даже после трансплантации печени. Рецидив ПСХ диагностируется на основании данных холангиографии в отсутствие явлений отторжения печени или сосудистой патологии (ишемии) в пересаженном органе. По данным одного исследования, проведение колэктомии при сочетанном течении ПСХ и ВЗК перед трансплантацией печени может снизить вероятность рецидива ПСХ после вмешательства.
ПСХ является заболеванием с окончательно не выясненным патогенезом, эффективная медикаментозная терапия данной патологии еще не разработана. Для лучшего понимания патогенеза ПСХ и разработки новых методов лечения при проведении больших исследований с участием хорошо фенотипированных когорт пациентов, а также при выполнении экспериментальных модельных (животные, органеллы) работ необходимо придерживаться объективных, так называемых -омик-подходов (геномика, эпигеномика, протеомика).
Статья печатается в сокращении.
Lazaridis K. N., LaRusso N. F. Primary Sclerosing Cholangitis. N Engl J Med 2016; 375: 1161-1170.
Перевела с англ. Лада Матвеева
Медична газета «Здоров’я України 21 сторіччя» № 20 (393), жовтень 2016 р.