3 листопада, 2016
Новое в ведении пищевода Барретта

После первого описания в 1959 г. пищевода Барретта (ПБ) определение этого заболевания несколько раз пересматривалось. В настоящее время под ПБ понимают состояние, при котором предрасполагающий к развитию рака метапластический столбчатый эпителий любой протяженности замещает плоский эпителий, в норме выстилающий пищевод. Поскольку риск развития злокачественного новообразования достоверно повышает только кишечная метаплазия (с бокаловидными клетками), ее наличие необходимо для установления диагноза. Тем не менее некоторые научные сообщества полагают, что наличие кардиальной слизистой оболочки (с муцинпродуцирующими столбчатыми клетками без бокаловидных клеток) также позволяет диагностировать ПБ. Однако злокачественный потенциал при наличии этого типа эпителия в пищеводе остается неясным, поэтому в подобных случаях использовать термин «пищевод Барретта» в целом не рекомендуется.
Эпидемиология и клинические вопросы
В общей взрослой популяции распространенность ПБ составляет 2-7%, заболеваемость варьирует от 23,1 до 32,7% на 100 тыс. Пищевод Барретта выявляется у 4% пациентов, подвергшихся эндоскопии верхних отделов гастроинтестинального тракта, и у 9% мужчин старше 50 лет.
К факторам риска развития ПБ относят наличие тяжелого и длительно существующего гастроэзофагеального рефлюкса (при котором значимую роль играет воздействие желчи и панкреатического сока), старший возраст, мужской пол, европеоидная раса, ожирение и потребление табака. Защитные факторы, снижающие риск развития ПБ, включают применение нестероидных противовоспалительных препаратов, Helicobacter pylori, высокое потребление фруктов и овощей.
Несмотря на отсутствие каких-либо клинических проявлений, ПБ является важнейшим известным фактором риска развития аденокарциномы пищевода (АП). В странах Запада за последние 40 лет заболеваемость раком этой локализации увеличилась в 4 раза, и АП занял первое место по росту смертности от злокачественных новообразований. У пациентов с ПБ риск их развития составляет примерно 0,5% в год, что на 40-50% выше по сравнению с общей популяцией.
Каскад злокачественной дегенерации предположительно начинается с недиспластической кишечной метаплазии, затем развиваются дисплазия низкой степени (ДНС), дисплазия высокой степени (ДВС) и в итоге – АП. Риск прогрессирования ДНС до ДВС или АП составляет 0,5-13,4% в год, риск прогрессирования ДВС в АП – 6-19% в год.
Скрининг
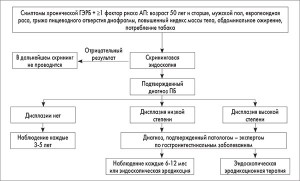
Высококачественные доказательства, на основе которых можно было бы разработать рекомендации по скринингу, на сегодня отсутствуют. Тем не менее скрининг ПБ может быть целесообразным у пациентов с хроническими симптомами гастроэзофагеальной рефлюксной болезни (ГЭРБ), имеющих по крайней мере 1 дополнительный фактор риска развития АП. Такими факторами являются возраст ≥50 лет, мужской пол, европеоидная раса, грыжа пищеводного отверстия диафрагмы, абдоминальное ожирение и потребление табака.
Эндоскопический диагноз
Гастроэзофагеальное соединение (ГЭС) не имеет четкого анатомического определения; ГЭС принято считать проксимальную границу складок желудка при его частичной инсуффляции. Плоскоклеточный эпителий пищевода имеет бледно-розовую окраску, в отличие от красного столбчатого эпителия слизистой желудка. Критериями диагноза ПБ является распространение столбчатого эпителия выше ГЭС и наличие столбчатой метаплазии, подтвержденной по данным биопсии пищевода.
В зависимости от протяженности метапластического эпителия ПБ разделяется на коротко- (<3 см) и длинносегментный (≥3 см). Тем не менее клиническая значимость этого разделения не установлена, поскольку отсутствуют четкие доказательства связи протяженности метапластического сегмента и риска возникновения рака. Более современной является Пражская классификация, при которой эндоскопически оценивается протяженность метаплазии по окружности пищевода (C) и ее максимальная протяженность (M). Эндоскопическое исследование не позволяет дифференцировать кишечную метаплазию от желудочной или распознавать дисплазию, поэтому для постановки диагноза в любом случае необходимо исследование биоптата.
Наблюдение
Несмотря на отсутствие соответствующих рандомизированных контролируемых исследований, пациентов с ПБ целесообразно наблюдать, поскольку в опубликованных исследованиях активное наблюдение коррелировало с более ранней диагностикой рака и лучшей выживаемостью. С другой стороны, эффективность периодических обследований ограничивается относительно низкой частотой рака у пациентов с ПБ, а также сложностями в интерпретации наличия дисплазии (вследствие случайного забора образцов, вероятности ложноотрицательных результатов при гистологическом исследовании биоптатов и высокой вариабельности при интерпретации дисплазии). Большинство клинических руководств все же рекомендуют эндоскопическое наблюдение пациентов с ПБ с целью ранней диагностики ДНС и ее прогрессирования в ДВС или раннюю стадию рака (при этом метастазы в лимфоузлах присутствуют в 0-2% случаев). Однако чтобы установить, действительно ли эта стратегия снижает риск развития или смертность от рака, необходимы соответствующие долгосрочные исследования.
Для оптимальной оценки ПБ настоятельно рекомендуется использовать эндоскопические аппараты с высокой разрешающей способностью. Четырехквадрантная биопсия должна осуществляться с шагом 2 см или даже 1 см (при известной или предполагаемой дисплазии). Дополнительно следует проводить биопсию всех подозрительных очагов.
Более сложные методы визуализации, такие как хромоэндоскопия, электронная хромоэндоскопия и конфокальная лазерная эндомикроскопия, не превосходят стандартную эндоскопию с белым светом и поэтому не рекомендуются для рутинного применения. Однако эти методы могут быть полезными для прицельной биопсии подозрительных в плане дисплазии очагов.
При отсутствии дисплазии после 2 эндоскопий, проведенных с интервалом 6-12 мес, это исследование рекомендуется повторить через 3-5 лет. При выявлении дисплазии промежуточной степени следует интенсифицировать антисекреторную терапию с целью заживления воспаления пищевода и через 6 мес повторить биопсию. Если обнаружена ДНС, эндоскопический контроль проводится через 6-12 мес, затем ежегодно до подтверждения отсутствия дисплазии в двух исследованиях подряд; альтернативной является эндоскопическая эрадикационная терапия. У пациентов с ДВС эрадикационная терапия становится практически обязательной, лишь в некоторых случаях возможно наблюдение каждые 3 мес. Алгоритм скрининга, наблюдения и ведения ПБ представлен на рисунке 1.
Ведение дисплазии и раннего рака
ДВС и интрамукозальная АП
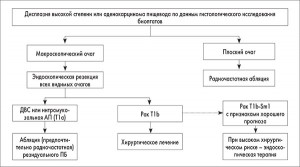
Традиционно пациентам с ПБ, ДВС или ранним АП рекомендовалось хирургическое лечение – эзофагэктомия, однако эта процедура ассоциировалась с тяжелыми послеоперационными осложнениями и повышенной смертностью. Даже в центрах с высокой операционной активностью летальность при эзофагэктомии, проводимой по поводу ДВС или раннего АП, достигала 4%. Сегодня благодаря усовершенствованию эндоскопических методов хирургическое лечение проводится только пациентам с опухолевой инфильтрацией подслизистого слоя и/или отсутствием ответа на эндоскопическую терапию.
Цель эндоскопической эрадикационной терапии у пациентов с ПБ – полностью устранить все очаги кишечной метаплазии и достигнуть полной реверсии до плоского эпителия. В многочисленных исследованиях было продемонстрировано, что ДВС и опухоли Т1m можно элиминировать в 80-100% случаев, а ПБ с кишечной метаплазией – в >75% случаев. Кроме того, при эндоскопическом наблюдении частота прогрессирования в рак была значительно выше по сравнению с таковой при абляционной терапии (после эндоскопической резекции слизистой оболочки – ЭРС). Таким образом, пациентам с подтвержденной ДВС или интрамукозальной аденокарциномой (Т1m) в пределах ПБ рекомендуется эндоскопическая эрадикационная терапия с радиочастотной абляцией (РЧА), фотодинамической терапией (ФДИ) или ЭРС. Основными осложнениями, возникающими вследствие применения этих методик, являются стриктуры, кровотечение и перфорация; может временно наблюдаться боль в груди, лихорадка и одинофагия.
Эндоскопическая резекция ассоциируется с такой же выживаемостью, как и хирургическое лечение, но приводит к меньшим осложнениям. Следовательно, поскольку ДВС не связана с метастазированием в лимфоузлы (при исключении глубокой инвазии по данным ЭРС), эндоскопическое лечение имеет преимущества перед хирургическим у большинства пациентов с ПБ и ДВС. С другой стороны, эндоскопическая терапия ассоциируется с более высокой частотой рецидивов ДВС; тем не менее их также можно лечить эндоскопически.
РЧА эффективно трансформирует пищевод с патологическими клетками в пищевод с нормальной слизистой, лишенной предраковых генетических отклонений. Недавно проведенный систематический обзор показал, что после РЧА стойкое устранение ДВС наблюдается у 90% пациентов. К преимуществам РЧА относятся безопасность и длительное сохранение эффекта (до 5 лет), которое ассоциируется со значительным снижением риска прогрессирования в рак. Для полной эрадикации метаплазии, как правило, требуется несколько сеансов абляции. Наиболее частым побочным эффектом (до 5% пациентов) является стеноз, однако частота тяжелых неблагоприятных событий при РЧА ниже по сравнению с другими абляционными техниками. В целом РЧА считается лучшим методом по показателю «стоимость/эффективность» у пациентов с ДВС.
При ДВС на макроскопических очагах для адекватной постановки диагноза и определения стадии заболевания требуется ЭРС, поскольку при обнаружении АП в образце риск развития злокачественной лимфопатии зависит от глубины инвазии. В идеале ЭРС должна захватывать менее 2/3 окружности пищевода, что снижает риск развития стриктур. Стеноз, как правило, можно корригировать с помощью эндоскопической дилатации.
После завершения ЭРС всех видимых очагов ДВС/Т1m рекомендуется эндоскопическая абляция резидуального ПБ, поскольку при наличии остаточных очагов ПБ в 11-30% случаев в течение 3 лет наблюдается рецидив неоплазии. Лучшим методом для лечения плоской ДВС и эрадикации резидуального ПБ после ЭРС считается РЧА.
Фотодинамическая терапия (ФДТ) также снижает риск прогрессирования в рак по сравнению с наблюдением, однако этот метод ассоциируется с высокой частотой осложнений, в частности развития стриктур (36 vs 6% после РЧА). Кроме того, ДВС персистирует у 33-50% пациентов после ФДТ. Криотерапия и аргоноплазменная коагуляция в рандомизированных исследованиях не оценивались и на сегодня не рассматриваются как альтернатива РЧА.
При раннем ПБ, распространяющемся на подслизистый слой, лучшим методом является хирургическое лечение, что связанно со значительным риском метастазирования в лимфоузлы (20-25% по сравнению с <3% при Т1а). Тем не менее у некоторых пациентов с Т1b-Sm1 (инвазия ограничивается поверхностным слоем слизистой оболочки) и гистопатологическими признаками низкого риска (инвазия <500 мкм, степень дифференцировки G1-G2, отсутствие лимфососудистой инвазии) вместо эзофагэктомии может применяться эндоскопическое лечение, особенно при высоком хирургическом риске. В этом случае рекомендуется ультразвуковое исследование видимых лимфоузлов.
Алгоритм ведения ПБ с ДВС или ранней АП представлен на рисунке 2.
ДНС
Дисплазия низкой степени диагностируется у 25-40% пациентов с ПБ во время наблюдения. Большинство руководств рекомендуют эндоскопический контроль каждые 6-12 мес для исключения диспластического прогрессирования. Относительно естественного течения ДНС остается множество вопросов. У одних больных ДНС прогрессирует в ДВС илиАП, у других остается стабильной или спонтанно исчезает. Тем не менее в недавно проведенном исследовании сообщалось о высокой частоте прогрессирования ДНС в ДВС (13,4% в год), поэтому эндоскопическая терапия в данной популяции также может рассматриваться.
Влияние РЧА на риск неопластического прогрессирования у пациентов с ПБ и ДНС четко не установлено; в то же время РЧА обеспечивает полную реверсию до нормального плоского эпителия в >90% случаев. В рандомизированном контролируемом исследовании, включившем 136 пациентов с ПБ и подтвержденной ДНС (68 пациентов подверглись РЧА ± ЭРС vs 68 больных находились под эндоскопическим наблюдением), РЧА ассоциировалась со значительным снижением риска неопластического прогрессирования после 3 лет наблюдения (1,5 vs 35,9%; р<0,001). Этот результат соответствует показателю NNT=4 (количество пациентов, которым необходимо выполнить РЧА для предотвращения 1 случая прогрессирования). У большинства пациентов группы РЧА была достигнута стойкая эрадикация дисплазии и метаплазии. Авторы пришли к выводу, что абляционная терапия является рациональной опцией у пациентов с верифицированной ДНС.
ПБ без дисплазии
У пациентов с ПБ без дисплазии эндоскопическая эрадикационная терапия не рекомендуется из-за низкой вероятности прогрессирования в АП (0,1-0,3% в год) и потенциальных осложнений (10-15%).
Наблюдение после эрадикации
После эндоскопической или хирургической эрадикации ДВС обязателен эндоскопический контроль. После субтотальной эзофагэктомии эндоскопия должна проводиться через 2, 5 и 10 лет, при обнаружении ПБ – каждые 2 года. Четкие интервалы наблюдения после эндоскопического лечения на сегодня не определены.
Химиопрофилактика и контроль симптомов
При наличии симптомов ГЭРБ и/или рефлюксного эзофагита показано лечение. Химиопрофилактика с помощью кислотоснижающих препаратов пока не может рекомендоваться, хотя в некоторых исследованиях была установлена связь антирефлюксной терапии и сниженной частоты прогрессирования в АП даже у пациентов без симптомов ГЭРБ. Эти данные косвенно указывают на возможную положительную роль ингибиторов протонной помпы (ИПП) в профилактике ПБ. С другой стороны, кислотоснижающая терапия, в частности ИПП, не снижает риск прогрессирования дисплазии в рак. ИПП также использовались для профилактики кислотного рефлюкса и ускорения реэпителизации после ЭМС или абляции.
Риск развития АП у пациентов, перенесших антирефлюксное хирургическое лечение, такой же, как и у больных, получающих ИПП. Таким образом, антирефлюксная операция не защищает от рака, и показания к ее проведению у пациентов с ПБ соответствуют таковым у больных ГЭРБ.
Достаточных доказательств целесообразности применения аспирина и других химиопрофилактических агентов при ПБ на сегодня нет. Аспирин может рекомендоваться только пациентам с ПБ и факторами кардиоваскулярного риска (при которых этот препарат показан), поскольку соотношение «польза/риск» является благоприятным только в данной ситуации.
Список литературы находится в редакции.
Macias-Garcia F., Dominguez-Munoz J.E. Update on management of Barrett’s esophagus. World J Gastrointest Pharmacol Ther 2016 May 6; 7 (2): 227-234.
Перевел с англ. Алексей Терещенко