4 липня, 2019
Осложнения интенсивной терапии массивного акушерского кровотечения
.jpg) Остановка кровотечения и проведение заместительной инфузионно-трансфузионной терапии являются основополагающими принципами интенсивной терапии массивной кровопотери. В современных условиях для восполнения объема циркулирующей крови применяется целый ряд лекарственных средств. В статье дана оценка препаратам, применяемым в лечении акушерских кровотечений, в аспекте риска развития побочных эффектов.
Остановка кровотечения и проведение заместительной инфузионно-трансфузионной терапии являются основополагающими принципами интенсивной терапии массивной кровопотери. В современных условиях для восполнения объема циркулирующей крови применяется целый ряд лекарственных средств. В статье дана оценка препаратам, применяемым в лечении акушерских кровотечений, в аспекте риска развития побочных эффектов.
Акушерские кровотечения остаются одной из основных причин материнской смертности во всем мире. Для них характерны остро возникающий дефицит объема циркулирующей крови (ОЦК), нарушения сердечной деятельности, анемическая и циркуляторные формы гипоксии. Основные причины нарушений гемодинамики при кровопотере – дефицит ОЦК и несоответствие между ним и емкостью сосудистого русла. Возникающая на этом фоне тканевая гипоксия сопровождается нарушением окислительно-восстановительных процессов с преимущественным поражением ЦНС, почек, печени. Кроме того, происходит нарушение водно-электролитного баланса, кислотно-щелочного состояния и ферментативных процессов. При массивных кровотечениях быстро развивается порочный круг, который может привести к терминальному состоянию и летальному исходу. Основная задача врачей при кровотечении заключается в своевременном использовании эффективных и надежных методов его остановки до возникновения симптомов геморрагического шока.
Выбор методов остановки кровотечения зависит от причины, объема, скорости кровопотери и тяжести состояния больной. Восполнение ОЦК и проведение инфузионной терапии базируется на старом и хорошо зарекомендовавшем себя принципе: чем раньше, тем лучше. От скорости восстановления ОЦК и эффективной перфузии органов и тканей в большей степени зависят исход и вероятность выживания пациентки.
Таким образом, основополагающие принципы терапии массивного акушерского кровотечения заключаются в следующем:
- немедленная остановка кровотечения (тяжесть состояния не является противопоказанием к операционному гемостазу) + утеротоники;
- массивная инфузионнно-трансфузионная терапия;
- терапия коагулопатии.
Вместе с тем введение каких-либо лекарственных средств является вмешательством во внутреннюю среду организма, которое может повлиять на функциональное состояние органов и гомеостаз. Не всегда такое влияние является положительным.
Возможные отрицательные эффекты интенсивной терапии кровотечения
Утеротоники
Окситоцин в физиологических дозах (< 0,5 мЕД/мин) не тормозит диурез и даже может незначительно усиливать его за счет повышения скорости клубочкового кровотока и снижения канальцевой реабсорбции воды и натрия. Однако применяемый в высоких дозах (>5 мЕД/мин) он оказывает антидиуретическое действие. Гипергидратация возможна при одновременном применении окситоцина с большим количеством 5% раствора глюкозы или 0,9% раствора NaCl. При быстром введении, если объем инфузии превышает 2,5 л, возможно развитие отека легких.
Отмечено существенное отрицательное влияние окситоцина на сердечно-сосудистую систему. При применении физиологических доз данный препарат вызывает вазодилатацию коронарных артерий и сосудов головного мозга, не изменяя уровня артериального давления (АД). При назначении высоких доз окситоцина АД временно может снижаться, а потом повышается, возникает рефлекторная тахикардия, могут развиться аритмии (в т. ч. желудочковые экстрасистолы), отек легких и синкопе.
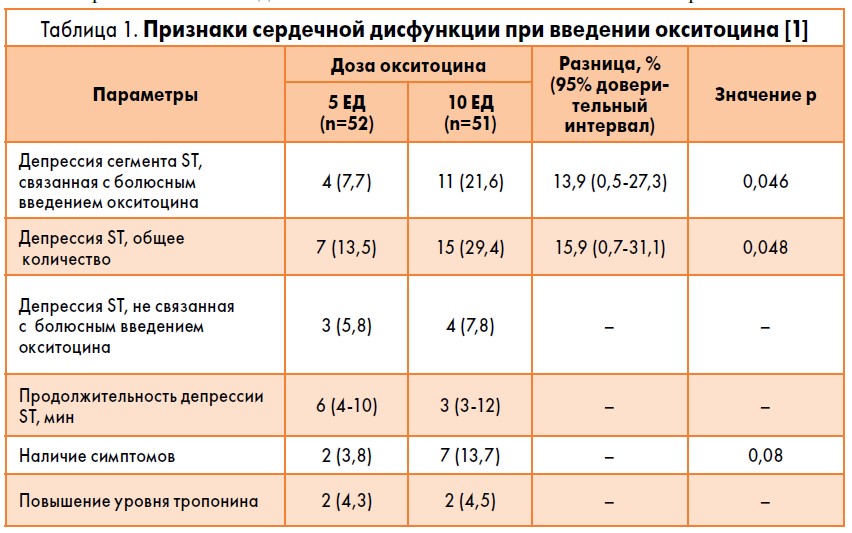
Отрицательное действие окситоцина на функцию сердца было продемонстрировано в ряде исследований. Так, согласно результатам исследования M. Jonsson et al. (2010), длительная инфузия окситоцина на фоне гипотонического кровотечения сопровождается депрессией сегмента ST и повышением концентрации тропонина, что свидетельствует об ишемии миокарда (табл. 1) [1]. Клинически эти явления характеризовались появлением боли и ощущения тяжести в груди, одышкой.
Еще в одном рандомизированном двойном слепом сравнительном исследовании эффективности применения окситоцина и метилэргометрина при кесаревом сечении и во время родов более выраженные признаки ишемии миокарда отмечены после введения окситоцина [2].
Для профилактики указанных осложнений при назначении окситоцина необходимо соблюдение скорости введения данного препарата. Согласно инструкции по применению окситоцина, для точного дозирования инфузионного раствора следует использовать инфузионную помпу или другое подобное устройство.
Карбетоцин в рекомендованных дозах (не более 100 мкг) практически не оказывает влияния на почки. Однако обладает определенным антидиуретическим действием, поэтому существует риск развития гипонатриемии и гипергидратации при массивных инфузиях. Во избежание этих осложнений следует отказаться от болюсного введения карбетоцина, а применять данный препарат инфузионно (в 100 мл физиологического раствора).
Терлипрессин – синтетический аналог вазопрессина. Его эффект состоит в снижении перфузии миометрия и эндометрия, стимуляции сократительной активности матки, воздействии на сосудистые V1a-рецепторы и V2-рецепторы почечных канальцев. В рекомендованных дозах (до 400 мкг) терлипрессин обладает определенным антидиуретическим действием. При его применении в высоких дозах (>1000 мкг) существует риск развития гипонатриемии, гипокалиемии и гипергидратации (особенно при массивных инфузиях) за счет повышенной реабсорбции воды. Как результат такого эффекта возможно развитие олигурии. Терлипрессин следует вводить дробно в течение 15 мин.
Со стороны сердечно-сосудистой системы в рекомендованных дозах терлипрессин вызывает незначительный вазоспазм (в первую очередь спланхнических сосудов), незначительно повышает АД, а в высоких дозах резко повышает АД, что приводит к рефлекторной брадикардии, аритмии (желудочковые экстрасистолы), отеку легких. Наиболее опасным возможным осложнением является инфаркт миокарда.
С учетом вышесказанного терлипрессин следует вводить на начальных этапах терапии, желательно внутриматочно.
Гемостатики
Транексамовая кислота. В соответствии с гайдлайном Европейского общества анестезиологов (2016) при акушерских кровотечениях рекомендуется назначение транексамовой кислоты для уменьшения объема кровопотери, продолжительности кровотечения и количества переливаемых доз препаратов крови. При плановом оперативном родоразрешении целесообразность введения транексамовой кислоты должна быть рассмотрена до начала кесарева сечения. На сегодняшний день рекомендуемые дозы транексамовой кислоты составляют 20‑25 мг/кг [3].
При исследовании эффективности и безопасности транексамовой кислоты прямого повреждающего эффекта на функцию почек не обнаружено; продемонстрировано, что риск тромбоза возможен при превышении дозы данного препарата в 400 раз. Вместе с тем описано образование тромба в мочеточнике с последующим блокированием почки при сопутствующей гематурии у пациентов с хронической патологией почек [4].
Концентрат протромбинового комплекса (оctaplex). Применение этого препарата не влияет на функцию почек и сердца. В то же время в литературе имеются сообщения, что совместное назначение концентрата протромбинового комплекса и свежезамороженной плазмы повышает риск развития почечной недостаточности [5].
Рекомбинантный фактор свертывания крови VIIa (новосевен). У данного препарата прямого повреждающего эффекта на функцию почек не обнаружено. Однако ряд исследователей сообщали о том, что его раннее введение в дозе от 90 до 120‑200 мкг/кг пациентам без развернутой клинической картины коагулопатии сопровождалось острым тромбозом почечных артерий и клубочков с развитием острой почечной недостаточности. Также сегодня доказан высокий риск развития тромбоэмболии легочной артерии вследствие применения рекомбинантного фактора свертывания крови VIIa. Учитывая эти факты, новосевен следует применять только как препарат резерва.
Инфузионная терапия
Физиологический раствор (0,9% раствор NaCl). Несмотря на название, раствор хлорида натрия по своему составу отличается от плазмы крови, особенно по количеству хлора (103 ммоль/л в плазме против 154 ммоль/л в растворе). В связи с этим при переливании высоких доз физиологического раствора возникает гиперхлоремия и, как результат, солевой ацидоз.
Опасность избыточного содержания хлора в изотоническом растворе поваренной соли заключается в следующем. Повышение плазменной концентрации иона хлора на 12 ммоль/л приводит к повышению почечного сосудистого сопротивления на 35%, снижению скорости клубочковой фильтрации на 20% [6]. Дальнейшее нарастание уровня хлора в плазме крови приводит к усугублению метаболических нарушений и развитию гиперхлоремического ацидоза, что клинически проявляется снижением скорости клубочковой фильтрации и, следовательно, уменьшением мочеотделения и системной вазодилатацией (снижением АД) [7]. Первая реакция на снижение темпа диуреза и уровня АД – увеличение инфузионной нагрузки, что замыкает порочный круг патогенеза. Изотонический 0,9% раствор NaCl – это лекарственный препарат, применение которого в объемах >1,5-2 л сопровождается тяжелыми осложнениями, которые трудно поддаются коррекции, поэтому его использование должно быть строго ограничено.
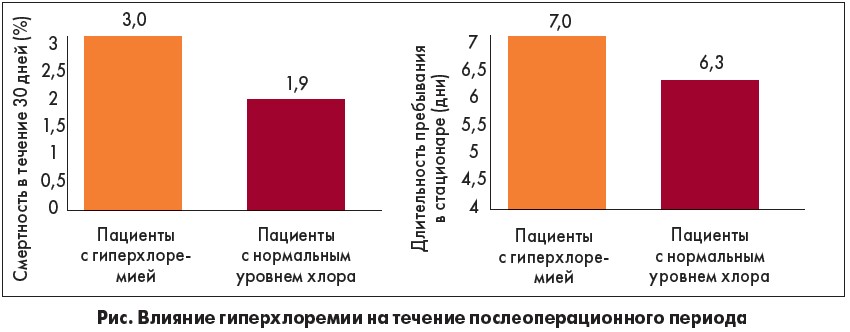
В исследовании S. A. McCluskey et al. (2013) [8] продемонстрирована связь между гиперхлоремией и неблагоприятными послеоперационными исходами: увеличение срока пребывания в стационаре, повышение заболеваемости и смертности в течение 30 дней после операции (рисунок).
С учетом вышеизложенного на сегодняшний день основным принципом рациональной интенсивной терапии является введение сбалансированных инфузионных растворов [9]. Предпочтение следует отдавать сбалансированным растворам, где в качестве носителя резервной щелочности включены ацетат или его комбинация с малатом (стерофундин ISO). В отличие от растворов, содержащих лактат, ацетат и малат преобразуются в бикарбонат в клетках всех тканей организма, поэтому их метаболизм не замедляется у пациентов в шоковом состоянии и у таковых с нарушением функции печени. При этом из 1 моля ацетата синтезируется 1 моль гидрокарбоната, а из 1 моля малата – 2 моля гидрокарбоната в течение 1-1,5 ч. Малат требует для преобразования в бикарбонат в 2 раза, а ацетат – в 1,5 раза меньше кислорода, чем лактат. Кроме того, малат обладает антигипоксантными и антиоксидантными свойствами, так как является энергетическим субстратом цикла трикарбоновых кислот (цикл Кребса). Наличие лактата, наоборот, увеличивает метаболическое потребление кислорода (из-за образования бикарбоната в печени), что усугубляет тканевую гипоксию, сопровождающую все критические состояния. Растворы, в составе которых содержится лактат, нежелательно использовать в случае шока, сопровождающегося гиперлактатемией или лактатным ацидозом. Введение таких инфузионных сред фальсифицирует лабораторные данные, поскольку повышение концентрации лактата в плазме крови часто трактуется как признак тканевой гипоксии. Также следует помнить, что лактат может вызывать интерстициальный отек головного мозга и повышает агрегацию тромбоцитов и эритроцитов.
Содержание электролитов в стерофундине практически идентично составу плазмы крови, поэтому способствует нормализации водно-электролитного баланса в организме и не сопровождается развитием электролитного дисбаланса. При применении данного раствора происходит восстановление и поддержание осмотического баланса как вне клетки, так и внутриклеточно.
Гидроксиэтилкрахмал (ГЭК) не следует применять для лечения пациентов в критическом состоянии до уточнения необходимых параметров. Согласно рекомендациям Ассоциации анестезиологов Германии по проведению инфузионной терапии у взрослых (2015), использование препаратов ГЭК возможно для терапии геморрагического шока, однако решение об их назначении должно быть взвешенным. Острую гиповолемию невозможно адекватно компенсировать лишь с помощью кристаллоидов, необходимо использовать препараты желатина или альбумин. Применение препаратов сукцинированного желатина в сбалансированном растворе (геласпан) также способствует снижению риска гиперхлоремии. Геласпан изотоничен, содержит все электролиты в концентрации, соответствующей плазме, и ацетатный буфер, т. е. является сбалансированным раствором.
В 2008 году публикация результатов исследования Volume Substitution and Insulin Therapy in Severe Sepsis (VISEP) [10] вызвала противоречивую дискуссию о выборе ГЭК для коллоидной поддержки при сепсисе. Эта дискуссия усилилась в 2012 году по завершении исследований 6S и Crystalloid versus Hydroxyethyl Starch Trial (CHEST) [11, 12]. В этих исследованиях было обнаружено негативное влияние ГЭК на функции почек и повышение риска смертности в отделении интенсивной терапии у лиц с/без сепсиса. В связи с этим некоторые авторы поставили под сомнение безопасность использования ГЭК у пациентов в критических состояниях [13, 14].
В дальнейшем было проведено два метаанализа с целью изучения безопасности ГЭК [15, 16]. Согласно результатам первого из них (19 исследований с участием в общей сложности 1567 пациентов хирургического профиля), не было выявлено разницы в отношении летальности и острого повреждения почек между группами, которым назначали 6% ГЭК, и не получавшими такового [15]. Аналогичные результаты представили бельгийские ученые при проведении метаанализа 59 исследований (4529 больных хирургического профиля) [16]. Не было выявлено никакой разницы в отношении побочных эффектов со стороны почек, увеличения объема кровопотери, повышения частоты случаев переливания эритроцитарной массы между группами, получающими и не получающими ГЭК.
С целью сравнения влияния на смертность коллоидных и кристаллоидных растворов при использовании для восполнения жидкости у хирургических больных в тяжелом состоянии было организовано исследование Colloids Versus Crystalloids for the Resuscitation of the Critically Ill (CRISTAL, 2013) [17]. Согласно его результатам, не обнаружено разницы в уровне летальности в течение 28 сут. Показатель смертности пациентов в течение 90 сут оказался выше в группе лиц, которым назначали кристаллоиды.
Главные правила применения ГЭК
Раствор ГЭК для лечения гиповолемии в результате острой кровопотери рекомендовано применять только в случае, когда эффективность кристаллоидных растворов недостаточна.
- Инфузию растворов ГЭК для лечения гиповолемии необходимо прекратить, как только достигнуто состояние нормоволемии.
- Дальнейшее применение раствора разрешено только при повторном появлении гиповолемии.
- Для профилактики острой почечной недостаточности у больных с дегидратацией перед началом применения ГЭК следует провести терапию кристаллоидом и контролировать диурез.
- До начала инфузии рекомендуется определить уровень креатинина в крови. При пограничных показателях (до 177 мкмоль/л), что характерно для компенсированной острой почечной недостаточности, необходимо тщательно оценить показания к терапии ГЭК и проводить частый контроль баланса жидкости, а также показателей азотемии.
- Рекомендуется также осуществлять контроль уровня электролитов в крови.
ГЭК разделяют на гетастрачи и пентастрачи. К гетастрачам относят препараты на основе кукурузного крахмала со средней молекулярной массой 450 000 Да (стабизол), к пентастрачам – со средней молекулярной массой 200 000 Да (рефортан). На сегодняшний день достаточно широко используется третье поколение ГЭК (венофундин, рефортан плюс, тетраспан) с молекулярной массой 130 000 Да, так как с уменьшением молекулярной массы снижается коагулопатическое влияние, что позволяет безопасно повысить дозы препарата. Для венофундина средняя молекулярная масса ГЭК составляет 130 000 Да, а степень замещения – около 0,42. Данный препарат является изоонкотическим раствором, т. е. внутрисосудистый объем плазмы при его инфузии увеличивается эквивалентно введенному объему. Этот ГЭК структурно родствен гликогену, что объясняет его хорошую переносимость и низкий риск анафилактических реакций. Тетраспан также относится к третьему поколению и содержит кроме ГЭК еще и сбалансированный раствор, в чем его большое преимущество по сравнению с другими ГЭК. Введение тетраспана предупреждает развитие гиперхоремии.
Объем инфузионной терапии
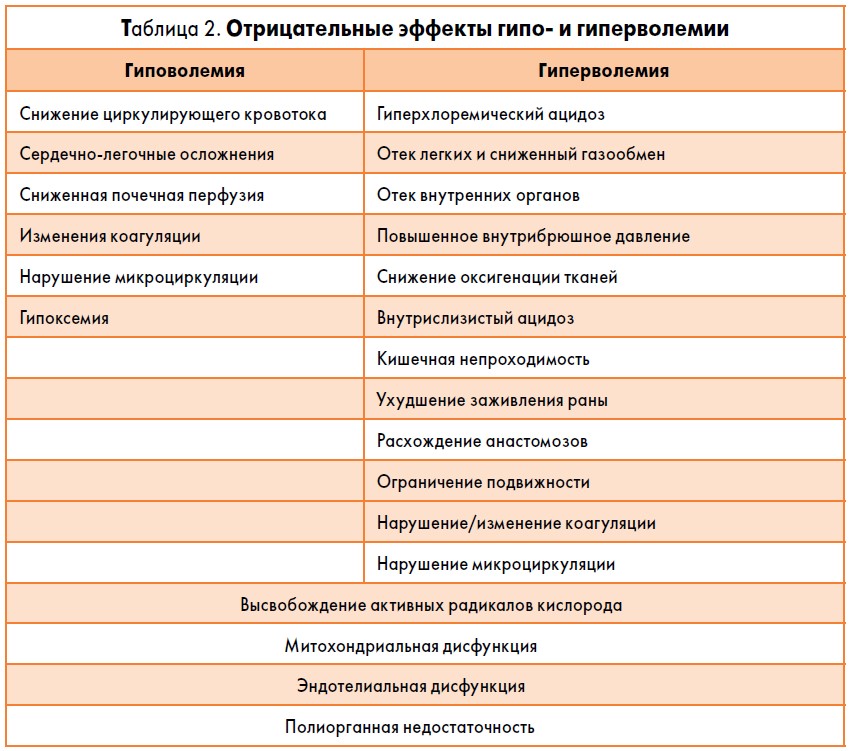
При проведении инфузионно-трансфузионной терапии кровотечений происходит разведение крови (гемодилюция). В зависимости от тактики ее проведения наблюдается три варианта гемодилюции: гиповолемическая (в результате рестриктивной стратегии терапии), нормоволемическая и гиперволемическая. При проведении интенсивной терапии следует стремиться к нормоволемии, поскольку и гипо-, и гиперволемия имеют отрицательные последствия (табл. 2).
Согласно рекомендациям Европейского общества анестезиологов, следует избегать гиперволемии кристаллоидами или коллоидами до уровня, превышающего интерстициальное пространство в устойчивом состоянии и за его пределами оптимальной сердечной преднагрузки [18].
Таким образом, эффективность проводимого лечения массивного акушерского кровотечения в значительной степени зависит от времени начала интенсивной терапии и организации мероприятий, направленных на окончательную остановку кровотечения. Для борьбы с гипоксией, возникающей вследствие кровопотери, необходимо восстановление внутрисосудистого объема как главного критического параметра для адекватного кровотока и, следовательно, транспорта кислорода. Гиповолемия должна корригироваться на наиболее ранних стадиях, потому что, как только гипоксия вызовет значительные изменения тканей, процесс становится необратимым и развивается полиорганная недостаточность. Инфузионная терапия имеет хороший эффект при условии, что врач четко знает цель применения препаратов, имеет представление о механизмах их действия, а также о положительных и отрицательных свойствах.
Литература
1. Jonsson M., Hanson U., Lidell C., Norde’n-Lindeberg S. ST depression at caesarean section and the relation to oxytocin dose. A randomised controlled trial. Br. J. Obstet. Gynaecol. 2010; 117: 76‑83.
2. Svanstrom M. C., Biber B., Hanes M. et al. Signs of myocardial ischaemia after injection of oxytocin: a randomized double-blind comparison of oxytocin and methylergometrine during Caesarean section. Br. J. Anaesth. 2008; 100: 683‑689.
3. Kozek-Langenecker S.A., Ahmed A. B., Afshari A., Albaladejo P. et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology: First update 2016. Eur J Anaesthesiol. 2017; 34 (6): 332‑395.
4. Ma T. K. et al. Manifestation of tranexamic acid toxicity in chronic kidney disease and kidney transplant patients: A report of four cases and review of literature. Nephrology (Carlton). 2017; 22 (4): 316‑321.
5. Wiedermann C. J. A word of caution on renal risks of prothrombin complex concentrate use in cardiac surger. Crit Care. 2016; 20: 63.
6. Wilcox C. S. Regulation of renal blood flow by plasma chloride. J Clin Invest. 1983; 71 (3): 726‑735.
7. Kaplan L. J., Frangos S. Clinical review: Acid-base abnormalities in the intensive care unit. Рart II. Crit Care. 2005; 9 (2): 198‑203.
8. McCluskey S.A. et al. Hyperchloremia after noncardiac surgery is independently associated with increased morbidity and mortality: a propensity-matched cohort study. Anesth Analg. 2013. 117 (2): 412‑421.
9. Zander R. Fluid Management-Second expanded edition. Melsungen: Bibliomed-Medizinische Verlagsgesellschaft mbH. 2009. – Р. 15‑31.
10. Brunkhorst F. M. et al. Intensive Insulin Therapy and Pentastarch Resuscitation in Severe Sepsis. N Engl J Med 2008; 358: 125‑139.
11. Myburgh J. A., Finfer S., Bellomo R. et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med. 2012. 15; 367 (20): 1901‑1911.
12. Perner A., Haase N., Guttormsen A. B. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N Engl J Med. 2012. 12; 367 (2): 124‑134.
13. Zarychanski R., Abou-Setta A.M., Turgeon A. F. et al. Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis. JAMA. 2013. 20; 309 (7): 678‑688.
14. Perel P., Roberts I., Ker K. et al. Colloids versus crystalloids for fluid resuscitation in critically ill patients. Cochrane Database Syst Rev. 2013 Feb 28 (2): CD000567.
15. Gillies M. A. Incidence of postoperative death and acute kidney injury associated with i.v. 6% hydroxyethyl starch use: systematic review and meta-analysis. Br J Anaesth. 2014; 112 (1): 25‑34.
16. Van Der Linden et al. Safety of modern starches used during surgery. Anesth Analg. 2013; 116 (1): 35‑48.
17. Annane D et al. Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized trial. JAMA. 2013. 6; 310 (17): 1809‑1817.
18. Kozek-Langenecker S.A. et al. Management of severe perioperative bleeding. Guidelines from European Society of Anaesthesiology. Eur. J. Anaesthesiol. 2013; 30:270‑382.
Медичні аспекти здоров’я жінки № 4 (117) 2018.
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 1 (33), березень 2019 р.