10 червня, 2016
Современное представление о синдроме избыточного бактериального роста
Флора должна оказывать влияние на самые разнообразные процессы, совершающиеся в организме, то благоприятствуя, то препятствуя наступлению болезни.
И.И. Мечников
Микробиота человека имеет выраженный индивидуальный характер и различается как на видовом, так и на штаммовом уровне. Состав микрофлоры каждого биотопа пищеварительного тракта является постоянным, что связано со способностью микроорганизмов фиксироваться к строго определенным рецепторам эпителиальных клеток слизистой оболочки (СО). В СО тонкой кишки имеются рецепторы для адгезии только аэробных бактерий, в то время как в толстой кишке преобладают рецепторы для фиксации анаэробных штаммов.
Микробный пейзаж значительно различается в проксимальных и дистальных отделах тонкой кишки. В физиологических условиях в верхних отделах тонкой кишки обитает примерно 102-104 КОЕ/мл бактерий, в тощей кишке – 107 КОЕ/мл, в толстой кишке их количество достигает 1010-1012 КОЕ/мл.
В последнее время благодаря использованию молекулярно-генетических методов было показано, что микробиота кишечника включает около 600 различающихся между собой типов бактерий, большинство из которых относятся к родам Firmicutes и Bacteroides, объединенных в три различных энтеротипа [13].
Кишечная микрофлора обладает огромным метаболическим потенциалом и способна осуществлять множество биохимических процессов, внося свой вклад в физиологию человека.
Защитная функция (колонизационная резистентность) заключается в предотвращении колонизации желудочно-кишечного тракта условно-патогенными и патогенными микроорганизмами. Микробный антагонизм многогранен и реализуется посредством конкуренции за питательные вещества и рецепторы адгезии, а также за счет выработки органических кислот, перекиси водорода, антибиотикоподобных веществ – бактериоцинов и других веществ, препятствующих росту патогенных микроорганизмов. Микрофлора принимает ключевое участие в обеспечении противовирусной защиты. Благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора приобретает способность перехвата и выведения вирусов.
Пищеварительная функция реализуется как за счет регуляции функций кишечника, так и за счет непосредственной утилизации питательных субстратов. Облигатная микрофлора толстой кишки в норме обеспечивает конечный гидролиз белков, омыление жиров, сбраживание высокомолекулярных углеводов, которые не абсорбировались в тонкой кишке. Протеолитические микроорганизмы (бактероиды, нормальная кишечная палочка) ферментируют протеины. Некоторые поступающие с пищей вещества могут метаболизироваться только кишечной микрофлорой: сахаролитическая микрофлора расщепляет целлюлозу и гемицеллюлозу до короткоцепочечных жирных кислот.
Детоксикационная и антиканцерогенная функция. Нормальная микрофлора способна нейтрализовать многие токсические субстраты и метаболиты (нитраты, ксенобиотики, гистамин, мутагенные стероиды), предохраняя энтероциты и отдаленные органы от воздействия повреждающих факторов и канцерогенов.
Синтетическая функция. Нормальная микрофлора обеспечивает синтез многих макро- и микронутриентов: витаминов группы В, С, К, фолиевой, никотиновой кислоты. Только кишечная палочка синтезирует 9 витаминов. Синтез гормонов и биологически активных веществ лежит в основе регуляторного действия микрофлоры на функции внутренних органов и центральной нервной системы.
Иммуногенная функция. СО кишечника обладает собственной лимфоидной тканью, известной как GALT (gut-associated lymphoid tissue), которая является одним из значимых компонентов иммунной системы макроорганизма. В СО кишечника локализовано около 80% иммунокомпетентных клеток, 25% СО кишечника состоит из иммунологически активной ткани. Таким образом, кишечник можно рассматривать как самый большой «иммунный орган» человека. Микрофлора участвует в формировании как местного (активация продукции IgА, фагоцитарной активности), так и системного иммунитета. Само наличие бактерий оказывает постоянный антигенный тренирующий эффект.
Регуляция обмена холестерина, оксалатов. Бифидо- и лактобактерии уменьшают всасывание холестерина, переводя его в нерастворимый копростапол. Некоторые лактобактерии в анаэробных условиях участвуют в метаболизме оксалатов и приводят к снижению экскреции оксалатов с мочой.
Генетическая функция. Микробиота является своего рода «генетическим банком», обмениваясь генетическим материалом с клетками человека путем фагоцитоза. В результате этого микробиота приобретает рецепторы и другие антигены, присущие хозяину и делающие ее «своей» для иммунной системы. Эпителиальные ткани в результате такого обмена приобретают бактериальные антигены. Известно также, что микроорганизмы влияют на экспрессию генов макроорганизма: при инфекции Mycobacterium tuberculosis, например, изменяется экспрессия 463 человеческих генов [7].
Функции микробиоты реализуются путем внутриклеточных (посредством фагоцитоза, эндоцитоза и т.п.), дистанционных (через «сигнальные молекулы») и контактных (через органораспознающие рецепторы) взаимодействий. Нормальная микрофлора подавляет воспалительные реакции и тормозит определенные пути передачи сигнала, тем самым поддерживая кишечный гомеостаз.
При изменении нормального состава кишечных бактерий в различных биотопах нарушаются функции микробиома желудочно-кишечного тракта (ЖКТ) с развитием клинических симптомов и метаболических последствий, а также с транслокацией бактерий во внутреннюю среду.
Нарушения состава кишечной микробиоты могут привести к расстройству питания (ожирение, метаболический синдром, пищевая непереносимость), развитию воспалительных заболеваний кишечника, аллергических заболеваний, синдрома раздраженного кишечника (СРК). Коррекция микробиоценоза необходима при желчнокаменной болезни, постхолецистэктомическом синдроме (ПХЭС), кишечных инфекциях, паразитарных инвазиях, синдроме мальабсорбции, диарее, ассоциированной с антибиотиками, запорах, пищевой аллергии, жировом гепатозе, инфекциях мочевых путей и т.д.
Количественные и качественные колебания состава микробиоты определяются возрастом человека, характером его питания, образом жизни, эпидемиологическими особенностями региона проживания, временем года и даже временем суток [32]. Постоянство видового баланса кишечных бактерий (эубиоз) является необходимым для сохранения «кишечного» здоровья человека.
Ведущая роль нормальной кишечной микрофлоры сводится к защите организма от колонизации условно патогенными и патогенными бактериями и предупреждению избыточного бактериального роста в кишечнике.
К факторам, которые позволяют сохранять количественное и видовое постоянство микробного пейзажа кишечника человека, относятся: генетическая предрасположенность, адекватный обмен веществ в организме, кислая желудочная среда, непрерывная пропульсивная перистальтика кишечника, интердигестивная сократительная активность, заключающаяся в том, что каждые 90-120 мин энтеральное содержимое перемещается в толстую кишку, синергизм анатомических сфинктеров ЖКТ (адекватность запирательной функции баугиниевой заслонки), постоянный уровень внутрипросветного рН в разных биотопах, состояние иммунной системы и барьерная и фагоцитарная функции СО (слизь является важным энергетическим ресурсом, механическим барьером, концентрирует IgA, α-дефензины, кателицидины, лизозимы и лектины, которые являются эндогенными пептидными антибиотиками микробного происхождения).
Независимо от индивидуальных различий в составе кишечной микробиоты кишечный микробиоценоз у каждого человека функционирует как целая экосистема и метаболический орган, который обеспечивает необходимое количество и профиль конечных метаболитов.
Нарушение любого из перечисленных защитных механизмов и функций микробиоты может привести к развитию синдрома избыточного бактериального роста (СИБР) в тонкой кишке.
Распространенность СИБР напрямую зависит от характеристики исследуемой популяции и метода диагностики, используемого для обнаружения или определения избыточного бактериального роста. Частота выявления избыточного роста бактерий в тонкой кишке при разных заболеваниях ЖКТ колеблется от 70 до 97% [1]. Распространенность СИБР при СРК варьируется от 30 до 85%, при циррозе печени составляет 50%, при целиакии – 50%, при ожирении распространенность СИБР отмечается в 17% случаев, при хроническом панкреатите дисбиотические нарушения в тонкой кишке встречаются у 30-40% пациентов, среди больных с функциональными нарушениями кишечника СИБР встречается у 39-90% больных.
Синдром избыточного бактериального роста представляет собой патологический полиэтиологический синдром, развивающийся вследствие бактериальной контаминации тонкой кишки различной микрофлорой и сопровождающийся функциональными нарушениями работы пищеварительного конвейера и нарушением трофологического статуса. Избыточный бактериальный рост в кишечнике обусловлен нарушением качественного и количественного состава микробного биоценоза тонкого кишечника, размножением условно-патогенных бактерий в количестве, не свойственном здоровому человеку.
При СИБР в тонкой кишке появляется микрофлора, качественно и количественно сходная с микрофлорой толстого кишечника, преимущественно грамотрицательные аэробные и анаэробные виды, которые вызывают брожение (ферментацию) углеводов с образованием газов. Обычно при СИБР обнаруживают Escherichia coli, Enterococcus spp., Klebsiella pneumonia, Proteus mirabilis, среди других (до 1010 КОЕ/мл) анаэробы (бактероиды, бифидобактерии, эубактерии, клостридии), аэробы (стрептококки, стафилококки, энтеробактерии, лактобактерии) и грибы. При изменении баланса микрофлоры в тонком кишечнике нарушаются процессы пищеварения, развивается воспаление, что приводит к появлению различных симптомов, включая вздутие живота, дискомфорт в животе и изменения характера стула.
В зависимости от характера микрофлоры и количества микроорганизмов в тонкой кишке выделяют 3 степени выраженности СИБР: I степень – увеличение аэробной нормальной кишечной микрофлоры (>105-106 КОЕ/мл), II степень – увеличение аэробной нормальной кишечной микрофлоры и появление анаэробных бактерий (>106-107 КОЕ/мл), III степень – преобладание анаэробной флоры (обсемененность на уровне 109 КОЕ/мл и более).
Механизмы, приводящие к развитию СИБР, многочисленны. Среди них можно выделить:
– нарушение моторно-эвакуаторной функции кишечника и транзита содержимого по кишке с нарушением клиренса бактерий и формированием стаза содержимого, что создает благоприятные условия для размножения микроорганизмов;
– нарушение функционирования илеоцекального клапана, вызывающее ретроградное поступление бактерий из толстой кишки в тонкую;
– замедленное очищение тонкой кишки при дивертикулезе, стриктурах (например, при болезни Крона (БК) или после хирургических вмешательств);
– чрезмерно интенсивное поступление бактерий в тонкую кишку при атрофическом гастрите, подавление секреции соляной кислоты в желудке, после резекции желудка и при кишечных свищах;
– изменения кишечной проницаемости;
– нарушения полостного пищеварения и всасывания (мальдигестия и мальабсорбция);
– избыточное высвобождение провоспалительных цитокинов и транслокация эндотоксинов и липополисахаридов в кровоток и многие другие.
Патогенез развития СИБР многогранен. Необходимым условием формирования СИБР является редукция нормальной микрофлоры, которую необходимо рассматривать как нарушение колонизационной резистентности СО тонкой кишки в условиях перманентного воздействия этиологических факторов.
Регулирование колонизации и патогенных свойств кишечными болезнетворными микробами через экспрессию генов является главным механизмом воздействия на клетки хозяина, который приводит к возникновению болезни и снижению иммунного ответа. Свободные жирные кислоты являются ингибитором экспрессии гена токсичности патогенных Enterobacteriaceae. Кроме того, они снижают pH среды ниже уровней функционирования болезнетворных микроорганизмов, таких как Salmonella spp. и E. coli. Действие болезнетворных микроорганизмов принимает иммунный характер, они приобретают способность вытеснять местную флору и нивелировать эффект колонизационной резистентности.
Сбалансированный уровень Tregs/Thelper тип 17 (Treg/Th17) является показателем кишечного гомеостаза. Регуляторные T-клетки (Tregs, CD4+, CD25+, Foxp3+), расположенные в собственной пластинке СО, подавляют IL‑10 медиаторный каскад, возникающий в результате чрезмерной активности T-клеток. Сапрофитная кишечная флора вызывает увеличение Tregs из недифференцированных Т-клеток и защищает от избыточного воспаления, вызванного кишечными патогенами, и повреждения слизистой. Например, определенные бактерии, такие как Bacteroides fragilis и Bifidobacterium infantis, или смеси Firmicutes bacteria способствуют увеличению количества Tregs и укрепляют кишечный барьер.
Toll-подобные рецепторы (TLRs) и NODs-рецепторы, расположенные на клеточной мембране, идентифицируют множество кишечных микробов и их антигенов (липополисахарид, пептидогликаны, нуклеотиды, белки и липопротеины). Эти рецепторы являются триггерами, запускающими воспаление при взаимодействии с болезнетворными бактериями.
В результате инвазии тонкой кишки патогенной флорой при СИБР формируется так называемая петля усиления прилипания инвазивных бактерий. По мере утяжеления патологии количество прилипающих патогенных бактерий все время увеличивается. Происходит уменьшение популяционного уровня бифидо- и лактобактерий и нарушение механизмов иммунологического гомеостаза. При проникновении эндотоксинов через поврежденный эпителиальный барьер из кишечника в микроциркуляторное русло наблюдается активация воспалительных реакций, модуляция иммунокомпетентных клеток, что обусловлено продукцией избыточного количества тумор-некротизирующего фактора (TNF) и факторов адгезии CEACAM‑6 (адгезивные молекулы 6-го типа – вещества белковой и полисахаридной природы, экспрессируемые на поверхности клеток) в условиях недостаточного иммунитета. Факторы адгезии и колонизации обеспечивают взаимодействие патогенных микроорганизмов со специфическими рецепторами клеток и стимулируют прилипание инвазивных микробов в условиях недостаточности местных и системных механизмов резистентности и специфических иммунологических механизмов защиты (рис.).
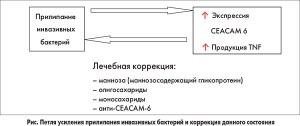
Установлено, что генетический контроль синтеза факторов патогенности, определяющих адгезию и колонизацию эпителия кишечника у патогенных эшерихий, пенетрацию и внутриклеточное размножение шигелл, сальмонелл и иерсиний, обеспечивается хромосомами и плазмидами. При этом плазмидные гены детерминируют факторы взаимодействия возбудителя с эпителием, а хромосомные – существование и размножение бактерий вне эпителия.
Вслед за рецепцией, адгезией возбудителя, колонизацией определенных экологических ниш в макроорганизме или параллельно с этими процессами возникает интенсивный синтез бактериальных токсинов, обладающих прямым или опосредованным цитопатогенным действием на клетки кишечника. К числу цитокинопосредованных реакций, формирующихся в динамике инфекционного процесса, относятся прежде всего иммунные реакции, аллергические реакции, иммунодефицитные состояния, а также аутоиммунная агрессия против собственных поврежденных или неповрежденных клеточных структур. Формирование эффективных реакций клеточного и гуморального иммунитета на фоне воздействия антигенов бактериально-токсической природы, а также интенсивная продукция гормонов адаптации сопровождают развитие и прогрессирование СИБР.
Дисбиотические изменения кишечника становятся самостоятельным фактором агрессии и обусловливают ухудшение клинического течения заболеваний. В этих условиях проградиентно нарастает выраженность клинических симптомов, увеличиваются сроки их существования, ухудшаются показатели результата лечения и качество жизни пациентов, клиническое течение приобретает часто рецидивирующий характер.
Негативное влияние на микробный пейзаж кишечника оказывают различные диеты для похудения и очищение кишечника с применением объемных клизм, особенно гидроколонотерапия, которая имеет определенную популярность, но настойчиво не рекомендуется гастроэнтерологами всего мира, так как грубо нарушает микробные биотопы.
Все это приводит к увеличению общего числа микроорганизмов в тонкой кишке и изменению их бактериального спектра со сдвигом в сторону грамотрицательной флоры и анаэробных микроорганизмов.
Сегодняш обсуждается возможность развития ИПП-индуцированного СИБР при длительном их приеме, особенно у пожилых лиц: ингибиторы протонной помпы (ИПП) являются мощными антисекреторными препаратами, приводящими к гипохлоргидрии, которая, в свою очередь, является фактором риска для развития СИБP. Установлено, что ИПП могут изменить бактериальные профили желудка, двенадцатиперстной кишки (ДПК) и тощей кишки [9, 18].
Частота выявления СИБР коррелирует с возрастом больных, страдающих гастроэнтерологическими заболеваниями.
Нарушения микробиоценоза тонкой и толстой кишки, являясь следствием имеющихся патологических состояний, усугубляют течение имеющейся основной патологии.
Синдром избыточного бактериального роста регистрируется у 20-25% пациентов с БК. Патогенетическую взаимосвязь этих заболеваний можно объяснить частой локализацией БК в илеоцекальной области, что создает благоприятные условия для контаминации тонкой кишки. У пациентов с БК признаки СИБР часто и необоснованно принимают за активизацию основного заболевания и назначаются противовоспалительные препараты, в частности кортикостероиды, в то время как больные нуждаются в адекватной антибактериальной терапии.
У пациентов с БК синдром избыточного бактериального роста наблюдается гораздо чаще, чем у больных язвенным колитом, поскольку при БК замедляется транзит содержимого по тонкой кишке. Сужение просвета дистальной части тонкой кишки и перенесенное хирургическое вмешательство по удалению баугиниевой заслонки у больных БК увеличивают риск развития СИБР. Кроме того, существуют данные исследований, указывающие на увеличение распространенности СИБР у пациентов с воспалительными заболеваниями кишечника, перенесших резекцию участков кишки (как тонкой, так и толстой), поскольку хирургические вмешательства создают идеальные условия для развития СИБР [2, 3, 14].
Избыточный бактериальный рост является причиной развития резервуарита (идиопатического воспаления в тонкокишечном резервуаре после колэктомии с наложением илеоанального резервуарного анастомоза).
Дисбиотические изменения наблюдаются почти у половины пациентов с неалкогольной жировой болезнью печени. На поверхности грамотрицательных бактерий, входящих в состав микрофлоры кишечника, непрерывно вырабатывается особый гликопротеид – эндотоксин. Избыточное поступление этого вещества в кровь приводит к интенсификации синтеза эндогенного холестерина в печени, а также к выбросу провоспалительных цитокинов. В результате развивается так называемая эндотоксин-опосредованная гиперхолестеринемия. Под влиянием эндотоксина уменьшается содержание естественных ингибиторов абсорбции холестерина, повышается индекс фиброза и стеатоза печени, развивается эндотелиальная дисфункция, что требует адекватной терапии СИБР.
Клиницистам важно помнить, что на фоне нарушений микрофлоры кишечника дислипидемия принимает устойчивую к лекарственной терапии форму: снижается эффективность статинов и некоторых гипотензивных препаратов.
Основные причины формирования СИБР в тонкой кишке после холецистэктомии: снижение барьерной функции желудка (увеличение числа билиарных рефлюксов, вызывающих ощелачивающий эффект и способствующих развитию рефлюкс-гастрита, снижение кислотообразующей функции желудка), нарушение кишечного клиренса, снижение бактерицидного действия желчи вследствие выпадения концентрационной функции желчного пузыря и бактерицидного действия панкреатического сока в связи с хронической внешнесекреторной недостаточностью поджелудочной железы, обусловленной билиарным панкреатитом. Важным патогенетическим звеном СИБР при развитии ПХЭС является преждевременная деконъюгация первичных желчных кислот, осуществляемая тонкокишечной микрофлорой.
Деконъюгированные желчные кислоты обладают детергентными свойствами и способны повреждать эпителий СО тонкой кишки. Вследствие этого снижаются синтез и сорбция ферментов на ее поверхности, что приводит к нарушению мембранного пищеварения и всасывания не только жиров и жирорастворимых витаминов A, D, Е, К, но также аминокислот и углеводов. Клинически эти нарушения проявляются креатореей, амилореей и стеатореей.
Основные механизмы, препятствующие развитию СИБР, заключаются в сохранной секреции соляной кислоты, солей желчных кислот, ферментов поджелудочной железы и тощей кишки, местных иммунных и воспалительных реакциях, бактерицидном действии секреторных иммуноглобулинов, быстром и постоянном обновлении эпителиального покрова СО, адекватной пропульсивной моторике тонкой кишки, препятствующей застою кишечного содержимого, нормальной функции илеоцекального клапана, предотвращающей ретроградное поступление бактерий из толстой кишки [11].
Клинические симптомы СИБР не имеют специфичности, их условно можно разделить:
– на местные (абдоминальные) – боль, метеоризм, особенно через небольшой промежуток после приема пищи, неустойчивый стул со склонностью к диарее, снижение массы тела. При микробной контаминации ДПК появляется горечь во рту, чувство быстрого насыщения, мучительная тошнота;
– общие (признаки дефицита жирорастворимых витаминов, цианокобаламина и фолиевой кислоты, железа; астенический синдром).
Мозаичность клинической симптоматики определяется тем, что симптомы СИБР как бы наслаиваются на картину основного заболевания, которое привело к формированию нарушения микробиоценоза.
При пальпации определяются болезненность, урчание и шум плеска по ходу ДПК и петель тонкой кишки. Нередко, преимущественно при транслокации кишечных бактерий за пределы кишки и при развитии реактивного мезаденита, выявляется выраженная болезненность при пальпации в зоне дуоденоеюнального изгиба (слева, выше пупка) и по ходу брыжейки тонкой кишки. Патогенетической основой формирования большинства местных клинических проявлений СИБР является мальабсорбция, обусловленная метаболическими эффектами размножающихся бактерий и повреждением энтероцитов.
Неспецифичность этих симптомов часто бывает причиной диагностических ошибок и требует дифференциального диагноза с СРК, непереносимостью лактозы или фруктозы.
Синдром избыточного бактериального роста является «универсальным патологическим процессом» и реализуется через хроническое альтернативное воспаление СО кишечника с последующим вовлечением всех слоев кишки и нарушением местных и системных процессов регуляции.
Микробиологическим критерием избыточного роста бактерий в тонкой кишке считается наличие фекальных микроорганизмов (кишечная палочка и штаммы облигатных анаэробов: бактероидов и клостридий) в концентрации более 105 КОЕ на 1 мл аспирата из тощей кишки.
Верификацию избыточного бактериального роста в тонкой кишке проводят с помощью прямого и непрямых методов диагностики.
Прямой метод (бактериологический) представляет собой посев дуоденального и еюнального аспиратов, полученных с помощью стерильного зонда, на соответствующие среды. Избыточный бактериальный рост при этом можно верифицировать при обнаружении более 105 клеток в 1 мл аспирата из тощей кишки и/или присутствия в нем фекальной микрофлоры. Недостатки данного метода – сложность и высокий процент ложноотрицательных результатов, связанный с трудностью воспроизведения нативных условий обитания микроорганизмов и, соответственно, анаэробного культивирования.
Наиболее удобными для диагностики СИБР являются непрямые методы, основанные на изучении метаболитов микрофлоры. К непрямым тестам относят водородный дыхательный тест (ВДТ) с глюкозой и/или лактулозой, 14С- или 13С-гликохолатный, 14С-D- или 13C-D-ксилозный дыхательные тесты, для выполнения которых необходимы изотопы и специализированная лаборатория.
Водородный дыхательный тест основан на определении градиента водорода из выдыхаемого воздуха. Водород образуется в процессе «ферментативной реакции» (брожение), которая происходит в результате метаболизма сахаров анаэробными бактериями кишечника; совместно с водородом образуются углекислый газ и короткоцепочечные жирные кислоты. Суть метода заключается в определении градиента водорода (в единицах измерения концентрации, ррm – рarts per million), после принятия нагрузки (чаще лактулоза в дозе 20-25 мл). «Пиковый» градиент водорода должен составлять 10-15 ррm, что свидетельствует о положительном результате ВДТ и считается диагностически значимым для диагностики СИБР.
Преимуществами ВДТ можно считать информативность, быстроту получения результата (в среднем около 2 ч), легкость воспроизведения для врача и пациента. По данным разных авторов, чувствительность ВДТ составляет 44-68%, специфичность – 17-70% [9, 13].
В настоящее время альтернативу бактериологическим исследованиям составляют химические методы дифференциации микроорганизмов, в частности газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС) микробных маркеров. Метод ГХ-МС позволяет анализировать состав микробиоты кишечника в пристеночной биопленке, а не микробиоты фекалий, как принято повсеместно. Он основан на определении компонентов бактериальных клеток, появляющихся в результате их естественного отмирания или атаки компонентов иммунной системы. В качестве маркеров используют минорные липидные компоненты мембран микробов. По их содержанию и количеству можно в течение нескольких часов определить до 170 видов аэробных и анаэробных бактерий и грибов, что позволяет создать микробный метаболический «паспорт» пациента.
В практику микробиологических исследований активно внедряются молекулярно-генетические методы изучения кишечной микробиоты с использованием полимеразной цепной реакции (ПЦР). С помощью ПЦР выделяется фрагмент макромолекулы ДНК или РНК бактериальной клетки, характерный только для конкретного микроорганизма. Метод количественной ПЦР в режиме реального времени заключается в возможности совмещения обнаружения (детекции) фрагментов искомой макромолекулы ДНК или РНК и их количественного определения в режиме реального времени.
К эффективным современным методам исследования микробиоты человека относятся секвенирование, или определение нуклеотидной последовательности ДНК, а также ДНК-микрочипы (DNA microarray). Еще одним молекулярно-генетическим методом считается метагеномика – исследование геномов, полученных от смешанной колонии микроорганизмов. Обсуждается возможность использования «электронного носа» (как способа имитации биологической обонятельной системы) для обнаружения летучих органических соединений в образцах биологического материала (выявление СИБР в амбулаторных условиях).
Лечение пациентов с СИБР должно быть комплексным, включая терапию основного заболевания (этиологическое лечение), устранение избыточного бактериального обсеменения тонкой кишки с восстановлением микробиоценоза кишечника, селективную деконтаминацию патогенной и условно-патогенной микрофлоры кишечника с применением кишечных антисептиков, фитопрепаратов, бактериофагов и антибактериальных препаратов; назначение пробиотиков (бифидобактерии и лактобациллы, которые составляют основу колонизационной резистентности кишечного барьера), нормализацию кишечного пищеварения и всасывания, энтеросорбцию и энтеропротекцию с применением энтеросорбентов, при необходимости – коррекцию моторно-секреторной функции желудочно-кишечного тракта с применением прокинетиков, спазмолитиков, желчегонных, полиферментных, антидиарейных препаратов, поливитаминов.
Показано функциональное питание, которое включает, прежде всего, натуральные продукты растительного, животного и микробного происхождения, содержащие бифидо- и лактобактерии, пищевые волокна, естественные антиоксиданты, пектины, протеины, витамины, минеральные вещества, оказывающие биокорректирующее действие.
К продуктам функционального питания, показанным при тонкокишечном дисбиозе, относят гречку, овсяную крупу, клюкву, картофель, бананы, соевое молоко, кисломолочные продукты.
Следует отметить, что увеличение количества пищевых волокон в рационе и более высокое потребление белка может способствовать метаногенезу, снижая концентрацию желчных кислот, поэтому использование пищевых волокон должно быть индивидуальным и не превышать 25-35 г/сут [28].
Приверженность диетическим рекомендациям способствует модуляции кишечной микробиоты. Предполагают разработку индивидуальных рационов питания для профилактики или лечения СИБР, основанных на «генетическом паспорте» микробиоты конкретного человека.
Для лечения СИБР в тонкой кишке обычно применялась трехступенчатая схема: 1) пробиотик; 2) кишечный антисептик; 3) антибиотик с контролем эффекта дыхательным тестом с лактулозой между ступенями [9].
Показаниями для назначения антибактериальных средств являются: избыточный бактериальный рост в тонкой кишке, транслокация кишечных бактерий за пределы кишки, воспалительные процессы в кишечнике, выявление условно-патогенной флоры в кишечнике, отсутствие эффекта от лечения без проведения деконтаминации [1].
При избыточном бактериальном росте в кишечнике предпочтение следует отдавать кишечным антисептикам, которые не всасываются в ЖКТ и минимальным образом влияют на облигатную микрофлору (рифаксимин, нитрофураны, метронидазол).
Наибольший опыт лечения СИБР в мире был приобретен с использованием рифаксимина.
Рифаксимин не обладает традиционным антибактериальным эффектом, он положительно влияет на кишечную микробиоту, в первую очередь на увеличение Bifidobacterium, Faecalibacterium prausnitzii и лактобактерий, без нарушения общего состава микробиоты [28]. Увеличение числа лактобактерий и подавление адгезии бактерий к СО кишечника опосредует противовоспалительные эффекты рифаксимина [1, 11, 14, 15, 18]. В микробиологических исследованиях установлено, что рифаксимин оказывает бактерицидное действие, ингибируя синтез РНК бактерий в результате связывания 3-й единицы ДНК-зависимой РНК-полимеразы бактерий [1].
Эубиотические эффекты рифаксимина были подтверждены в клинических исследованиях, где продемонстрировано значительное увеличение числа лактобактерий в конце периода лечения (10 дней), которое сохранялось в течение месяца, что подтверждает противовоспалительную активность рифаксимина [26]. По данным различных исследований, рифаксимин улучшает симптомы у 33-92% пациентов и нивелирует избыточный бактериальный рост при СИБР у 80% пациентов [16, 20]. Отмечается отсутствие резистентности внутрикишечных бактерий к рифаксимину за счет его селективного действия в ЖКТ по сравнению с системными антибиотиками. Анализ результатов применения рифаксимина у 8,5 млн человек показал, что препарат обладает высоким профилем безопасности, не влияет на метаболизм других лекарственных препаратов, используемых одновременно с ним, благодаря отсутствию специфического воздействия на ферменты цитохрома Р‑450 и очень низкой абсорбции (<0,4%) [1].
В лечении СИБР используются пре- и пробиотики с целью повышения колонизационного барьера кишечника и модуляции кишечной микробиоты. Высокоактивные сорбенты на основе лигнина, кремния, пектина, целлюлозы оказывают сорбционное, противомикробное, дезинтоксикационное действие. Для коррекции болевого синдрома применяются селективные кишечные спазмолитики. В случае выраженного дуоденостаза назначаются прокинетики. С целью устранения избыточного метеоризма применяются пеногасители, для повышения общей реактивности организма назначаются витаминно-минеральные комплексы, сбалансированные диетические лечебные смеси, антиастенические средства.
Прогноз при СИБР определяет основное заболевание, которое приводит к избыточному бактериальному росту в тонкой кишке. Помимо наличия основного заболевания, приводящего к СИБР, другими факторами риска рецидива данной патологии являются нерациональное питание, неконтролируемый прием антибиотиков, старший возраст, аппендэктомия в анамнезе и длительное лечение ИПП [17].
Список литературы находится в редакции.



