9 вересня, 2019
Тромбоэмболические осложнения у больного с имплантацией искусственного водителя ритма
Тромбоэмболия легочной артерии (ТЭЛА) чаще всего ассоциируется с наличием тромбоза глубоких вен (ТГВ) нижних конечностей и объединяется с ним в одно понятие «венозный тромбоэмболизм» (ВТЭ). У терапевтической группы пациентов, в зависимости от наличия предрасполагающих факторов и их выраженности, существует риск возникновения ТЭЛА. Настороженность врача в отношении оценки вероятности развития ТЭЛА – первый шаг в диагностике, лечении и профилактике этого грозного состояния, которое вызывает до трети летальных исходов в стационаре [1].
Для оценки вероятности развития ВТЭ применяется балльная система шкал, согласно которым пациенты стратифицируются в группы низкого или высокого риска в зависимости от количества баллов (шкалы Padua, Improve). Также существуют методики оценки клинической вероятности ТЭЛА и риска кровотечений. Однако стоит отметить, что все имеющиеся системы дают возможность проанализировать степень развития ТЭЛА, но не установить диагноз.
По данным современных рекомендаций, ТЭЛА считается «подтвержденной», если ее вероятность достаточно высока для назначения специфической терапии, и «исключенной» – если при отсутствии специфической терапии риск развития относительно невысок [2]. Признаки и симптомы заболевания неспецифичны, поэтому при возникновении подозрений необходимо проводить тщательное обследование пациента. Наиболее часто встречающиеся симптомы массивной ТЭЛА: диспноэ – 50%, колющая боль в грудной клетке – 39%, давящая боль за грудиной – 5%, кашель – 23%, потеря сознания – 6%, кровохарканье – 8% [3, 4].
Предрасполагающие факторы сгруппированы по относительному риску развития ТЭЛА: слабый, средний и высокий [2, 5].
Слабый:
- постельный режим более трех дней;
- длительное пребывание в положении сидя (например, в самолете, машине);
- возраст (с течением времени риск повышается);
- лапароскопические операции (например, холецистэктомия);
- ожирение;
- беременность;
- варикозная болезнь;
- сахарный диабет;
- артериальная гипертензия.
Средний:
- артроскопические операции на коленном суставе;
- центральные венозные катетеры;
- химиотерапия;
- хроническая сердечная или дыхательная недостаточность (ДН);
- заместительная гормональная терапия;
- злокачественные новообразования;
- прием пероральных контрацептивов;
- инсульты с развитием параличей;
- послеродовой период;
- аутоиммунные заболевания;
- трансфузии крови;
- инфекции (особенно пневмонии, инфекции мочевыводящих путей и ВИЧ);
- воспалительные заболевания кишечника;
- экстракорпоральное оплодотворение;
- тромбоз поверхностных вен.
Сильный:
- переломы нижних конечностей (костей голени, бедренной кости);
- протезирование тазобедренных или коленных суставов;
- большие хирургические операции;
- тяжелые травмы;
- повреждение спинного мозга;
- госпитализация по поводу сердечной недостаточности (СН) или фибрилляции (трепетания) предсердий (ФП) в течение предшествующих трех месяцев;
- инфаркт миокарда (в предшествующие три месяца);
- предшествующие эпизоды ВТЭ.
Есть факторы риска, которые не учтены или не полностью прописаны как вероятные по причинно-следственной связи развития ТЭЛА.
В связи с актуальностью вопроса, в статье представлен клинический случай пациента с ТЭЛА и имплантированным электрокардиостимулятором (ЭКС), который может привлечь внимание с практической точки зрения, а также повысить настороженность врачей относительно возможной причины развития заболевания. Кроме того, данное клиническое наблюдение представляет интерес для профилактического применения антикоагулянтов после имплантации ЭКС.
Клинический случай
Пациент, 78 лет, поступил в клинику 14.02.2019 через две недели после первого обращения в поликлинику по поводу сухого кашля, одышки, субфебрильной температуры тела (37,3). Провел в больнице пять койко-дней.
В анамнезе: в 2015 г. – имплантация постоянного искусственного водителя ритма сердца (ИВР) ЭКС‑522 (VVI) по поводу интермиттирующей атриовентрикулярной блокады (АВ) III степени и ФП. Выписан из стационара в удовлетворительном состоянии, проводилась антитромбоцитарная терапия, но антикоагулянты не были рекомендованы.
Ухудшение самочувствия отмечает в течение последних двух недель.
29.01.2019 с диагностической целью больному проведена рентгенография органов грудной клетки, сделано заключение о наличии двусторонней пневмонии. В связи с неэффективностью предшествующего лечения на амбулаторном этапе, пациент обращался в университетскую клинику, где была проведена коррекция проводимого лечения. Состояние не улучшалось, обратился в областную клиническую больницу, где ему отказали в госпитализации на основании «отсутствия показаний».
11.02.2019 проведена компьютерная томография (КТ) органов грудной клетки. Заключение: КТ-картина застойных явлений в малом круге кровообращения. Признаки интерстициального отека легких. Двусторонний малый гидроторакс.
12.02.2019 – ухудшение самочувствия. Лечение кордароном, аспаркамом, коргликоном, тиотриазолином, милдрокардом, рибоксином, сульфокамфокаином, спиронолактоном, фуросемидом, цефтриаксоном, эноксапарином, амброксолом, реосорбилактом и глюкозой оказалось неэффективным. Вызвал «скорую помощь» и был ургентно госпитализирован в больницу по месту жительства.
В течение двух суток на фоне проводимого лечения состояние не улучшалось.
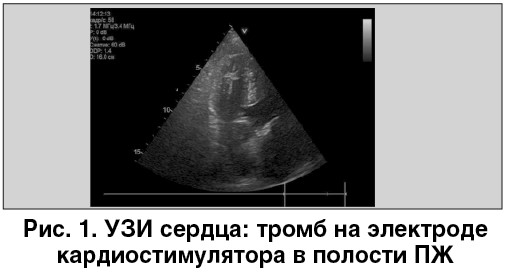 В стационаре проведен консультативный осмотр пациента профессором, проведено ультразвуковое исследование (УЗИ) сердца, обнаружен тромб на электроде кардиостимулятора в полости правого желудочка (ПЖ) (рис. 1) установлен диагноз ТЭЛА высокого риска. SpO2 – 54% без ингаляции кислорода, 81% – с ингаляцией кислорода.
В стационаре проведен консультативный осмотр пациента профессором, проведено ультразвуковое исследование (УЗИ) сердца, обнаружен тромб на электроде кардиостимулятора в полости правого желудочка (ПЖ) (рис. 1) установлен диагноз ТЭЛА высокого риска. SpO2 – 54% без ингаляции кислорода, 81% – с ингаляцией кислорода.
14.02.2019 больной в ургентном порядке переведен в Одесскую городскую клиническую больницу № 3 имени профессора Л.И. Алейниковой для проведения специфического лечения. Диагноз: тромб электрода ПЖ. ТЭЛА высокого риска. Ишемическая болезнь сердца (ИБС). Диффузный кардиосклероз. Полная преходящая АВ-блокада. Имплантация ИВР (2015 г.). Пароксизмальная ФП, трепетание предсердий, пароксизм неизвестной давности. Недостаточность митрального клапана (МК) III ст., недостаточность аортального клапана (АК) I ст., СН IIА.
При поступлении отмечались небольшая тахикардия (90/мин), тахипноэ (31/мин) при показателях артериального давления 140/90 мм рт. ст.
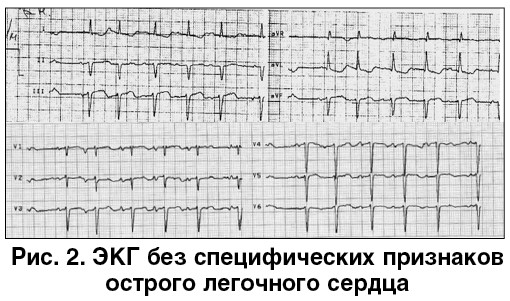 Электрокардиография (ЭКГ). Специфических признаков острого легочного сердца не обнаружено (рис. 2).
Электрокардиография (ЭКГ). Специфических признаков острого легочного сердца не обнаружено (рис. 2).
УЗИ сердца. Дилатация полостей правого предсердия, ПЖ, лоцируется электрод в полости правого предсердия и ПЖ без признаков тромбоза, фиксирован у верхушки ПЖ. Регургитация на трикуспидальном клапане I ст., давление в легочной артерии – 70 мм рт. ст., при фракции выброса (ФВ) левого желудочка (ЛЖ) 45%.
В связи с дестабилизацией гемодинамических показателей, которая сопровождалась уменьшением сатурации артериальной крови на фоне ингаляции кислорода (SpO2 56%), пациенту проведена фибринолитическая терапия (50 мг альтеплазы в течение 15 мин) c предварительным внутривенным введением 5000 МЕ нефракционированного гепарина (НФГ). Уменьшилась одышка, исчезла тахикардия, увеличилась сатурация кислорода до 75% без ингаляции. Продолжена внутривенная инфузия НФГ 150 МЕ/кг/ч под контролем активированного частичного тромбопластинового времени (50‑86 с).
После стабилизации гемодинамических показателей больному проведено контрольное УЗИ сердца: дилатация полостей правого предсердия, ПЖ, лоцируется электрод в полости правого предсердия и ПЖ без признаков тромбоза, фиксирован у верхушки ПЖ. Регургитация на трикуспидальном клапане I ст., давление в легочной артерии – 30 мм рт. ст., при ФВ ЛЖ 47%.
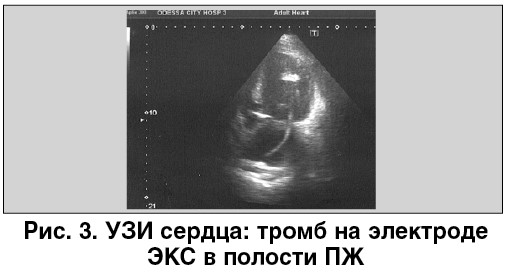 В остальном картина оказалась идентичной предшествующему исследованию, но в своем заключении врач УЗИ не отметил наличие тромба на электроде ЭКС в полости ПЖ (рис. 3).
В остальном картина оказалась идентичной предшествующему исследованию, но в своем заключении врач УЗИ не отметил наличие тромба на электроде ЭКС в полости ПЖ (рис. 3).
Через 14 часов у больного вновь возникла одышка, тахикардия, АД снизилось до 110/70 мм рт. ст. Повторно назначена фибринолитическая терапия (50 мг альтеплазы в течение 15 мин), продолжено антикоагулянтное лечение. Через 8 мин после окончания инфузии альтеплазы у пациента развилась резкая брадикардия, трансформировавшаяся в идиовентрикулярный ритм. ЭКС не включился, хотя исходно был запрограммирован на работу в режиме «по требованию». Развилась электромеханическая диссоциация – состояние клинической смерти (рис. 4). Проведенные реанимационные мероприятия эффекта не дали. Констатирована биологическая смерть.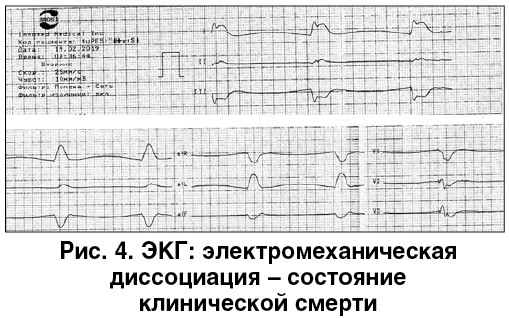
Установлен окончательный клинический диагноз:
- Основной: тромбоз электрода в полости ПЖ; ТЭЛА высокого риска; тромболитическая терапия (ТЛТ) проведена 14/15.02.2019.
- Осложнение: инфаркт-пневмония; ДН III ст.; отказ ИВР; электромеханическая диссоциация.
- Сопутствующий: ИБС; диффузный кардиосклероз; синдром слабости синусового узла; ФП, пароксизмальная форма; преходящая полная АВ-блокада; имплантация ИВР (2015 г.), операция – репозиция электрода в полости ПЖ (2015 г.); недостаточность митрального клапана III ст., недостаточность аортального клапана I ст.; СН IIБ.
Патологоанатомическое исследование проведено в тот же день.
Патологоанатомический диагноз:
- Основной: хроническая ИБС; атеросклеротический кардиосклероз при стенозирующем более чем на 2/3 атеросклеротическом коронаросклерозе и гипертонической болезни (толщина стенки ЛЖ – 2 см, масса сердца – 380 г).
- Осложнение: хроническая СН: гидроторакс справа и слева 500 мл, гидроперикард – 80 мл, асцит – 500 мл, состояние после имплантации ИВР в 2015 г.; тромбоз электрода ИВР (по клиническим данным); состояние после ТЛТ; мелкоочаговые субарахноидальные кровоизлияния в обеих затылочных долях; паренхиматозная дистрофия печени, почек, миокарда; отек легких, ткани головного мозга.
- Сопутствующий: атеросклеротический порок – недостаточность митрального клапана.
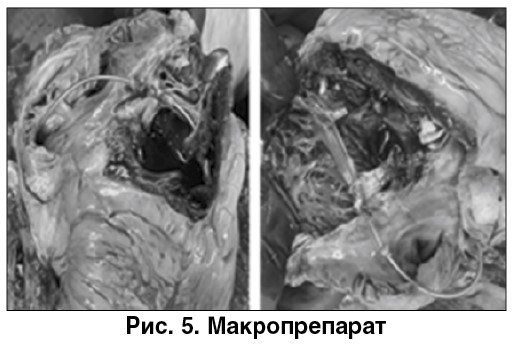 При патологоанатомическом исследовании сердца обнаружено, что электрод ИВР проходит через полость ПЖ и сквозь трабекулярную мышцу (рис. 5).
При патологоанатомическом исследовании сердца обнаружено, что электрод ИВР проходит через полость ПЖ и сквозь трабекулярную мышцу (рис. 5).
Ретроспективный анализ записей в истории болезни динамики течения заболевания позволяет предположить, что, по клиническим данным, у больного имела место ТЭЛА с успешной реперфузией в системе легочной артерии после проведения ТЛТ. Однако нет уверенности в том, что источник тромбоэмболии был правильно идентифицирован, поскольку визуальное утолщение дистальной части электрода на УЗИ могло быть обусловлено не наличием тромба, а эффектом наслоения отражения ультразвука от участка трабекулярной мышцы, через который введен электрод (рис. 6). Возможно, картина танатогенеза была обусловлена также нарастающей СН в сочетании с отказом работы имплантированного ЭКС. Не исключена и гипердиагностика ТЭЛА.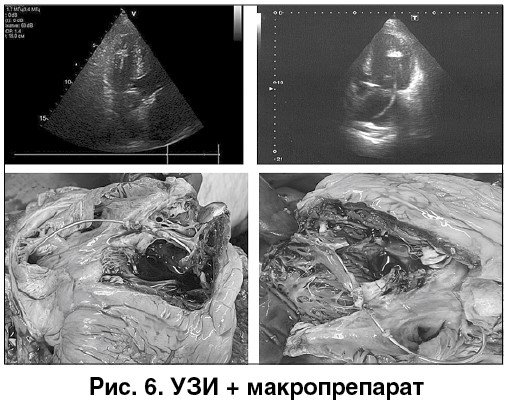
Выводы
Анализ данного клинического случая порождает больше вопросов, чем ответов.
Но на главный вопрос «Необходимо ли было в 2015 г. после имплантации больному ИВР при ФП назначить антикоагулянты?» существует один ответ – «Да!». А вот вопрос для дискуссий: «Каждому ли пациенту следует назначать антикоагулянтную терапию после имплантации ИВР?». Возможно, нет. Однако при задокументированных эпизодах ФП – безусловно, да.
Литература
- Верткин А.Л., Грицанчук А.М. Тромбоэмболия легочной артерии: эпидемия, о которой все молчат // Архивъ внутренней медицины. – 2014. – № 1 (15).
- Авторы/члены рабочей группы: Konstantinides S.V. (председатель) (Германия/Греция), Torbicki A. (сопредседатель) (Польша), Agnelli G. (Италия), Danchin N. (Франция), Fitzmaurice D. (Соединенное Королевство), Gali N. (Италия), Simon J., Gibbs R. (Великобритания), Huisman M.V. (Нидерланды), Humbert M. (Франция), Kucher N. (Швейцария), Lang I. (Австрия), Lankeit M. (Германия), Lekakis J. (Греция), Maack C. (Германия), Mayer E. (Германия), Meneveau N. (Франция), Perrier A. (Швейцария), Pruszczyk P. (Польша), Rasmussen L.H. (Дания), Schindler T.H. (США), Svitil P. (Чехия), Noordegraaf A.V. (Нидерланды), Zamorano J.L. (Испания), Zompatori M. (Италия). Комитет ESC по подготовке практических рекомендаций (КПР): Zamorano J.L. (председатель) (Испания), Achenbach S. (Германия), Baumgartner H. (Германия), Bax J.J. (Нидерланды), Bueno H. (Испания), Dean V. (Франция), Deaton C. (Великобритания), Erol C. (Турция), Fagard R. (Бельгия), Ferrari R. (Италия), Hasdai D. (Израиль), Hoes A. (Нидерланды), Kirchhof P. (Германия/Великобритания), Knuuti J. (Финляндия), Kolh P. (Бельгия), Lancellotti P. (Бельгия), Linhart A. (Чехия), Nihoyannopoulos P. (Великобритания), Piepoli F.M. (Италия), Ponikowski P. (Польша), Sirnes P.A. (Норвегия), Tamargo J.L. (Испания), Tendera M. (Польша), Torbicki A. (Польша), Wijns W. (Бельгия), Windecker S. (Швейцария). 2014 ESC Guidelines On The Diagnosis And Management Of Acute Pulmonary Embolism / The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS).
- Sue D.Y. Pulmonary Disease. In: Dongard F.S. (ed.) // Critical Care Diagnosis & Treatment –US – a lange medical book. – First Edition. – P. 496.
- Task Force Report. Guidelines on diagnosis and management of acute pulmonary embolism / European Society of Cardiology // Europ Heart J. – 2000. – Vol. 21, P. 1301‑1336.
- Перепеч Н.Б. Научно-клинический и образовательный центр «Кардиология» Института высоких медицинских технологий медицинского факультета Санкт-Петербургского государственного университета. Тромбоэмболия легочной артерии диагностика и лечение // Медицинский совет. – 2015. – № 12.
Спецвипуск «Клінічні випадки та сценарії у невідкладній кардіології», вересень 2019 р


