13 вересня, 2019
Клинический случай ведения пациента с тромбоэмболией легочной артерии промежуточно-высокого риска
Пациент А., 55 лет, доставлен в отдел реанимации и интенсивной терапии ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины (г. Киев) каретой скорой медицинской помощи с диагнозом «ишемическая болезнь сердца: острый коронарный синдром (ОКС) без элевации сегмента ST». На момент поступления предъявлял жалобы на боли за грудиной давящего характера, умеренную одышку. По словам больного, дискомфорт (боли) за грудиной, сопровождающийся умеренной одышкой, отмечается после физической нагрузки в течение последней недели. В день поступления после подъема по лестнице почувствовал резкую одышку, позже появилась боль давящего характера, что послужило причиной обращения за медицинской помощью. В анамнезе: артериальная гипертензия, хронический гастродуоденит, варикозное расширение и тромбофлебит вен нижних конечностей (в 2010 г. проводились флебэктомия и удаление тромба из глубоких вен нижних конечностей). Регулярно терапию не применял.
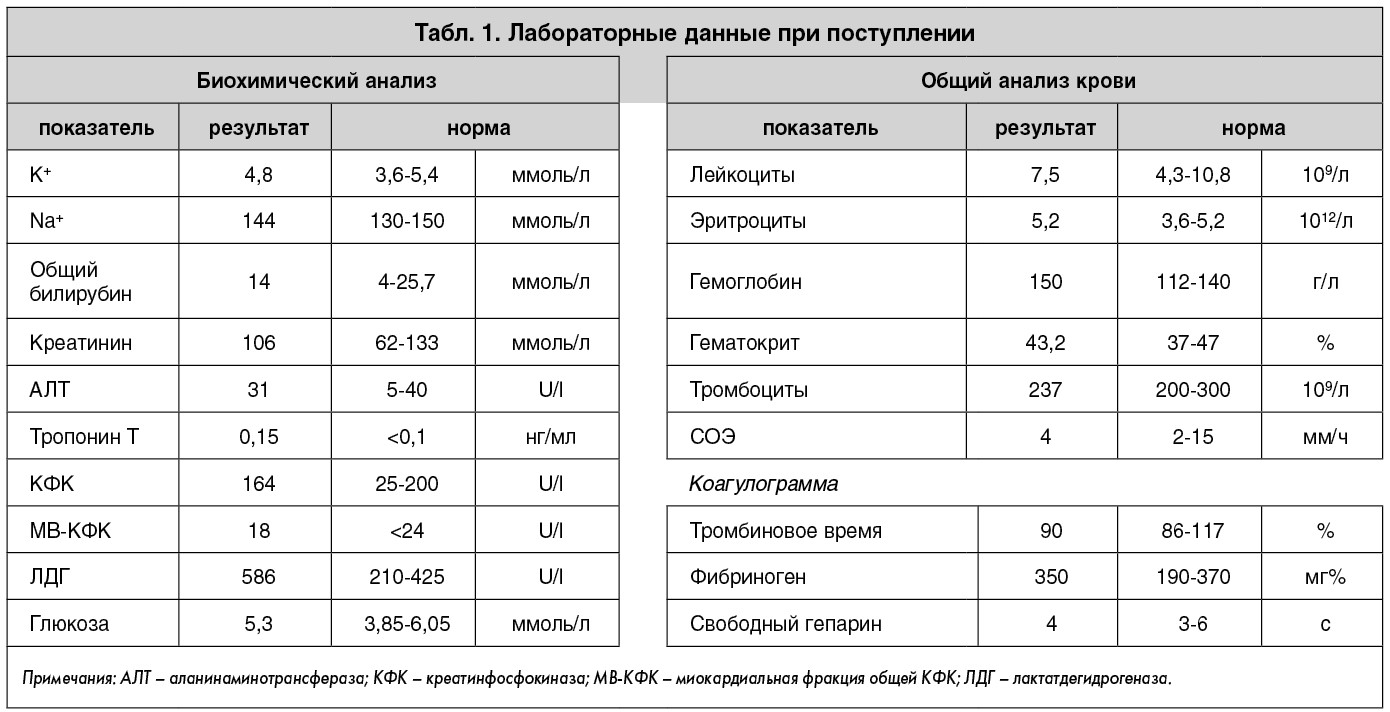
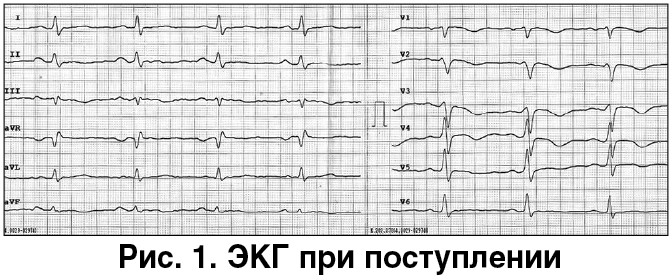 При поступлении общее состояние – средней степени тяжести. Повышенного питания. Кожные покровы телесной окраски, акроцианоз, слизистые оболочки с цианотичным оттенком. Артериальное давление – 120/80 мм рт. ст., частота сердечных сокращений (ЧСС) – 90 уд./мин, насыщение артериальной крови кислородом при пульсоксиметрии (SpO2) – 87% (93% на фоне оксигенотерапии). Деятельность сердца ритмичная, тоны приглушены. В легких дыхание жесткое, хрипы не выслушиваются. Живот безболезненный, мягкий. Нижний край печени чувствительный, на 4 см ниже края реберной дуги. Пастозность голеней с обеих сторон. Варикозное расширение вен нижних конечностей. Электрокардиограмма (ЭКГ) и данные лабораторных исследований представлены на рисунке 1 и в таблице 1.
При поступлении общее состояние – средней степени тяжести. Повышенного питания. Кожные покровы телесной окраски, акроцианоз, слизистые оболочки с цианотичным оттенком. Артериальное давление – 120/80 мм рт. ст., частота сердечных сокращений (ЧСС) – 90 уд./мин, насыщение артериальной крови кислородом при пульсоксиметрии (SpO2) – 87% (93% на фоне оксигенотерапии). Деятельность сердца ритмичная, тоны приглушены. В легких дыхание жесткое, хрипы не выслушиваются. Живот безболезненный, мягкий. Нижний край печени чувствительный, на 4 см ниже края реберной дуги. Пастозность голеней с обеих сторон. Варикозное расширение вен нижних конечностей. Электрокардиограмма (ЭКГ) и данные лабораторных исследований представлены на рисунке 1 и в таблице 1.
Таким образом, анамнестические, клинические и лабораторные данные свидетельствовали о необходимости проведения дифференциальной диагностики между тромбоэмболией легочной артерии (ТЭЛА) и ОКС. Клиническая вероятность ТЭЛА у пациента оценена как средняя (4,5 балла по шкале Wells и 6 баллов по шкале Женевский счет) [4]. На этапе диагностического поиска больному была назначена полнодозовая антикоагулянтная терапия в дополнение к нагрузочным дозам ацетилсалициловой кислоты и клопидогреля, которые он получал на догоспитальном этапе в связи с подозрением на ОКС. В данной ситуации предпочтительным антикоагулянтным препаратом являлся эноксапарин.
На сегодняшний день эноксапарин имеет наибольшую среди всех низкомолекулярных гепаринов (НМГ) доказательную базу у лиц с ОКС, а также хорошо зарекомендовал себя в лечении венозной тромбоэмболии (ВТЭ). У пациентов с ТЭЛА назначение НМГ имеет сравнимую эффективность и более благоприятную безопасность (меньшее количество больших кровотечений и меньшую вероятность развития гепарин-индуцированной тромбоцитопении) по сравнению с нефракционированным гепарином (НФГ). Немаловажным преимуществом НМГ является возможность назначения в стандартной дозе, причем для эноксапарина доза препарата 1 мг/кг массы тела 2 р/сут рекомендована как при ОКС, так и у больных ВТЭ. Назначение НФГ возможно только при условии тщательного лабораторного контроля за антикоагулятной эффективностью посредством измерения активированного частичного тромбопластинового времени. Пациент также получал β-блокаторы, статины и блокаторы протонной помпы.
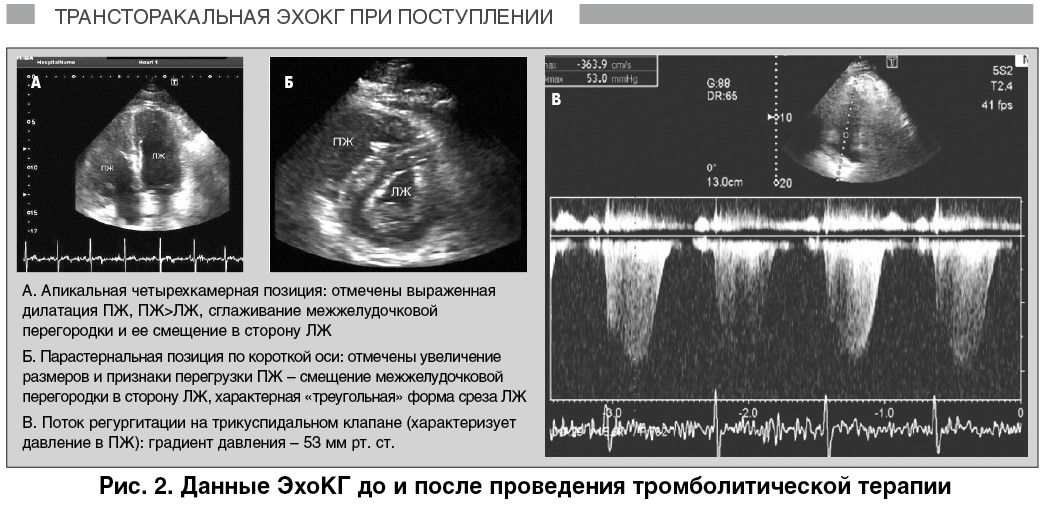
С целью дифференциальной диагностики была проведена трансторакальная эхокардиография (ЭхоКГ), которая подтвердила отсутствие нарушений сегментарной сократимости левого желудочка (ЛЖ) и выявила признаки дилатации и перегрузки правых отделов сердца (рис. 2).
ЭхоКГ при поступлении. Градиент давления на трикуспидальном клапане составил 53 мм рт. ст. У пациента отмечен положительный признак МакКоннелла – выраженное нарушение сократимости свободной стенки правого желудочка (ПЖ) при сохраненной сократимости его верхушки, который является высокоспецифичным признаком острой ТЭЛА [4].
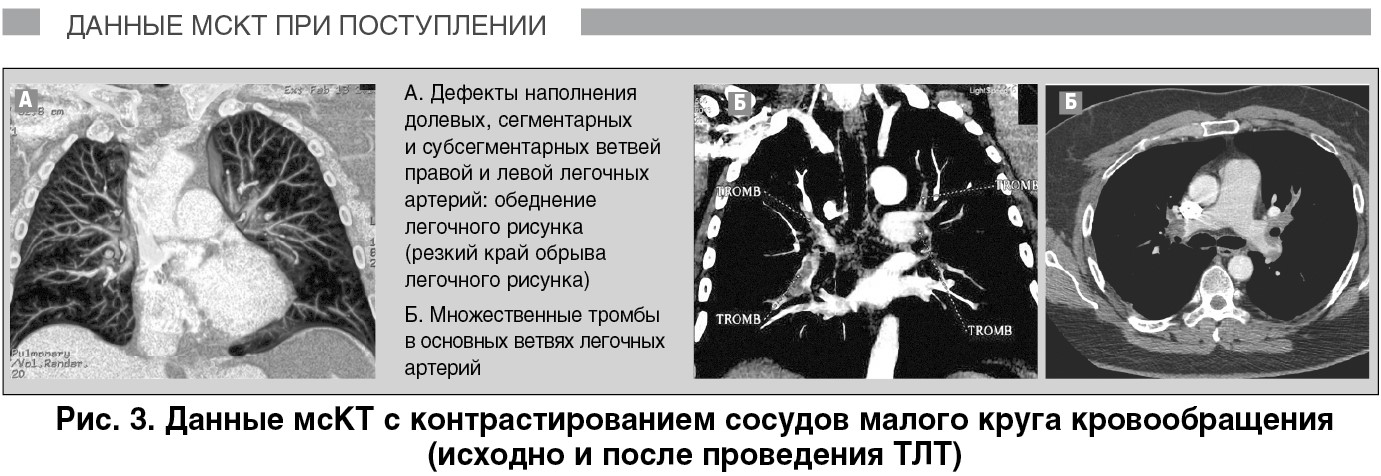
Для окончательной верификации диагноза (поскольку состояние больного оставалось гемодинамически стабильным) была проведена мультиспиральная компьютерная томография (мсКТ), которая подтвердила наличие ТЭЛА и выявила множественные тромбы в основных ветвях обеих легочных артерий (рис. 3).
Современная классификация ТЭЛА основана не на морфологических критериях степени обструкции русла легочной артерии, а на клинической картине заболевания и определяет риск развития смерти у данной категории пациентов. В ряде исследований, проведенных в середине 2000-х гг., было показано, что данные КТ не позволяют точно прогнозировать риск смерти от ТЭЛА, а степень тромбоза основных разветвлений легочной артерии у умерших и выживших лиц с субмассивной ТЭЛА практически не отличалась. В соответствии с современной классификацией и с учетом клинической картины заболевания (нормальные параметры центральной гемодинамики), данных инструментальных (признаки дисфункции ПЖ на ЭхоКГ, мсКТ) и лабораторных (повышение уровня тропонина) методов исследования, у пациента была диагностирована ТЭЛА промежуточно-высокого риска [2, 4].
Таких пациентов необходимо немедленно госпитализировать в отделения реанимации / неотложной терапии с возможностью постоянного мониторного наблюдения за параметрами центральной гемодинамики, где у них должна быть продолжена парентеральная антикоагулянтная терапия. В отличие от больных высокого риска (нарушения гемодинамики в виде шока или стойкой артериальной гипотензии), у которых проведение тромболитической терапии (ТЛТ) при отсутствии противопоказаний является обязательным, у лиц с промежуточно-высоким риском этот вопрос окончательно не решен.
В 2013 г. были оглашены результаты многоцентрового рандомизированного плацебо-контролируемого исследования PEITHO, которое на сегодняшний день является самым большим проектом, посвященным данной проблеме [8]. В исследование вошло 1006 пациентов (медиана возраста – 70 лет) с ТЭЛА, которых рандомизировали для приема антикоагулянта/плацебо или антикоагулянта/тенектеплазы. У всех больных диагноз ТЭЛА подтверждался при помощи методов визуализации (в 95% случаев – мсКТ), а также были выявлены дисфункция ПЖ (ЭхоКГ или мсКТ) и повышение уровня тропонинов; таким образом, пациенты имели промежуточно-высокий риск согласно современной классификации ТЭЛА. Частоту случаев смерти и/или развития гемодинамического коллапса в течение семи дней наблюдения оценивали в качестве первичной конечной точки. Проведение ТЛТ позволило снизить вероятность развития событий первичной конечной точки на 56% (2,6% в группе тенектеплазы по сравнению с 5,6% – плацебо; p=0,015). В то же время не было получено достоверного влияния ТЛТ на вероятность смерти от всех причин как через семь (1,2% в группе ТЛТ по сравнению с 1,8% – контроля; р=0,43), так и 30 дней наблюдения (2,4 по сравнению 3,2% соответственно; p=0,42). Проведение ТЛТ тенектеплазой сопровождалось достоверным увеличением количества больших кровотечений в течение 30 дней наблюдения: 6,3 против 1,5% в группе плацебо (p<0,001), а также геморрагических инсультов: 10 против 1 в группе плацебо.
По результатам длительного наблюдения, проводившегося у части пациентов (~98% в течение 6 мес и ~83% в течение 24 мес), включенных в исследование, также не было выявлено различий между группами по частоте летальных случаев от всех причин [5]. Более того, выделенные группы не отличались по функциональному состоянию – длительности персистирования и выраженности одышки, а также частоте развития хронической посттромбоэмболической легочной гипертензии. Таким образом, предотвращение гемодинамических осложнений в ранний период заболевания на фоне ТЛТ у лиц с ТЭЛА промежуточно-высокого риска не реализовалось в последующее снижение смерти от всех причин (как при кратковременном, так и при длительном наблюдении) или улучшение функционального состояния пациентов, однако сопровождалось увеличением геморрагических осложнений.
В то же время, по данным одного из последних метаанализов, в который было включено 1775 пациентов с субмассивной ТЭЛА (8 исследований), проведение ТЛТ достоверно снижало летальность (1,39% при ТЛТ против 2,92% без ТЛТ; p=0,03), однако приводило к более чем трехкратному повышению количества больших кровотечений (7,74% при ТЛТ против 2,25% без ТЛТ; p<0,001) [1]. В другом метаанализе (n=1833, 11 исследований) существенное уменьшение повторных эпизодов ТЭЛА на фоне ТЛТ не ассоциировалось с достоверным снижением смерти и сопровождалось увеличением риска больших и внутричерепных кровотечений у гемодинамически стабильных больных [11]. Согласно полученным данным, для того чтобы у лиц с гемодинамически стабильной ТЭЛА, получающих антикоагулянты, развилось одно дополнительное большое кровотечение или геморрагический инсульт, необходимо провести ТЛТ 27 и 91 пациенту соответственно, а чтобы предотвратить одну смерть, – назначить ТЛТ 125 больным.
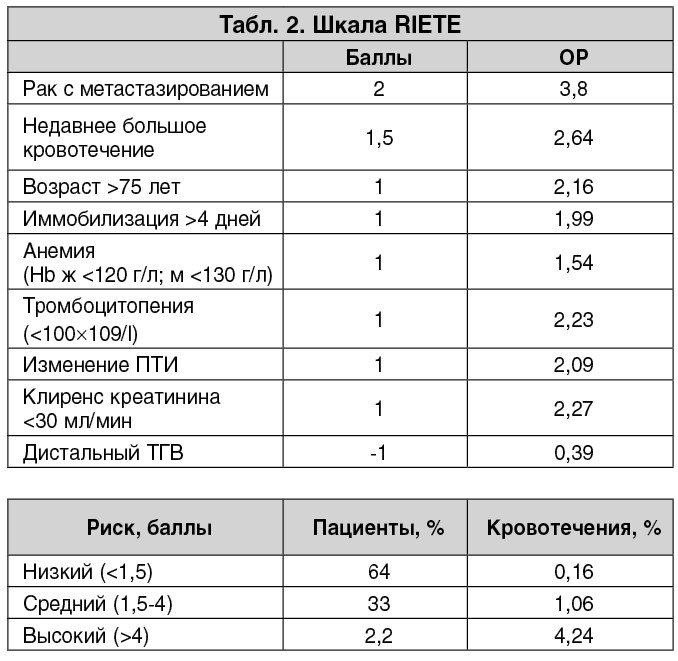 В настоящее время большинство экспертов сходятся во мнении, что у лиц с ТЭЛА промежуточно-высокого риска должна быть предпринята выжидательная тактика [2, 4]. Проведение ТЛТ показано только тем пациентам, у которых на фоне инициальной антикоагулянтной терапии отмечены отсутствие клинической стабилизации состояния, прогрессирование симптоматики заболевания или развитие нового гемодинамического компромисса. Повышения безопасности ТЛТ возможно также добиться путем отбора для этой процедуры больных с минимальным риском кровотечений или путем изменения режима/способа введения фибринолитика. К сожалению, в настоящее время отсутствует общепринятая шкала для определения риска кровотечений у лиц с ТЭЛА. В 2010 г. на основе анализа данных более 24 тыс. пациентов с ТЭЛА, включенных в регистр RIETE [9], была предложена шкала риска развития фатальных кровотечений (табл. 2). Более новая шкала VTE-BLEED (табл. 3) разработана на базе исследования RE-COVER и определяет степень риска возникновения больших кровотечений [3]. Обе методики не являются специфичными для больных, которым планируется проведение ТЛТ, однако позволяют среди всех лиц с ТЭЛА выделить категории с очень высоким риском геморрагических осложнений и, соответственно, высоким риском осложнений при проведении системной ТЛТ. Такие факторы риска, как активное злокачественное новообразование, анемия, кровотечение в анамнезе, возраст и почечная дисфункция являются общими в обеих клинических шкалах.
В настоящее время большинство экспертов сходятся во мнении, что у лиц с ТЭЛА промежуточно-высокого риска должна быть предпринята выжидательная тактика [2, 4]. Проведение ТЛТ показано только тем пациентам, у которых на фоне инициальной антикоагулянтной терапии отмечены отсутствие клинической стабилизации состояния, прогрессирование симптоматики заболевания или развитие нового гемодинамического компромисса. Повышения безопасности ТЛТ возможно также добиться путем отбора для этой процедуры больных с минимальным риском кровотечений или путем изменения режима/способа введения фибринолитика. К сожалению, в настоящее время отсутствует общепринятая шкала для определения риска кровотечений у лиц с ТЭЛА. В 2010 г. на основе анализа данных более 24 тыс. пациентов с ТЭЛА, включенных в регистр RIETE [9], была предложена шкала риска развития фатальных кровотечений (табл. 2). Более новая шкала VTE-BLEED (табл. 3) разработана на базе исследования RE-COVER и определяет степень риска возникновения больших кровотечений [3]. Обе методики не являются специфичными для больных, которым планируется проведение ТЛТ, однако позволяют среди всех лиц с ТЭЛА выделить категории с очень высоким риском геморрагических осложнений и, соответственно, высоким риском осложнений при проведении системной ТЛТ. Такие факторы риска, как активное злокачественное новообразование, анемия, кровотечение в анамнезе, возраст и почечная дисфункция являются общими в обеих клинических шкалах.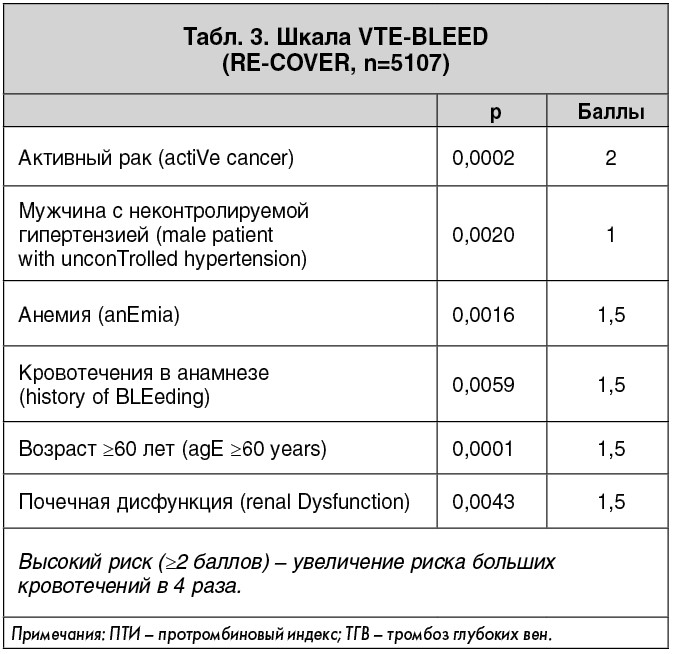
Предпосылками к снижению дозы тромболитического препарата у больных ТЭЛА могут быть особенности кровоснабжения легких (единственный орган, через который проходит весь объем циркулирующей крови и, соответственно, вся доза фибринолитика, введенная системно) и высокая активность собственной фибринолитической системы в легочной ткани [13]. Такой подход также тестировался в ряде небольших исследований. В проспективном рандомизированном многоцентровом испытании C. Wang et al. [14] в ходе обследования 118 пациентов с массивной и субмассивной ТЭЛА не было выявлено существенных отличий между двумя режимами введения альтеплазы в дозах 50 или 100 мг (инфузия в течение 2 ч) по основным показателям эффективности: функция ПЖ и динамика систолического давления в легочной артерии по данным ЭхоКГ; степень обструкции легочных артерий по данным мсКТ; количество дефектов наполнения по данным вентиляционно-перфузионной сцинтиграфии. Оба режима ТЛТ также существенно не отличались по влиянию на летальность и вероятность развития повторных ВТЭ. В то же время при использовании низкодозового режима наблюдалась тенденция к более редкому развитию больших кровотечений (3 по сравнению с 10% соответственно; р=0,288), особенно у пациентов с массой тела <65 кг (14,8 по сравнению с 41,2% соответственно; р=0,049).
В многоцентровом рандомизированном исследовании MOPETT у 121 больного с субмассивной ТЭЛА тестировалось введение «безопасной» дозы альтеплазы (50 мг у пациентов c массой тела ≥50 кг или 0,5 мг/кг при массе тела <50 кг) на фоне «безопасного» режима антикоагулянтной терапии (по сравнению со стандартными дозами антикоагулянтов) [12]. Проведение ТЛТ привело к достоверному снижению вероятности развития первичной конечной точки (повторная ТЭЛА + легочная гипертензия) через 28 мес наблюдения (р<0,001). В группе ТЛТ также достоверно реже наблюдались случаи развития смерти и повторных ВТЭ (1,6 по сравнению с 10%; р=0,049), а также существенно сокращались сроки пребывания пациентов в стационаре (p<0,001). В исследовании MOPETT большие кровотечения не были зарегистрированы ни в одной из групп.
Значительное снижение дозы тромболитического агента возможно также при использовании катетерного (направленного) тромболизиса. Этот метод позволяет дополнительно напрямую контролировать давление в системе легочной артерии и в онлайн-режиме оценивать эффективность терапии, однако является инвазивным и связан с дополнительным перипроцедурным риском (в том числе кровотечений). В настоящее время имеются результаты трех исследований, посвященных применению катетерной направленной ТЛТ (КНТ) у пациентов с ТЭЛА. В исследовании ULTIMA у лиц с субмассивной ТЭЛА эндоваскулярное введение тромболитического препарата проводили специальным катетером EkoSonic с возможностью усиления эффекта терапии при помощи ультразвука (n=30 – основная группа и n=29 – контрольная) [6]. Это позволило существенно улучшить параметры ПЖ в острый период заболевания по сравнению с группой антикоагулянтной терапии, снизить применяемые дозы тромболитических препаратов до минимума и избежать развития дополнительных кровотечений [6].
В исследовании SEATTLE II у 150 пациентов с массивной и субмассивной ТЭЛА применение КНТ катетером EkoSonic позволило достоверно уменьшить размеры ПЖ и снизить давление в системе легочной артерии без развития внутричерепных кровотечений [10]. Основным ограничением этого испытания является отсутствие контрольной группы. Подобные результаты были продемонстрированы и в многоцентровом регистре PERFECT (n=101) [7]. Данные исследований послужили основой для одобрения катетера EkoSonic Управлением по контролю качества продуктов питания и лекарственных средств США (FDA) для применения у лиц с ВТЭ.
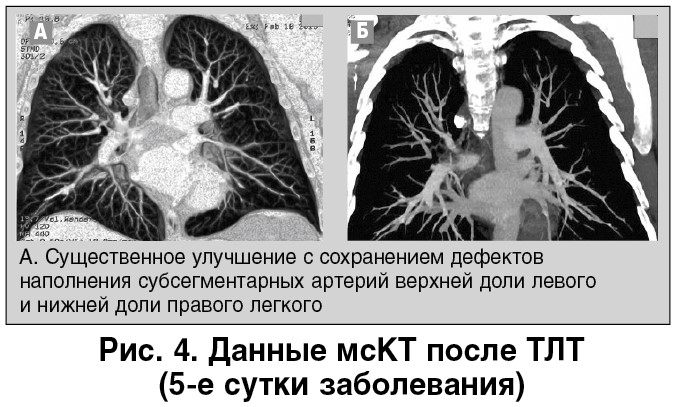 В нашем случае наличие у больного выраженного одышечного и болевого синдромов, массивность тромботической закупорки основных ветвей легочной артерии, выраженная степень дисфункции ПЖ, низкая сатурация (SpO2 – 87%), отсутствие улучшения клинической симптоматики на фоне антикоагулянтной терапии в течение 4-6 ч наблюдения, а также низкий геморрагический риск стали основанием для проведения системной ТЛТ. Терапию проводили альтеплазой в дозе 100 мг в течение 2 ч. В ходе применения ТЛТ отмечалась кровоточивость десен, которую удалось остановить полосканием полости рта раствором аминокапроновой кислоты. Других кровотечений не было. Через 12 ч после завершения ТЛТ состояние пациента существенно улучшилось, боли в грудной клетке и одышка прекратились. Насыщение артериальной крови кислородом при пульсоксиметрии (SpO2) возросло до 96% (дыхание воздухом), ЧСС снизилась до 70 уд./мин. Повторная ЭхоКГ выявила существенное уменьшение размеров и перегрузки ПЖ, снижение степени легочной гипертензии. Контрольная мсКТ, проведенная на 5-е сутки после ТЛТ (рис. 4), обнаружила значительное улучшение легочного кровотока с наличием единичных тромбов в субсегментарных ветвях легочной артерии.
В нашем случае наличие у больного выраженного одышечного и болевого синдромов, массивность тромботической закупорки основных ветвей легочной артерии, выраженная степень дисфункции ПЖ, низкая сатурация (SpO2 – 87%), отсутствие улучшения клинической симптоматики на фоне антикоагулянтной терапии в течение 4-6 ч наблюдения, а также низкий геморрагический риск стали основанием для проведения системной ТЛТ. Терапию проводили альтеплазой в дозе 100 мг в течение 2 ч. В ходе применения ТЛТ отмечалась кровоточивость десен, которую удалось остановить полосканием полости рта раствором аминокапроновой кислоты. Других кровотечений не было. Через 12 ч после завершения ТЛТ состояние пациента существенно улучшилось, боли в грудной клетке и одышка прекратились. Насыщение артериальной крови кислородом при пульсоксиметрии (SpO2) возросло до 96% (дыхание воздухом), ЧСС снизилась до 70 уд./мин. Повторная ЭхоКГ выявила существенное уменьшение размеров и перегрузки ПЖ, снижение степени легочной гипертензии. Контрольная мсКТ, проведенная на 5-е сутки после ТЛТ (рис. 4), обнаружила значительное улучшение легочного кровотока с наличием единичных тромбов в субсегментарных ветвях легочной артерии.
При компрессионной сонографии вен нижних конечностей тромбы в глубоких венах нижних конечностей не выявлены (имеются признаки посттромбофлебитической болезни). Пациент был переведен на длительный прием пероральных антикоагулянтов и выписан в удовлетворительном состоянии. ЭКГ при выписке представлена на рисунке 5.
Cписок литературы находится в редакции.
Спецвипуск «Клінічні випадки та сценарії у невідкладній кардіології», вересень 2019 р