23 вересня, 2019
Нормалізація порушень менструальної функції у дівчат-підлітків – запорука збереження репродуктивного здоров’я у жінок
 Дівчата з порушеннями менструальної функції (ПМФ) формують групу високого ризику щодо виникнення певних гінекологічних захворювань у жінок репродуктивного віку, оскільки багато хронічних хвороб дорослих – це пролонгована патологія підлітків. Своєчасне виявлення захворювань органів репродуктивної системи у дівчат-підлітків із подальшим коригуванням виявлених порушень є важливим завданням практичної охорони здоров’я [1].
Дівчата з порушеннями менструальної функції (ПМФ) формують групу високого ризику щодо виникнення певних гінекологічних захворювань у жінок репродуктивного віку, оскільки багато хронічних хвороб дорослих – це пролонгована патологія підлітків. Своєчасне виявлення захворювань органів репродуктивної системи у дівчат-підлітків із подальшим коригуванням виявлених порушень є важливим завданням практичної охорони здоров’я [1].
Процес статевого дозрівання складається з певних етапів і характеризується послідовними змінами ступеня зрілості надгіпоталамічних центрів центральної нервової системи (ЦНС), гіпоталамуса, гіпофіза, статевих залоз і органів-мішеней статевих стероїдів.
Статеве дозрівання і розвиток репродуктивної системи є однією із стадій процесу, який починається статевою диференціацією і формуванням під час онтогенезу гіпоталамо-гіпофізарно-гонадної системи у плода й завершується статевою зрілістю. У перші 2-3 роки після менархе можуть спостерігатися нерегулярні місячні, що зумовлено поступовим процесом становлення й стабілізації ритму секреції та виділенням гонадоліберинів. Менструації у цьому віці, як правило, ановуляторні, без повноцінного дозрівання фолікулів та жовтого тіла [2]. Доведено, що у дівчат 12-13 років фізичний розвиток протікає більш інтенсивно та нерівномірно, ніж у дівчат старшого віку, що проявляється різким збільшенням концентрації пролактину і вільного тироксину до завершення стадії розвитку репродуктивної системи при незмінній концентрації трийодтироніну та істотно високої концентрації кортизолу. У старших дівчат (14-17 років) відбувається плавне збільшення концентрацій більшості гормонів на фоні зниження трийодтироніну. У них до завершення періоду статевого дозрівання (17-18 років) закінчується формування стійкої гормональної функціональної системи, що проявляється в закономірному збільшенні корелятивних зв’язків між показниками гормонального статусу з нейровегетативними й антропометричними показниками [3].
Механізм, що забезпечує повноцінність менструального циклу (МЦ), надзвичайно складний і включає в себе комплексний взаємозв’язок між системою «гіпоталамус – гіпофіз – яєчники» та маткою. Його формування продовжується до закінчення періоду статевого дозрівання. Різні несприятливі впливи змінюють цей перебіг, вони можуть як прискорювати, так і гальмувати його.
Відомо, що формування репродуктивного здоров’я дівчат-підлітків зумовлено комплексним впливом біологічних, соціальних та економічних факторів, станом екології, якістю медичної допомоги населенню, способом життя підлітка. В пубертатному періоді дівчина-підліток відчуває на собі дію двох природних, але неоднозначних процесів інтенсивної соціалізації її особистості й активної фізіологічної перебудови організму. За неадекватних умов ці процеси можуть знизити адаптаційні можливості організму й збільшити ризик виникнення порушень нейросекреції гіпоталамічних субстанцій [4].
Причинами, що призводять до ПМФ у період статевого дозрівання, є порушення пульсуючого ритму секреції гонадотропін-рилізинг-гормону (ГнРГ) гіпоталамусу, який є високоспеціалізованою структурою, що пов’язує між собою ЦНС та ендокринну систему. Таким чином, розрив центральних ланок, що регулюють механізми системи «гіпоталамус – гіпофіз – яєчники», відбувається внаслідок її надзвичайної чутливості до різних факторів, починаючи з екологічного неблагополуччя навколишнього середовища і «техногенної агресії» до суто особистих переживань психологічного плану підлітка.
Згідно із сучасними даними, є багато нейротрансмітерів і нейромодуляторів, які відіграють важливу роль у регуляції функції репродуктивної системи. Крім того, в регуляції секреції гонадотропінів важлива роль належить опіоїдним пептидам, які модулюють дію речовин, що впливають на продукцію та секрецію гонадоліберину і на зворотний зв’язок між статевими стероїдами та ЦНС [5].
Порушення синтезу та частоти й амплітуди виділення гонадотропних гормонів – лютеїнізуючого (ЛГ) та фолікулостимулюючого (ФСГ) – призводить до порушення фолікулогенезу в яєчниках під дією недостатньої гонадотропної стимуляції з боку гіпофіза та порушення процесів стероїдогенезу в яєчниках (низький рівень естрогенів, дефіцит прогестерону). Тобто гіпоталамо-гіпофізарний комплекс та яєчники не інтегруються між собою, не синхронізують свої функції, а отже, й не забезпечують достатній рівень секреції естрадіолу, який здатний викликати овуляторний викид ЛГ. Позитивний зворотний зв’язок, який завершує цей етап статевого дозрівання, у дівчат не формується, що призводить до розвитку клінічних проявів різноманітних ПМФ. Ступінь розладів МЦ визначається як рівнем та глибиною порушень нейрогормональної регуляції, так і змінами органів-мішеней статевої системи.
Крім того, такі поведінкові фактори, як нераціональне харчування, гіподинамія, сумарні стресові та надмірні фізичні навантаження, шкідливі звички, ранній початок статевих відносин, у свою чергу, також можуть мати певний вплив на виникнення порушень статевого дозрівання у дівчат-підлітків.
За даними літератури, серед дівчат-підлітків у структурі гінекологічної захворюваності на першому місці серед ПМФ стоять нерегулярні місячні й аменорея – до 45%. Друге місце у структурі ПМФ серед підлітків посідають аномальні маткові кровотечі (АМК) – до 20%. Третє місце в обох вікових групах займають ПМФ на фоні гіпоталамічного синдрому та дисменорея – 10% [6].
Аменорея
Аменорея у підлітків – одна з найактуальніших, найскладніших проблем сучасної ендокринної гінекології. Частота цієї патології становить до 12% у структурі всіх порушень МЦ у дівчат-підлітків. Аменорею традиційно розподіляють на первинну та вторинну (табл. 1).
Первинна аменорея – це відсутність менархе у дівчат віком 15-16 років. Первина аменорея є ключовим симптомом при затримці статевого дозрівання яєчникового генезу (48%); при порушенні статевого диференціювання 46 XY-типу; при станах, що пов’язані зі спадковим та набутим дефіцитом гонадотропінів; при ензимних дефектах синтезу гормонів; при вроджених вадах розвитку матки й піхви; при вродженй дисфункції кори надниркових залоз (ВДКН).
Первинна аменорея внаслідок дисфункції ЦНС-гіпоталамо-гіпофізарної системи
Ці форми аменореї характеризуються низьким рівнем гонадотропінів і відсутністю їх циклічної секреції.
Етіологія. Дана форма аменореї є наслідком інфекційно-токсичних впливів, хронічних соматичних захворювань, порушень функції щитоподібної залози, надлишкових стресових і фізичних навантажень, втрати маси тіла.
Патогенез. Первинне порушення виникає на гіпоталамо-гіпофізарному рівні й призводить до зниження секреції гонадотропінів, порушення циклічності їх секреції, що, в свою чергу, зумовлює вторинну недостатність яєчників.
Клінічна картина. Хворі мають характерну євнухоподібну будову тіла (довгі ноги та руки, вузький таз), зовнішні статеві органи сформовані за жіночим типом, але вторинні статеві ознаки недостатньо розвинуті або відсутні. Відмічається гіпоплазія малих статевих губ, відставання кісткового віку від хронологічного, прояви вегето-судинної дистонії.
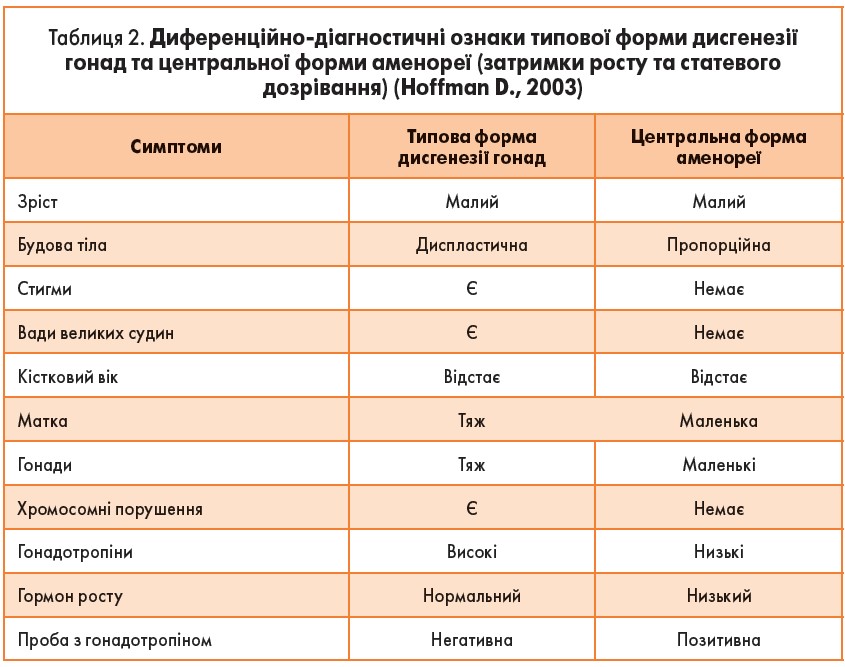
Діагностика центральної форми первинної аменореї ґрунтується на астенічній чи євнухоподібній будові тіла; наявності матки та яєчників; низьких рівнях ФСГ і ЛГ, естрогенів. При проведенні спеціального гінекологічного огляду, УЗД виявляється гіпоплазія матки, яєчники містять у собі дрібні примордіальні й преантральні фолікули.
Лікування цієї форми первинної аменореї тривале й включає загальнооздоровчі засоби, рекомендації щодо дотримання режиму повноцінного харчування та відпочинку, уникання психоемоційних перевантажень. Призначається вітамінотерапія, спрямована на нормалізацію функції репродуктивної системи (фолієва, аскорбінова, глютамінова кислоти, токоферолу ацетат), вітамінно-мінеральний комплекс Магне-В6, а також фізіотерапевтичні методи лікування.
За відсутності ефекту від негормональної терапії дівчатам після 16 років для компенсації гормонального дефіциту призначається циклічна гормональна терапія курсом 3-6 міс, яка діє на рецептори органів-мішеней, відновлюючи тим самим нестачу статевих гормонів в організмі. Спочатку призначаються естрогени, а після появи менструації переходять до циклічної гормональної терапії у секвенціальному режимі естрогенами та гестагенами. Призначення низькодозованих монофазних комбінованих оральних контрацептивів (КОК) слід розглядати як альтернативний метод лікування цієї форми аменореї, але перевагу слід віддавати препаратам, що містять натуральні естрогени та гестагени. Лікування тривале, із перервою на 1-2 міс після 3-4-місячних курсів терапії.
За даними різних авторів [8, 9], натуральні естрогени при проведенні стартової гормональної терапії забезпечують більш фізіологічне підвищення рівня естрогенів в організмі дівчини, збільшення розмірів матки. Додавання до естрогенної терапії гестагенів, особливо аналогів натурального прогестерону у вигляді таблеток або гелю, надійно забезпечує модуляцію МЦ, повноцінне формування структур молочних залоз, профілактику виникнення аденокарциноми ендометрія. Дози естрогенів призначаються з урахуванням динаміки зросту пацієнтки, її кісткового віку, розмірів матки та молочних залоз. При лікуванні гіпоталамічних форм затримки статевого дозрівання можна застосовувати синтетичний аналог РГ-ЛГ у пульсуючому режимі.
При аменореї, що виникла внаслідок втрати маси тіла або надмірних фізичних навантажень, гормонотерапія проводиться після усунення цих причин.
Первинна аменорея внаслідок органічних порушень гіпоталамо-гіпофізарної системи
Етіологія. Серед органічних причин аменореї найчастіше зустрічається пухлина, що виникає у ніжці гіпофіза (краніофарінгома).
Клінічна картина характеризується неврологічною симптоматикою, сильним головним болем на фоні євнухоподібної будови тіла й нерозвинених вторинних статевих ознаках.
Діагностика. Пухлина виявляється при рентгенологічному дослідженні гіпофіза. При гормональному дослідженні визначаються низькі рівні гонадотропінів і статевих стероїдів. При гінекологічному та УЗ-дослідженні виявляються гіпопластична матка і яєчники з дрібними фолікулами.
Лікування: хірургічне видалення пухлини.
Первинна аменорея яєчникового генезу
Етіологія. Найбільш частою причиною первинної аменореї яєчникового генезу є затримка статевого розвитку внаслідок різних форм дисгенезії гонад (типова, стерта, чиста та змішана), що зумовлені хромосомним чи генетичним дефектом або тяжким ураженням гонад в ембріональному чи ранньому постнатальному періоді.
Патогенез. Причиною патології є генетичне порушення – кількісна та якісна аномалія (аномальні набори) статевих хромосом, що не можуть забезпечити нормальний розвиток структурних компонентів повноцінної гонади. Відсутність функціонально-активної тканини яєчників призводить до первинного естрогенного дефіциту з відповідною реакцією з боку гіпоталамо-гіпофізарних структур: збільшується синтез та виділення гонадотропінів. У хворих спостерігається первинна аменорея, відсутній розвиток вторинних статевих ознак на фоні низькорослості або прогресуючої високорослості, наявності інших зовнішніх характерних ознак, що викликає у хворих комплекс неповноцінності й соціальної дезадаптації.
Діагностика. Для всіх форм дисгенезії гонад є загальні діагностичні критерії (табл. 2):
- первинна аменорея;
- відсутність або різке недорозвинення вторинних статевих ознак,
- генітальний інфантилізм;
- УЗ-ознаки дисгенезії гонад;
- високий рівень гонадотропінів, особливо ФСГ;
- каріотип з аномальним набором статевих хромосом;
- негативна проба с гестагенами, але позитивна з естрогенами та гестагенами;
- гонади являють собою сполучнотканинні тяжі з елементами яєчників (примордіальні фолікули) або наявності нерозвинутого яєчка при змішаній формі дисгенезії.
Рентгенологічне обстеження кісток вказує на відставання кісткового віку від хронологічного на 2-7 років.
Лікування хворих із дисгенезією гонад спрямоване на:
- фемінізацію фігури, появу статевого оволосіння на лобку, розвиток молочних залоз, матки;
- зниження рівня гонадотропінів;
- циклічні зміни в ендометрії з менструальноподібною реакцією;
- профілактику естрогендефіцитних станів (остеопороз, метаболічні порушення);
- стимуляцію росту при низькорослості;
- соціальну адаптацію.
Хворим, які мають недостатність гормону росту, низький зріст (до 150 см), ендокринолог призначає гормон росту. У віці 14-15 років, при досягненні пацієнтками показників кісткового віку, що відповідає 11-12 рокам, можна починати постійне призначення естрогенів у вигляді таблеток, гелю, пластирів під обов’язковим УЗД-контролем стану ендометрія та яєчників.
Лікування проводиться до появи першої менструальноподібної реакції та досягнення відповідної товщини ендометрія. Кращий ефект досягається при призначенні препаратів – аналогів натурального естрадіолу. Можливим є також прийом кон’югованих естрогенів або етінілестрадіолу. Після появи менструації естрогени призначаються послідовно з гестагенами з перервами до 7 днів або в постійному режимі – замісна гормональна терапія (ЗГТ). Така гормональна терапія призначається цим хворим постійно, впродовж багатьох років, тому перевагу слід віддавати аналогам натурального естрадіолу й прогестерону. Лікування проводиться під контролем стану статевих органів, молочних залоз, гормонального профілю хворих, стану кісткової тканини. Гормональна терапія може доповнюватися комплексами вітамінів, загальнотонізуючих препаратів, також за показаннями призначаються гормони щитоподібної залози.
Лікування є ефективним, якщо мають місце: поява розвитку молочних залоз та статевого оволосіння; збільшення лінійного росту; наближення показників біологічного (кісткового) віку пацієнток до їх паспортного віку. Все це сприяє вирішенню морально-психологічних проблем, покращенню якості життя.
При порушенні статевого диференціювання за 46 XY-типом у плода з чоловічим набором хромосом 46 ХY-тестикули під час ембріогенезу не спроможні до сперматогенезу та синтезу в достатній кількості тестостерону. Ці захворювання відносяться до псевдочоловічого гермафродитизму, зумовленого структурним дефектом Y-хромосоми.
Усі хворі з цим порушенням мають чоловічий генотип, але жіночий фенотип, тобто зовнішні геніталії сформовані за жіночим типом, але матка, фалопієві труби та піхва частково або повністю відсутні. Естрадіол, що утворюється з тестостерону, сприяє розвитку молочних залоз. Гонади розташовані у черевній порожнині або у пахових каналах.
Наявність каріотипу 46 ХY або фрагментів Y-хромосоми є абсолютним показанням для своєчасного хірургічного видалення дисгенетичних гонад з огляду на високий ризик їх малігнізації. За наявності жіночої психосоціальної орієнтації після видалення гонад хворим проводиться тривала ЗГТ жіночими статевими гормонами.
У хворих із вродженою вірілізацією зовнішніх статевих органів показана коригуюча пластика геніталій. Після чого також проводиться тривала ЗГТ із застосуванням препаратів – аналогів натурального естрадіолу й прогестерону або КОК для системної профілактики порушень із боку урогенітальної, кісткової, серцево-судинної систем внаслідок дефіциту статевих гормонів. За необхідності перед заміжжям проводиться пластична операція для створення повноцінної піхви.
Первинна аменорея без затримки статевого дозрівання може бути проявом вроджених вад розвитку матки та піхви, зумовленого порушенням каналізації нижнього відділу урогенітального синусу під час внутрішньоутробного розвитку дівчинки. Ця патологія встановлюється при гінекологічному дослідженні та ехографії малого таза.
Гормональні дослідження малоінформативні: рівні гонадотропінів та статевих гормонів у межах норми. Лікування – хірургічне.
Вторинна аменорея – це відсутність менструації впродовж ≥6 міс, навіть якщо у дівчини була всього одна менструація. Вторинна аменорея становить до 75% серед усіх форм аменореї і може бути проявом гормональних порушень як яєчників, так і щитоподібної залози, а також органічної та функціональної гіперпролактинемії. При цьому в більшості хворих причиною захворювання є патологія підкіркових структур мозку.
Вторинна аменорея внаслідок синдрому полікістозних яєчників
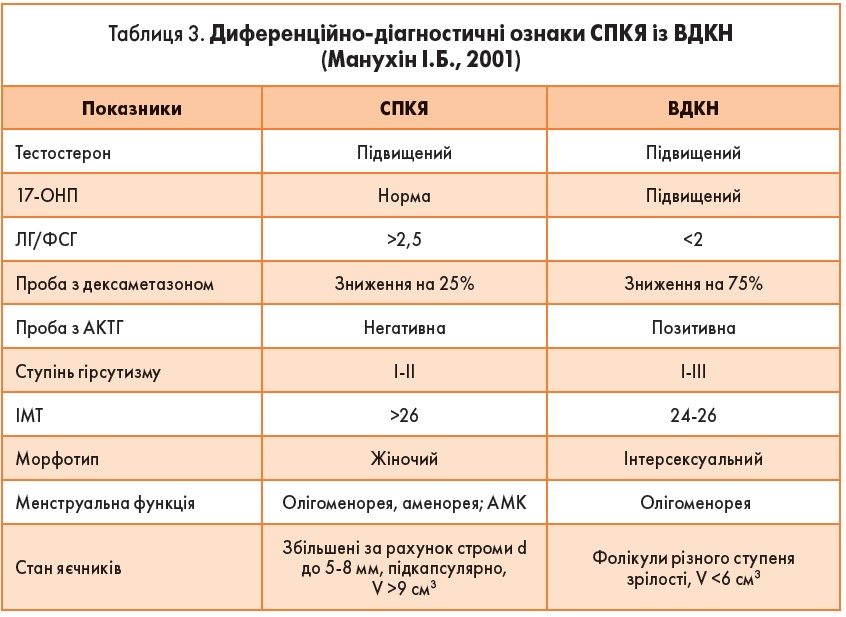
Синдром полікістозних яєчників (СПКЯ) – мультифакторіальна гетерогенна патологія, що характеризується порушенням МЦ, гіперандрогенією, кістозними змінами яєчників, ановуляцією. Результатами проведених досліджень показано, що вже на етапі формування СПКЯ у дівчат-підлітків виникають клінічні та метаболічні порушення, притаманні СПКЯ дорослих жінок.
При дискоординації секреції ФСГ і ЛГ фолікули втрачають можливість повноцінно реагувати на гонадотропні стимули. При тривалому високому базальному рівні ЛГ розвивається гіперпродукція андрогенів тека-клітинами й відбувається зупинка розвитку фолікулів на стадії антральних. Порушується рівновага між андрогенами, естрогенами й секрецією гонадотропінів.
До факторів ризику розвитку СПКЯ у підлітків відносяться: передчасне пубархе, яке свідчить про гіперпродукцію адреналових андрогенів, що, у свою чергу, призводить до посилення біосинтезу андрогенів у яєчниках; надлишкова маса тіла (ожиріння); наявність інсулінорезистентності [10].
Діагностика. Гіпертрихоз або гірсутизм у поєднанні з порушенням МЦ, надмірна секреція тестостерону, особливо вільного тестостерону та ЛГ, підвищене співвідношення ЛГ/ФСГ, інсулінорезистентність, гіперлептинемія (табл. 3).
Лікування. У дівчат-підлітків з яєчниковою гіперандрогенією лікування рекомендується починати з призначення вітамінних та мінеральних комплексів, фізичних факторів впливу, спрямованих на нормалізацію функції підкіркових структур ЦНС. Обов’язковими є нормалізація режиму харчування, зниження підвищеної маси тіла, фізична активність.
У відповідності до патогенезу СПКЯ найбільш виправданим є лікування з призначенням КОК, що мають антиандрогенні властивості й призводять до зниження гіперандрогенії та нормалізації МЦ. Комбінація етинілестрадіолу і гестагенів, що містяться у КОК, пригнічують секрецію гонадотропінів, особливо ЛГ, що, у свою чергу, призводить до зниження оваріальної продукції андрогенів. Також застосовується ципротерон як препарат, що має антиандрогенні властивості за рахунок зворотного його зв’язування з рецепторами андрогенів. Для лікування дівчат із СПКЯ застосовують спіронолактон, що також проявляє антиандрогенну активність за рахунок блокади периферічних андроген-рецепторів.
Вторинна аменорея внаслідок гіпоталамічного синдрому пубертатного періоду (ГСПП)
ГСПП (дисфункція гіпоталамуса, пубертатний базофілізм, діенцефальний синдром) – це складне захворювання у підлітків, яке характеризується поєднанням ПМФ та обмінно-ендокринних порушень на фоні ожиріння. Спостерігається у дівчат, як правило, через 1-3 роки після менархе.
Розвиток ГСПП у ранньому пубертаті може бути спровокований фізіологічною віковою активацією тропних функцій гіпофіза, коли відбуваються зміни функціонування яєчників, наднирників, щитоподібної залози, відмічається пубертатний «стрибок росту». При порушенні їхніх фізіологічних зворотних зв’язків і секреції порушується утворення та ритм виділення гіпофізарних ГнРГ і кортиколіберину, а також нейротрансмітерів (дофаміну, серотоніну, ендорфінів). Розвивається гіперкортицизм із підвищенням рівня кортизолу та андрогенів наднирникових залоз, у яєчниках формуються кістозно-атретичні фолікули з підвищенням секреції андрогенів. Порушується інсулінорезистентність, підвищується секреція С-пептиду [11].
Діагностика проводиться визначенням рівнів ЛГ, ФСГ, пролактину, тестостерону, естрадіолу, дегідроепіандростерон-сульфату (ДГЕА-с), кортизолу, гормонів щитоподібної залози, вивченням рівня глюкози в крові, УЗД малого таза, щитоподібної залози та наднирників.
Диференційна діагностика проводиться з хворобою Іценко – Кушинга за допомогою гормональної проби з дексаметазоном. Зниження рівня адренокортикотропного гормону (АКТГ)і кортизолу в крові на ≥50% в обстежуваних свідчить про функціональний характер порушення гіпоталамо-гіпофізарно-наднирникової системи.
Лікування захворювання тривале. Першим етапом є санація хронічних вогнищ інфекції, зниження маси тіла, дозоване збільшення фізичних навантажень. Одночасно призначається циклічна вітамінотерапія (фолієва, глютамінова, аскорбінова кислоти, токоферолу ацетат). За необхідності регуляції МЦ призначається гормональна терапія гестагенами – аналогами натурального прогестерону (у циклічному режимі), КОК з антиандрогенними властивостями. Застосовується сечогінний засіб з антиандрогенним ефектом – спіронолоктон.
Вторинна аменорея внаслідок гіперпролактинемії
Підвищення секреції пролактину передньою часткою гіпофіза зустрічається у 7% дівчат-підлітків. Етіологія та патогенез порушення функції репродуктивної системи полягає в тому, що порушується контроль секреції пролактину внаслідок зниження синтезу пролактин-інгібуючого фактору. Підвищення рівня пролактину зумовлює вторинний дефіцит ФСГ і ЛГ, що, у свою чергу, призводить до зниження рівнів статевих гормонів та чутливості яєчників до гонадотропінів, пригнічення стероїдогенезу в яєчниках, зниження стероїд-зв’язуючих глобулінів, підвищення рівня андрогенів надниркових залоз.
Клінічна картина. Патологічна гіперпролактинемія майже завжди призводить до порушення функції яєчників у вигляді затримок менструацій аж до їх тривалої відсутності, тобто до вторинної аменореї.
Діагностика включає огляд молочних залоз для виявлення галактореї, визначення рівня пролактину, гормонів щитоподібної залози у крові.
Диференційна діагностика проводиться з пролактиномою. Рентгенологічне дослідження черепа пацієнтки, огляд окуліста й нейрохірурга допомагають виключити наявність такої пухлини. Зниження рівня пролактину після проведення гормональної проби з агоністом дофаміну до нормальних величин вказує на функціональний характер захворювання.
Лікування. За наявності гіперпролактинемії призначаються препарати, що знижують рівень пролактину в крові. Лікування тривале, проводиться під щомісячним контролем рівня пролактину й перебігу статевого дозрівання пацієнтки. Внаслідок лікування відбувається зниження пролактину як у хворих з мікропролактиномами, так і з функціональною гіперпролактинемією.
Аномальні маткові кровотечі
АМК у підлітковому віці є однією з найбільш поширених форм ПМФ і складають до 20-22% у структурі гінекологічної захворюваності дівчат. Протягом останніх років накопичено багато нових доказових даних щодо діагностичних підходів і схем лікування при маткових кровотечах у жінок різних вікових груп, у тому числі у дівчат-підлітків. Це призвело до їх перегляду. В уніфікованому клінічному протоколі МОЗ України від 2016 року представлений огляд існуючих методів діагностики та лікування АМК і запропоновані алгоритми діагностики та лікування цієї патології в Україні [12].
За міжнародною класифікацією хвороб 10-го перегляду (МКХ‑10) АМК включають такі патологічні стани:
Код:
N92. Надмірна, часта та нерегулярна менструація
N92.0 Надмірна і часта менструація з регулярним циклом
N92.1 Надмірна і часта менструація з нерегулярним циклом
N92.2 Надмірна менструація в період статевого дозрівання
N92.3 Овуляційна кровотеча
N92.8 Дисфункціональна маткова кровотеча
Патогенез. Первинною ланкою порушення гормонального гомеостазу у хворих з АМК є порушення циклічної секреції гонадотропінів, співвідношення між естрогенами та прогестероном, недостатність лютеїнової фази МЦ, відсутність овуляції, що призводить до неповноцінної секреторної трансформації ендометрія. Маткова кровотеча виникає внаслідок неодночасного відторгнення гіперпроліферативного ендометрія і посилення внутрішньоматкового фібринолізу, що, у свою чергу, збільшує крововтрату.
Таким чином, відсутність овуляції і подальшого вироблення жовтим тілом прогестерону створює стан хронічного впливу естрогенів на органи-мішені, у тому числі на ендометрій. Монотонна й тривала продукція естрогенів викликає проліферацію ендометрія та відсутність або недостатню секреторну трансформацію останнього, внаслідок чого виникає його гіперплазія. Одночасно у період статевого дозрівання відмічається зниження скорочувальної функції матки.
Сила та інтенсивність менструації визначається не тільки відторгненням слизової оболонки матки та її структурою, а й інтенсивністю м’язових шарів міометрія, скороченням артеріол та агрегацією тромбоцитів, тобто здатністю до судинного тромбоутворення. Для зупинки маткової кровотечі необхідні напруга основних ланок гемостазу та підвищення стероїд-продукуючої активності яєчників, що забезпечують локальний гемостаз на рівні ендометрія.
Відомо, що гемостаз в ендометрії являє собою складний збалансований процес між агрегацією тромбоцитів, утворенням фібрину й регенерацією тканин, з одного боку, та інгібуванням тромбоцитів простагландинами, вазодилатацією і фібринолізом – з іншого [13]. Гемостаз відбувається насамперед за рахунок спазму судин у відповідь на їх стимуляцію судинозвужувальними речовинами (серотонін, тромбоксан А2) та рефлекторної стимуляції з боку симпатичної нервової системи. Взаємодія елементів крові з ендотелієм при його порушенні призводить до утворення тромбоцитарного агрегату, його консолідації фібрином та до ретракції кров’яного згустку. Одночасно активуються фактори згортання та запускається коагуляційний гемостаз.
Різні клітини ендометрія здатні синтезувати різні фактори росту та цитокіни, які, у свою чергу, є посередниками проявів різних стероїдзалежних функцій. Фактори росту впливають на проліферацію клітин ендометрія, диференціювання та ангіогенез. Гіперпроліферація ендометрія викликає порушення його кровопостачання, внаслідок чого з’являються ділянки ішемії та некрозу з подальшим нерівномірним відторгненням ендометрія та кровотечею. Кровотеча також підтримується підвищеним рівнем простагландинів за наявності тривалої проліферації ендометрія [14, 15]. При рясних та тривалих маткових кровотечах система гемостазу нерідко буває недостатньою або вичерпаною.
Клінічна картина. До цього захворювання відносять усі циклічні та ациклічні кровотечі з матки зі збільшеною тривалістю (більше 7-8 днів), з об’ємом крововтрати >100-120 мл на добу та з інтервалом <21 день. Тяжкість захворювання визначається інтенсивністю, тривалістю крововтрати і ступенем вторинної постгеморагічної анемії.
Лікування АМК складається з двох етапів: гемостазу та профілактики рецидивів захворювання. Вибір методу гемостазу залежить від загального стану пацієнтки та ступеня тяжкості вторинної анемії (легка, середня чи тяжка) внаслідок крововтрати. За наявності анемії обов’язково призначається антианемічна терапія.
При компенсованому стані пацієнтки внаслідок помірної крововтрати та вторинної анемії легкого ступеня впродовж 5-7 днів гемостаз проводиться за допомогою гемостатичних засобів, насамперед транексамової кислоти. Призначення транексамової кислоти забезпечує зниження інтенсивності крововтрати за рахунок зменшення фібринолітичної активності плазми крові, при цьому вираженого впливу на систему гемостазу в цілому немає. Можна призначати також амінокапронову кислоту та інші гемостатики. Для посилення скоротливої функції міометрія призначаються утеротонічна терапія (окситоцин) та фітопрепарати, що сприяють зменшенню об’єму й тривалості маткової кровотечі, покращують скоротливу здатність міометрія. Без попередньої симптоматичної терапії гормональний гемостаз призначається дівчатам із тривалими та рясними кровотечами, що супроводжуються вторинною анемією (гемоглобін нижче 80 г/л, гематокрит ≤25%), рецидивним характером захворювання, наявністю УЗ-ознак гіперплазії ендометрія (М-ехо >10 мм). З метою гормонального гемостазу застосовуються КОК і гестагенні препарати.
Профілактика рецидивів захворювання з метою формування нормального МЦ є другим обов’язковим етапом лікування АМК.
Критеріями ефективності лікування маткових кровотеч у пубертатному періоді є: нормалізація менструальної функції протягом року; відсутність рясних, тривалих крововтрат та больового синдрому під час менструацій; відсутність патологічних змін з боку внутрішніх геніталій при проведенні спеціального гінекологічного огляду та УЗД органів малого таза.
Дисменорея
Дисменорея – це больовий симптомокомплекс із супутніми нейровегетативними, обмінними та психоемоційними порушеннями, які супроводжують менструальне відторгнення ендометрія й циклічно повторюються.
Частота дисменореї у підлітків у структурі гінекологічної захворюваності становить від 7,9 до 22%. Дисменорею розподіляють на первинну (ідіопатична, функціональна) та вторинну. Первинна дисменорея – це болючі менструації за відсутності патології з боку органів таза. Захворювання частіше зустрічається у дівчат-підлітків і виникає з менархе або впродовж 1-1,5 року після менархе. Вторинна дисменорея є наслідком різних органічних патологічних процесів і захворювань внутрішніх статевих органів.
Етіологія. Передумовою появи первинної дисменореї є: гіпоестрогенія, недостатність лютеїнової фази, недостатній рівень ендогенних опіатів, вегето-судинна дисфункція, функціональна неспроможність тканинних протеолітичних ферментів ендометрія, гіпертонус перешийка матки, гіперантефлексія матки, надлишкова кількість простагландинів та лейкотриєнів у крові, гіпомагніємія.
Патогенез. Згідно із сучасними поглядами, у патогенезі розвитку первинної дисменореї важливу роль відіграють високі рівні простагландинів та лейкотриєнів, які посилено синтезуються й надходять до ендометрія та (або) міометрія, спричиняючи гіпертонус матки, вазоконстрикцію та ішемію. Крім того, має місце порушення співвідношення естрадіолу і прогестерону. Відомо, що синтез та вивільнення простагландинів регулюються естрогенами та прогестероном: останній інгібує їх вивільнення, а естрогени стимулюють синтез. Ці процеси мають таку послідовність: зниження стабільності лізосомальних клітинних мембран внаслідок падіння рівня прогестерону → посилення звільнення фосфоліпази → збільшення вмісту попередника простагландинів (арахідонової кислоти) внаслідок активації фосфоліпази → посилений синтез простагландинів [16].
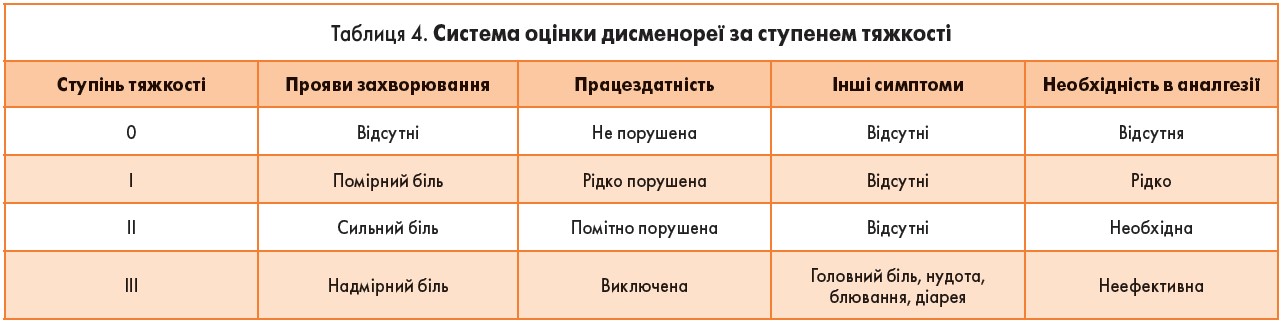
До виникнення симптомів первинної дисменореї призводить також посилення викиду окситоцину, вазопресину, брадикініну, біогенних амінів. Мають значення емоціональна нестабільність, середовищні фактори, фізичне та психологічне навантаження, індивідуальне сприйняття болю (табл. 4).
Клінічна картина характеризується болем, що локалізується у нижніх ділянках живота з іррадіацією у поперек. Біль може виникати вже за 1-2 дні до менструації й тривати у перші 2-3 дні. Часто він супроводжується різними нейровегетативними, обмінними, психоемоційними порушеннями (слабкість, нудота, головний біль, діарея, здуття живота, дратівливість тощо).
Пацієнти з тяжкою формою первинної дисменореї частіше скаржаться на поганий сон, у них наявний підвищений ризик виникнення тривожності, депресії. Результати опитувальників якості життя дівчат із дисменореєю свідчили при негативний вплив цієї патології на їхнє фізичне та психосоціальне функціонування [17].
Діагностика заснована на наявності болючих менструацій, які не мають органічної причини та супроводжуються можливими вегето-судинними порушеннями. Диференційна діагностика спрямована на виключення захворювань, які мають органічну причину виникнення больового симптому. На відміну від дисменореї, хронічний тазовий біль триває ≥6 міс, може мати постійний, періодичний характер і бути циклічним або ациклічним [18].
Для уточнення причини захворювання можливим є проведення проби з інгібіторами синтезу простагландинів, які призначають під час очікування больового симптому.
Лікування первинної (функціональної) дисменореї включає призначення нестероїдних протизапальних препаратів (НПЗП) як інгібіторів синтезу простагландинів в індивідуальних дозах. Найбільш ефективним є призначення цих препаратів за 1-2 дні до початку чергової менструації та протягом перших 2-3 днів під час менструації. За недостатньої ефективності одного з НПЗП можна спробувати призначати інший. Як додаткову терапію до НПЗП можна призначати токоферолу ацетат (вітамін Е) в якості антиоксиданту; препарати, що містять магній. Відомо, що при перших ступенях тяжкості первинної дисменореї хороший терапевтичний ефект мають голкорефлексотерапія, лікувальна фізкультура та дихальна гімнастика, що сприяють нормалізації кровообігу та функціональної активності органів черевної порожнини та малого таза, прийом відповідних фітопрепаратів у вигляді настоїв трав. Застосування спазмолітиків є паліативним лікувальним впливом і не завжди дає очікуваний знеболювальний ефект.
Якщо застосування НПЗП не забезпечує достатнього покращення стану пацієнтки, у циклічному режимі призначаються гормональні препарати: КОК та гестагени, краще ті, що є аналогами натурального прогестерону. Гормональна терапія у дівчат з первинною дисменореєю буде сприяти корекції їхнього гормонального стану, запобіганню виникнення гіперплазії ендометрія, що призводить до зменшення синтезу простагландинів та лейкотриєнів і нормалізує простагландин-залежні реакції організму. Препарати призначають у звичайному циклічному режимі протягом не менше 3 місяців.
Агоністи гонадотропін-рилізинг-гормонів не призначають для емпіричного лікування дівчат із підозрою на первинну дисменорею через можливість їх негативного впливу на мінеральну щільність кісток.
Причини вторинної дисменореї:
- ендометріоз;
- вроджені обструктивні вади розвитку мюллерових проток;
- стеноз шийки матки;
- кісти яєчників;
- поліпи матки;
- лейоміома матки;
- аденоміоз;
- запальні захворювання органів таза;
- спайковий процес у порожнині таза.
Згідно з даними Комітету охорони здоров’я підлітків експертів Американського коледжу акушерів-гінекологів (2018) були наданні наступні рекомендації [19]:
- Первинна дисменорея починається у підлітків переважно із встановленням овуляторних циклів, як правило, протягом 6-12 міс від початку менархе.
- У більшості підлітків із дисменореєю діагностовано її первинну форму. Такі пацієнти будуть позитивно реагувати на лікування НПЗП, які слід вважати першочерговими засобами для полегшення болю у підлітків, або (та) на гормональну терапію (КОК, гестагени).
- Якщо пацієнтка не відчуває клінічного покращення протягом 3-6 міс від початку терапії, особливо якщо за даними анамнезу, фізичного обстеження та УЗД органів таза не була встановлена інша причина хронічного тазового болю або вторинної дисменореї, слід розглядати наявність ендометріозу.
- Рекомендованим лікуванням ендометріозу у підлітків є консервативна хірургічна терапія з діагностичною та лікувальною метою у поєднанні із супресивною терапією для попередження проліферації ендометрія.
- У пацєнтів з ендометріозом, які страждають від стійкого болю, незважаючи на консервативну хірургічну терапію та гормональне лікування, часто дієвим є призначення агоністів ГрРГ протягом 6 міс у комбінації з «терапією прикриття».
- НПЗП слід вважати першочерговими засобами для полегшенню болю у підлітків з ендометріозом.
- Підліткам при ендометріозі не слід тривало призначати знеболювальні препарати без спеціалізованого нагляду.
Література
1. Вовк І.Б., Юзько О.М., Вдовиченко Ю.П. (ред.) Гінекологія дитячого та підліткового віку: Підручник. – К.: ВСВ «Медицина», 2011. – 424 с.
2. Маркин Л.Б., Яковлева Э.Б. Справочник детского гинеколога. – К.: Интермед, 2004. – 384 с.
3. Тронько М.Д., Большова О.В. Раціональна діагностика та лікування ендокринних захворювань у дітей та підлітків. – К.: ТОВ «Доктор-Медіа», 2008. – 380 с.
4. Тумилович Л.Г., Геворкян М.А. Справочник гинеколога-эндокринолога. – М.: Практическая медицина, 2010. – 208 с.
5. Кулаков В.И., Уварова Е.В. Стандартные принципы обследования и лечения детей и подростков с гинекологическими заболеваниями и нарушениями полового развития. – М.: Триада-Х, 2004. – 135 с.
6. Adams Hillard P.J Menstruation in young girls: a clinical perspective. – Obstet. Gynecol., 2002, 99. – Р. 655-662.
7. Богданова Е.А. Гинекология детей и подростков. – М.: МИА, 2004. – 334 с.
8 Вольф А.С., Миттаг Ю.Э. Атлас детской и подростковой гинекологии: пер. с нем. / Под ред. В.И. Кулакова. – М.: ГЭОТАР Медиа, 2004. – 304 с.
9. Heinz M. Hormonal development therapy (HDT) in hypogonadism in long-term view. J. Best Pract. Res. Clin. Obstet. Gynecol. – 2010. – № 2. – P. 149-155.
10. Hoffman B., Bradshaw K.D. Deleyed Puberty and Amenorrea // Seminars in Reproductive Medicin. 2003. – Vol. 82. № 4. – P. 353-362.
11. Alzubaidі N.H., Chapin H.L., Vanderhoof V.H., Calis K.A., Nelson L.M. Meeting the needs of young women with secondary amenorrhea and spontaneous premature ovarian failure. – J. Obstet. Gynecol. 2002, 99. – Р. 720-725.
12. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги при аномальних маткових кровотечах. Наказ Міністерства охорони здоров’я України № 353 від 13.04.2016 р.
13. Tsai M.C., Goldstein S.R. Office diagnosis and management of abnormal uterine bleeding. – J. Clin. Obstet. Gynecol. – 2012. – № 3. – Р. 635-650.
14. Wilkinson J.P., Kadik R.A. Management of abnormal uterine bleeding in adolescents. – J. Pediatr. Adolesc. Gynecol. – 2010. – № 6. – P. 22-30.
15. Seravalli S., Herweek S. Overview of bleeding disorders in Adolescents females with menorragic. – J. Pediatr. Adolesc. Gynecol. 2010. – № 23. – P. 15-21.
16 De Sanctis V., Soliman A., Bernasconi S., Bianchin L. еt al. Primary Dysmenorrhea in Adolescents: Prevalence, Impact and Recent Knowledge. – J. Pediatr Endocrinol Rev. – 2015. – № 13. – Р. 512-516.
17 Greene R., Stratton P., Cleary S. Diagnostic experience among 4,334 women reporting surgically diagnosed endometriosis. J. Fertil Steril. 2009, № 91. – P. 32-41.
18. Hazel Z. Dysmenorrhea in adolescents and young adult: an update on pharmacological treatments and management strategist / J. Expert Opin Pharmacother. 2012. – № 13. – Р. 215-770.
19. Dysmenorrhea and endometriosis in the adolesctnt. – AGOG Committee Opinion № 760. American College of Obstetricians and Gynecologists. J. Obstet. Gynecol. – 2018. – № 132. – Р. 249-258.
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 2 (34), червень 2019 р.