9 жовтня, 2019
Прогностические биохимические маркеры преэклампсии
Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности (после 20-й недели) и характеризующееся артериальной гипертензией de novo (≥140/90 мм рт. ст.) в сочетании с протеинурией (≥0,3 г/л в суточной пробе) и проявлениями полиорганной недостаточности [1, 2]. Ежегодно в мире регистрируется свыше 8 млн случаев ПЭ, от чего умирают 60 тыс. женщин [3]. Фактически в структуре акушерских причин материнской смертности ПЭ занимает второе место после тромбоэмболических осложнений.
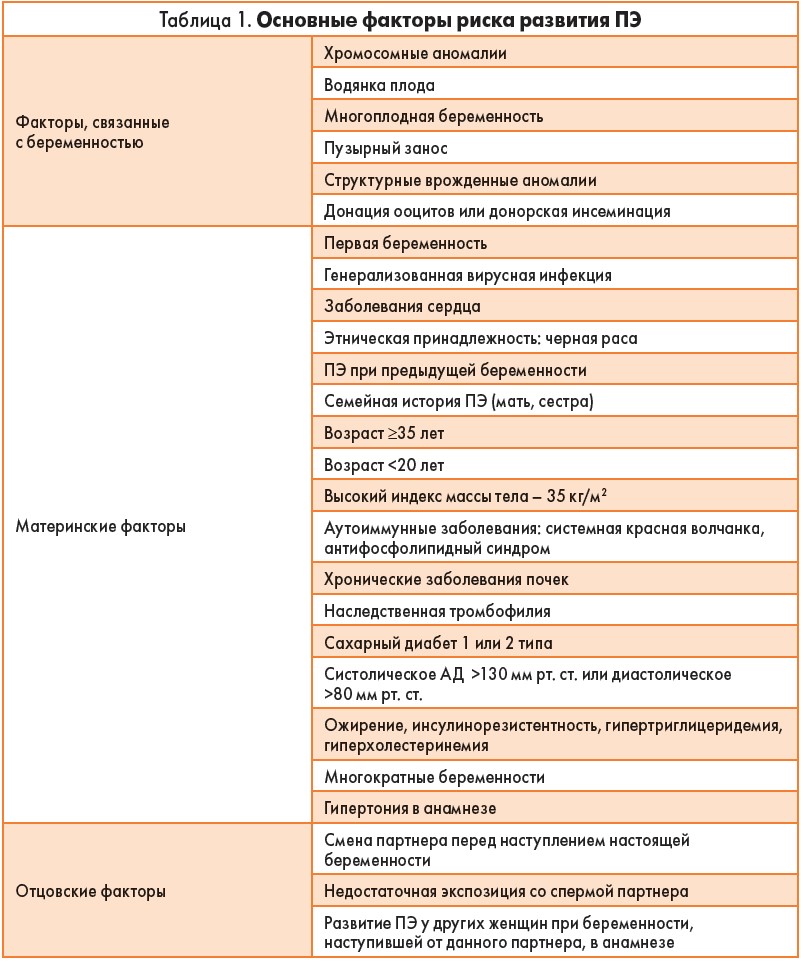
Частота ПЭ достигает 3-8% всех беременностей с существенными различиями в зависимости от страны проживания [4]. Так, в развивающихся странах с ограниченным доступом к высококачественной медицинской помощи показатели смертности достигают 15% среди пациенток с ПЭ, тогда как в высокоразвитых странах этот показатель составляет всего 0-1,8% [5]. В настоящее время отмечается рост заболеваемости ПЭ даже в странах с высоким уровнем дохода [6]. Причиной тому является увеличение частоты таких заболеваний, как ожирение, диабет, хроническая артериальная гипертензия. Преэклампсия является мультифакторным, тяжелейшим осложнением беременности. Среди факторов риска ПЭ выделяют непосредственно факторы, связанные с беременностью, а также материнские и отцовские (табл. 1) [7-10].
ПЭ имеет широкий спектр клинических проявлений, которые могут оказывать влияние на центральную нервную, сердечно-сосудистую и мочевыделительную системы, желудочно-кишечный тракт, систему крови, плод.
Патогенез ПЭ
Существует несколько десятков этиопатогенетических теорий о возникновении ПЭ, однако ни одна из них не объясняет в полной мере многообразие происходящих при данной патологии беременности морфофункциональных изменений и клинических манифестаций. В качестве основы и первопричины формирования ПЭ были изучены генетические, иммунологические, сосудистые и гуморальные факторы. По мнению многих исследователей, развитие ПЭ у беременных является результатом множества патогенетических факторов [11].
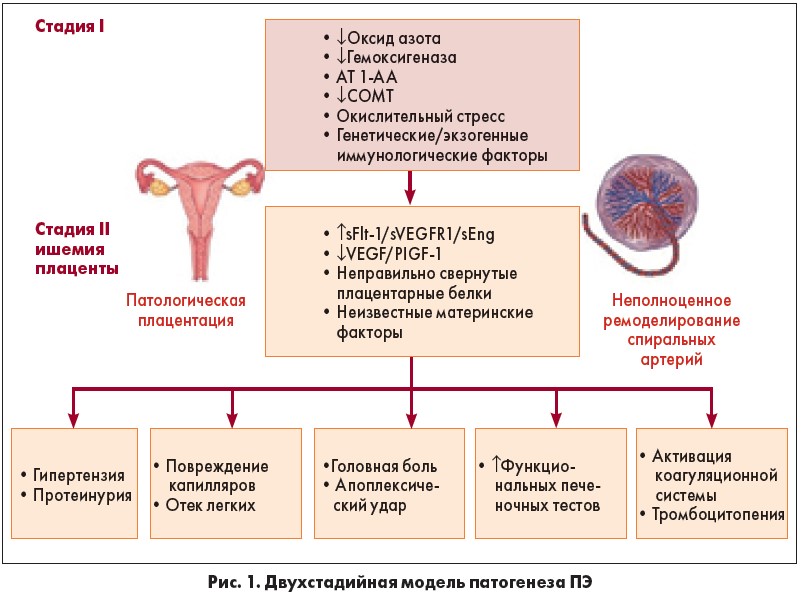
В настоящее время считается, что развитие ПЭ имеет две стадии. На первом этапе происходит неполное ремоделирование спиральной артерии в матке, которая способствует плацентарной ишемии, а на второй стадии – высвобождение ангиогенных факторов из ишемической плаценты в материнское кровообращение, что приводит к повреждению эндотелия [12, 13] (рис. 1). Клинические симптомы ПЭ возникают в результате развития эндотелиальной дисфункции в организме беременной вследствие оксидативного стресса, вазоспазма, гипоксически-ишемических изменений органов-мишеней [14, 15].
Одной из важнейших задач современной медицины является определение групп риска развития ПЭ, а также своевременная дифференциальная диагностика. Скрининг и ранее выявление женщин с риском ПЭ может обеспечить надлежащее применение дородового наблюдения и лечение [16]. На сегодняшний день скрининг ПЭ состоит из оценки клинического риска таких факторов, как возраст, индекс массы тела, семейная история, в сочетании с ультразвуковым исследованием для выявления группы высокого риска на ранних сроках беременности и проведения профилактического лечения. К сожалению, прогностическая значимость этих факторов не велика [17]. Поэтому для диагностики ПЭ используют материнские сывороточные маркеры, измерение которых является чрезвычайно эффективным при прогнозировании ПЭ.
Прогностические маркеры развития преэклампсии
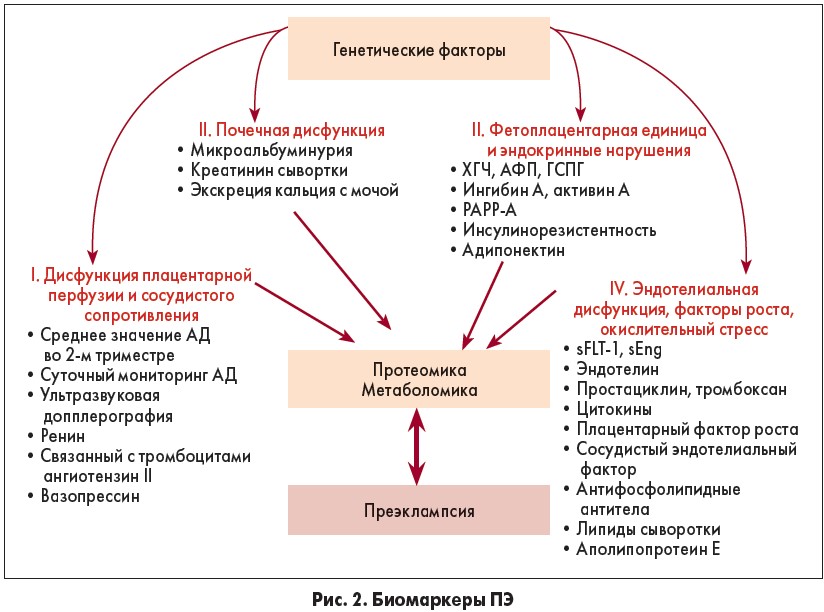
Биомаркеры ПЭ условно разделяют на четыре основные группы (рис. 2) [18]. Продуцирование и уровни биомаркеров зависят от генетических факторов. Однако в отличие от статического генома, протеом является динамическим. В то время как геном не изменяется во время беременности или при связанной с беременностью ПЭ, протеом претерпевает изменения. Поэтому для оценки риска ПЭ используют определение протеомных и метаболических биомаркеров и их уровни.
Ангиогенные факторы
Плацентарное кровообращение представляет собой динамическую сеть кровеносных сосудов, которая во время беременности изменяется в соответствии с потребностями растущего плода. Плацентарный ангиогенез (процесс образования новых кровеносных сосудов в органе или ткани, в процессе которого происходит реорганизация капиллярной сети) тщательно регулируется путем баланса между проангиогенными и антиангиогенными факторами. На ранних сроках беременности трофобласты проникают в плаценту, что приводит к ремоделированию спиральных артерий и обеспечивает свободный приток крови к плоду. При ПЭ цитотрофобластическая инвазия спиральных артерий нарушается, из-за чего они становятся узкими и ограничивают кровоснабжение плода. По мере развития беременности последствия ограниченного кровоснабжения становятся более значимыми. Нарушение кровоснабжения и питания приводит к ишемии плаценты, что способствует высвобождению различных факторов плаценты и про- и антиангиогенных факторов. Некоторые из них могут выступать в качестве биомаркеров при ПЭ [19].
Проангиогенные маркеры
Проангиогенные факторы представлены сосудистым эндотелиальным фактором роста (Vascular Endothelial Growth Factor, VEGF) и плацентарным фактором роста (Placental Grows Factor, PlGF), которые стимулируют рост сосудов и принимают участие в формировании плацентарного кровообращения.
Сосудистый эндотелиальный фактор роста. Семейство VEGF состоит из пяти родственных белков: VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-Е и плацентарного фактора роста. Лучше всего изучен VEGF-A, который в литературе называют просто VEGF. VEGF является стимулятором ангиогенеза, повышает проницаемость сосудов внутри плацентарного ложа, регулирует дифференцировку, пролиферацию и инвазию клеток цитотрофобласта во время плацентации. Возрастание уровня VEGF при физиологической беременности свидетельствует о вовлечении его в процесс развития сосудов плаценты. У пациенток, беременность которых осложняется ПЭ, отмечается нарушение VEGF с начала 2-го триместра беременности и характеризуется достоверно низкими его показателями в течение всего периода гестации.
Плацентарный фактор роста – это гликопротеин с молекулярной массой 45-50 кДа, продуцируемый синцитиотрофобластом [20, 21]. Относится к семейству VEGF и имеет с ним 42% гомологии. Ген находится на длинном плече 14q24 хромосомы и кодирует четыре изоформы PlGF 1-4, включающие соответственно 131, 152, 203 и 224 аминокислоты. Основным различием между этими четырьмя изоформами является то, что PlGF‑1 и PlGF‑3 не имеют гепарин-связывающего участка, в то время как PlGF‑2 и PlGF‑4 имеют дополнительный гепарин-связывающий домен [22]. PlGF экспрессируется плацентарной тканью, клетками хориокарциномы и эндотелиальными клетками [23]. При нормально протекающей беременности продукция PlGF начинается с 8-10-й недели гестации и характеризуется резким увеличением, достигая своих самых высоких значений к 28-30-й неделе, а к концу беременности спадает.
Референтные значения PlGF для небеременных женщин – 20,3-85,9 (пг/ мл), для беременных – представлены в табл. 2.
У женщин с развившейся впоследствии ПЭ отмечено снижение концентрации PlGF уже на 13-16-й неделях гестации [24]. Пограничный уровень PlGF, являющийся границей между нормально протекающей беременностью и ПЭ на сроке беременности 15-18 недель, составляет 42,7±23,2 пг/мл (без признаков ПЭ – 80,6±35,2 пг/мл). Таким образом, прогностическим маркером ПЭ является уровень PlGF в сыворотке крови 50-100 пг/мл, который служит ранним, ценным маркером при диагностике этого заболевания, поскольку показывает начальные признаки нарушений в фетоплацентарном комплексе, возникающие задолго до клинической плацентарной недостаточности.
Антиангиогенные маркеры
Неотъемлемой частью нормального ангиогенеза является продукция антиангиогенных факторов, которые характеризуются высокой специфической экспрессией на эндотелии. К ним относятся s-Flt‑1 или растворимая fms-подобная тирозинкиназа‑1, VEGF-R2, VEGF‑3 и эндоглин. Растворимые формы этих рецепторов способны связывать сосудистые факторы роста в циркуляции крови, замедляя или блокируя процессы ангиогенеза.
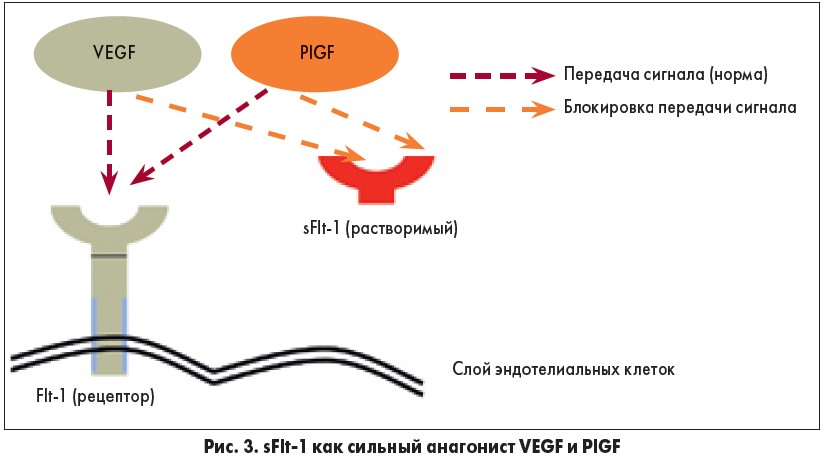
Растворимая fms-подобная тирозинкиназа‑1. Факторы семейства VEGF взаимодействуют с клеткой через тирозинкиназные рецепторы. Рецептор VEGF 1-го типа (VEGF-R1, Flt‑1) экспрессируется гемопоэтическими стволовыми клетками, моноцитами, макрофагами и эндотелиальными клетками сосудов. sFlt‑1 представляет собой гликозилированный белок с молекулярной массой 90-100 кДа. Является усеченным сплайс-вариантом мембраносвязанного Flt‑1 (трансмембранный рецептор VEGF), свободно циркулирует в плазме, действуя как рецептор-«ловушка» для VEGF и PlGF, и выступает в роли их мощного антагониста (рис. 3). В результате этих свойств sFlt‑1 проявляет антиангиогенный эффект [25].
В исследованиях была обнаружена связь между повышенными уровнями sFlt‑1 и ПЭ. Уже за 5-6 недель до начала ПЭ уровни sFlt‑1 увеличиваются и остаются повышенными по сравнению с нормальной физиологической беременностью. В 2003 году белок sFlt‑1 был предложен в качестве возможного фактора, повреждающего эндотелий при беременности [26, 27].
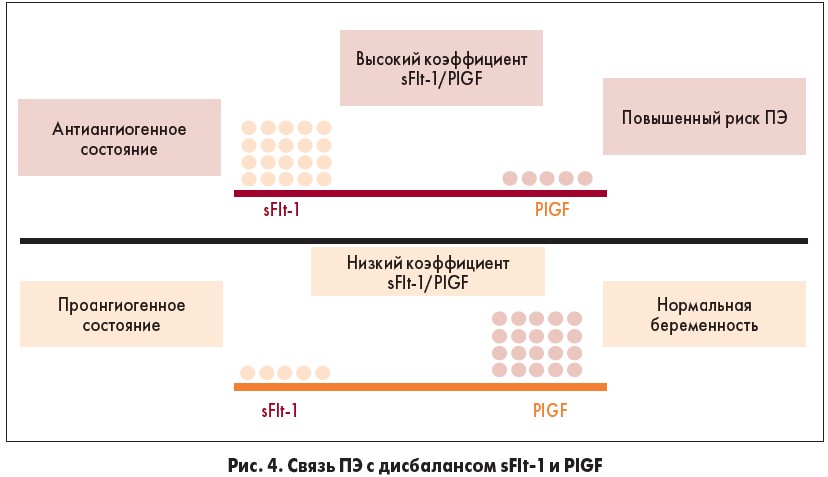
Определение содержания PlGF и sFlt‑1 в кровотоке матери позволяет прогнозировать развитие ПЭ, поскольку эти показатели отражают дисбаланс между проангиогенными и антиангиогенными факторами. Обнаружено достоверное снижение PlGF и увеличение концентрации sFlt‑1 у беременных с ПЭ по сравнению со здоровыми беременными (рис. 4).
В последнее время в лабораторную практику начали внедрять определение соотношения sFlt‑1/PlGF с целью диагностики и краткосрочного прогнозирования развития ПЭ у беременных женщин. По данным многих авторов, соотношение уровней sFlt‑1 и PlGF оказалось более надежным прогностическим и диагностическим маркером ПЭ, чем каждый из этих показателей в отдельности [28-30].
Соотношение sFlt‑1/PlGF. Изменения маркеров sFlt‑1 и PlGF наблюдается уже во 2-м триместре беременности, что позволяет использовать соотношение sFlt‑1/PlGF для диагностки и прогнозирования ПЭ. Подтверждением ПЭ являются предельные значения соотношения sFlt‑1/PlGF >85 (срок беременности от 20+0 до 35+6 недель) и sFlt‑1/PlGF >110 (34+0 недель до родов) [31]. Повышенное соотношение sFlt‑1/PlGF отражает патологию неэффективной плацентации, плацентарной ишемии и считается перспективным биомаркером для прогнозирования и диагностики заболевания [32]. В 2016 году этот анализ был рекомендован Национальным институтом клинического совершенствования (National Institute for Clinical Excellence, NICE) для исключения ПЭ у пациенток с подозрением на данную патологию [33]. Кроме того, соотношение может также применяться для прогнозирования эклампсии и HELLP-синдрома.
Интерпретация результатов
- Соотношение sFlt‑1/PlGF <38 исключает ПЭ по меньшей мере в течение 1 недели независимо от срока беременности. У более чем 80% пациенток, принадлежащих к этой группе, клиницисты могут исключить ПЭ и проводить в дальнейшем дородовое наблюдение.
- Соотношение sFlt‑1/PlGF >85 (ПЭ с ранним началом) или >110 (ПЭ с поздним началом) является очень показательным при ПЭ.
- Соотношение sFlt‑1/PlGF 38-85 (ПЭ с ранним началом) или 38-110 (ПЭ с поздним началом) предоставляет дополнительную информацию о том, какие женщины подвергаются умеренному или высокому риску развития ПЭ в течение четырех недель (рис. 5).
Растворимый эндоглин (sEng)
Растворимый эндоглин представляет собой усеченную форму рецепторов трансформирующих факторов роста TGF-β1 и TGF-β3. Он является потенциальным антиангиогенным фактором, который препятствует связыванию TGF-β1 с его рецептором и тем самым влияет на выработку оксида азота (NO), вазодилатацию и образование капилляров эндотелиальными клетками [34]. Эндоглин участвует в регуляции основных клеточных процессов, включая пролиферацию, дифференцировку, миграцию, апоптоз, адгезию, организацию цитоскелета и ремоделирование внеклеточного матрикса. Растворимая изоформа эндоглина связывает циркулирующий TGF-β, так как содержит TGF-β-связывающий домен. TGF-β является проангиогенной молекулой, но при повышенном уровне sEng он утрачивает свои свойства и инактивируется. sEng играет большую роль в развитии дисфункции эндотелия и в патогенезе ПЭ. Было показано, что sEng увеличивается при ПЭ, причем уровень sEng коррелирует с тяжестью заболевания и снижается после родов. При нормальной беременности уровни sEng снижаются между 1-м и 2-м триместрами и повышаются во 2-м триместре у пациенток с предрасположенностью к ПЭ [35].
Другие биомаркеры преэклампсии
Протеин А плазмы, ассоциированный с беременностью (PAPP-A)
PАPP-А – это большой высокогликозилированный белок, относящийся к цинксодержащим ферментам (металлопротеиназам), который синтезируется трофобластами [36]. PAPP-А отщепляет от инсулиноподобного фактора роста белковые фрагменты и повышает его биологическую активность. Благодаря этому процессу обеспечивается полноценный рост и развитие плаценты. Его содержание в крови увеличивается при физиологической беременности. Снижение уровня PАРР-А в плазме крови отмечается в 1-м триместре беременности, связаной с ПЭ [37]. По данным многих исследователей, сывороточные уровни PАРР-А и PlGF – два наиболее изученных биохимических маркера, которые возможно использовать для раннего прогнозирования ПЭ [38-40].
Плацентарный белок 13 (РР‑13)
Плацентарный белок РР‑13 – относительно небольшой димерный белок с молекулярной массой 32 кДа. Представитель суперсемейства галектинов (галектин 13), секретируется в большом количестве в плаценте. При нормальной беременности уровень PP‑13 постепенно увеличивается до момента родов. Снижение концентрации РР‑13 в сыворотке крови в 1-м триместре прогнозирует ПЭ как у беременных с умеренным и низким уровнем риска, так и у беременных высокого риска [41, 42].
Ингибин А и активин А
Ингибин А и активин А являются гликопротеинами и относятся к семейству трансформирующих факторов роста β. Оба в значительной степени выделяются фетоплацентарной единицей во время беременности. Ингибин А играет важную эндокринную роль, участвуя в процессах регуляции отрицательной обратной связи гонадотропинов, а активин А действует на различные биологические процессы [43]. Основным источником этих циркулирующих белков явялется плацента. Концентрации ингибина А и активина А увеличиваются в 3-м триместре у пациенток с физиологической беременностью. При тяжелой ПЭ их уровни повышаются примерно в 10 раз [44]. При ПЭ наблюдается повышение окислительного стресса и системное воспаление, что стимулирует выработку активина А и его секрецию плацентарными эксплантами и эндотелиальными клетками [45].
Пентраксин‑3 (PTX3)
Пентраксины – это семейство эволюционно консервативных белков. В зависимости от их первичной структуры они делятся на короткие (25 кДа) и длинные (40-50 кДа). Короткие пентраксины, такие как С-реактивный белок, вырабатываются печенью, длинные пентраксины (пентраксин‑3) экспрессируются сердцем. Пентраксин‑3 (фактор некроза опухоли – стимулируемый ген‑14) состоит из 318 аминокислот, представитель суперсемейства пентраксина, включающего С-реактивный белок и сывороточный Р-компонент амилоида [46]. Синтезируется в ответ на провоспалительное действие и секретируется клетками различных типов, включая макрофаги, нейтрофилы, клетки яичника, эндотелиальные клетки, фибробласты, альвеолярные, эпителиальные и глиальные клетки. Пентраксин‑3 – острофазный белок, уровень которого в плазме возрастает при воспалении и различных инфекциях. При ПЭ в ответ на воспаление его уровни повышаются [47].
Дизинтегрин и металлопротеиназа‑12 (ADAM‑12)
Дизинтегрин и металлопротеиназа‑12 является цинк-зависимой мембраносвязанной протеазой, представителем семейства ADAM группы белков, принимающих участие в межклеточных взаимодействиях при оплодотворении. Для гена, кодирующего ADAM, свойствен альтернативный сплайсинг, в результате которого образуются две формы белка. Недавние исследования обнаружили связь между повышенным уровнем ADAM‑12 и ПЭ [48].
МикроРНК
МикроРНК – это класс нуклеоидных коротких последовательностей РНК, которые не участвуют в синтезе белка. МикроРНК задействованы в механизме посттранскрипционной экспрессии генов: связываясь со специфическими участками матричных РНК в цитоплазме, они обеспечивают репрессию трансляции или деградацию транскриптов мишеней. МикроРНК могут регулировать до 60% генома человека. Способны управлять сложными процессами, такими как рост клеток, дифференцировка, стресс-реакция и ремоделирование тканей, что при определенных условиях может играть ключевую роль при многих патологических процессах, включая ПЭ. В последнее время особое внимание уделяется определению уровней микроРНК как возможному предиктору ПЭ на ранних сроках [49].
Лептин
Лептин представляет собой белок, состоящий из 167 аминокислот, он относится к цитокинам и имеет общую молекулярную массу 16 кДа. Лептин играет важную роль в некоторых физиологических процессах, включая размножение, ангиогенез, воспаление и регуляцию эндокринной и иммунной функций. Основным источником лептина является жировая ткань, но во время беременности лептин также продуцируется плацентой. При нормальной беременности экспрессия плацентарного лептина увеличивается по сравнению с таковой у небеременных и поддерживает имплантацию, выработку гонадотропина человека, рост плаценты и митогенез. Дисрегуляция уровня лептина может указывать на гестационные осложнения или приводить к ним. По данным ряда авторов, уровень лептина повышается при ПЭ по сравнению с женщинами с физиологическим течением беременности [50, 51]. В связи с этим лептин может быть потенциальным биомаркером для прогнозирования ПЭ и выступать как инструмент скрининга на ранних сроках гестации.
Чемерин
Чемерин – сравнительно недавно обнаруженный адипокин, который участвует в патогенезе ожирения и воспаления. Было показано, что его уровень может резко возрастать в 1-м триместре беременности и служить маркером ПЭ [52, 53].
Цистатин С
Цистатин С является хорошо исследованным маркером функции почек. Цистатин С – негликозилированный белок с молекулярной массой 13,4 кДа, относится к семейству ингибиторов цистеиновых протеиназ, идентичен пост-γ-глобулину. Впервые был идентифицирован у пациентов с почечной недостаточностью. Цистатин С с постоянной скоростью синтезируется клетками, содержащими ядра, полностью метаболизируется в почках, свободно фильтруется через клубочковую мембрану, не секретируется проксимальными почечными канальцами. Плацентарная экспрессия цистатина С увеличивается при развитии ПЭ, что может приводить к повышенному уровню цистатина С в плазме крови [54].
Адипонектин
Адипонектин – это выделенный из адипоцитов коллагеноподобный белок, обладающий инсулинсенсибилизирующими, антиатерогенными и противовоспалительными свойствами, который участвует в патогенезе ожирения. Экспрессия адипонектина происходит исключительно в жировой ткани. Многочисленные исследования последних лет подтверждают повышение уровня адипонектина у женщин с ПЭ [55].
Висфатин
Висфатин – недавно обнаруженный адипокин массой 52 кДа, вовлеченный в регуляцию гомеостаза глюкозы и выступающий как маркер эндотелиальной дисфункции. Hu W. и соавт. [56] в своем исследовании обнаружили низкую концентрацию висфатина при ПЭ. Кроме того, было показано, что беременные с тяжелой ПЭ имели значительно более низкую концентрацию висфатина в сыворотке крови, чем те, у которых ПЭ была умеренной.
Матриксная металлопротеиназа‑2 (ММР‑2)
Матриксная металлопротеиназа‑2 экспрессируется в мезенхимальных клетках (в основном в фибробластах) в период развития и репарации ткани, а также синтезируется нейтрофилами, макрофагами и моноцитами. Имеются указания на то, что на развитие осложнений беременности, в том числе и ПЭ, влияют как избыточная продукция протеаз, так и их недостаток. В ряде работ было показано, что MMP‑2 значительно выше в сыворотке крови у женщин с ПЭ по сравнению с небеременными или при физиологически протекающей беременности.
Аполипопротеин Е (ApoE)
Одним из механизмов развития ПЭ является нарушение метаболизма липидов, связанное с окислительным стрессом. Женщины с ПЭ имеют аномальный липидный профиль с повышенными концентрациями липопротеинов, богатых триглицеридами, которые могут способствовать эндотелиальной дисфункции. ApoE является основным компонентом липопротеинов очень низкой плотности, роль которого заключается в изменении воспалительных реакций и удалении избыточного холестерина из кровообращения посредством регуляции поглощения в печени. Ген ApoE на 19-й хромосоме имеет 3 общих аллеля, кодирующих 3 изоформы ApoE в плазме, – e2, e3 и e4. Было высказано предположение, что уровни ApoE и полиморфизмы его гена связаны с повышенным риском ПЭ. Обнаружена более высокая частота аллеля ApoE e2 среди женщин с ПЭ по сравнению с контрольной группой [57]. Эти данные не были подтверждены в других исследованиях [58, 59]. Роль данного направления исследований в прогнозировании ПЭ в настоящее время считается неопределенной.
Внеклеточная ДНК (вкДНК)
Фрагменты ДНК, циркулирующие в межклеточной среде организма, называют внеклеточной ДНК [60]. Существует несколько гипотез о происхождении вкДНК, основными из которых являются образование пула внеклеточных нуклеиновых кислот в результате гибели клеток («гипотеза клеточной гибели») и активная секреция ДНК живыми клетками («гипотеза метаболической ДНК») [61]. Повышенный интерес к вкДНК связан с возможностью ее использования в качестве маркера для диагностики. В составе вкДНК, выделенной из плазмы или периферической крови, обнаруживается ДНК плода (при беременности), что позволяет анализировать геном плода, не прибегая к биопсии.
Недавно была изучена связь между фетальной ДНК и ПЭ. В группе пациенток с высоким риском развития ПЭ наблюдалось более высокое содержание фетальной ДНК [62, 63]. Другие исследователи [64] наблюдали увеличение в 5 раз вкДНК плазмы у женщин с ПЭ по сравнению с беременными контрольной группы. Из 13 исследований, в которых определяли количество вкДНК для прогнозирования ПЭ, в 11 обнаружили более высокое содержание вкДНК [65].
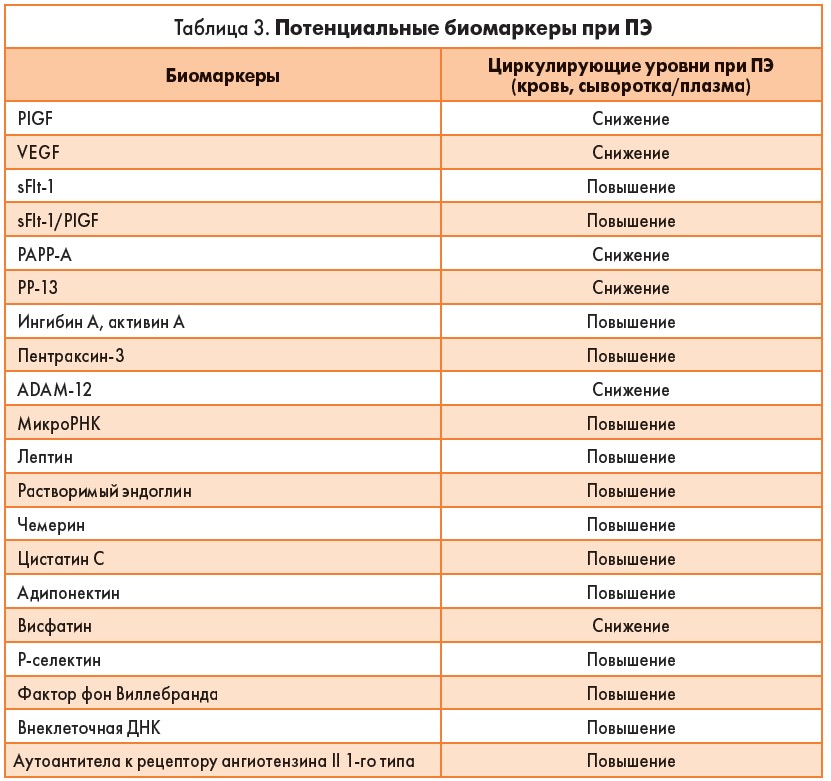
Таким образом, за последнее десятилетие появился целый ряд перспективных и интересных биохимических маркеров, которые могут быть использованы для своевременной и ранней диагностики группы риска, т. е. выявления беременных, у которых вероятность развития ПЭ очень высокая (табл. 3).
Выводы
Преэклампсия – это сложное и специфическое заболевание при беременности, механизмы которого еще не полностью понятны. Считается, что центральным звеном ПЭ является системное повреждение эндотелия сосудов микроциркуляции с развитием эндотелиальной дисфункции. Однако эндотелиальная дисфункция регистрируется при многих соматических заболеваниях и патологических состояниях, таких как сахарный диабет, атеросклероз, сепсис, хронические заболевания почек, гиперлипидемия, артериальная гипертензия, легочная гипертензия и др. В связи с этим исследовано большое количество биохимических маркеров для прогнозирования ранней диагностики и оценки степени тяжести ПЭ. Однако ни один из них официально не рекомендован к практическому применению в связи с достаточно низкой чувствительностью и специфичностью для ПЭ. Более того, определение уровня лишь одного какого-либо маркера не позволяет получить полноценную информацию о всех функциях эндотелия, нарушенных при ПЭ в той или иной степени.
Результаты современных исследований свидетельствуют о том, что лучшей предсказательной ценностью обладает сочетание клинических данных и биохимических параметров. На сегодняшний день поиск как клинических данных, так и лучших по своей предсказательной ценности биомаркеров продолжается, оставаясь одной из главных тенденцией научных исследований в акушерстве и гинекологии, учитывая тяжесть этого осложнения беременности.
Cписок литературы находится в редакции.
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 2 (34), червень 2019 р.