12 квітня, 2016
Застосування фіксованої комбінації інгібітора протонної помпи та прокінетика – сучасний підхід до лікування пацієнтів з функціональною шлунковою диспепсією
Сьогодні в медичній практиці вважається загальновідомим той факт, що функціональні захворювання травного тракту, не спричиняючи безпосередньої загрози для життя пацієнта, відчутно погіршують його якість та вимагають значних витрат на медичне обслуговування і лікування.
Одним із найбільш розповсюджених станів в структурі гастроентерологічної патології на сучасному етапі є шлункова диспепсія, про що переконливо свідчать результати численних популяційних досліджень, проведених у США та Європі. Вона спостерігається у 20-40% дорослого населення розвинутих країн світу [8].
У 2/3 хворих шлункова диспепсія має функціональний характер, виявити органічні чинники, що пояснюють причини її виникнення, вдається лише у 1/3 обстежених [11, 12].
У жінок функціональна шлункова диспепсія (ФШД) зустрічається у 2 рази частіше, ніж у чоловіків, а найбільша кількість звернень із диспептичними скаргами припадає на пацієнтів віком 35-45 років [9].
ФШД – це стан, який характеризується наявністю у пацієнта симптомів, що локалізуються у гастродуоденальній ділянці, за відсутності будь-яких органічних, системних та метаболічних порушень, які могли б стати поясненням цих скарг [13].
Сучасні наукові гіпотези розглядають ФШД як гетерогенний розлад [9].
Серед етіологічних чинників функціональної диспепсії важливу роль відіграють:
• спадковість;
• наявність порушень моторної функції шлунка і кишечнику;
• інфекція Helicobacter pylori (Нр-інфекція);
• психосоціальні фактори і спосіб життя (зловживання алкоголем, тютюнокуріння, нераціональне харчування);
• ятрогенні впливи (прийом нестероїдних протизапальних препаратів (НПЗП), антибіотиків, теофіліну, засобів на основі наперстянки та ін.).
Для синдрому шлункової диспепсії характерна наявність таких симптомів, як:
• біль або дискомфорт в епігастральній ділянці;
• відчуття швидкого насичення відразу ж після початку прийому їжі, незалежно від спожитого об’єму;
• відчуття затримки їжі в шлунку (переповнення), що може зумовлюватись вживанням їжі або мати іншу природу;
• здуття в епігастральній ділянці (суб’єктивне відчуття розпирання в епігастральній ділянці, яке необхідно диференціювати зі справжнім здуттям, зафіксованим під час огляду).
• нудота.
Слід зазначити, що на основі виключно клінічної картини шлункової диспепсії визначити її характер – органічна чи функціональна – досить складно.
Враховуючи серйозність прогнозу для хворих саме у випадку органічних захворювань стравоходу, шлунка та дванадцятипалої кишки (пептична виразка шлунка та дванадцятипалої кишки (ПВДПК), гастроезофагеальна рефлюксна хвороба (ГЕРХ), пухлини, жовчнокам’яна хвороба, хронічний панкреатит), перед верифікацією діагнозу ФШД необхідно виключити можливі органічні причини [12].
Виконання верхньої ендоскопії необхідне хворим, у яких діагностуються тривожні симптоми (так звані червоні прапорці, до яких відносять анемію, блювання, дисфагію, немотивоване зниження маси тіла, лихоманку, високий показник ШОЕ) та фактори ризику (прийом НПВП, вік >40 років).
Згідно з Римськими критеріями ІІІ для ФШД характерні наявність хоча б одного симптому (відчуття важкості в шлунку після вживання їжі, швидке насичення, печіння/біль в епігастрії) тривалістю не менше ніж 3 міс впродовж останніх 6 міс та відсутність органічних причин, які могли б пояснити виникнення патологічних проявів [26]. Слід звернути увагу на те, що у випадку ФШД симптоми хвороби не зникають після дефекації і не пов’язані із змінами частоти та характеру випорожнень.
На Міжнародній конференції гастроентерологів та гематологів (Таїланд, 2010 р.) було відзначено, що у 7-20% хворих на ФШД, крім симптомів, типових для вказаної патології, спостерігаються ознаки ГЕРХ, а у 8-50% – клінічна картина синдрому подразненого кишечнику. Наявність даної патології не виключає ФШД, а є підставою для верифікації декількох самостійних діагнозів [25].
Залежно від того, які саме клінічні прояви захворювання переважають, виділяють постпрандіальний дистрес-синдром – ППДС (дискінетична форма за Римськими критеріями ІІІ) та епігастральний больовий синдром – ЕБС (виразкоподібна форма за Римськими критеріями ІІІ) [11, 13, 27].
Для ППДС характерні відчуття:
• швидкого насичення (виникає після разового прийому їжі декілька разів у тиждень);
• важкості після їди (перешкоджає завершенню прийому їжі, фіксується декілька разів у тиждень).
Для ЕБС типовими є інтермітуючий біль або печіння, легкі або помірні за вираженістю, які локалізуються в епігастрії і турбують не менше 1 разу протягом тижня.
Згідно з концепцією N. J. Talley виділяють такі етіологічні чинники розвитку ФШД [9, 11]:
1. Спадковість (генотип GNβ3 cc).
2. Порушення моторної функції шлунка та кишечнику.
3. Нр-інфекція.
4. Кислотно-пептичний фактор, шлункова гіперсекреція на тлі гіперчутливості хеморецепторів дванадцятипалої кишки.
5. Шкідливі звички (зловживання алкоголем та тютюнокуріння).
6. Прийом медикаментів (НПЗП, антибіотиків, теофіліну, засобів на основі наперстянки, гормонів щитовидної залози).
Як зазначається у міжнародних консенсусах щодо діагностики та лікування Нр-інфекції (Маастрихт ІІІ, 2005 р.), успішна ерадикація Н. рylori покращує перебіг ФШД тільки у частини хворих (приблизно у 25%), однак усім пацієнтам із ознаками ФДШ слід призначити обстеження щодо інфікування Н. рylori та ерадикаційну терапію у випадку його підтвердження, що дозволяє зменшити ризик виникнення у майбутньому органічної патології шлунка та дванадцятипалої кишки [11, 12].
Провідну роль у виникненні симптомів ФШД відіграють моторна дисфункція верхніх відділів шлунково-кишкового тракту (ШКТ), а також вісцеральна гіперчутливість хеморецепторів дванадцятипалої кишки [11]. У 75% хворих на ФШД спостерігаються різноманітні зміни гастродуоденальної перистальтики [17, 20, 21, 24]:
• сповільнення евакуаторної функції шлунка;
• зниження частоти і амплітуди перистальтики шлунка;
• розлад антродуоденальної координації;
• послаблення постпрандіальної моторики антрального відділу шлунка;
• порушення рецептивної та адаптивної релаксації шлунка, що асоціюється зі зміною розподілу їжі всередині шлунка і викликає відчуття швидкого насичення.
Крім того, хворі на ФШД досить часто мають особливий психосоціальний статус, для якого характерні підвищений рівень тривоги, хронічний стрес, депресивні прояви, знижена психологічна адаптація, невротичні та іпохондричні реакції.
Загальні принципи ведення хворих на ФШД, вперше запропоновані N. J. Talley та G. Holmann у 2000 р., залишаються актуальними і сьогодні [11]:
1. Інвазивні обстеження після встановлення діагнозу мають бути мінімізовані, повторні тести виконуються тільки за наявності обґрунтованих показань.
2. Під час кожного візиту хворого та в рамках бесід обов'язково слід фокусувати увагу на доброякісному характері захворювання.
3. Необхідно мотивувати пацієнта щодо модифікації дієти та способу життя.
4. По можливості терапія має впливати на патофізіологічні механізми захворювання.
5. Препарати потрібно призначати згідно принципів раціональності та доцільності з урахуванням симптомів, що викликають найбільший дискомфорт.
6. В кожному конкретному випадку слід розглядати необхідність проведення психотерапії.
7. У кожного пацієнта може існувати потенційна потреба в тривалій курації.
Основні дієтичні рекомендації пацієнтам із ФШД спрямовані на усунення симптомів [11, 13]:
1. Вживати таку кількість їжі, яка не спричиняє дискомфорту.
2. Приймати їжу дрібними порціями 5-6 разів впродовж дня.
3. Тверді та рідкі страви вживати окремо.
4. Не приймати горизонтальне положення протягом 2-3 год після прийому їжі.
5. Уникати фізичного навантаження після їжі.
6. Відмовитися від продуктів, що провокують появу симптомів.
7. Зменшити в харчовому раціоні рівень жирів і збільшити – білків.
8. Обмежити вживання кави, алкоголю, шоколаду, цитрусових, томатів, винограду, слив, яблук та інших продуктів, що сповільнюють евакуаторну функцію шлунка.
Крім дієтичних рекомендацій та модифікації способу життя, враховуючи патогенез захворювання, значну роль в лікуванні ФШД відіграє кислотосупресивна фармакотерапія та заходи, спрямовані на відновлення моторно-евакуаторної функції стравоходу, шлунка та дванадцятипалої кишки [11, 13].
Призначення кислотосупресивних засобів супроводжується зменшенням закислення дванадцятипалої кишки та зниженням її вісцеральної гіперчутливості. Крім того, збільшення інтрадуоденального рН зменшує вивільнення холецистокініну, який бере безпосередню участь в розвитку порушень моторики верхніх відділів ШКТ [11]. Як правило, позитивна відповідь на призначення монотерапії інгібітором протонної помпи (ІПП) спостерігається у хворих на ФШД із клінічними проявами ЕБС.
Слід зазначити, що вимоги до кислотосупресивної фармакотерапії при ФШД повинні бути менш радикальними, ніж при лікуванні ПВДПК та ГЕРХ [11].
При виборі кислотосупресантів для лікування хворих на ФШД перевагу слід надавати ІПП [11], які характеризуються:
• швидким та помітним кислотосупресивним ефектом, що забезпечує позитивну клінічну динаміку;
• зручністю прийому (1 р/добу);
• відсутністю синдрому відміни;
• ефектом післядії;
• мінімальним ризиком виникнення побічних ефектів та безпечністю у разі тривалого використання.
Цей клас препаратів пригнічує протонну помпу – Н+/К+-АТФазу (незалежно від того, взаємодією з яким рецептором вона була активована). Сьогодні фармацевтичний ринок пропонує досить широкий асортимент ІПП: омепразол, езомепразол, лансопразол, пантопразол, рабепразол. Вони подібні за механізмом дії (блокують протонну помпу), проте мають суттєві розбіжності за параметрами швидкості, вираженості та тривалості кислотної супресії, що обумовлено різною молекулярною структурою, особливостями фармакокінетики і фармакодинаміки.
Серед представників ІПП найбільш вивченим є омепразол. Препарат тривалий час займає провідні позиції в лікуванні кислотозалежних захворювань [14, 16].
На кафедрі внутрішньої та сімейної медицини Вінницького національного медичного університету ім. М. І. Пирогова за допомогою добового гастро-рН-моніторингу проводили оцінку ефективності кислотоблокуючої дії омепразолу в дозі 0,02 та 0,04 г при лікуванні хворих на ПВДПК: в 1-шу добу від початку лікування, на 4-6-ту добу прийому омепразолу та через 2-3 дні після відміни препарату [1, 2, 3, 4].
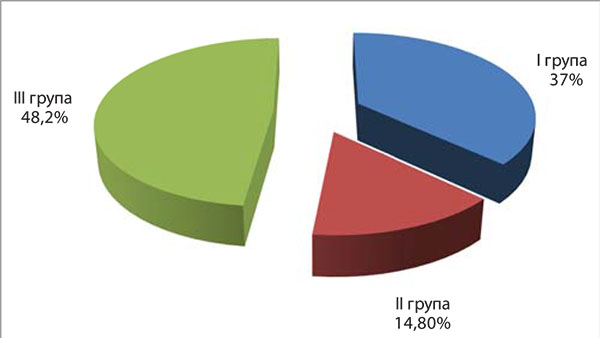
Проаналізувавши результати лікування омепразолом в дозі 0,02 г на 6-7-й день від початку проведення фармакотерапії, було встановлено, що у 37% обстежених хворих (група І) рівень рН шлунка >3,5 зберігався протягом 24 год; у 48,2% (група ІІІ) – від 17 до 20 год і тільки у 14,8% учасників (група ІІ) – <16 год на добу (рис. 1) [1].
Крім того, через 2-3 дні після відміни прийому омепразолу в дозі 0,02 г 1 р/добу більш ніж у 80% пролікованих пацієнтів з ПВДПК спостерігався ефект післядії [3].
В той же час слід підкреслити, що у значної частини хворих монотерапія ІПП не забезпечує редукції симптомів. У таких випадках слід розглянути можливість призначення прокінетиків – препаратів, що впливають на моторно-евакуаторну функцію шлунка та дванадцятипалої кишки [11] та відносяться до засобів патогенетичної терапії.
Їх фармакологічні ефекти реалізуються за рахунок відновлення [5, 11]:
• тонусу та моторики антрального відділу шлунка;
• антродуоденальної координації;
• моторно-евакуаторної функції шлунка;
• постпрандіальної моторики шлунка.
Прокінетичну дію мають:
1. Агоністи холінергічних рецепторів.
2. Блокатори дофамінових рецепторів:
а) неселективні (метоклопрамід);
б) селективні (домперидон);
в) селективні з антихолінестеразною дією (цизаприд).
3. Макроліди.
4. Препарати, які взаємодіють з 5НТ3-рецепторами (ондансетрон).
5. Гормональні пептиди (октреотид).
6. Агоністи κ-рецепторів (федотозин).
7. Антагоністи рецепторів холецистокініну.
8. Антагоністи опіатних рецепторів.
Найбільш вивченими серед прокінетиків є неселективні та селективні блокатори дофамінових рецепторів [5, 11]. Домперидон, на відміну від метоклопраміду, не проникає через гематоенцефалічний бар’єр, тому ризик побічних ефектів, притаманних метоклопраміду (лакторея, порушення менструального циклу та гінекомастія, екстрапірамідні розлади), на фоні терапії домперидоном мінімальний, що значно покращує прихильність пацієнтів до лікування [5, 7].
Домперидон активує перистальтику антрального відділу та сприяє покращенню евакуаторної функції шлунка [5, 19, 28]. Він досить ефективний в лікуванні гастропарезу, особливо діабетичної етіології, та гіпокінезії жовчного міхура [19, 22, 23]. Однак за силою антирефлюксної дії домперидон поступається ІПП та блокаторам Н2-рецепторів [18]. Так, у порівняльному дослідженні антирефлюксної ефективності ІПП, блокаторів Н2-рецепторів та домперидону, яку оцінювали під час контрольної верхньої ендоскопії через 4 та 8 тиж від початку лікування, найменш виражений терапевтичний вплив щодо епітелізації ерозій стравоходу зафіксовано при застосуванні домперидону [5, 11].
Під час аналізу результатів добового езофаго-рН-моніторингу автори дослідження В. Т. Івашкін та Є. Ю. Абидін встановили відсутність антирефлюксної дії домперидону (0,01 г 4 р/добу) на кислотні та на лужні гастроезофагеальні рефлекси [5].
Подібні дані були отримані в роботі С. П. Колісника та В. М. Чернобрового. Езофаго-рН-моніторинг виконували до початку прийому препарату та на 7-й день лікування домперидоном в дозі 0,01 г 4 р/добу. Аналіз результатів не виявив істотних змін частоти як кислотних, так і лужних гастроезофагеальних рефлюксів [6].
На нашу думку, недостатній вплив домперидону на гастроезофагеальні рефлюкси та симптоми ФШД пов’язаний із особливостями його фармакокінетики, а саме низьким рівнем біодоступності та коротким періодом напіввиведення, що зумовлює необхідність більш частого прийому препарату [7].
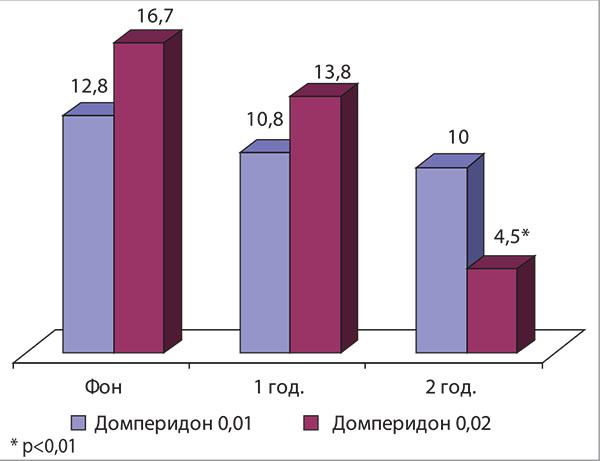
Підтвердженням такого припущення стало дослідження, виконане на кафедрі внутрішньої та сімейної медицини Вінницького національного медичного університету ім. М. І. Пирогова. За допомогою езофаго-рН-моніторингу вивчалась антирефлюксна дія домперидону в дозі 0,02 та 0,01 г протягом двох годин (рис. 2). Було встановлено, що домперидон в дозі 0,01 г не впливає ні на кислотні, ні на лужні гастроезофагеальні рефлюкси. Водночас виявлено вірогідне (р<0,01) зменшення кількості кислотних гастроезофагеальних рефлюксів протягом 2 год після прийому препарату в дозі 0,02 г [15].
В той же час в низці робіт показано, що ефективність та безпечність медикаментозного лікування ФШД збільшуються при одночасному застосуванні ІПП і прокінетиків. Раціональним вибором є використання комбінацій кислотосупресивного препарату із доведеною ефективністю та безпечного прокінетика (наприклад, селективного блокатора дофамінових рецепторів домперидону), бажано з повільним вивільненням, яке забезпечило б адекватну терапевтичну концентрацію діючої речовини протягом 12-24 год.
На фармацевтичному ринку України представлений комбінований препарат Лімзер виробництва компанії «Мега». Одна капсула препарату Лімзер містить 0,02 г омепразолу в кишковорозчинних гранулах та 0,03 г домперидону в особливій формі випуску – гранули з пролонгованим вивільненням (форма SR).
Завдяки використанню форми SR забезпечується достатня терапевтична концентрація домперидону протягом тривалого періоду часу, що дозволяє застосовувати Лімзер 1 раз на добу (рекомендується прийом ліків за 15-30 хв до їжі).
В Україні проведено ряд досліджень, присвячених вивченню ефективності використання препарату Лімзер в лікуванні пацієнтів з патологією верхніх відділів ШКТ [10, 14].
А. С. Свінцицький та співавт. вивчали його вплив на симптоми ФШД у пацієнтів з хронічним ерозивним гастритом. Автори оцінювали динаміку внутрішньошлункового рН та за допомогою гастросцинтіграфії вивчали вплив препарату на швидкість евакуації шлункового вмісту. Також визначались час початку евакуації шлункового вмісту, період напіввиведення колоїду, міченого 99Тс; відсоток виведення колоїду, міченого 99Тс, за 30 хв.
До групи порівняння увійшли пацієнти, які отримували омепразол та домперидон (у традиційній формі випуску) в дозі 0,01 г 3 р/добу.
Лімзер швидко усував симптоми ФШД, при цьому він продемонстрував ефективність щодо пригнічення секреції хлористоводневої кислоти парієтальними клітинами шлунка. Лімзер суттєво (р<0,01) переважав комбінацію омепразолу та домперидону за здатністю впливати на моторно-евакуаторну функцію шлунка [14].
В іншому дослідженні, проведеному в Українській військово-медичній академії МО України на базі Національного військово-медичного клінічного центру «Головний військовий клінічний госпіталь»
МО України (м. Київ) Г. В. Осьодло, C. М. Прокопчуком та О. С. Зубрицьким, вивчалась динаміка клінічних проявів ФШД, оцінювалась якість життя пацієнтів та можливості поєднаного застосування препарату Лімзер з методами апаратної фізіотерапії при функціональній диспепсії у військовослужбовців.
Згідно з аналізом результатів, здійсненим через
4 тиж від початку лікування, позитивна динаміка клінічних симптомів відзначалася у більшості обстежених військовослужбовців. Особливо це стосувалось таких проявів, як відчуття переповнення після їжі, важкості, здуття та болю в епігастрії, нудоти і печії.
Дослідники відзначили, що у пацієнтів з ФШД спостерігалося підвищення середнього показника якості життя по шкалі загального здоров’я з 76,3±3,4 до 89,7±6,4 бала (p<0,05), життєздатності – з 60,1±2,9, до 78,5±5,9 бала (p<0,05), рольового емоційного функціонування – з 74,1±4,1 до 97,8±5,4 бала (p<0,05).
Автори дослідження прийшли до висновку, що терапія препаратом Лімзер забезпечує зменшення клінічних проявів ФШД, покращення якості життя хворих, підвищення показника тесту з водним навантаженням, що свідчить про зниження гіперчутливості шлунка [10].
Слід відзначити, що ФШД є актуальною проблемою сучасної гастроентерології, вирішення якої потребує комплексного підходу. До етіологічних чинників виникнення ФШД відносять порушення моторно-евакуаторної функції шлунка та гіперчутливість рецепторного апарату слизової оболонки дванадцятипалої кишки до хлористоводневої кислоти.
Використання у лікуванні ФШД комбінованого препарату Лімзер, до складу якого входять омепразол (0,02 г) та домперидон (0,03 г) у вигляді гранул з пролонгованим вивільненням (форма SR), є раціональним та обґрунтованим як з патогенетичної, так і з клінічної точки зору.
Список літератури знаходиться в редакції.
| Медична газета «Здоров’я України 21 сторіччя» №5 (378), березень 2016 р |