29 грудня, 2015
От висмута до Де-Нола – современные стратегии и перспективы
История висмута (англ. Bismuth, франц. Bismuth, нем. Wismut) достаточно интересна: вплоть до XVIII в. этот металл путали со свинцом, оловом и сурьмой. Как своеобразный металл, а также в виде солей висмут был известен в Центральной Европе с XV в. под разными названиями. Его упоминают многие авторы книг XV-XVII вв., в частности Валентин и Парацельс; производство висмута описал Агрикола. Липпман в своей книге Geschichte des Wismuts zwischen 1460 und 1800 (1930) приводит 21 название металла, встречающееся в литературе XV-XVII вв. В «Алхимическом словаре» Руланда (1612) висмут (Bisematum) объясняется как «всякий легчайший, бледнейший и дешевейший свинец», в том же словаре упоминается о белом висмуте как синониме альбедо (albe do – белое), белом марказите (под которым, однако, понимали не минерал FeS2, а некоторые металлические руды), свинцовой золе (Plmbum cinereum) и др. В XVI и XVII вв. висмут широко применялся в сплавах (в частности, в типографском сплаве), а его соли – в медицине и косметологии, но лишь в XVIII в. Потт и Бергман установили его отличия от других металлов и предложили считать висмут простым телом.
Происхождение названия висмута неясно. По мнению Липпмана, наиболее вероятно, что оно произошло от горняцких слов wis и mat, т. е. белая масса, белая материя. В русской научной литературе сведения о висмуте встречаются у Ломоносова в его «Первых основаниях металлургии». В «Словаре химическом» Кадета, изданном Севергиным в 1810 г., довольно подробно описаны висмут и некоторые его соединения, а также приведены многие синонимы названия: демогоргон, глаура, нимфа, стекловатое олово, серое олово. В начале XIX в. висмут в России называли иногда визмутом и бисмутом.
Физиологическая роль висмута
В организм человека висмут поступает с пищей, а также с воздухом и водой, в количестве 5-20 мкг/сут. Всасывание висмута в желудочно-кишечном тракте (ЖКТ) является незначительным и составляет менее 1% [56]. После всасывания висмут попадает в кровь в виде соединений с белками и проникает в эритроциты. Между органами и тканями висмут распределяется относительно неравномерно. Преимущественно висмут накапливается в печени, почках (до 1 мкг/г), селезенке и костях, а также в незначительном количестве – в головном мозге. Висмут, прошедший через ЖКТ, выделяется в виде сульфида висмута, окрашивая кал в темный цвет. Из организма висмут выделяется с мочой [1].
Физиологическая роль висмута недостаточно изучена. Сегодня доказано, что висмут индуцирует синтез низкомолекулярных белков, участвует в процессах оссификации, образует внутриклеточные включения в эпителии почечных канальцев. Вероятность попадания токсичных доз висмута в организм с водой или пищей незначительна. Преимущественно это возможно при длительном системном или местном применении лекарственных препаратов, в состав которых входит висмут [2]. Определение содержания висмута в организме проводится по результатам исследований биосубстратов – мочи, крови, волос и биоптатов. При хронической интоксикации висмутом определяют его уровень в суточной моче. В норме концентрация висмута в организме не превышает нескольких мкг/л: в крови <3 мкг/л, в костях <0,2 мкг/г, в почках – 0,4±0,1 мкг/г.
Применение висмута в медицинской практике
Еще в конце XIX в. некоторые соединения висмута начали использоваться как противомикробные препараты и наружные средства, обладающие подсушивающим эффектом, в частности для наружного лечения кожных проявлений сифилиса и ряда других неспецифических кожных воспалительных процессов.
Препараты висмута выпускают в форме порошков, мазей, паст и таблеток. Наружно применяют препараты висмута в форме присыпок и мазей (ксероформ, дерматол) при дерматитах, экземе, поверхностных пиодермиях, трофических язвах. Для инъекций использовались суспензии некоторых соединений висмута в растительном масле (бисмоверол, бийохинол, пентабисмол) для лечения сифилиса [3].
Комбинированные препараты, в состав которых входит нитрат висмута основной (викалин, викаир), проявляют вяжущее, умеренное послабляющее действие, а также снижают кислотность. Нитрат висмута основной применяют внутрь при воспалительных заболеваниях кишечника (колитах, энтеритах), при язвенной болезни желудка и двенадцатиперстной кишки; диареи различного генеза [4].
Препараты висмута применялись как средства терапии ЖКТ уже в XVI в. Особенно широкое распространение для лечения диспептических явлений они получили в XIX в. (в частности, в Германии и Англии). В клинической практике использовались и продолжают применяться различные препараты висмута (висмута субцитрат, висмута субсалицилат, висмута субгаллат и др.), но наиболее часто в настоящее время назначается коллоидный висмута субцитрат (КВС) [5].
Бренды и генерики – реалии фармацевтического рынка
На современном фармацевтическом рынке преобладают не оригинальные лекарственные средства (ЛС), а воспроизведенные формы (генерики), содержащие активные фармацевтические ингредиенты (АФИ), срок патентной защиты которых закончился, в связи с чем они перестали быть собственностью компании-разработчика. Их доля в общем мировом производстве к началу нынешнего столетия превысила 70%, в то время как в 1975 г. она составляла лишь 9% [7]. Распространенность генериков на национальных рынках неоднородна: объем продаж воспроизведенных ЛС в США и странах Западной Европы колеблется в пределах 25-35%, в Восточной Европе – 55-70%, а в странах СНГ превышает 75% [8-12]. Преобладают генерики зарубежного и отечественного производства и в Украине. Главное преимущество таких препаратов – более низкая по сравнению с оригинальными ЛС стоимость, а недостаток – качественная неоднородность, что, несмотря на невысокую цену, при низкой эффективности и неподтвержденной безопасности ведет к значительным дополнительным затратам вследствие побочных реакций и осложнений. Так, частота проявления нежелательных эффектов у отдельных ЛС, содержащих в качестве АФИ диклофенак натрия, ~ 16,9%, в то время как для оригинального препарата Вольтарен® она значительно ниже – ~ 3,7% [13].
В связи с этим возникают проблемы обоснованной фармацевтической замены и выбора критериев соответствия воспроизведенного ЛС бренду. Доказательства терапевтической идентичности имеют особое значение для препаратов с малым терапевтическим индексом (ТИ = ЛД50/ЭД50, или отношение медианной смертельной дозы к медианной эффективной дозе), предназначенных для длительного применения при лечении заболеваний, влияющих на уровень инвалидизации и смертности, таких как кардио- и цереброваскулярная патология, сахарный диабет, бронхиальная астма, а также для антибактериальных средств. Широкое распространение исследования по оценке подобия копий оригинальным ЛС получили в государствах Западной Европы в 1980-1990-е гг. В результате в ряде стран были созданы реестры, в которых для удобства врачей, провизоров и пациентов генерики представлены в виде двух категорий: с доказанной в клинических условиях терапевтической эквивалентностью и без таковой. Примером является публикуемая в США «Оранжевая книга» (Approved Drug Products with Therapeutic Equivalence Evaluation) [14]. В Украине в связи с преобладанием на рынке воспроизведенных ЛС проблема их идентичности брендам чрезвычайно актуальна, ее научные аспекты достаточно широко обсуждаются многими специалистами [15-17], однако количественная оценка основных биофармацевтических показателей копий пока не получила должного распространения.
В связи с этим неизбежно возникают вопросы: является ли фармакокинетическая эквивалентность доказательством терапевтической и достаточное ли это основание для замены бренда на воспроизведенное ЛС? В первую очередь критически рассматривается величина максимально допустимых клинически важных отличий в AUC, Cmax, tmax, в настоящее время составляющая 20%. Особое значение это имеет для ЛС с малым ТИ. Некоторые специалисты предлагают снизить этот показатель по крайней мере до 10-15% [18]. В упомянутой выше «Оранжевой книге» для препаратов из группы А с клинически доказанной терапевтической эквивалентностью отличия от брендов в основных фармакокинетических параметрах не превышают 4%.
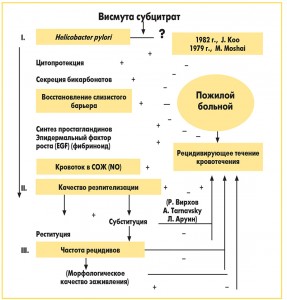
Традиционно КВС относят к цитопротекторным средствам, повышающим устойчивость слизистой оболочки ЖКТ к действию различных агрессивных факторов. Так, при приеме КВС в кислой среде желудочного содержимого (при рН<4) осаждаются нерастворимые оксихлорид и цитрат висмута, образующие хелатные соединения с белковым субстратом, которые в виде пленки, сохраняющейся в течение нескольких часов, покрывают язвенный кратер, защищая его от действия соляной кислоты, пепсина и желчных кислот. Кроме того, КВС стимулирует синтез простагландинов, увеличивая таким образом выработку слизи и секрецию бикарбонатов; приводит к накоплению эпидермального фактора роста в зоне язвенного дефекта; усиливает кровоток в слизистой оболочке (СО); повышает пролиферативную способность эпителиальных клеток СО желудка за счет увеличения концентрации ионов кальция и активность MAP-киназы; участвует в реконструкции экстрацеллюлярного матрикса и полноценном ангиогенезе; подавляет продукцию провоспалительных цитокинов [19, 20].
В последние годы показано значение окислительного стресса, потенцируемого бактериями H. pylori (особенно имеющими генотип CagA+/vacAs1), в развитии хронического гастрита [21]. Препараты висмута оказались способными улавливать свободные кислородные радикалы, образующиеся при окислительном стрессе и повреждающие СО желудка, что служит одной из составляющих их цитопротекторного действия [22].
Хорошие цитопротекторные свойства КВС обеспечили его широкое применение в 1970-1980 гг. для курсового лечения обострений язвенной болезни желудка и двенадцатиперстной кишки, в том числе в виде монотерапии. В настоящее время, помимо цитопротекторного эффекта препаратов висмута, привлекает внимание их бактерицидное действие, благодаря чему он используется в схемах эрадикации инфекции H. pylori.
Обнаружение в 1983 г. Helicobacter pylori (H. pylori) в слизистой оболочке желудка коренным образом изменило взгляд на этиопатогенез воспалительных заболеваний верхних отделов (ВО) ЖКТ. Одним из основных механизмов болезни в настоящее время считается инфекционный фактор. В результате изменились взгляды не только на патогенез патологии, но и на основополагающие принципы ее терапии: как и при лечении любого инфекционного процесса, при H. pylori-ассоциированных заболеваниях ВО ЖКТ стали широко использоваться антибактериальные средства.
Среди средств, обладающих антибактериальным эффектом, одним из первых препаратов для антихеликобактерной терапии стал КВС. Исторически препараты висмута широко использовались при различных желудочно-кишечных нарушениях с конца XVIII в. В арсенале врачей имелось большое разнообразие солей висмута: субнитрат, субкарбонат, субгалат, тартрат и субсалицилат [23], однако их активность и растворимость были неодинаковыми. Ряд исследователей определяли минимальную подавляющую концентрацию (МПК) в отношении H. pylori для различных солей висмута; было обнаружено, что МПК для КВС являются наименьшей [24-26]. В Украине КВС известен под торговым названием Де-Нол®. Важным является тот факт, что растворимость КВС в желудочной слизи в 20-100 раз выше по сравнению с другими препаратами висмута [55] .
Растворимость КВС с увеличением рН (до 7) только возрастает, в отличие от других солей висмута, для которых оптимальное значение pH находится в пределах 4-7 [55]. Соединение цитрата с гидроксидом висмута способствует образованию молекулярных комплексов различной структуры и размеров, что приводит к переходу водного раствора в коллоидный [27].
Другие соли, не являющиеся комплексными, должны быть подготовлены с помощью сильных кислот или щелочей и воздействия ультразвуком, чтобы стать дисперсными и тем самым получить возможность проявить антибактериальную активность. Такая подготовка не может быть осуществлена in vivo. Преимуществами Де-Нола являются также более низкий уровень МПК, чем у блокаторов Н2-рецепторов гистамина и ингибиторов протонной помпы (ИПП). Антихеликобактерные свойства препарата Де-Нол® обеспечиваются за счет снижения адгезии H. pylori к клеткам эпителия; ослабления действия ферментов H. pylori, таких как уреаза, каталаза, липаза; разрушения бактериальной стенки за счет образования комплексов-депозитов на бактериальной стенке и в периплазматическом пространстве [28-30]. Критерием антихеликобактерного действия для препаратов висмута является их способность подавлять адгезию H. pylori. В этом отношении существующие препараты не могут составить конкуренции Де-Нолу, т. к. у большинства из них антиадгезивная активность усиливается при концентрации ≥500 мкг/мл, в то время как у Де-Нола она составляет практически 100% при концентрации в 1000 раз меньше. Коллоидная форма Де-Нола позволяет ему эффективно пенетрировать в желудочную слизь, поэтому препарат хорошо проникает вглубь желудочных ямок и уничтожает бактерии, находящиеся в недосягаемости для других антибактериальных средств.
Для оценки действия антибактериального средства в организме используется не только МПК, но и определение влияния препарата на кинетику роста микроорганизма, поскольку этот показатель лучше отражает то, как действительно работает ЛС. Так, исследование кинетики роста H. pylori in vitro при добавлении в среду различных препаратов показало, что наиболее сильным и быстрым бактерицидным эффектом обладал кларитромицин (2-8 ч инкубации); Де-Нол®, ципрофлоксацин и метронидазол приводили к выраженному угнетению роста в период действия препаратов от 8 до 24 ч после добавления их в среду; производные пенициллина проявляли максимальный эффект через 48 ч. Следовательно, Де-Нол® обладает ингибирующей рост H. pylori активностью, сравнимой с таковой у отдельных антибиотиков, и в то же время он действует длительно, проявляя максимум своего бактерицидного эффекта в течение 16 ч, разрушая покоящиеся клетки [31].
Де-Нол® также обеспечивает более быстрое и качественное заживление дефектов слизистой за счет ряда факторов: при приеме больным Де-Нола менее 1% препарата всасывается в желудке и тонкой кишке и элиминируется почками, а остальная часть выводится через кишечник [32, 33].
Это свойство Де-Нола позволяет принимать его достаточно продолжительный период времени (до 8 нед согласно инструкции), причем концентрация висмута в сыворотке крови сохраняется (в среднем) на уровне 37,67±25,06 мкг/л [34, 35], препарат полностью выводится на 30-й день после начала лечения. При приеме Де-Нола возможными нежелательными реакциями являются диспептические явления (тошнота, рвота, боль в эпигастрии, снижение аппетита, неприятный (металлический) привкус во рту, метеоризм, болезненность по ходу кишечника, диарея/запор, псевдомембранозный колит, боль в области ануса), гингивиты, артралгии, нефропатия, а также развитие энцефалопатии.
Причинами указанных явлений является повышение в сыворотке крови концентрации висмута. Так, признаки висмутовой энцефалопатии (такие как головная боль, головокружение, повышенная возбудимость или сонливость, нарушение сна, депрессии, светобоязнь, шаткость походки) начинают проявляться при концентрации висмута субцитрата >1500 мкг/л [38], другие побочные эффекты могут проявляться при повышении концентрации висмута в крови >100 мкг/л [39].
Использование Де-Нола замедляет процессы всасывания некоторых антибиотиков. Так, при одновременном применении Де-Нол® уменьшает абсорбцию антибиотиков группы тетрациклина, способствуя тем самым повышению их концентрации в желудочном содержимом – месте приложения при лечении хеликобактерной инфекции. В исследованиях как in vitro, так и in vivo было показано, что Де-Нол® обладает синергизмом с другими антибиотиками в отношении H. pylori. Благодаря этому свойству он стал непременным компонентом антихеликобактерной терапии, а его сочетание с двумя антибиотиками и сегодня называют классической тройной терапией [40].
Кроме того, одним из способов преодоления резистентности H. pylori является применение в качестве базисного препарата КВС. Это положение подтверждается изучением антибактериальной активности in vitro комбинаций различных препаратов с кларитромицином и амоксициллином в отношении штаммов H. pylori, чувствительных или резистентных к макролидам. Было показано, что свойства Де-Нола играли решающую роль в преодолении резистентности штаммов и обеспечении стойкого бактерицидного эффекта указанных комбинаций препаратов.
Кроме этого, было установлено, что КВС оказывает антихеликобактерный эффект при невысоких значениях МПК, составляющих <25 мг/л. КВС образует комплекс с белками бактериальной стенки и вызывает деградацию бактерий за счет окислительного стресса, препятствует адгезии H. pylori к эпителиоцитам, блокирует подвижность бактерий, подавляет активность вырабатываемых ими ферментов (уреазы, каталазы, фосфолипазы, протеаз) [41, 42].
КВС назначают преимущественно в качестве одного из препаратов, входящих в состав четырехкомпонентной схемы эрадикации H. pylori в комбинации с ИПП, тетрациклином и метронидазолом. Немаловажно, что эта схема оказывается эффективной и у больных, резистентных к метронидазолу.
Последние рекомендации согласительного совещания «Маастрихт-IV» предлагают применение квадротерапии с препаратами висмута в качестве альтернативы тройной терапии (ИПП, амоксициллин, кларитромицин) и предусматривают возможность назначения квадротерапии в качестве схемы первой линии в тех случаях, когда есть основание предполагать устойчивость штаммов H. pylori к кларитромицину (например, во Франции или Италии, где частота таких штаммов в популяции превышает 20%) [43].
Было показано, что квадротерапия с препаратами висмута может применяться как схема первой линии также при проведении эрадикации инфекции H. pylori у больных сахарным диабетом, у которых стандартная тройная схема эрадикации оказывается, как правило, малоэффективной [44].
Современные рекомендации, принятые Американской коллегией гастроэнтерологов (США), также предполагают возможность назначения квадротерапии с препаратами висмута в качестве схемы первой линии, обеспечивающей частоту эрадикации H. pylori, сопоставимую с таковой при применении схемы тройной терапии с амоксициллином и кларитромицином (соответственно 87 и 85% при оценке по методике per protocol) [45].
В настоящее время получены хорошие результаты использования схемы квадротерапии с КВС при атрофическом гастрите [46]. При ее применении у больных с атрофией слизистой оболочки желудка и сниженной секрецией соляной кислоты частота эрадикации составляет 92,6% [47].
Были проанализированы результаты отдаленного наблюдения за состоянием слизистой оболочки желудка у больных с атрофическим гастритом, у которых проводилась эрадикация с применением схем тройной терапии (ИПП + кларитромицин + амоксициллин) и тройной схемы, включающей КВС, амоксициллин и кларитромицин. Частота достигнутой эрадикации в обеих группах оказалась почти одинаковой (соответственно 81,3 и 84%). При оценке динамики морфологических показателей через 18 мес после лечения было отмечено, что выраженность атрофии и кишечной метаплазии не изменилась, однако обнаруженное у больных повышение соотношения пепсиногена I к пепсиногену II свидетельствовало об улучшении процессов регенерации в слизистой оболочки тела желудка [48].
Большой интерес представляют результаты применения у больных с пангастритом КВС в комбинации с амоксициллином и метронидазолом вместо обычно используемых в таких случаях ИПП. Авторы данного исследования исходили из того, что поражение тела желудка с последующим снижением секреции соляной кислоты делает нецелесообразным назначение этим пациентам стандартных схем эрадикации с ИПП. В сравнительном исследовании эффективности применения двух 7-дневных схем эрадикации, включавших либо лансопразол + амоксициллин + метронидазол, либо КВС + амоксициллин + метронидазол, было показано, что частота эрадикации (при оценке по методике per protocol) в случае схемы с висмутом (78,8%) была статистически достоверно выше, чем при использовании схемы на основе ИПП (51%) [49].
Опубликованы результаты исследований, в которых препараты висмута назначались в составе резервных схем эрадикации при неэффективности стандартных схем первой и второй линий. Так, применение комбинации рабепразола, амоксициллина, висмута субцитрата и фуразолидона в течение 7 или 14 дней позволяло достичь эрадикации соответственно у 82 и 90% больных [50, 51].
Для оценки эффективности и безопасности применения в педиатрической практике различных схем тройной терапии, базисным препаратом для которых является КВС (ДеНол®), было обследовано 186 детей с хроническими воспалительными заболеваниями ВО ЖКТ, ассоциированными с H. pylori-инфекцией, в возрасте от 6 до 15 лет (97 мальчиков и 89 девочек). Все они имели длительный анамнез заболевания (более 1 года). Большинство детей неоднократно получали курсы антацидов, цитопротекторов, ферментов, фитотерапии, однако эрадикационная терапия никому не проводилась. У всех пациентов была типичная клиническая картина, характерная для воспалительных заболеваний ВО ЖКТ. Кроме того, у 21% обследованных детей имелись эрозии слизистой оболочки различных отделов (пищевода, желудка, луковицы двенадцатиперстной кишки), у 12 (6,5%) детей определялись активные единичные или множественные язвы луковицы двенадцатиперстной кишки. Для диагностики H. pylori-инфекции применялись полимеразная цепная реакция (ПЦР) биопсийного материала из антрального и фундального отделов желудка, ПЦР копрофильтрата, иммуноферментный анализ фекалий (ИФА), гистологическое исследование биоптатов; в качестве экспресс-диагностики использовались быстрый уреазный тест и серологическая диагностика. Положительные результаты ПЦР биопсии были получены у 93%, кала – у 56%, ИФА кала – у 89%, быстрого уреазного теста – у 79%, серологических исследований – у 90% детей. При гистологическом исследовании у 100% пациентов была диагностирована H. pylori-инфекция, причем слабая степень обсеменения выявлена у 29%, средняя – у 50%, высокая – у 21% детей.
Все больные в течение 7 дней получали антихеликобактерную терапиюпо определенным схемам. Первая группа: Де-Нол® – 8 мг/кг/сут (≤480 мг/сут), нифурател – 15 мг/кг/сут, амоксициллин – 30 мг/кг/сут (≤1000 мг); вторая группа (20 человек): ДеНол®, нифурател в тех же дозировках и кларитромицин – 7,5 мг/кг/сут (≤500 мг); третья группа – Де-Нол®, амоксициллин, кларитромицин [52, 53]. При наличии резистентных штаммов H. pylori или проведения предыдущей неудачной эрадикационной терапии в течение последнего года назначалась квадротерапия, включавшая Де-Нол®, нифурател, амоксициллин и омепразол (0,5 мг/кг). После окончания эрадикационной терапии прием Де-Нола продлевался еще на одну неделю.
После проведенной терапии у всех детей была достигнута клиническая ремиссия и отмечалась положительная динамика эндоскопической картины. Однако при использовании схем с амоксициллином наблюдалось усиление метеоризма и появление диареи (p<0,05). Других побочных явлений, по нашим данным, не отмечалось.
Результаты исследования продемонстрировали не только высокую эффективность эрадикационной терапии с применением Де-Нола в качестве основного компонента эрадикационной терапии, но и доказали его безопасность при использовании в терапевтических дозах и непродолжительным курсом [54].
Даже в европейских странах, с учетом возрастающей резистентности H. pylori к метронидазолу и кларитромицину, все чаще обращаются к схемам эрадикации с применением препаратов висмута. Более того, Маастрихтским консенсусом IV созыва (2012) рекомендовано использовать квадротерапию с препаратом висмута в терапии первой линии (табл).
 Проблема выбора между оригинальными препаратами и генериками многогранна. Для оценки рисков, связанных с заменой брендов на воспроизведенные лекарственные средства, врачи должны опираться на достоверные данные об их надлежащем качестве, безопасности и клинической эффективности. При этом показатели фармацевтической и фармакокинетической эквивалентности являются необходимыми, но далеко не достаточными условиями терапевтической эквивалентности, для доказательства которой необходимы клинические испытания.
Проблема выбора между оригинальными препаратами и генериками многогранна. Для оценки рисков, связанных с заменой брендов на воспроизведенные лекарственные средства, врачи должны опираться на достоверные данные об их надлежащем качестве, безопасности и клинической эффективности. При этом показатели фармацевтической и фармакокинетической эквивалентности являются необходимыми, но далеко не достаточными условиями терапевтической эквивалентности, для доказательства которой необходимы клинические испытания.
Список литературы находится в редакции.