24 грудня, 2019
Нарушение системы гемостаза при сепсисе
Сепсис – это угрожающая жизни дисфункция внутренних органов, которая возникает при нарушении регуляции ответа организма на инфекцию и вызывает повреждение собственных тканей, что может привести к серьезному ухудшению состояния или смерти [1]. Согласно статистике, заболеваемость сепсисом составляет 270 случаев на 100 тыс. человек в год с уровнем смертности 26% [2]. В США приблизительно 750 тыс. случаев данной патологии регистрируется каждый год, 225 тыс. из которых являются смертельными. На пациентов с этим заболеванием расходуется около 24 млрд долларов в год. Ежегодно сепсисом страдает 3 млн новорожденных и 1,2 млн детей [3]. В связи с беременностью и родами каждая десятая смерть происходит по причине материнского сепсиса [4, 5].
Признаки и симптомы у сепсиса могут быть различными, так как данное клиническое состояние вызывается множеством возбудителей и меняет свой характер на всех этапах. К основным симптомам сепсиса относятся: повышение или понижение температуры тела, озноб, учащенное сердцебиение, ослабление пульса, низкое давление крови, олигурия, синюшность или мраморность кожи, похолодание конечностей, сильные боли или дискомфорт в теле [6-8]. Возникновение подозрения на сепсис является первым шагом к его распознаванию и диагностике.
Сепсис часто связан с изменениями системы гемостаза, начиная от субклинической активации свертывания крови (гиперкоагуляция), которая может способствовать развитию локализованной венозной тромбоэмболии, до острого ДВС‑синдрома (диссеминированное внутрисосудистое свертывание), который характеризуется распространением микрососудистого тромбоза. Это приводит к истощению тромбоцитов и белков свертывания, вызывая кровотечение. Ключевым событием, лежащим в основе этого опасного для жизни осложнения, является чрезвычайно сильная воспалительная реакция хозяина в ответ на инфекционный агент, приводящая к сверхэкспрессии медиаторов воспаления [9].
Система гемостаза и воспаление – это тесно взаимосвязанные патофизиологические процессы, которые в значительной мере влияют друг на друга [10, 11]. Такое тесное взаимодействие между этими системами объясняется попыткой организма восстановить нормальное функционирование тканей после повреждения из-за травмы или инфекционных патогенов. Местная активация системы гемостаза является неотъемлемой частью защиты хозяина как от инфекционных, так и неинфекционных агентов. В зависимости от действия провоспалительных медиаторов при воспалении система гемостаза сдвигается в сторону прокоагулянтного состояния, чтобы активировать процесс свертывания и ингибировать антикоагулянтную и фибринолитическую активность.
Патогенез тромбообразования при сепсисе
Повышение прокоагулянтной регуляции
При сепсисе происходит повсеместная активация гемостаза, которая индуцирована патоген-связанными молекулярными структурами, такими как липополисахарид (ЛПС) и экзотоксины. Так, генерация тромбина определяется уже через несколько часов на моделях у здоровых людей при инфузии фактора некроза опухоли (TNF) и эндотоксина [12, 13]. Кроме того, повреждение эндотелия наблюдалось спустя 15 минут после инфузии ЛПС у животных [14]. Ключевым моментом этого прокоагулянтного состояния является взаимодействие между тканевым фактором (TF) и высвобождением воспалительных цитокинов. TF является ответственным за связывание и активацию фактора VII (FVII) на поверхности клеток, образуя комплекс фермент-кофактор, что приводит к усиленному продуцированию фактора Xa (FXa). Продолжаются споры по поводу первичного источника TF, так как не только эндотелиальные клетки и мононуклеарные фагоциты (моноциты и макрофаги) могут экспрессировать TF, но и клетки легкого, почек и астроциты мозга [15]. Провоспалительные цитокины – TNF, интерлейкин‑1 (IL‑1) и интерлейкин‑6 (IL‑6) – повышаются после экспрессии TF и играют главную роль в подавлении действия природных антикоагулянтов и повреждении эндотелия [16]. Фактор активации тромбоцитов (PAF) высвобождается непосредственно после воспаления, и активированные тромбоциты способствуют ускорению тромбоза. Экспрессия Р‑селектина приводит к увеличению экспрессии TF и адгезии тромбоцитов к лейкоцитам и эндотелию [18]. Прилипшие к лейкоцитам и эндотелию тромбоциты служат поверхностью для генерации тромбина.
Нарушение антикоагулянтной активности
При сепсисе происходит нарушение трех эндогенных антикоагулянтов, что способствует коагулопатии на ранней стадии воспаления. Ингибитор пути тканевого фактора (TFPI) является ранним регулятором коагуляции, который активируется TF и взаимодействием с FVIIa. TFPI, ранее известный как ингибитор внешнего пути, действует для предотвращения коагуляции в два этапа. Во-первых, TFPI связывает и ингибирует FXa. Во-вторых, комплекс TFPI-FXa связывается с TF-FVIIa и ингибирует его, тем самым предотвращая раннюю амплификацию коагуляции. При сепсисе происходит потребление и деградация TFPI, что приводит к прокоагулянтному состоянию [19]. Потребление TFPI происходит быстро из-за его относительно небольшой концентрации в плазме (~1,0-2,5 нмоль/л). В эндотелиальных клетках сосудов наблюдается снижение экспрессии TFPI за счет регуляции плазмина. Этот эффект был продемонстрирован у бабуинов, которым вводили E. сoli и наблюдали снижение TFPI c одновременным увеличением тканевого активатора плазминогена [20]. Активированный белок С (АРС) является мощным антикоагулянтом, который обладает профибринолитическими и противовоспалительными свойствами. При сепсисе нарушение функционирования АРС способствует ранней гиперкоагуляции. АРС активируется тромбином, связанным с тромбомодулином, а рецептор эндотелиального АРС и кофактор протеина S усиливают эту активацию в несколько раз. АРС протеолитически расщепляет фактор V (FV) и FVII, которые необходимы для продуцирования тромбина. Синтез АРС нарушается под действием нейтрофильной эластазы. Происходит также резкое снижение экспрессии тромбомодулина под действием воспалительных цитокинов, таких как IL‑1, IL‑6, TNF. В конечном счете происходит подавление эндотелиального рецептора при сепсисе, ограничивая тем самым активацию АРС [21]. Антитромбин (АТ), или сериовая протеаза, является природным антагонистом тромбина. При сепсисе синтез АТ подавляется, и его потребление существенно увеличивается из-за продолжающегося образования тромбина. Кроме того, происходит снижение мембраносвязанных гепариноподобных гликозамингликанов на поверхности эндотелия из-за действия провоспалительных цитокинов. Это снижение еще более ограничивает биологическую активность антитромбина.
Резистентность к фибринолизу
У здоровых добровольцев инфузия эндотоксина вызывала предсказуемые и быстрые изменения в системе свертывания. Во-первых, в течение 120 минут был отмечен рост маркеров воспаления (TNF, IL‑6) с одновременным повышением активаторов плазминогена, указывающих на активацию эндотелия. Во-вторых, снижение уровня АРС из-за ограничения доступности тромбомодулина также может играть роль в снижении фибринолиза. При сепсисе опосредованное TF‑продуцирование тромбина приводит к образованию плотных сгустков, устойчивых к фибринолизу. Считается, что это опосредуется как TAFI, так и секрецией полифосфатов тромбоцитами, что делает TAFI менее эффективным [22]. Кроме того, секреция нейтрофильной эластазы снижает фибринолитические протеазы, способствующие сохранению сгустка. Продуцирование такого плотного агрегированного сгустка может быть механизмом защиты от секретируемых бактериями протеаз, которые нарушают его целостность. У пациентов с менингококковой инфекцией уровни TAFI заметно повышены, коррелируют с тяжестью заболевания и связаны с более высокой смертностью.
Повреждение эндотелия
Эндотелий сосудов является важным регулятором гемостаза и местом клеточного взаимодействия иммунных клеток. Эндотелиальные клетки опосредуют про- и противоспалительные механизмы, регулируют фибринолиз, вазомоторный тонус и обладают способностью передавать сигналы иммунным клеткам. Таким образом, эндотелий выступает в качестве важного барьера для защиты хозяина при бактериальной инвазии. Поверхностный слой эндотелиальных клеток представляет собой отрицательно заряженный микротонкий слой гликозамингликанов и гликопротеинов, называемый гликокаликс. В лучшем случае эндотелий может сбалансировать прокоагулянтные и антикоагулянтные механизмы после травмы, тем самым противодействуя образованию тромбина. Однако когда местное повреждение становится системным, как при сепсисе, баланс смещается в сторону прокоагулянтного состояния [23]. Повышенная проницаемость сосудов, вторичная по отношению к воспалению, является отличительной чертой сепсиса и вносит значительный вклад в дисфункцию органов и нарушение коагуляции. Поскольку воспаление и коагуляция тесно связаны, терапевтические методы, сопряженные с защитой эндотелия, могут помочь при этом патологическом состоянии [24-27]. Ранний сдвиг в сторону прокоагулянтного состояния опосредуется провоспалительными маркерами, которые приводят к снижению экспрессии мебраносвязанных белков, таких как тромбомодулин [28]. Повреждение эндотелия вызывает снижение экспрессии эндотелиальных рецепторов АРС. Эндотелиальный клеточный апоптоз, возникающий в результате действия ЛПС или эндотоксинов, вызывает высвобождение внутриклеточного гистона, что усугубляет воспаление и индуцирует тромбоз. Разрушение эндотелия при сепсисе приводит к быстрой адгезии тромбоцитов. Это может спровоцировать микрососудистый тромбоз. Разрушение эндотелиальных клеток способствует ранней коагулопатии при сепсисе (рис. 1).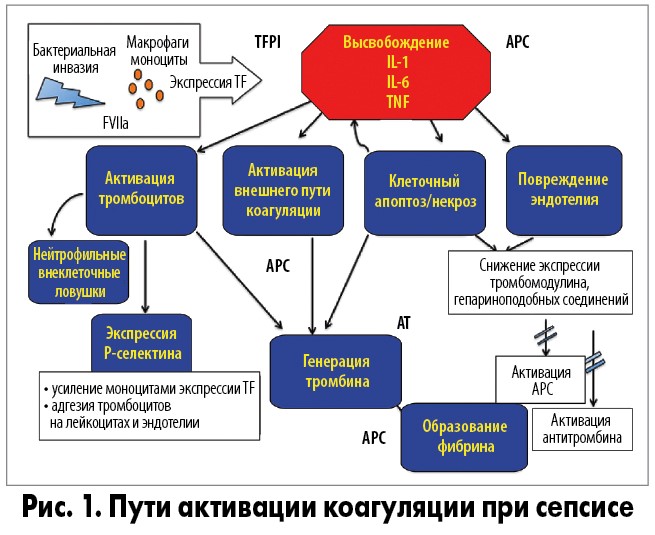
Патофизиология системы гемостаза при сепсисе
Тромбоз как защитный механизм при сепсисе
Наше понимание тромбоза и воспаления при сепсисе развивалось на протяжении десятилетий путем исследований на животных и людях. Ключевая ошибка в неправильном представлении этого процесса состояла в том, что ранние исследования проводились на животных. Обычно на моделях мышей применяют внутривенное введение эндотоксина либо ЛПС или даже живых бактерий, таких как E.сoli. Эти модели имели тенденцию к переоценке провоспалительного ответа у хозяина [29, 30]. В этих исследованиях рассматривалось воспаление только в качестве медиатора сепсиса, что не соответствовало клиническим условиям. Так, был отмечен более высокий уровень смертности среди пациентов при поступлении в отделение интенсивной терапии, которые имели высокую склонность к кровотечению [30]. Эта стратегия игнорировала защитный механизм компартментализации, который включает острую фазу провоспалительного ответа в попытке изолировать бактерии или вторгшиеся организмы. Белки острой фазы (фибриноген, FV) возрастают при остром сепсисе, усиливая гиперкоагуляционный ответ [31] с одновременным снижением двух мощных природных антикоагулянтов (АРС, антитромбин) и выступают как негативные белки острой фазы в этом раннем механизме защиты. Таким образом, современная модель сепсиса рассматривается как провоспалительная и антивоспалительная или MARS – Mixed Antiinflammatory Response Syndrome (cиндром смешанного антивоспалительного ответа).
Полифосфаты
Высокомолекулярные неорганические полифосфаты (ПолиФ) представляют собой линейные полимеры ортофосфорной кислоты, в которых фосфорные остатки соединены между собой фосфоангидридными связями. Количество фосфатных остатков в молекулах полифосфатов, присутствующих в живых клетках, может изменяться от 3 до 1000. Эти соединения являются для живых клеток не только резервом фосфора, но и энергии. ПолиФ имеются практически у всех групп организмов. В наибольшем количестве они накапливаются в клетках микроорганизмов, в частности в некоторых бактериях. Период полураспада ПолиФ очень короткий из-за их расщепления под действием фосфатаз [32]. Среднего размера ПолиФ60-80 высвобождаются при активации тромбоцитов и тучных клеток. Они способны индуцировать активацию фактора XII (FXII) лишь в случае их большого количества [33]. В присутствии фибрин-полимеров, ассоциированных с ПолиФ60-80, α-FXIIa может превратить связанный с фибрином плазминоген в плазмин, в результате чего внутренняя фибринолитическая активность преодолеет антифибринолитические свойства [34]. Интересно, что активированные тромбоциты могут удерживать ПолиФ60-80 на их поверхности в виде нерастворимых сферических наночастиц с двухвалентными ионами металлов (Ca2+, Zn2+). Эти наночастицы обеспечивают более высокий размер и способны выступать в роли триггера для контактной активации [35]. Бактериями и дрожжами высвобождается также крупный нерастворимый ПолиФ150-200, который способен поддерживать активацию FXIIa и участвовать в генерировании тромбина независимо от FXI. ПолиФ может связывать фибрин-мономеры, что приводит к образованию сгустков с пониженной жесткостью и повышенной деформированностью [36]. Кроме того, ПолиФ150-200 включается в фибриновую сетку, тем самым ингибируя фибринолиз.
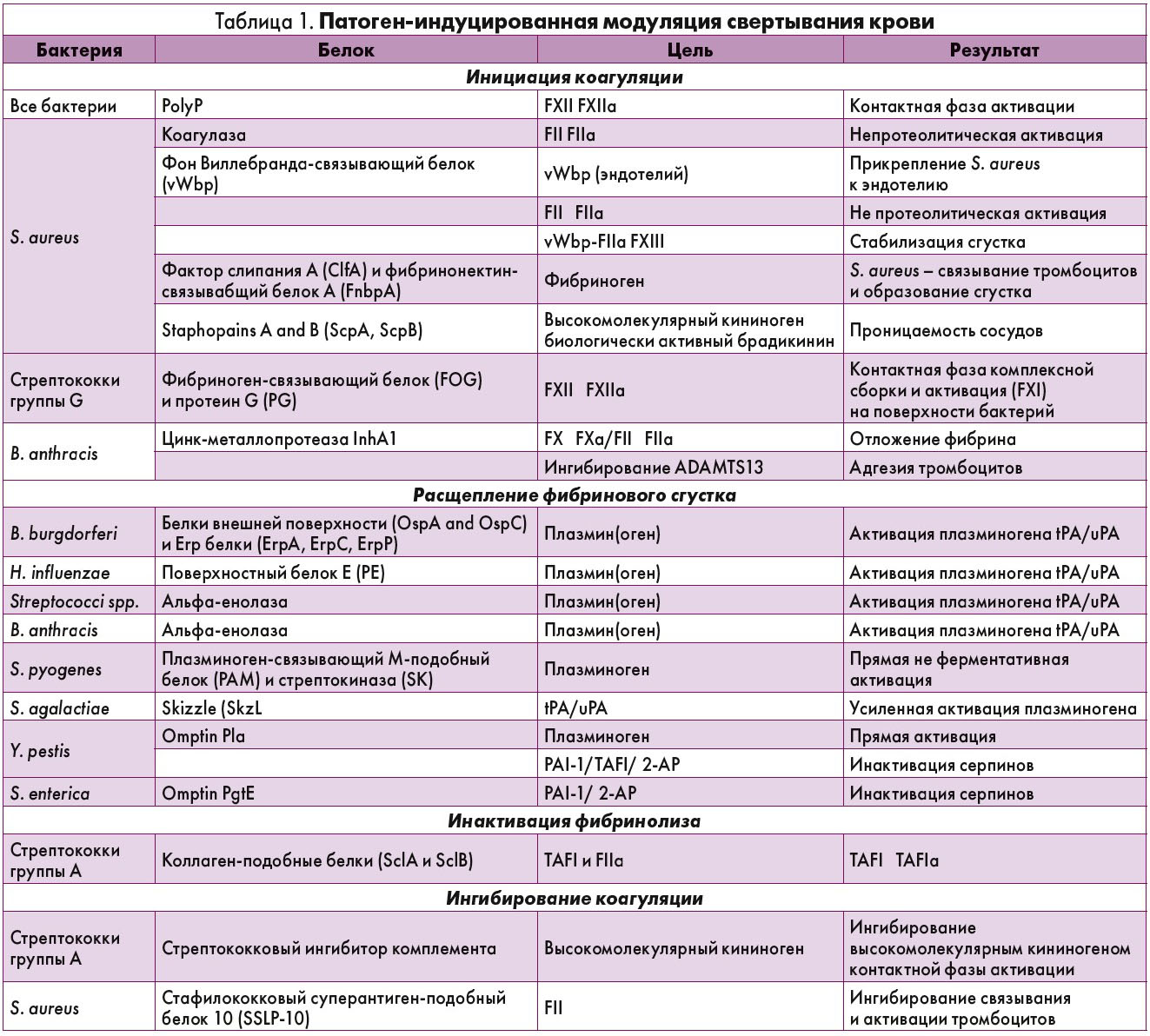
Патоген-индуцированная модуляция свертывания крови
Многие бактерии могут вызывать свертывание крови по зависимому от ПолиФ пути. Для этого они используют специфические методы для индуцирования тромбина и образования фибрина [37-44] (табл. 1).
Нейтрофильные внеклеточные ловушки
Недавно был описан новый механизм антимикробного действия нейтрофилов. Оказалось, что нейтрофильные гранулоциты после активации выбрасывают во внеклеточное пространство сетеподобные структуры, в состав которых входят ДНК, гистоны, а также различные белки и ферменты гранул, такие как эластаза и миелопероксидаза. Эти структуры были названы «нейтрофильные внеклеточные ловушки» (Neutrophil Extracellular Traps, NETs или НВЛ). Вначале цель данного явления была не ясна. Тем не менее сразу было высказано предположение, что сетеподобные структуры изолируют и уничтожают грамположительные и грамотрицательные бактерии, грибковые патогены [45-47]. НВЛ играют важную роль в защите хозяина не только при врожденном иммунитете, но и через прокоагулянтные механизмы:
- отрицательно заряженная ДНК представляет собой активированную поверхность для сборки факторов свертывания, в том числе контактной фазы;
- ферментативное ингибирование TFPI и тромбомодулина с помощью эластазы нейтрофилов;
- прямая активация тромбоцитов гистонами [48].
Последние данные подтверждают прямую активацию ДНК и гистонов больше, чем непосредственно самих нейтрофильных внеклеточных ловушек [49]. Высокие уровни циркулирующих гистонов были обнаружены при септическом шоке. Инфузия гистонов индуцирует внутрисосудистую коагуляцию с развитием тромбоцитопении и увеличением Д‑димера. В экспериментальных моделях антигистоновые антитела предотвращали повреждения легких и сердца. С‑реактивный белок может связываться с гистонами и снижать гистон-индуцируемое повреждение эндотелиальных клеток [50].
Медиаторы воспаления
Главным механизмом, ответственным за нарушение гемостаза у септических больных, считается неконтролированное действие воспалительных медиаторов.
Цитокины
Эндотоксины ЛПС являются компонентами внешней мембраны грамотрицательных бактерий, которые ответственны за многие случаи сепсиса. Внедрение эндотоксина в системную циркуляцию вызывает выработку провоспалительных цитокинов. Последующее повреждение ткани усугубляется через образование свободных радикалов, генерируемых активированными лейкоцитами. Этот дисбаланс в нормальном гемостазе приводит к образованию тромбов в сосудах малого и среднего калибра и к потере тонуса сосудов.
Фактор некроза опухоли
TNF синтезируется в макрофагах и появляется одним из первых цитокинов в кровообращении. Играет важную роль в инициировании воспалительного цитокинового каскада и повреждении ткани. TNF оказывает влияние на моноциты, нейтрофилы и эндотелий сосудов, вызывая продуцирование провоспалительных цитокинов (1b, 6 и 8). Кроме того, стимулирует выработку молекул адгезии, таких как межклеточная молекула адгезии‑1, E‑селектин.
Механизмы активации тромбоцитов при сепсисе
В интактной системе крообращения тромбоциты циркулируют с высокой скоростью сдвига и находятся в неактивном состоянии благодаря простациклину и оксиду азота, выделяемых эндотелиальными клетками. При сепсисе воспаление вызывает коагуляцию и приводит к чрезмерному образованию тромбина, который является важным агонистом тромбоцитов. Тромбин действует на тромбоциты в первую очередь за счет необратимого связывания с клеточными PAR‑рецепторами (Protease-Activated Receptors), присутствующими на мембране тромбоцитов. При отщеплении N‑концевого фрагмента у этих рецепторов происходит их активация. Рецептор PAR1 считается главным, высокоаффинным рецептором тромбина, в то время как PAR4 вносит вклад в активацию тромбоцитов, главным образом в условиях ингибирования PAR1 [51]. Кроме того, патогенез сепсиса характеризуется активацией эндотелия, которая приводит к экспрессии на эндотелиальных клетках субэндотелиального коллагена, vWF и тканевого фактора. Коллаген и vWF могут связываться с рецепторами тромбоцитов GPVI и GPIbα-GPIX-GPV, а тканевой фактор дополнительно инициирует внешний путь коагуляции приводя к продуцированию больших количеств тромбина [52]. При бактериальной инфекции активируется также система комплемента. Эта активация приводит к образованию белков, которые способствуют лизису и опсонизации микроорганизмов. Происходит регуляция воспалительной реакции, при которой имеется связь между врожденным и адаптивным иммунным ответом. Было показано, что С1q дополнительно может активировать тромбоциты через рецептор C1qR. Активация через FcyRIIa зависит от IgG и GPIIb/IIIa. Тромбоцитарный фактор 4 (PF4) связывается с бактериями и уменьшает время задержки агрегации. Циркулирующие патогены и высвобождающиеся патоген-ассоциированные молекулярные структуры, такие как гистоны, участвуют в активации тромбоцитов во время сепсиса через сигнализацию TLR. Активированный GPIIb/IIIa опосредует активацию тромбоцитов благодаря своей способности связывать растворимый фибриноген. Активация тромбоцитов усиливается через коагуляционный каскад, высвобождение TXA2 и ADP, приводит к изменению их формы, образованию агрегатов, выделению биологически активных веществ из гранул (рис. 2).
Лабораторные тесты
Какой-либо один лабораторный тест не способен диагностировать и стратифицировать сепсис-индуцированную коагулопатию. Такие классические лабораторные тесты, как протромбиновое время, активированное частичное протромбиновое время и определение концентрации фибриногена, имеют существенное ограничение, которое заключается в том, что при их использовании невозможно оценить вклад тромбоцитов. В качестве диагностических тестов при сепсисе используют лабораторные тесты, представленные в таблице 2.
Однако следует отметить, что многие из этих тестов относятся к категории «анализы только для исследований». Это значит, что они выполняются только в специализированных лабораториях и не относятся к рутинным исследованиям. Более того, как и в случае выполнения классических тестов, здесь не учитываются такие важные факторы, как эндотелиальное взаимодействие, кислородное напряжение, давление крови, то есть те важные параметры, характерные для системы свертывания в условиях in vivo. Поэтому в последнее время в отделениях реанимации и интенсивной терапии все чаще стали использовать для характеристики коагулопатии при сепсисе такие методы, как тромбоэластография (ТЭГ) и ротационная тромбоэластометрия (ROTEM) [53-57].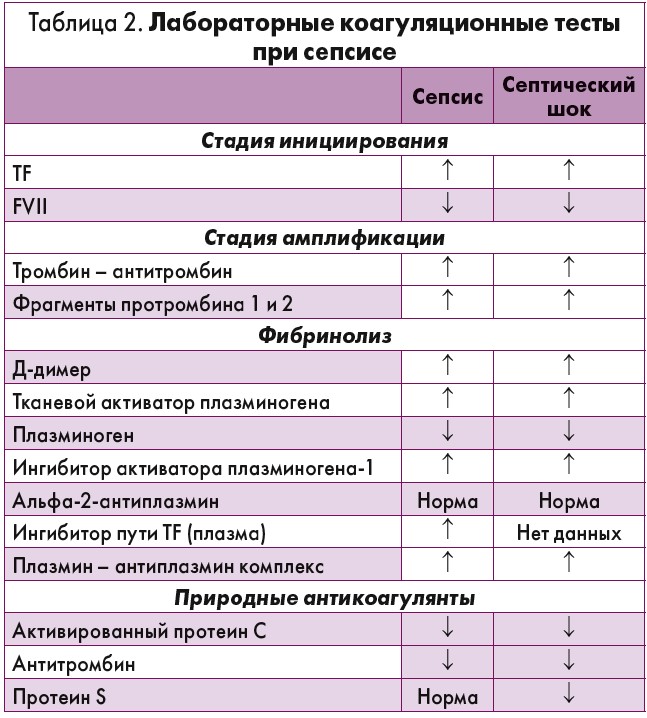
Выводы
В основе сепсиса лежит формирование реакции генерализованного воспаления, которое инициировано инфекционным агентом. Причина органно-системных расстройств заключается в неконтролируемом выбросе эндогенных медиаторов воспаления и недостаточностью механизмов, ограничивающих их повреждение. Сепсис и его осложнения представляют собой нарастающую по своей тяжести последовательность клинических и патофизиологических фаз: сепсис, тяжелый сепсис, септический шок, синдром полиорганной недостаточности (СПОН). Нарушения в системе гемостаза являются одним из главных патогенетических звеньев развития органной патологии при сепсисе. Система гемостаза реагирует на сепсис активацией свертывания, снижением активности природных антикоагулянтов и фибринолитической активности плазмы крови, что создает условия для микротромбирования и играет важную роль в формировании СПОН. С помощью традиционных тестов, таких как протромбиновое время, активированное частичное тромбопластиновое время, определение концентрации фибриногена, эту активацию свертывания крови при сепсисе у большинства больных выявить невозможно. Для этих целей используют методы ТЭГ или ROTEM.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 22 (467), листопад 2019 р.