25 грудня, 2019
Роль кишкової мікрофлори у підтриманні здоров’я або формуванні певних захворювань та трансплантація фекальної мікробіоти як перспективний метод корекції серйозних патологічних станів
 Трансплантація фекальної мікробіоти є новим, а для більшості українських лікарів – деякою мірою футуристичним напрямом терапії. Розкрити ключові моменти методики, її можливості та досягнення люб’язно погодилися перші українські представники у цій галузі, члени робочої групи Європейського консенсусу з трансплантації фекальної мікробіоти, доктор медичних наук, професор Олена Юріївна Губська та доктор медичних наук Олексій Євгенович Гріднєв.
Трансплантація фекальної мікробіоти є новим, а для більшості українських лікарів – деякою мірою футуристичним напрямом терапії. Розкрити ключові моменти методики, її можливості та досягнення люб’язно погодилися перші українські представники у цій галузі, члени робочої групи Європейського консенсусу з трансплантації фекальної мікробіоти, доктор медичних наук, професор Олена Юріївна Губська та доктор медичних наук Олексій Євгенович Гріднєв.
Кишкова мікрофлора як важливий аспект здоров’я людини
Мікрофлора людини виконує безліч життєво важливих функцій, починаючи від захисної та закінчуючи метаболічно-трофічною. Переважна частина мікрофлори людини міститься у шлунково-кишковому тракті, а саме в кишечнику, який заселяють дев’ять основних філ бактерій: Actinobacteria, Bacteroidetes, Cyanobacteria, Deferribacteres, Firmicutes, Proteobacteria, Tenericutes, TM7 і Verrucomicrobia. Серед них абсолютну перевагу мають Bacteroidetes и Firmicutes. За сучасним розумінням кишкова мікробіота є ще одним органом організму людини, який важить приблизно 2 кг і налічує близько 100 білонів клітин мікроорганізмів, що в 10 разів більше, ніж власних клітин організму-хазяїна.
За даними вчених із консорціуму MetaHIT9, визначено три основні типи мікробних асоціацій – так звані ентеротипи – з превалюванням у першому ентеротипі роду Bacteroides, у другому – Prevotella, в третьому – Firmicutes (Ruminococcus і Faecalibacterium). Однак розділення на ентеротипи ніяк не корелювало з віком, статтю, національною належністю, що викликало критику цієї теорії в науковій спільноті. Також не знайшла підтвердження теорія генетичної схильності до формування тієї чи іншої мікробіоти – мікробіота однояйцевих близнюків мала не більшу подібність, ніж мікробіота інших членів сім’ї. Тому була висловлена думка, що мікробіота не піддається жорсткій категоризації, радше можна говорити про безперервний градієнт її складу, оскільки таксономічний склад мікробіоти кишечнику людини значно варіює на індивідуальному рівні внаслідок впливу багатьох факторів.
Сучасний спосіб життя, режим харчування, розвиток промисловості та сільського господарства мають вагомий вплив на мікробіом. Через поширення додавання у харчові продукти консервантів, антибіотиків та інших речовин відбуваються значні зміни в мікробіоті кишечнику. За результатами досліджень у мікробіоті кишечнику дітей – жителів Африки переважали бактерії роду Prevotella, що пов’язують із необхідністю отримання більшої кількості енергії зі складних вуглеводів, які становлять їх основний раціон. Водночас у мікробіоті європейських дітей було виявлено більший вміст представників роду Bacteroides, асоційованих із так званою західною дієтою, багатою на тваринні жири та білок.
Крім географічних відмінностей способу життя і харчування, на мікробіоту кишечнику людини впливає вік. Дитина отримує мікробіоту, проходячи пологовими шляхами і харчуючись материнським молоком, або навіть раніше, під час перинатального розвитку. У перші місяці життя дитини мікробіота нестійка, але вже до 3-6 років мікрофлора кишечнику стабілізується і набуває характерного дорослим складу. Спочатку в мікрофлорі переважають біфідобактерії, причому їх кількість залежить від способу вигодовування (грудне або штучне) і зменшується протягом усього життя. У літньому-похилому віці підвищується частка Proteobacteria, зменшується кількість генів, що беруть участь у синтезі коротколанцюгових жирних кислот, відбувається загальне зниження сахаролітичного потенціалу, звуження різноманітності мікробіоти. Останнє особливо негативно позначається на її функціях, тому що чим екосистема різноманітніша, тим вона стійкіша, а отже – менше зазнає зовнішніх шкідливих впливів.
Кишкова мікрофлора перетворює сигнали навколишнього середовища та дієтичні молекули в сигнальні метаболіти для зв’язку з хазяїном і впливає на обмінні процеси в різних органах, сприяє вивільненню низки гормонів у кишечнику і їх синтезу, захищає від інвазії патогенними мікроорганізмами. Тому нормальний фізіологічний стан мікробіоти шлунково-кишкового тракту є одним із найважливіших факторів гомеостазу організму людини, а його порушення можуть ускладнювати перебіг і лікування хвороб, які призвели до цих порушень, і супутніх захворювань.
Однією з основних функцій кишкової мікробіоти є деградація неперетравлених компонентів їжі. Мікробіота ферментує білки, вуглеводи з утворенням коротколанцюгових жирних кислот (переважно ацетат, пропінат і бутират) і газів (водень, метан тощо). Коротколанцюгові жирні кислоти, які продукуються кишковою мікрофлорою, відіграють важливу роль у фізіології організму-хазяїна, в тому числі забезпечують регулювання енергетичного метаболізму, імунного запалення й артеріального тиску та ін.
Співвідношення одержуваних від мікробіоти коротколанцюгових жирних кислот, імовірно, залежить від її складу, зокрема від співвідношення Bacteroidetes і Firmicutes, у яких істотно відрізняються профілі утилізації полі- й олігосахаридів. Так, B. thetaiotamicron здатний розщеплювати низку полісахаридів із їжі і з організму-хазяїна до моносахаридів і продукує пропіонат та ацетат. Ацетат потім споживається Eubacterium rectale, яка з нього синтезує бутират. Firmicutes є основними продуцентами бутирату, який перешкоджає канцерогенезу.
За останні десятиліття харчування людини різко змінилося: у раціон стали включатися різні синтетичні інгредієнти, зокрема штучні підсолоджувачі для зниження калорійності продукту. За результатами експериментальних досліджень застосування таких некалорійних підсолоджувачів у тварин і людей асоціювалося зі стимулюванням інсулінорезистентності та збільшенням маси тіла. Так, у мишей, які споживали сахарин, сукралозу або аспартам, розвивалася непереносимість глюкози, яка модифікувалася прийомом антибіотиків. Споживання сахарину призводило до збільшення кількості бактероїдів і бактерій, які беруть участь у деградації гліканів. Дослідження у людей так само засвідчили мікробіотозалежний розвиток непереносимості глюкози після гострого споживання сахарину.
Інший приклад впливу синтетичних харчових інгредієнтів на мікробіом – застосування так званих емульгаторів, які нині широко використовуються в харчовій промисловості. Результати дослідження B. Chassaing та співавт. показали, що застосування «дієтичних» емульгаторів зумовлює зміну складу кишкового мікробіому і збільшення кишкової проникності та відповідно підвищений рівень циркулювальних ліпополісахаридів. Додавання емульгатора до раціону мишей з ожирінням призводило до збільшення ступеня ожиріння і підвищення рівня глюкози в крові.
Ще однією важливою функцією мікробіоти кишечнику є її безпосередня взаємодія з імунною системою або опосередкована через кишковий епітелій. Ця взаємодія відбувається через так звані toll-like рецептори – білки, які здатні розпізнавати специфічні молекулярні патогени й індукувати імунну відповідь. Ефекти імуномодулювання кишковою мікробіотою необхідні для імунотолерантності. В експерименті було доведено, що бактеріальний капсульний полісахарид здатний коригувати дисбаланс Т-хелперів у гнотобіотичних мишей.
Коменсальна мікробіота запобігає інфікуванню ентеропатогенами шляхом конкуренції за субстрат і продукування бактерицидних факторів. Так, штам Bacillus thuringiensis, ізольований зі зразка калу, продукує антимікробний пептид (turicine) з вузьким спектром дії проти Clostridium difficile. Ацетат, вироблений Bifidobacterium, пригнічує перенесення токсинів ентерогеморагічної кишкової палички з кишечнику в кров, а бутират, вироблений Firmicutes, є протизапальним фактором.
Бактеріальні метаболіти надходять у метаболічні тканини й органи хазяїна, беруть участь у забезпеченні метаболічної функції всього організму. Доведено зв’язок кишкової мікрофлори і надлишкової маси тіла й ожиріння. Зміни в складі мікробіоти можуть зумовлювати додатковий «збір енергії» з клітковини, зокрема має значення співвідношення Bacteroidetes і Firmicutes. Крім того, зменшення кількості бактерій Firmicutes при значному збільшенні Bacteroidetes сприяє розвитку інсулінорезистентності, цукрового діабету 2 типу та системного запалення і, відповідно, прогресуванню захворювання. Представники Ruminococcus виробляють велику кількість триметиламіну, який, перетворюючись на оксид, під впливом ферментів печінки стає субстратом для розвитку атеросклерозу. Деякі дослідники також вказали на наявність в атеросклеротичних бляшках бактеріальної ДНК, що за філогенетичним складом була схожа на склад кишкової мікробіоти, а кількість бактеріальної ДНК в атеросклеротичних бляшках корелювала з тяжкістю запалення.
При запальних захворюваннях кишечнику також відбуваються зміни складу мікробіоти: зменшується кількість Firmicutes, насамперед таких продуцентів бутирату, як Clostridium та Bifidobacterium, на тлі збільшення кількості сульфат-редукторів та Escherichia coli. Це підвищує ризик виникнення запалення в мукозному шарі кишечнику, що в свою чергу підвищує ризик розвитку онкологічної патології, оскільки у пацієнтів з колоректальним раком також знижений рівень продуцентів бутирату (Eubacterium rectale, Faecalibacterium prausnitzii) на тлі збільшення рівня Enterococcus faecalis, котрий продукує супероксид, який ушкоджує ДНК в епітелії.
Мікроорганізми, що заселяють кишечник, і самі можуть стати збудниками захворювань. Так, інфекція, викликана бактерією Clostridium difficile, є тяжким кишковим захворюванням, що складно піддається лікуванню антибіотиками.
Одним з останніх найважливіших досягнень стало відкриття осі головний мозок – кишечник – мікробіом. Сьогодні вважається доведеним факт двоспрямованої взаємодії між мікробіомом кишечнику, власне кишечником і головним мозком.
Кишковий мікробіом впливає на головний мозок шляхом активації в ньому нейронних еферентних ланцюгів і продукції метаболітів, що безпосередньо діють на центральну нервову систему (насамперед гамма-аміномасляна кислота, яка синтезується лакто- та біфідобактеріями, ентерококами нормальної флори). Мікробіота може впливати на вегетативну нервову систему, іннервацію кишечнику шляхом вироблення гормоноподібних сполук. У свою чергу вплив головного мозку на кишковий мікробіом призводить до порушення бар’єрної функції кишечнику, продукції муцину, функції ентероендокринних клітин кишечнику, перистальтики й імунної відповіді.
Важливою проблемою є порушення бар’єрної функції кишечнику, що виникає при дисбіозі. У нормі кишкова стінка є інтактним бар’єром, який має щільні міжепітеліальні контакти, що запобігає транслокації мікробів, їх компонентів і метаболітів. При дисбіозі, стресах тощо порушується цілість щільних контактів – формується «негерметичний» кишечник, що дозволяє кишковим бактеріям і їх метаболітам проникати у підслизовий шар. Там їх взаємодія з клітинами імунної системи призводить до гіперпродукції прозапальних цитокінів, персистування місцевого запалення низького ступеня активності та подальшого підвищення проникності кишкового бар’єра. Все це дає змогу проникнути в кровообіг ліпополісахаридам грамнегативних бактерій – так званому ендотоксину, – що має виражену біологічну активність. У нормі частина молекули ліпополісахариду в складі хіломікронів надходить з кишечнику у кровообіг і забезпечує фізіологічний рівень активності адаптивних систем (імунної, згортальної, центральної нервової), у тому числі за рахунок здатності активувати рецептори вродженого імунітету. Однак надмірна концентрація ендотоксину у крові є універсальним фактором патогенезу захворювань і синдромів, індукуючи системне запалення, яке набуває певної нозологічної форми через наявність генетичної або набутої схильності.
Мікробіота кишечнику має ще багато інших важливих функцій: впливає на засвоєння лікарських препаратів, на їх фармакокінетику і спектр побічних дій, здатна синтезувати вітаміни та ін.
Нині виділяють велику кількість захворювань, патогенез яких пов’язаний із порушенням мікробного складу кишечнику: діарея, запори, запальні захворювання кишечнику, синдром подразненого кишечнику, гіпо- та гіпертензія, гіпо- і гіперхолестеринемія, ревматоїдний артрит та інші ураження сполучної тканини, сечокам’яна і жовчнокам’яна хвороби, дерматити, алергози, портальна і системна енцефалопатії, неалкогольна жирова хвороба печінки, ендо- та суперінфекція різної локалізації.
Зрозуміло, що маючи властивість викликати широкий спектр біохімічних реакцій, які саме й чинять безпосередній вплив на фізіологію організму-хазяїна (як у здорових осіб, так і з хворобливими станами), кишкові мікроорганізми можуть індукувати різноманітні зміни та скарги, не пов’язані з наявністю органічних захворювань (C.S. Reigstad, P.C. Kashyap, 2013; G.A. Preidis, J. Versalovic, 2009). Тому продовжується поглиблене вивчення взаємозв’язків між зміненим складом кишкового мікробіому та формуванням функціональних розладів травлення, передусім функціональної диспепсії та синдрому подразненого кишечнику (СПК). Наприклад, добре відомо, що СПК досить часто (в 10% випадків) починається саме після перенесеної кишкової інфекції або інфекційного гастроентериту (постінфекційний СПК; J. Jalanka et al., 2015).
Зміни кишкової мікробіоти зумовлюють різноманітні реакції. Наприклад, біль у животі, здуття живота у хворих із функціональною диспепсією та СПК пов’язані з гіперчутливістю внутрішніх органів до механічних і хімічних подразників. У нещодавніх дослідженнях (Riba et al., 2014) встановлено наявність кореляції між вісцеральною гіперчутливістю та збільшенням кількості E. coli в лабораторних тварин з подальшою індукцією гіперчутливості у відповідь на введення шлункового зонда, інфікованого кишковою паличкою. Зміни кишкової мікрофлори в дитинстві зумовлюють тривалі, часто пожиттєві, порушення вісцеральної чутливості.
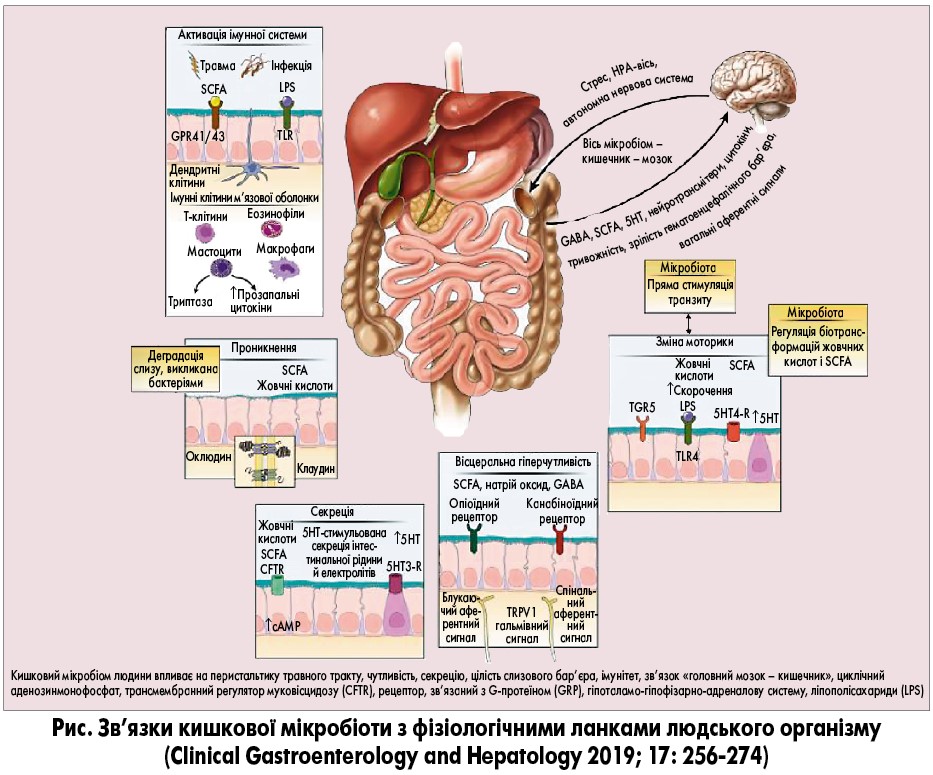
Узагальнені уявлення про вплив кишкової мікробіоти на фізіологію організму-хазяїна (моторику, чутливість, секрецію, бар’єрну функцію, взаємодію кишечнику та головного мозку) представлено на рисунку.
Таким чином, мікробіота кишечнику безпосередньо впливає на функціонування організму-хазяїна та рівень його здоров’я, а її склад прямо залежить від характеру харчування та способу життя людини.
Пребіотики та пробіотики становлять собою спрямовану на мікробіом терапію, яку широко застосовують для підтримання здорового складу кишкової мікрофлори або відновлення бактеріального гомеостазу при патології, в патогенезі якої зміни кишкової мікробіоти відіграють певну роль. Як про-, так і пребіотики надають додаткову користь травному каналу в плані підтримання та відновлення його функціонального стану. Це відбувається за рахунок модуляції та відновлення бар’єрної функції кишечнику, мікробного метаболізму, імунної відповіді та нейром’язової функції. Літературні дані свідчать про ефективність пробіотиків при низці захворювань: антибіотикасоційованій діареї, інфекції Helicobacter pylori, СПК, паучиті, виразковому коліті та печінковій енцефалопатії.
Окремим методом корекції дисбіотичних кишкових змін порівняно нещодавно стала трансплантація фекальної мікрофлори. Саме цьому методу присвячена величезна кількість досліджень останніх десятиліть в усьому світі.
Концепція методу трансплантації фекальної мікробіоти
Трансплантація фекальної мікробіоти (ТФМ) – введення нефільтрованої гомогенізованої суспензії калу або його фільтрованого розчину від здорового донора/донорів у шлунково-кишковий тракт реципієнта. Цей метод лікування відносно недавно отримав світове визнання і запроваджений у практичну діяльність. Однак ТФМ має дуже давню історію, що формально налічує вже більше 1600 років. Вперше випадок фекальної трансплантації був описаний у IV столітті нашої ери в Стародавньому Китаї (повідомлення про застосування чужих фекалій для лікування харчових отруєнь та діареї). Набагато пізніше, у XVI столітті, китайський лікар Лі Ши-Чжень повідомляв про ефективне лікування «хвороб живота» з використанням свіжих, висушених або ферментованих фекалій. Під час Другої світової війни німецькі солдати повідомляли, що бедуїни Північної Африки як ліки від дизентерії використовували свіжий верблюжий послід, який у них вважався дуже ефективним засобом. У наш час перше повідомлення про успішну ТФМ у людей датується 1958 р., коли у США Бен Ейземан зі співавторами описали випадок перенесення суспендованих фекалій за допомогою клізми чотирьом пацієнтам у загрозливому для життя стані з псевдомембранозним колітом, викликаним антибіотикотерапією. Лікування забезпечило швидку (декілька днів) ефективність, що відкрило сучасну еру ТФМ.
Нині ТФМ – ефективний і безпечний метод лікування інфекції Clostridium difficile. Інфузія фекальних мас здорового донора в шлунково-кишковий тракт реципієнта дозволяє відновити мікробний пейзаж, нівелювати вегетативні форми Clostridium difficile, сприяти якнайшвидшому одужанню. Проведення ТФМ дає змогу врятувати дорогоцінні людські життя і значно знизити економічний тягар, пов’язаний із рекурентною інфекцією Clostridium difficile.
Незважаючи на активне вивчення, механізм дії ТФМ і сьогодні достеменно не з’ясований. Відомо, що маніпуляції з бактеріальною флорою призводять до зниження продукції прозапальних цитокінів (фактор некрозу пухлини, інтерлейкін‑6 та ін.) за допомогою знижувальної регуляції фактора NF-kB (універсальний фактор транскрипції, який контролює експресію генів імунної відповіді, апоптозу та клітинного циклу), зменшення окисного стресу, зниження фекального рН, амінокислотної ферментації й адсорбції аміаку. Отже, можна припустити, що введення з фекальним трансплантатом як живих мікроорганізмів, так і частин бактерій і їх метаболітів сприятиме різноманіттю мікробіому (колонізація слизової оболонки новими видами донорських бактерій, а також збільшення чисельності нормальних видів реципієнта, щодо яких існує дефіцит) і нормалізації його функції за рахунок дії сигнальних молекул з трансплантату. Напевне, також має місце конкурентна боротьба за нутрієнти, виділення бактеріоцинів і створення середовища, що не сприяє росту патогенних та умовно-патогенних бактерій. Певною мірою може впливати кількісний вміст жовчних кислот – після ТФМ відмічено збільшення рівня вторинних жовчних кислот у калі, що чинить гальмівний вплив на Clostridium difficile, позаяк тільки первинна жовчна кислота (таурохолат) сприяє проростанню її спор.
Значення ТФМ у лікуванні інфекції Clostridium difficile та патології травного тракту
Сьогодні практичні рекомендації з проведення ТФМ Американської колегії гастроентерологів (2013), Європейського товариства клінічної мікробіології та інфекційних захворювань (2014), Американського товариства інфекційних захворювань у співдружності з Американським товариством епідеміології охорони здоров’я (IDSA/SHEA, 2017), Всесвітнього товариства невідкладної хірургії (WSES) об’єднує схвалення доцільності виконання ТФМ як високоефективного способу терапії при рецидивуючій інфекції Clostridium difficile. Подібність рекомендацій різних товариств зумовлена тим, що у більшості проведених клінічних досліджень підтверджено високу результативність ТФМ у лікуванні рецидивуючої/рефрактерної інфекції Clostridium difficile: ймовірність досягнення клінічного ефекту у таких хворих перевищує 90%, що достовірно перевищує аналогічний показник при проведенні тривалої антибактеріальної терапії (20-30%).
У Європейському консенсусі з трансплантації фекальної мікробіоти в клінічній практиці (2017) активне застосування ТФМ рекомендується як метод лікування легкої і тяжкої рекурентної та рефрактерної інфекції Clostridium difficile.
У нормі мікробіота створює особливі умови, що перешкоджають появі вегетативних форм Clostridium difficile, спори якої здебільшого завжди можна виявити в товстій кишці людини. Якщо ця рівновага порушується (наприклад, через прийом антибіотиків), Clostridium difficile починає розмножуватися та продукувати два потужних білкових токсини: токсин А (ентеротоксин TcdA) і токсин В (переважно цитотоксин TcdB), які запускають каскад прозапальних реакцій з активним синтезом медіаторів запалення й ушкодженням слизової оболонки, формуванням виразок, зон некрозу, васкуліту. Слід зазначити, що морфологічні зміни в слизовій оболонці товстої кишки зумовлені дією винятково токсинів, самі бактерії Clostridium difficile не мають інвазивних властивостей і, як правило, у підслизовий шар не проникають.
За останні 30 років метронідазол та ванкоміцин були основними антибіотиками, які використовували в лікуванні коліту, асоційованого з Clostridium difficile. У 1980-1990-х роках були виконані порівняльні дослідження ефективності метронідазолу та ванкоміцину. Відмінностей у результатах лікування не було (кожен з рукавів дослідження включав не більше 50 хворих). У 2000 р. нові дослідження дали змогу встановити наявність певних переваг перорального застосування ванкоміцину над метронідазолом. Пізніше для лікування коліту, асоційованого з Clostridium difficile, Управлінням з контролю якості харчових продуктів і лікарських препаратів США був схвалений препарат фідаксоміцин.
Лікування першого рецидиву кишкової інфекції рекомендується проводити препаратом ванкоміцину для перорального застосування (звуженим або пульс-режимом, що має переваги перед стандартним, 10-денний, повторний прийом) або фідаксоміцином (10-денним курсом). Антибіотикотерапія для хворих з подальшими рецидивами коліту, асоційованого з Clostridium difficile, включає пероральний прийом ванкоміцину у звуженому або пульс-режимі та стандартний курс перорального ванкоміцину з продовженням лікування рифаксиміном або фідаксоміцин.
При частих рецидивах та після невдалих спроб антибіотикотерапії попередніх епізодів коліту, асоційованого з Clostridium difficile, рекомендується виконання ТФМ. Ефективність та успішність лікування рецидивів інфекції Clostridium difficile також залежить і від способу введення фекальної мікробіоти: за різними даними, вони коливаються від 77-94% при введенні верхнім способом (до проксимальних відділів тонкої кишки) до 80-99% при введенні нижнім способом (інстиляції в товсту кишку). На березень 2016 р. вже виконано понад 1945 процедур ТФМ, висвітлених у фахових виданнях. Результати першого проспективного рандомізованого клінічного дослідження з порівняння ефективності стандартної антибіотикотерапії з ТФМ було представлено ще у 2013 р. За даними найбільшого з усіх рандомізованих досліджень, ефективність ТФМ завдяки введенню матеріалу в клізмі досягала 50%. Ефективність зростала до 75% після двох процедур і досягала 90% після більш ніж двох трансплантацій.
Останній метааналіз, опублікований в United European Gastroenterology Journal (7(8), 2019) об’єднав результати 6 рандомізованих контрольованих досліджень, у яких вивчали роль ТФМ при рецидивуючій клостридіальній інфекції (РКІ). У цих дослідженнях взяли участь 348 хворих на РКІ, які зазнавали різних терапевтичних втручань. ТФМ від донорів забезпечила найвищі результати за ефективністю порівняно з призначенням традиційних у плані лікування РКІ антибіотиків (ванкоміцину та фідаксоміцину). Дослідники зробили висновок, що сьогодні ТФМ від донорів слід вважати оптимальною, найефективнішою терапевтичною опцією при лікуванні РКІ, особливо порівняно з рекомендованими для цього найчастіше використовуваними антибіотиками (T. Rokkas et al., 2019).
ТФМ також має великі перспективи в лікуванні запальних захворювань кишечнику, метаболічних захворювань, СПК, неврологічної патології, у педіатричній практиці та ін. Так, принаймні, припускають європейські експерти. Як підтвердження трохи пізніше з’явилися свідчення ефективності цього методу лікування при метаболічному синдромі, системному склерозі, аутизмі, поліорганній патології у тяжкохворих пацієнтів. Ці дані дозволили авторам оновленого систематичного огляду (J. Wang et al., 2019) сформувати можливі показання до проведення ТФМ в найближчому майбутньому (крім інфекції Clostridium difficile): запальні захворювання кишечнику (виразковий коліт, хвороба Крона), функціональна патологія (СПК, запор), метаболічний синдром (цукровий діабет 2 типу, неалкогольний стеатогепатит), ожиріння, аутоімунні захворювання, хвороба Паркінсона, аутизм, системний склероз, ідіопатична тромбоцитопенічна пурпура, мультирезистентні інфекції, поліорганна дисфункція у тяжкохворих пацієнтів.
Ефективність ТФМ при запальних захворюваннях кишечнику показана в багатьох дослідженнях, причому вона більш виражена при виразковому коліті, ніж хворобі Крона. Однак ця проблема потребує подальшого вивчення, оскільки у деяких пацієнтів із запальними захворюваннями кишечнику відбувалося погіршення стану після ТФМ та загострення перебігу захворювання. Це зрозуміло, тому що на результат впливає багато факторів, включаючи форму запального захворювання кишечнику, варіабельність складу донорського матеріалу, дозу матеріалу та частоту проведення ТФМ і супутню терапію. У майбутньому, можливо, ТФМ буде замінена селективною трансплантацією певних мікробних спектрів, що позитивно вплине на перебіг запальних захворювань кишечнику.
Визначення характерних змін у мікробіомі кишечнику при СПК дало змогу припустити, що цей механізм може лежати в основі патогенезу проявів СПК – вісцеральної гіперчутливості, порушення бар’єрної функції та моторики кишечнику. Все це і спонукало до розвитку нових лікувальних стратегій, що ставлять за мету ребіоз порушеного мікробіому, у тому числі застосування ТФМ.
Саме пошуку успішних результатів ТФМ у хворих на СПК присвячений систематичний огляд результатів метааналізу, опублікований в United European Gastroenterology Journal (7(8), 2019). Вивчали зміни в шкалах тяжкості проявів СПК та якості життя у хворих, яким виконували ТФМ, зокрема і порівняно з плацебо. У дослідженнях, які проводилися одним рукавом, у 59,5% хворих із СПК було встановлено достовірне покращення. У рандомізованих контрольованих дослідженнях різниці між групами ТФМ та контролю не було, так само як і між показниками шкал тяжкості проявів та якості життя пацієнтів з СПК. З вищезазначеного було зроблено висновки про неефективність ТФМ у хворих на СПК. Проте автори наголосили на важливості порівняння результатів ТФМ, проведеної різними методами, що могло б стати окремим фактором сприяння гетерогенності результатів наявних досліджень (K. Myneedu et al., 2019).
Аналогічно з дослідженням стану мікробіоти у пацієнтів із СПК було проведено низку досліджень у пацієнтів з ожирінням, а також неалкогольною жировою хворобою печінки та цукровим діабетом 2 типу. Їх результати також виявили відмінності в складі мікроорганізмів порівняно зі здоровими особами, що показало роль мікробіоти товстої кишки у розвитку зазначених нозологій. Це стимулювало дослідження впливу на мікробіом (у тому числі за допомогою ТФМ) як стратегію лікування при цих захворюваннях. Так, в експерименті та неконтрольованих дослідженнях було показано, що пересадження кишкової мікробіоти від худих суб’єктів повним сприяє підвищенню чутливості до інсуліну, збільшенню різноманітності кишкової мікробіоти, підвищенню вироблення бутирату, зменшенню маси тіла.
Отримані результати вказують напрям для визначення мікробної асоціації з метою лікування ожиріння, метаболічного синдрому та цукрового діабету 2 типу та ролі у цьому ТФМ.
Процедура ТФМ
До процедури ТФМ треба провести велику роботу з відбору донорів. Відбір осіб, що можуть бути донорами фекального матеріалу, слід проводити дуже ретельно та згідно з вимогами чинного європейського консенсусу, оскільки від цього залежатиме не тільки ефективність ТФМ, а й безпека реципієнта.
По-перше, треба провести співбесіду з потенційним донором і детально проаналізувати його медичну документацію й анамнестичні дані. Це потрібно для виключення на першому етапі скринінгу пацієнтів, що інфіковані вірусами імунодефіциту людини (ВІЛ), гепатиту В, C, сифілісом, Т-лімфотропним вірусом людини 1 або 2 типу, малярією, трипаносомозом, туберкульозом, пріонами, ротавірусами, Giardialamblia та іншими мікроорганізмами, що уражають шлунково-кишковий тракт, а також дає змогу виявити недавнє (<6 міс) перебування в тропічних країнах, країнах із високим ризиком розвитку інфекційних захворювань/діареї мандрівників, або яких вакциновано з використанням живих ослаблених вірусів, за умови наявності потенційного ризику трансмісії. Важливо також прояснити, чи має місце небезпечна сексуальна поведінка (анонімні сексуальні контакти, сексуальні контакти з працівницями комерційного сексу, наркоманами, інфікованими ВІЛ, гепатитом, сифілісом; обтяжений анамнез за захворюваннями, що передаються статевим шляхом), індивідуальна робота з тваринами з метою виключення ризику трансмісії зоонозних інфекцій, недавнє (<6 міс) нанесення татуювань, виконання пірсингу, акупунктури, проведення медикаментозного лікування в місцях з незадовільними гігієнічними умовами або обтяжений анамнез щодо випадкового уколу голкою.
Необхідно приділити увагу наявності обтяженого анамнезу за СПК, запальними захворюваннями кишечнику, функціональним хронічним запором, целіакією, іншими хронічними гастроентерологічними, системними аутоімунними захворюваннями (з залученням у патологічний процес шлунково-кишкового тракту), неврологічними/нейродегенеративними захворюваннями та психічною патологією, а також наявність надлишкової маси тіла або ожиріння.
Крім того, треба зібрати дані про прийом медикаментів, акцентуючи увагу на використанні препаратів, що не мають офіційних показань до застосування та тих, які здатні несприятливо вплинути на склад кишкової мікробіоти (недавній, <3 міс, прийом антибіотиків, імуносупресантів, хіміопрепаратів, тривале застосування інгібіторів протонної помпи).
Окремо слід з’ясувати, чи не був пацієнт реципієнтом трансплантованих органів, а у працівників охорони здоров’я – можливість інфікування мультирезистентними мікроорганізмами.
Ще одним заходом щодо зменшення можливих ризиків є вікові обмеження – вік майбутніх донорів не має перевищувати 60 років.
Якщо після вищенаведеного опитування не визначено факторів виключення, особа, яка бажає стати донором калових мас, має письмово відповісти на питання спеціально розробленого опитувальника та пройти планове обстеження, здавши аналізи калу та крові принаймні за 4 тижні до донорства. За необхідності обстеження можна повторити через 8 тижнів. Таке обстеження включає дослідження на віруси (цитомегаловірус, вірус Епштейна – Барр, гепатиту А, B, C, Е, ВІЛ‑1/-2), збудники сифілісу, Entamoeba histolytica, антитіла до людського Т-лімфотропного вірусу 1 та 2 типів, Strongyloidesster coralis, а також повний клінічний аналіз крові, визначення рівня С-реактивного протеїну, альбуміну, креатиніну, електролітів, амінотрансферази, білірубіну, гамма-глутамілтранспептидази, лужної фосфатази, наявності Clostridium difficile, кишкових патогенів, включаючи Salmonella, Shigella, Campylobacter, Escherichia coli O157 H7, Yersinia, ванкоміцинрезистентні ентерококи, метицилінрезистентні Staphylococcus aureus, грамнегативні мультирезистентні бактерії, норовіруси, антигени і/або кислотостійке фарбування на Giardialamblia і Criptosporidium parvum, найпростіші (включаючи Blastocystis hominis) і гельмінти, та аналіз калу на приховану кров.
Крім планового скринінгу, донорам також належить пройти ще одне обстеження у день здачі фекального матеріалу. На думку низки фахівців, цей проміжок часу має бути за можливості якомога коротшим для запобігання вторинної контамінації фекалій. Якщо при цьому буде виявлено ознаки та симптоми загального нездужання або ураження шлунково-кишкового тракту, які нещодавно з’явилися (лихоманка, збільшення лімфатичних вузлів, діарея, блювання, абдомінальний біль, жовтяниця тощо), чи з’ясується, що донор з моменту скринінгу перебував у тропічних регіонах, мав контакт із кров’ю людини (уколи, рана, пірсинг, татуювання), сексуальні контакти високого ризику, а також приймав антибіотики й інші препарати, що здатні негативно вплинути на стан кишкової мікробіоти, або у членів його сім’ї протягом 4 тижнів до донорства наявна діарея (більше 3 випорожнень неоформленим/рідким калом), фекальний матеріал не забирають.
Такий ретельний відбір необхідний для запобігання інфікуванню реципієнтів і зниження ймовірності розвитку небажаних явищ після ТФМ. У цьому аспекті вважається, що ідеальним донором калових мас може бути близький родич хворого – використання фекального матеріалу таких донорів дає змогу максимально знизити ризик трансмісійних інфекцій. На цьому закінчується етап скринінгу та починається етап підготовки отриманого фекального матеріалу.
Отриманий фекальний матеріал піддають спеціальній обробці залежно від того, у якому вигляді він буде застосовуватися – свіжим чи замороженим. Наявні докази, що обидва види матеріалу можуть бути застосовані – ефективність ТФМ не залежить від типу використаних фекалій.
Свіжі калові маси необхідно обробляти протягом 6 год після дефекації. Мінімальна кількість калу становить 30 г. З метою захисту бактерій слід максимально швидко забезпечити правильне зберігання й обробку матеріалу при температурі навколишнього середовища (20-30 °C), за можливості це здійснюють в анаеробних умовах. Фекальний матеріал розводять у фізіологічному розчині за допомогою блендера або вручну, потім просіюють з метою запобігання закупорюванню шприца і трубок під час інфузії.
Якщо фекальний матеріал буде заморожуватися, то фекалії необхідно розвести в 150 мл фізіологічного розчину та додати гліцерин у кінцевій концентрації 10%; такий матеріал зберігають при температурі -80 °C. У день інфузії суспензію калових мас слід розморозити на теплій (37 °C) водяній бані і настоювати протягом 6 год після відтанення. Після розморожування у суспензію можна додати фізіологічний розчин для отримання бажаного об’єму.
Європейські експерти більш прихильно ставляться до використання заморожених калових мас, вважаючи такий метод ТФМ оптимальним для створення банку фекального матеріалу, стандартизації процесу ТФМ. Крім того, він дозволяє використовувати фекальні маси за потреби, без затримки, зумовленої проведенням скринінгу.
Реципієнти фекального матеріалу потребують психологічної, медикаментозної та інформаційної підтримки. Так, пацієнтам з рекурентною інфекцією Clostridium difficile до процедури ТФМ слід рекомендувати прийом ванкоміцину або фідаксоміцину щонайменше протягом 3 днів, застосування антибіотиків припиняють за 12-48 год до інфузії фекальних мас. Це необхідно для пригнічення кишкової популяції Clostridium difficile. Якщо проведення ТФМ заплановано у хворих з іншою патологією, наприклад, із запальним захворюванням кишечнику, немає переконливих доказових даних щодо доцільності прийому антибіотиків, навіть якщо попереднє застосування протимікробних засобів може збільшити клінічну ефективність процедури.
Способи доставки фекального матеріалу, що використовують сьогодні, умовно поділяють на верхні (пероральні капсули), середні (за допомогою езофагогастродуоденоскопії або назогастрального/єюнального/дуоденального зонда) та нижні (за допомогою колоноскопії або ретенційної клізми).
Однією з перспективних методик ТФМ вважається пероральний прийом капсул, які містять фекальні маси. Передбачається, що використання таких капсул дозволить збільшити доступність ТФМ-терапії і підвищити прихильність пацієнтів до лікування.
Середній спосіб доставки фекального матеріалу нині не набув поширеності. Частота виникнення серйозних небажаних ефектів у реципієнтів (особливо тяжкохворих), які перенесли ТФМ через верхні відділи шлунково-кишкового тракту, значно перевершувала таку в осіб, яким фекальну суспензію вводили через нижні відділи шлунково-кишкового тракту.
У багатьох систематичних оглядах і метааналізах показано, що нижній спосіб доставки під час колоноскопії дозволяє домогтися найбільш високих показників у лікуванні рекурентної інфекції Clostridium difficile і має такий самий профіль безпеки, як і інші способи введення. Фахівці підкреслюють відсутність необхідності в розподілі суспензії калових мас кишечником невеликими порціями, тому що вона все одно буде поширюватися товстою кишкою завдяки її перистальтичній активності (200-500 мл фекальної суспензії, отриманої з 20-100 г калу, може бути максимально безпечно доставлено у товсту кишку порівняно з іншими локаціями). За можливості донорський фекальний матеріал вводять у праві відділи товстої кишки через робочий канал колоноскопа. У разі тяжкого перебігу коліту з метою безпеки фекальну суспензію можна вводити у ліві відділи кишечнику.
Якщо інфузія фекального матеріалу буде здійснюватися під час колоноскопії, перед її проведенням реципієнтам слід виконати очищення кишечнику з використанням поліетиленгліколю. Експерти підкреслюють, що у разі обрання як способу доставки ретенційної клізми необхідності в повному лаважі кишечнику немає.
Висновки
Таким чином, останні наукові досягнення розширили розуміння ролі фекальної мікрофлори в підтриманні здоров’я людини та причин виникнення певних хвороб. Величезна кількість досліджень, які проводяться в світі, проливає світло на неоднозначність вивчення мікробіому та спонукає до нових випробувань. Вже отримані відповіді на певні запитання стосовно можливості виконання ТФМ різними шляхами та сформовано основні показання для виконання зазначеної процедури, серед яких саме рецидивуюча інфекція Clostridium difficile є найпершим.
Список літератури знаходиться в редакції.
Більше інформації з питань трансплантації фекальної мікробіоти можна отримати на ресурсі Fecal Transplant Resources Guide.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (54), 2019 р.