6 січня, 2020
Профілактика серцево-судинних ускладнень при цукровому діабеті 2 типу: нові доказові дані – нові реальні можливості
 Як відомо, цукровий діабет (ЦД) 2 типу являє собою дуже поширене в популяції дорослих осіб хронічне та прогресуюче захворювання, що характеризується розвитком мікро- й макроваскулярних ускладнень (Meigs J.B., 2003). Хоча сьогодні в арсеналі лікарів існують ефективні та різноманітні лікарські засоби для досягнення глікемічного контролю, смертність пацієнтів із ЦД 2 типу досі залишається високою. При цьому провідною її причиною стають серцево-судинні ускладнення. Так, серед пацієнтів із ЦД показник серцево-судинної смертності в 3 рази перевищує такий серед осіб без цього захворювання, а смертності від усіх причин – у 2 рази (Preis S. R. et al., 2009; Taylor K. S. et al., 2013).
Як відомо, цукровий діабет (ЦД) 2 типу являє собою дуже поширене в популяції дорослих осіб хронічне та прогресуюче захворювання, що характеризується розвитком мікро- й макроваскулярних ускладнень (Meigs J.B., 2003). Хоча сьогодні в арсеналі лікарів існують ефективні та різноманітні лікарські засоби для досягнення глікемічного контролю, смертність пацієнтів із ЦД 2 типу досі залишається високою. При цьому провідною її причиною стають серцево-судинні ускладнення. Так, серед пацієнтів із ЦД показник серцево-судинної смертності в 3 рази перевищує такий серед осіб без цього захворювання, а смертності від усіх причин – у 2 рази (Preis S. R. et al., 2009; Taylor K. S. et al., 2013).
Саме тому згідно з останніми рекомендаціями провідних асоціацій ендокринологів і кардіологів – Американської діабетологічної асоціації (ADA, 2018), Європейської асоціації з вивчення діабету (EASD, 2019), Американської колегії кардіологів (АСС, 2018), Європейського товариства кардіологів (ESC, 2019) – профілактика фатальних і нефатальних кардіоваскулярних подій наразі розглядається як ключова мета лікування пацієнтів із ЦД 2 типу (Davies M.J. et al., 2018; Das S.R. et al., 2018; Cosentino F. et al., 2109). Задля її досягнення хворим у складі комплексної терапії традиційно призначають лікарські засоби 2 фармакотерапевтичних класів – антигіпертензивні та гіполіпідемічні препарати. Утім, протягом останніх років у розпорядженні клініцистів з’явилися принципово нові дані про те, що деякі інноваційні протидіабетичні препарати, зокрема представники класу агоністів рецепторів глюкагоноподібного пептиду‑1 (ГПП‑1), також мають здатність знижувати кардіоваскулярний ризик (Zelniker T.A. et al., 2019).
! Отже, застосування цих сучасних препаратів відкриває можливості не тільки контролю глікемії та маси тіла, а й позитивного впливу на стан серцево-судинної системи у хворих на ЦД 2 типу.
ГПП‑1 являє собою есенціальний інкретиновий гормон, який чинить трофічні ефекти на β-клітини підшлункової залози. ГПП‑1 здатний стимулювати біосинтез інсуліну й експресію генів інсуліну, що робить його потужним цукрознижувальним агентом, який може модифікувати природний перебіг ЦД 2 типу (Lovshin J.A., 2017). Великим досягненням сучасної фармакології стало створення рекомбінантних аналогів ГПП‑1, упровадження яких у клінічну практику дало змогу кардинально покращити комплексне лікування ЦД 2 типу.
Про неабиякий інтерес учених до багатогранних ефектів агоністів рецепторів ГПП‑1 свідчить той факт, що останніми роками була проведена ціла низка досліджень із метою оцінки кардіоваскулярної безпеки та їх ефективності в пацієнтів із ЦД 2 типу. Кількість цих досліджень уже стала достатньою для систематизації їх результатів, і в другому півріччі 2019 р. побачили світ результати одразу 3 незалежних масштабних метааналізів рандомізованих клінічних досліджень (РКД), присвячених оцінці саме кардіоваскулярних наслідків терапії агоністами рецепторів ГПП‑1. Безперечно, їх результати та висновки заслуговують на ретельний розгляд.
! Так, у серпні цього року на сторінках авторитетного журналу The Lancet Diabetes & Endocrinology групою вчених із Великої Британії та Данії (Kristensen S.L. et al., 2019) був представлений систематичний метааналіз клінічних досліджень з оцінки впливу терапії агоністами рецепторів ГПП‑1 на частоту серцево-судинних подій, смертність і ниркову функцію в пацієнтів із ЦД 2 типу.
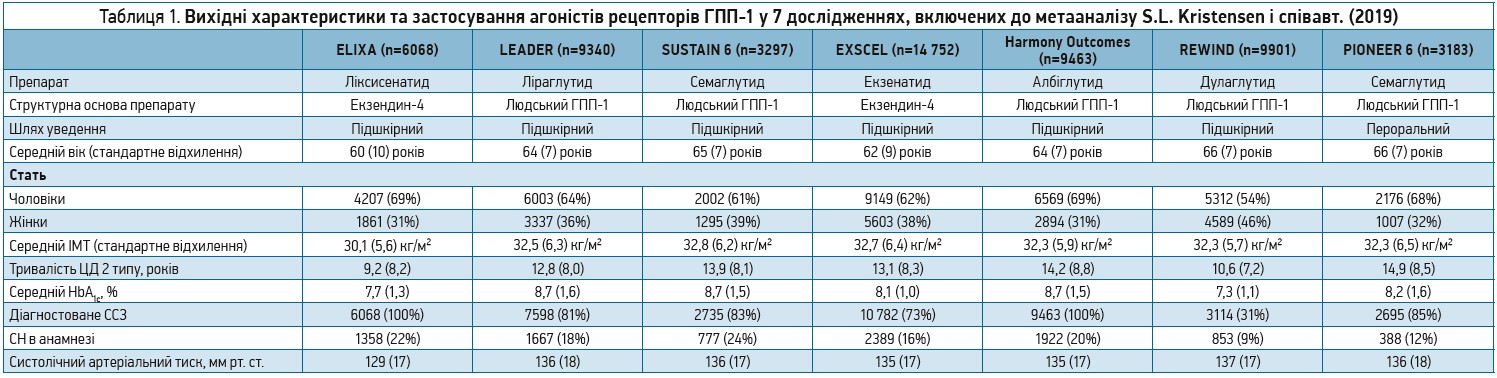
У цьому огляді була зроблена спроба синтезувати доступні докази щодо насамперед кардіоваскулярних ефектів цих препаратів з огляду на різницю в їхній структурі та тривалості дії. З цією метою в базах даних MEDLINE та в Кокранівському центральному реєстрі контрольованих клінічних випробувань автори виконали пошук плацебо-контрольованих досліджень (до 16 червня 2019 р.), у результатах яких повідомлялося би про частоту тяжких небажаних серцево-судинних подій (major adverse cardiac events – МАСЕ). Із використанням моделі випадкових ефектів була здійснена оцінка загальних показників відносного ризику (ВР) виникнення МАСЕ, смерті від усіх причин, госпіталізації з приводу серцевої недостатності (СН), погіршення ниркової функції та ключових критеріїв безпеки (тяжка гіпоглікемія, панкреатит і рак підшлункової залози). Також був здійснений окремий аналіз частоти МАСЕ у декількох підгрупах на основі характеристик пацієнтів (анамнез серцево-судинного захворювання, індекс маси тіла (ІМТ), вік, вихідний рівень HbA1c та вихідна розрахункова швидкість клубочкової фільтрації – рШКФ), тривалості дослідження, інтервалу дозування призначеного препарату та його структурної гомології.
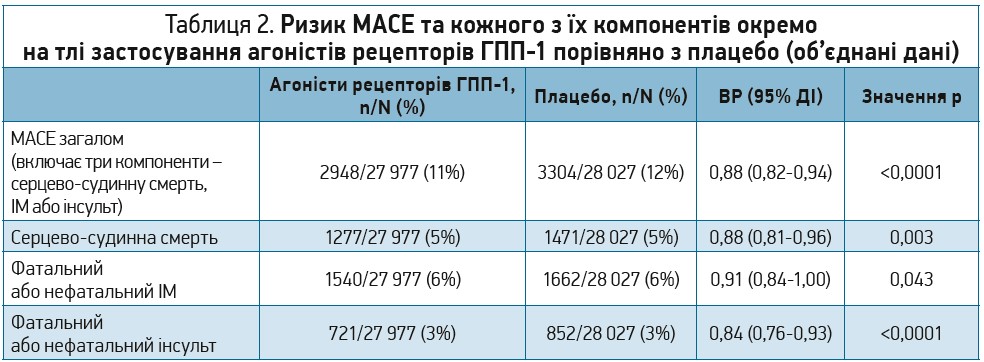
Із 27 ідентифікованих під час скринінгу публікацій було відібрано 7 клінічних випробувань за участю загалом 56 004 учасників (табл. 1): дослідження ELIXA (ліксисенатид), LEADER (ліраглутид), SUSTAIN 6 (семаглутид), EXSCEL (екзенатид), Harmony Outcomes (албіглутид), REWIND (дулаглутид) і PIONEER 6 (пероральний семаглутид). Метааналіз їх результатів у цілому продемонстрував, що лікування агоністами рецепторів ГПП‑1 знижувало частоту виникнення МАСЕ на 12% (ВР 0,88; 95% довірчий інтервал (ДІ) 0,82-0,94; p<0,0001) (табл. 2).
Лікування агоністами рецепторів ГПП‑1 сприяло зниженню смертності від усіх причин на 12% (ВР 0,88; 95%
! Результати цього найбільшого на сьогодні метааналізу, до якого були включені об’єднані дані 7 масштабних досліджень, продемонстрували, що агоністи рецепторів ГПП‑1 достовірно знижують смертність, ризик серцево-судинних подій та погіршення функції нирок у пацієнтів із ЦД 2 типу.
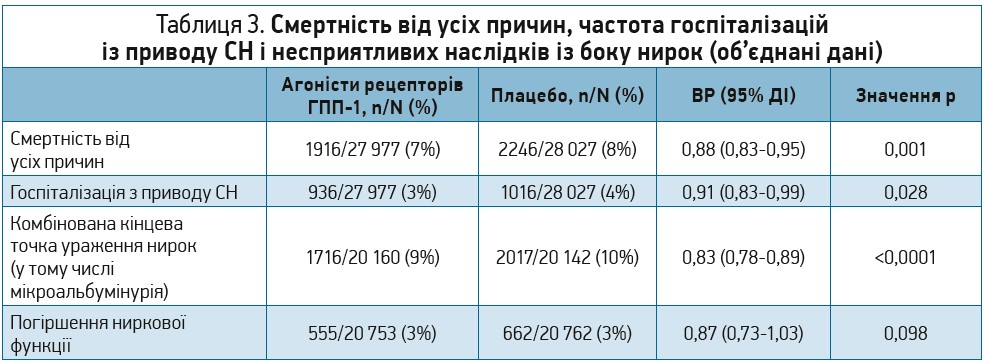
Більше того, порівняно з попередніми метааналізами, до цього були включені дані щодо більшої кількості пацієнтів без діагностованого захворювання серцево-судинної системи та дані щодо двох додаткових препаратів (дулаглутид і пероральна форма семаглутиду). Результати демонструють, що лікування агоністами рецепторів ГПП‑1 знижувало ризик виникнення МАСЕ та їх окремих складових, а також зменшувало смертність від усіх причин, частоту госпіталізацій із приводу СН і досягнення комбінованої кінцевої точки ураження нирок. Перевага впливу лікування цими препаратами на частоту виникнення МАСЕ була стабільною в усіх підгрупах за винятком однієї, тому було висловлено припущення про те, що похідні екзендину‑4, можливо, чинять менш виражений сприятливий кардіоваскулярний ефект. Стабільні й узгоджені ефекти агоністів рецепторів ГПП‑1 були зафіксовані в підгрупах пацієнтів, виділених залежно від анамнезу серцево-судинного захворювання, ІМТ, віку, вихідного рівня HbA1c, вихідної рШКФ, тривалості дослідження й інтервалу дозування призначеного препарату.
Практичні наслідки отримання вказаних доказів полягають у тому, що виявлені кардіопротекторні ефекти агоністів рецепторів ГПП‑1, а також зменшення на тлі їх застосування ризику СН і погіршення ниркової функції відкривають перед лікарями важливі терапевтичні можливості зниження серцево-судинної захворюваності та смертності в пацієнтів із ЦД 2 типу.
! У жовтні 2019 р. італійськими вченими (Manucci E. et al.) у журналі Diabetes Obesity and Metabolism був представлений оновлений метааналіз і підгруповий аналіз РКД із вивчення кардіоваскулярних ефектів терапії агоністами рецепторів ГПП‑1 у пацієнтів із ЦД 2 типу із серцево-судинними подіями в анамнезі чи без таких.
Пошук контрольованих досліджень із вивчення впливу агоністів рецепторів ГПП‑1 на кардіоваскулярні кінцеві точки здійснювався в базах даних MEDLINE, EMBASE, Кокранівській базі даних і на ресурсі clinicaltrials.gov. Обов’язковими критеріями включення дослідження виступали оцінка кардіоваскулярних наслідків лікування та тривалість періоду подальшого спостереження за хворими не менш ніж 52 тиж. Загалом до метааналізу було включено 7 плацебо-контрольованих клінічних досліджень високої якості, в ході яких агоністи рецепторів ГПП‑1 (екзенатид, ліраглутид, ліксисенатид, албіглутид, дулаглутид і семаглутид) порівнювали з плацебо (табл. 4). Як головна кінцева точка в цьому метааналізі розглядалася частота МАСЕ; як вторинні кінцеві точки – ІМ (нефатальний і фатальний), інсульт, серцево-судинна смертність і смертність від усіх причин, а також госпіталізація з приводу СН. За можливості проводився також порівняльний аналіз частоти розвитку МАСЕ у таких підгрупах:
- пацієнти з уже діагностованим серцево-судинним захворюванням атеросклеротичного генезу порівняно з пацієнтами з наявністю лише декількох факторів кардіоваскулярного ризику;
- пацієнти чоловічої статі порівняно з пацієнтами жіночої статі;
- пацієнти віком ≥65 років порівняно з пацієнтами віком <65 років;
- пацієнти з різним ІМТ (≥30 кг/м2 порівняно з <30 кг/м2);
- пацієнти, котрі проживають у різних географічних регіонах (Північна Америка, Європа, Азіатсько-Тихоокеанський регіон);
- пацієнти з різною рШКФ (<60 мл/хв порівняно з ≥60 мл/хв).
До того ж окремі підгрупові аналізи були проведені з метою порівняння ефектів агоністів рецепторів ГПП‑1 короткої та тривалої дії, а також препаратів на основі рекомбінантного людського ГПП‑1 (ліраглутид, албіглутид, дулаглутид, семаглутид) порівняно з агоністами рецепторів ГПП‑1, подібними до екзендину (екзенатид, екзенатид із повільним вивільненням і ліксисенатид).
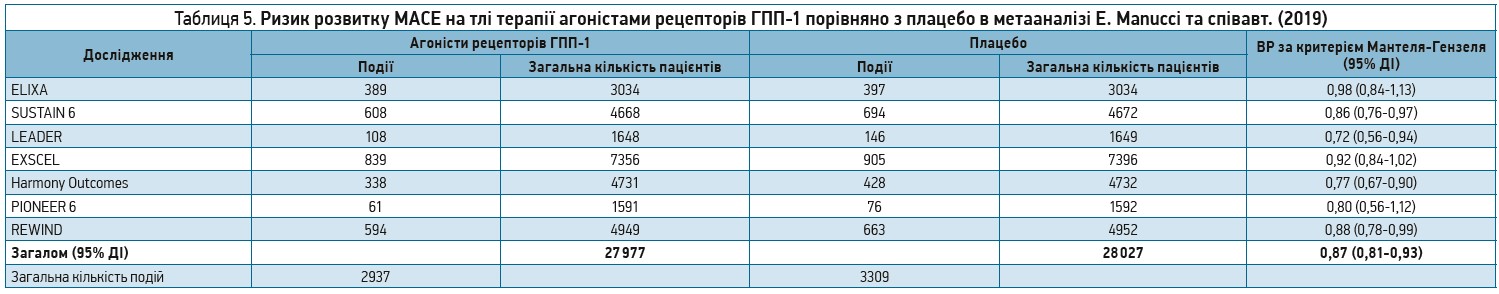
Загалом у всіх 7 дослідженнях, включених до цього метааналізу, було зареєстровано 2937 випадків МАСЕ у групах застосування агоністів рецепторів ГПП‑1 та 3309 – у контрольних групах.
! Отримані результати засвідчили, що лікування агоністами рецепторів ГПП‑1 було асоційоване з достовірним зменшенням частоти розвитку МАСЕ (ВР за критерієм Мантеля-Гензеля 0,87; 95% ДІ 0,81-0,93) (табл. 5).
 Також було констатовано зниження серцево-судинної смертності (ВР за критерієм Мантеля-Гензеля 0,88; 95% ДІ 0,80-0,96) та смертності від усіх причин (ВР за критерієм Мантеля-Гензеля 0,90; 95% ДІ 0,82-0,98) (табл. 6), зменшення частоти ІМ (ВР за критерієм Мантеля-Гензеля 0,91; 95% ДІ 0,84-0,98) та інсульту (ВР за критерієм Мантеля-Гензеля 0,86; 95% ДІ 0,77-0,97). Результати щодо частоти госпіталізацій із приводу СН не були статистично достовірними (ВР за критерієм Мантеля-Гензеля 0,93; 95% ДІ 0,83-1,04).
Також було констатовано зниження серцево-судинної смертності (ВР за критерієм Мантеля-Гензеля 0,88; 95% ДІ 0,80-0,96) та смертності від усіх причин (ВР за критерієм Мантеля-Гензеля 0,90; 95% ДІ 0,82-0,98) (табл. 6), зменшення частоти ІМ (ВР за критерієм Мантеля-Гензеля 0,91; 95% ДІ 0,84-0,98) та інсульту (ВР за критерієм Мантеля-Гензеля 0,86; 95% ДІ 0,77-0,97). Результати щодо частоти госпіталізацій із приводу СН не були статистично достовірними (ВР за критерієм Мантеля-Гензеля 0,93; 95% ДІ 0,83-1,04).
Цікаво, що тоді як терапія агоністами рецепторів ГПП‑1 асоціювалася з достовірним зниженням частоти МАСЕ у пацієнтів із діагностованими серцево-судинними захворювання атеросклеротичного генезу, в підгрупах пацієнтів із наявністю декількох факторів кардіоваскулярного ризику такого вираженого ефекту не спостерігалося. Можливо, протекторний ефект агоністів рецепторів ГПП‑1 є менш вираженим у пацієнтів із низьким ризиком (у ситуації первинної профілактики), ніж у осіб із наявністю серцево-судинних подій в анамнезі. Також подальший статистичний аналіз у підгрупах продемонстрував, що статистично значуще зниження частоти МАСЕ було асоційоване із застосуванням саме людських рекомбінантних агоністів рецепторів ГПП‑1, а не препаратів, подібних за своєю структурою до екзендину. Це свідчить про те, що різниця в структурі агоністів рецепторів ГПП‑1 також може позначатися на різниці в кардіоваскулярних ефектах.
Окремі метааналізи, виконані в підгрупах пацієнтів, продемонстрували достовірне зниження частоти МАСЕ на тлі застосування агоністів рецепторів ГПП‑1 незалежно від статі, віку та наявності ожиріння.
! Таким чином, лікування цими інноваційними препаратами асоційовано зі зниженням серцево-судинної захворюваності та смертності в пацієнтів із ЦД 2 типу та високим кардіоваскулярним ризиком.
Але ймовірно, що лікування агоністами рецепторів ГПП‑1 може чинити різні ефекти в рамках первинної та вторинної профілактики серцево-судинних ускладнень, і це питання потребує подальшого ретельного вивчення.
! Нарешті, C.-M. Duan і співавт. у листопаді цього року в журналі Medicine опублікували систематичний огляд і метааналіз РКД за участю пацієнтів із ЦД 2 типу, котрий мав на меті оцінити загальні серцево-судинні наслідки терапії одним із сучасних представників класу агоністів рецепторів ГПП‑1 – ліраглутидом – порівняно з плацебо або іншими референтними препаратами.
Ліраглутид являє собою інноваційний рекомбінантний аналог ГПП‑1, амінокислотна послідовність якого на 97% ідентична такій ендогенного ГПП‑1. Цей препарат чинить тривалу дію та призначається ін’єкційно лише 1 раз на добу. Ефективність ліраглутиду стосовно зниження рівнів глюкози крові була переконливо підтверджена в ході відповідних клінічних досліджень. Окрім того, багато попередніх досліджень продемонстрували, що терапія ліраглутидом асоціюється зі зниженням маси тіла й артеріального тиску (Du Q. et al., 2014; Robinson L. E. et al., 2013; Iepsen E. W. et al., 2015).
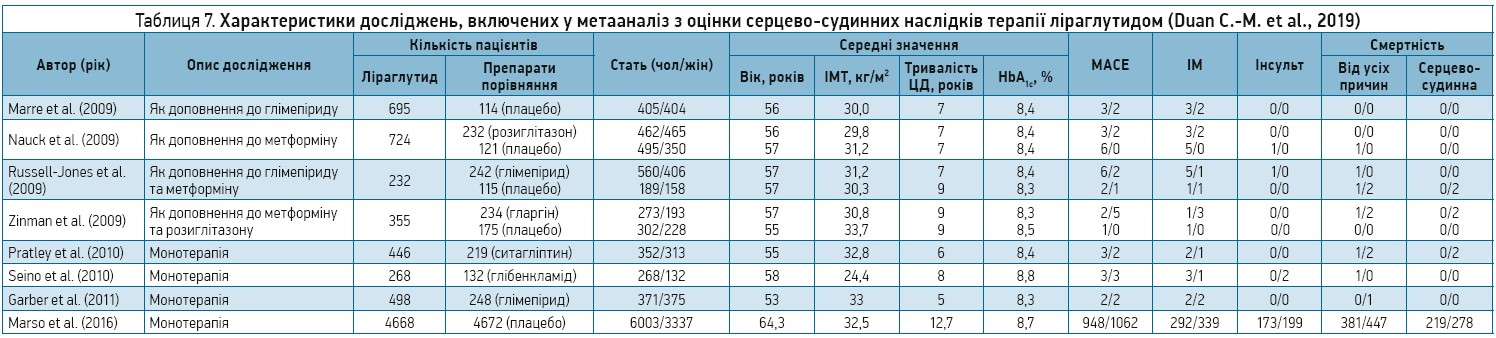
Для вивчення кардіоваскулярних ефектів ліраглутиду автори відібрали в базах даних PubMed, Embase та Web of Knowledge відповідні РКД, які були надруковані до 1 вересня 2017 р. Загалом обраним критеріям включення відповідали 8 досліджень, участь у яких у цілому взяли 14 608 пацієнтів (табл. 7).
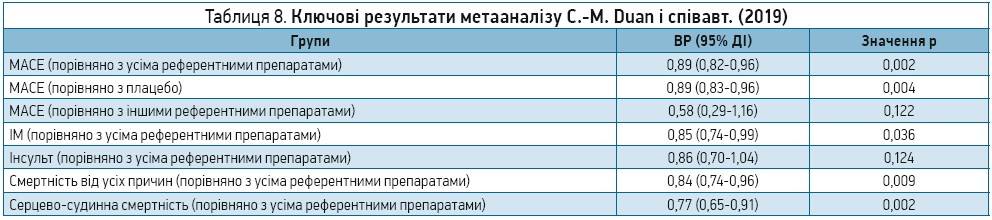
! Згідно з результатами метааналізу, в пацієнтів, які отримували терапію ліраглутидом, відзначався менший, аніж в інших групах порівняння, ризик виникнення тяжких МАСЕ, зокрема гострого ІМ, а також нижчі показники смертності від усіх причин і серцево-судинної смертності (табл. 8).
Проте в ході підгрупового аналізу МАСЕ достовірне зниження їх частоти спостерігалося лише в плацебо-контрольованих дослідженнях (ВР 0,89; 95% ДІ 0,83-0,96; P=0,004), а не в дослідженнях з активними препаратами порівняння. На думку авторів, це може пояснюватися надто малими розмірами вибірки в дослідженнях із порівняння ризику МАСЕ між ліраглутидом та іншими активними референтними препаратами. Крім того, згідно з наявними знаннями ризик виникнення МАСЕ корелював із рівнем HbA1c у пацієнтів із ЦД 2 типу (Selvin Е. et al., 2004), і попередні дослідження показали, що агоністи рецепторів ГПП‑1 не демонструють достовірної різниці з точки зору зниження рівнів HbA1c порівняно з інсуліну гларгіном і ліксисенатидом (Li W. X. et al., 2010; Htike Z.Z. et al., 2017). У сукупності ці докази можуть пояснити, чому лікування ліраглутидом не демонструє значущої різниці порівняно з іншими референтними препаратами в зниженні ризику МАСЕ у пацієнтів із ЦД 2 типу. Для підтвердження цього результату необхідно провести масштабніші та краще сплановані РКД.
Також метааналіз надав важливі докази щодо профілю кардіоваскулярної безпеки ліраглутиду в пацієнтів із ЦД 2 типу: відповідно до офіційної позиції Управління з контролю якості продуктів харчування та лікарських засобів США (FDA), починаючи з 2009 р. аби препарати для лікування ЦД 2 типу були визнані безпечними, для них мають бути надані формальні докази відсутності будь-якого ризику та зокрема ризику МАСЕ, при цьому верхня межа 95% ДІ має дорівнювати 1,30. Цей метааналіз виявив, що коефіцієнт захворюваності для МАСЕ при застосуванні ліраглутиду становив <1,0 порівняно з усіма референтними групами; верхня межа 95% ДІ також становила <1,0.
Варто зазначити, що в метааналізі були зроблені висновки стосовно зниження частоти МАСЕ лише для ліраглутиду. Тобто на підставі цих результатів не можна казати про те, що встановлений ступінь зниження кардіоваскулярного ризику є класовим ефектом агоністів рецепторів ГПП‑1.
Гіпотетично сприятливий вплив ліраглутиду на кардіоваскулярний ризик можна пояснити певними механізмами. Добре відомо, що метаболічні фактори ризику тісно пов’язані із захворюваністю та смертністю в пацієнтів із ЦД 2 типу, а їх ефективний контроль може знизити як захворюваність, так і смертність (Yakoob M. Y. et al., 2016).
! Як повідомлялося раніше, агоністи рецепторів ГПП‑1 можуть ефективно впливати на метаболічні фактори ризику, включаючи рівні HbA1c, масу тіла й артеріальний тиск (Sivertsen J. et al., 2012).
Рандомізоване плацебо-контрольоване подвійне сліпе перехресне дослідження виявило, що лікування ліраглутидом може достовірно знижувати рівні біомаркерів кардіоваскулярного ризику, включаючи фактор некрозу пухлини та середньорегіональний проадреномедулін (MR-proADM); при цьому відомо, що зниження рівнів середньорегіонального пропередсердного натрійуретичного пептиду (MR-proANP) пов’язано з клінічними перевагами в пацієнтів із СН (von Scholten B. J. et al., 2017). Водночас нещодавнє дослідження з вивчення агоніста рецепторів ГПП‑1 албіглутиду продемонструвало відсутність його впливу на ризик MACE у пацієнтів із ЦД 2 типу (Fisher M. et al., 2015). Ця різниця може пояснюватися більшою статистичною
потужністю цього аналізу порівняно з попередніми. Можуть мати значення й інші фактори: наприклад, різні ефекти агоністів рецепторів ГПП‑1 на частоту серцевих скорочень, збільшення якої вважається асоційованим із вищим кардіоваскулярним ризиком (Cooney M. T. et al., 2010; Perret-Guillaume C., 2009). Отже, фактори, що роблять свій внесок у ці розбіжності між албіглутидом і ліраглутидом, мають бути вивчені в наступних дослідженнях.
* * *
Підсумовуючи важливі результати, отримані в ході вищеописаних 3 масштабних метааналізів, можна з упевненістю стверджувати, що впровадження в практику лікування пацієнтів із ЦД 2 типу інноваційних препаратів із класу агоністів рецепторів ГПП‑1 (зокрема, ліраглутиду) дійсно відкриє нову сторінку в історії боротьби з цим захворюванням, причому не лише завдяки власне покращенню контролю глікемії, а й унаслідок їх додаткового сприятливого впливу на ризик виникнення серцево-судинних подій, який сьогодні можна вважати доведеним із позицій доказової медицини.
Підготувала Анжела Томічева
Медична газета «Здоров’я України 21 сторіччя» № 24 (469), грудень 2019 р.