5 лютого, 2020
Рак молочной железы у молодых женщин
 Рак молочной железы (РМЖ) у женщин молодого возраста (РМЖМ) большинство специалистов определяет как РМЖ у пациенток моложе 40 лет. В экономически развитых странах его частота оценивается в 7% от всех случаев РМЖ, в странах с низким доходом его доля может быть значительно выше – до 20%. Возможным объяснением такой разницы является воздействие факторов внешней среды, генетические отличия и различия в репродуктивних переменных в разных регионах мира [1].
Рак молочной железы (РМЖ) у женщин молодого возраста (РМЖМ) большинство специалистов определяет как РМЖ у пациенток моложе 40 лет. В экономически развитых странах его частота оценивается в 7% от всех случаев РМЖ, в странах с низким доходом его доля может быть значительно выше – до 20%. Возможным объяснением такой разницы является воздействие факторов внешней среды, генетические отличия и различия в репродуктивних переменных в разных регионах мира [1].
Несмотря на относительно невысокую частоту РМЖМ, эта локализация рака остается наиболее часто диагностируемой среди взрослых женщин и ведущей причиной онкологической смертности в этой возрастной группе (рис. 1). Молодые женщины сталкиваются с потенциально летальным заболеванием на пике их профессиональной карьеры и планирования семьи. При анализе структуры заболеваемости у молодых пациенток отмечается большая частота тройных негативных и HER2-позитивных вариантов, более высокая степень злокачественности, большее количество местнораспространенных и метастатических опухолей.
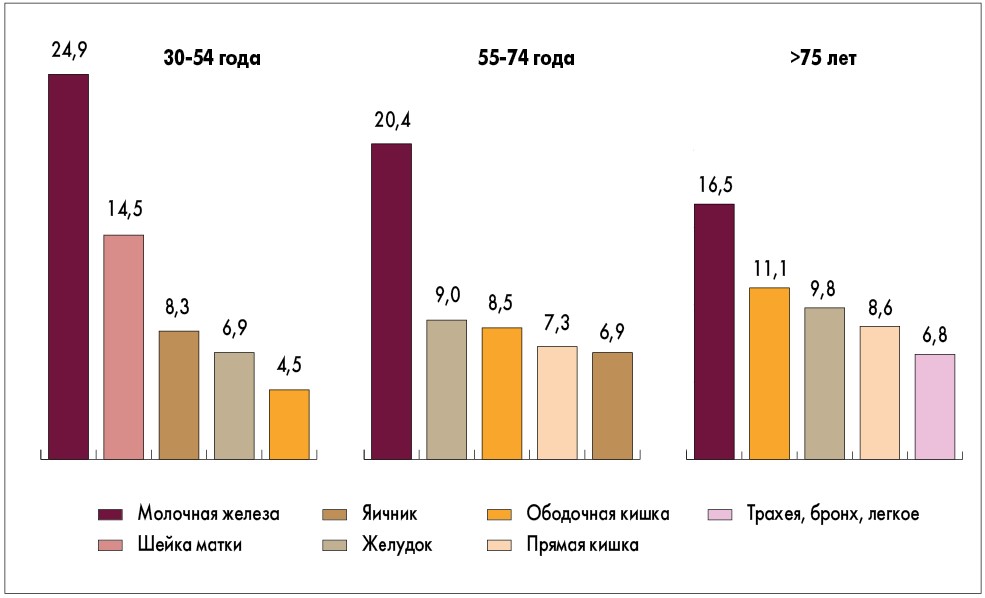 Рис. 1. Удельный вес 5 основных нозологических форм злокачественных новообразований в возрастной структуре смертности женщин Украины, % (данные Национального канцер-регистра Украины, 2012 г.)
Рис. 1. Удельный вес 5 основных нозологических форм злокачественных новообразований в возрастной структуре смертности женщин Украины, % (данные Национального канцер-регистра Украины, 2012 г.)
Толерантность к токсичности лечения в этой когорте ниже, чем у пациенток старшего возраста, из-за риска нарушения фертильности и возникновения преждевременной менопаузы. В этой связи для молодых пациенток характерно меньшее предпочтение системной адъювантной терапии, особенно эндокринной, что может повышать риск рецидива. Следовательно, молодой возраст является предиктором возможного худшего прогноза при люминальных типах РМЖ, но не при тройном негативном и HER2-позитивном РМЖ [2].
Обнаружены также различия в профиле экспрессии генов в опухолях молочных желез у пациенток молодого и старшего возраста. В большом исследовании Azim и соавт. (2012) обнаружено, что гены, вовлеченные в процессы, связанные с популяциями незрелых клеток молочной железы (RANKL, c-kit, BRCA1) и сигнальные пути ростовых факторов (MAPK, PI3K), демонстрируют более высокую экспрессию у женщин молодого возраста [3].
Путем анализа 784 случаев РМЖ установлено, что пациентки моложе 45 лет имели более низкую экспрессию mRNA ERα, ERβ, и PR, но более высокую экспрессию HER2 и EGFR, чем женщины старше 65 лет. У женщин моложе 40 лет была обнаружена более низкая экспрессия ERα и ERβ по сравнению с пациентками в возрасте 40-50 лет. Кроме того, последовательности генов, характерные для молодых женщин, включали биологически релевантные и потенциально активные процессы, такие как сигнальный путь mTOR/rapamycin, BRCA1, обеспечение иммунных функций [4].
РМЖ у пациентки моложе 35 лет служит основанием для проверки его наследственного характера и для тестирования на мутации (реже – на мутации TP53). В популяционном исследовании случай-контроль установлено, что вероятность наличия определяемой мутации BRCA1/2 у женщин моложе 35 лет составляла 9,4% (в общей популяции – 0,2%). Семейный анамнез РМЖ/рака яичника и этническое происхождение (евреи ашкенази) могут повышать вероятность наличия мутации.
Имеются расовые различия в биологии РМЖМ. Согласно данным американской базы SEER (Surveillance, Epidemiology, and End Result), по результатам анализа показателей более 126 тыс. женщин моложе 49 лет с РМЖ обнаружено, что доля чернокожих женщин моложе 40 лет была больше. В этой когорте также выявлены более высокая частота гормононегативных опухолей, более высокие стадия и степень злокачественности. В исследовании Carolina Breast Cancer Study было отмечено преобладание базальноподобного РМЖ у чернокожих женщин в период пременопаузы (39%) по сравнению с другими группами пациенток [5].
В 2011 г. Европейское общество специалистов по раку молочной железы (EUSOMA) обозначило лечение РМЖМ как одну из наиболее важных проблем, требующих консенсусного мнения экспертов. Для этого после предшествующей работы над систематическим обзором и подготовки рекомендаций на основе данных доказательной медицины была организована встреча 13 экспертов. Итогом встречи было создание международного консенсуса по РМЖМ. Консенсус обновляется и дополняется, материалы его обсуждаются на периодически проходящей международной конференции по РМЖМ, последняя из которых под эгидой Европейской школы онкологии и Европейского общества медицинской онкологии (ESO-ESMO) состоялась в 2018 г. в Лугано (Швейцария) [6].
Диагностика
Диагностика РМЖМ может быть затруднена. Это связано с рядом факторов. Во-первых, пациентки моложе 40 лет, как правило, не участвуют в скрининговых программах (из-за возрастного ценза), они ранее не проходили маммографию, что затрудняет сравнительную оценку подозрительных очагов. Во-вторых, эта когорта пациенток характеризуется повышенной плотностью молочных желез, которая снижает диагностическую ценность маммографии. Наконец, определенную роль имеет психологическая неготовность как самих пациенток, так и специалистов здравоохранения допустить наличие РМЖ у молодой женщины, а тем более беременной или кормящей матери. Все это объясняет относительно большую долю пациенток молодого возраста с распространенным РМЖ.
Таким образом, инструментальная диагностика РМЖМ имеет ряд сложностей и особенностей и должна проводиться только высококвалифицированными специалистами. Учитывая возрастные ограничения рентгеновской маммографии (ММГ), следует более широко использовать ультразвуковое сканирование, в некоторых случаях отдавая ему предпочтение (с учетом возраста, плотности ткани молочных желез, характеристик подозрительных очагов, данных клинического обследования). При наличии патологических выделений из молочных желез и обоснованных подозрений на протоковую карциному следует проводить ММГ даже у молодых женщин с целью выявления микрокальцинатов. Магнитно-резонансная томография (МРТ) обычно не рекомендуется для оценки обнаруженных путем маммографии и ультразвукового исследования новообразований; подозрительные очаги необходимо исследовать с применением рутинных методик, включая биопсию, даже при негативных результатах МРТ. Роль и место томосинтеза предстоит оценить в исследованиях. Необходимо помнить, что отрицательные результаты любого исследования методом лучевой визуализации не исключают наличие рака, в случае присутствия пальпируемого новообразования биопсия обязательна.
Хирургическое лечение
Хирургическое лечение пациенток с РМЖМ проводится по тем же принципам, что и у старших женщин, и включает радикальную мастэктомию (РМЭ) либо органосохраняющую операцию (ОСО). Хотя имеются данные о более высокой частоте рецидивов и более агрессивном фенотипе опухолей у пациенток молодого возраста, разницы в выживаемости у пациенток после РМЭ и ОСО не выявлено, также как и в случае выполнения дополнительной профилактической контрлатеральной мастэктомии при отсутствии повышенного мутационного риска [7, 8].
Показания к биопсии сторожевого лимфатического узла при РМЖМ не отличаются от таковых для остальных возрастных категорий. На сегодня нет данных, свидетельствующих о худшем исходе заболевания у молодых пациенток, подвергшихся биопсии сторожевого лимфатического узла.
Таким образом, молодой возраст не является противопоказанием к ОСО. Однако исследователи из США в последнее время отмечают увеличение числа выполняемых РМЭ, что связано с уверенностью врачей и пациенток в возможности таким образом улучшить исход заболевания и с совершенствованием техники реконструкции молочных желез [9].
Лучевая терапия
Лучевая терапия, проводимая после ОСО, снижает риск рецидива и улучшает выживаемость. Ее назначение обосновано более высоким абсолютным риском локального рецидива у молодых женщин, в связи с чем и польза от адъювантного облучения при РМЖМ выше.
При РМЖМ ранних стадий особенно важным является решение вопроса об объеме лечения. Ускоренное частичное облучение молочной железы (accelerated partial breast irradiation, APBI) не является опцией выбора для пациенток молодого возраста. Хотя результаты исследования NSABP B‑39, в котором сравнивали эффективность частичного облучения и облучения всей молочной железы, еще анализируются, в критериях отбора для APBI во всех ведущих руководствах указывается возраст 45-60 лет. Они основаны на опубликованных данных по применению APBI у пациенток старше 50 лет, повышенном риске мультицентричных и мультифокальных опухолей у молодых женщин, и установленном повышенном риске рецидива у пациенток молодого возраста, подвергшихся обучению всей молочной железы. Между тем, в исследование NSABP B‑39 включали пациенток в возрасте от 18 лет; окончательный анализ исходов болезни у них, вероятно, внесет ясность в этот вопрос.
Другим дискутабельным вопросом является целесообразность использования boost-методики и гипофракционирования. В исследовании European Organization for Research and Treatment of Cancer установлено, что применение boost-методики уменьшает 20-летнюю кумулятивную частоту ипсилатерального рецидива с 16,4 до 12% (относительный риск – ОР – 0,65; P<0,0001). Польза от такого облучения более выражена у молодых женщин. Уменьшение абсолютного риска составляло 4,4% во всей когорте и 11,6% у пациенток моложе 40 лет. Гипофракционирование на всю железу для отдельных категорий пациенток оказалось столь же эффективным, как и традиционные методики. Тем не менее, большая часть этих данных получена у больных старше 50 лет. Поэтому большинство профессиональных руководств рекомендуют для молодых женщин лучевую терапию на область всей молочной железы стандартным фракционировнием.
В рандомизированных исследованиях при местнораспространенном РМЖ выявлена эффективность послеоперационной лучевой терапии в отношении частоты рецидивов и выживаемости у пациенток с опухолями >5 см, инвазией кожи и грудной стенки, поражением лимфатических узлов [10]. Ретроспективный анализ 107 случаев РМЖ II и III стадий у пациенток моложе 35 лет, получавших лучевую терапию после мастэктомии, выявил улучшение 5-летних результатов локального контроля и общей выживаемости по сравнению с не получавшими облучения [11]. Поскольку молодой возраст и/или пременопаузальный статус являются факторами риска локорегионарного рецидива, именно молодые пациентки без поражения лимфатических узлов могут получить наибольшую пользу от послеоперационной лучевой терапии, если они имеют дополнительные факторы риска. Учитывая молодой возраст и ожидаемую высокую выживаемость, особое внимание во время планирования и проведения лучевой терапии следует обращать на минимизацию облучения соседних органов для снижения риска возникновения отдаленных побочных эффектов лучевой терапии и вторичных опухолей.
Химиотерапия
Подходы к выбору программ химиотерапии (ХТ) для всех пациенток с ранним РМЖ одинаковы независимо от их возраста. В целом у большинства пациенток с РМЖ высокого риска используют комбинированные схемы, включающие антрациклины и таксаны. В метаанализе Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) определено влияние адъювантной полихимиотерапии (ПХТ) на исход заболевания у молодых женщин по сравнению со старшими. Использование антрациклинсодержащих комбинаций способствовало большему снижению ежегодной смертности от РМЖ в группе женщин моложе 50 лет по сравнению с группой 50-69-летних (на 38 против 20%). Улучшение 5-летних результатов лечения при использовании ПХТ было приблизительно в 2 раза значительнее при гормононегативном раке по сравнению с гормонопозитивным, но 15-летние результаты меньше зависели от гормонального статуса опухоли, вероятно, из-за различий в сроках рецидивов при HR-негативном и HR‑позитивном РМЖ.
Анти-HER2+ терапия
Пациентки с РМЖМ должны получать анти-HER2+ препараты (трастузумаб, пертузумаб и др.) в (нео)адъювантном режиме на общих основаниях с учетом их эффективности в отношении безрецидивной и общей выживаемости.
Эндокринная терапия
Первое упоминание о эндокринной терапии (ЭТ) при РМЖ относится к 1896 г., когда в журнале The Lancet появилась статья «К лечению иноперабильных случав карциномы молочной железы: предложения нового лечебного метода с иллюстративными случаями». В ней хирург Эдинбургского опухолевого госпиталя Джордж Томас Битсон описал историю 33-летней женщины, обратившейся после удаления злокачественной опухоли молочной железы с рецидивом заболевания и диссеминацией по коже грудной клетки. Рецидивная опухоль была запущенной, и хирургическое вмешательство представлялось невозможным. Однако автор 15 июня 1895 г. прооперировал пациентку, удалив ей фаллопиевы трубы и яичники (операцию он назвал «оофорэктомия»). Через 8 месяцев результаты исследований показали, что проявления опухоли исчезли. В последующих публикациях сообщалось, что пациентка прожила 4 года после вмешательства. У двух других пациенток, прооперированных подобным образом, наблюдалось улучшение.
Таким образом, овариэктомия стала первым практически примененным методом ЭТ. Методы достижения выключения функции яичников со временем менялись; в настоящее время для обозначения хирургической или лучевой кастрации используют термин «овариальная абляция», а понятие «овариальная супрессия» соответствует фармакологической кастрации.
Следующий этап аблятивной ЭТ начался в 1971 г. с установлением исследовательскими группами Р. Гиймена и Э. Шалли химической структуры гипоталамического рилизинг-фактора лютеинизирующего гормона. Исследователям понадобились 165 тыс. гипоталамусов свиней, чтобы выделить химическую субстанцию в количестве, достаточном для определения ее формулы (800 мкг).
В 1971 г. Э. Шалли хотел синтезировать антагонисты рилизинг-фактора гонадотропного гормона (GnRH, ГнРГ), однако эти попытки потерпели неудачу. С этого момента усилия ученых были сконцентрированы на разработке пептидных молекул с более высокой биологической активностью. Целью этих исследовательских программ было получение потенциальных ГнРГ-агонистов для стимуляции функции гонад при лечении бесплодия.
С 1972 по 1979 г. группа Э. Шалли синтезировала более 300 аналогов ГнРГ, в том числе перспективные биодоступные и «долгоживущие» препараты с активностью в 100-200 раз более высокой, чем нативный пептид. Однако опыты у самцов крыс установили вместо ожидаемой стимуляции функции гонад парадоксальную реакцию – некоторое уменьшение массы предстательной железы и семенных пузырьков, хотя и менее выраженное, чем при хирургической кастрации. Такой эффект был результатом снижения стероидогенеза в яичках под влиянием высокого уровня лютеинизирующего гормона, индуцированного ГнРГ-агонистами. Еще более неожиданным оказалось то, что наибольший ингибирующий эффект ГнРГ-агонистов на андрогеногенез наблюдался именно у человека (по сравнению с крысами и приматами).
Разработка безопасного и высокоэффективного способа медикаментозной кастрации, имеющего незначительные побочные эффекты (в сравнении с эстрогенами и андрогенами), способствовала в 1980-е гг. возобновлению интереса к гормонотерапии рака предстательной и молочной желез, появлению большого количества клинических исследований. Был синтезирован целый ряд коммерчески перспективных ГнРГ-агонистов с приблизительно одинаковыми характеристиками. С существенными трудностями столкнулись фармакологи при разработке лекарственных форм ГнРГ-агонистов, доз, путей их введения, что в первую очередь было связано с коротким временем полувыведения препаратов. Успешно пройдя путь от ежедневного интраназального введения до ежемесячной подкожной инъекции, к 1990‑м гг. эта группа средств для конкурентной ЭТ заняла одно из ведущих мест в медикаментозном лечении гормонозависимого РМЖ [12].
ЭТ при метастатическом РМЖМ
Согласно одному из наиболее авторитетных руководств – IV международному консенсусному руководству по распространенному раку молочной железы Европейской школы онкологии и Европейского общества медицинской онкологии, – пациенткам в период пременопаузы с метастическим рецепторпозитивным РМЖ следует назначать овариальную абляцию/супрессию в комбинации с другими средствами ЭТ. При достижении искусственной менопаузы дальнейшая тактика ведения соответствует таковой у женщин в постменопаузе [14]. При этом предпочтительным вариантом является комбинация овариальной супресии и тамоксифена или ингибиторов ароматазы. Тамоксифен также можно использовать в монорежиме, хотя существуют данные о его большей эффективности в сочетании с овариальной супрессией.
Все клинически важные исследования по ЭТ метастатического РМЖ последних лет охватывали только пациенток в постменопаузе или тех, которые становились таковыми при включении в исследование. В настоящее время не существует клинически значимых исследований по лечению РМЖ у пациенток, остающихся в пременопаузе. Это, а также наличие доказательств эффективности овариальной супрессии/абляции в лечении пременопаузального РМЖ, стали основаниями для таких рекомендаций.
Особо оговаривается, что в лечении распространенного РМЖ предпочтение отдается применению ЭТ, даже при наличии висцеральных метастазов. ХТ рекомендуется в качестве резерва для случаев быстропрогрессирующего заболевания (т.е. при наличии висцерального криза – состояния, сопровождающегося серьезным нарушением функции внутреннего органа(ов), а не просто при висцеральных метастазах) или доказанной резистентности к ЭТ. Аналогичных подходов придерживаются эксперты Американского общества клинической онкологии (ASCO) и Национальной онкологической сети США (NCCN) [14, 15].
Вторым важным фактором для выбора метода паллиативной терапии является характер и длительность предшествующей ЭТ. Пациенткам в период пременопаузы, у которых развился метастатический РМЖ во время адъювантного лечения тамоксифеном или в течение 1 года после его окончания, следует назначать овариальную супрессию ингибиторами ароматазы (ИА).
Следует подчеркнуть, что женщинам в период пременопаузы ИА в монорежиме не назначают, даже при наличии у них аменореи, индуцированной химиотерапией. Такая аменорея может быть неполной и нестойкой (особенно у пациенток молодого возраста), ИА вследствие снижения концентрации эстрогенов могут активировать путем обратной связи гипоталамо-гипофизарно-яичниковую ось и вызвать повышение гонадной продукции эстрогенов. В таких случаях (а особенно в случаях появления прорывных маточных кровотечений) рекомендуется мониторинг овариальной функции измерением сывороточной концентрации фолликулостимулирующего гормона, эстрадиола, показателей овариального резерва. Подробно методология такого мониторинга изложена в наших предыдущих публикациях.
Адъювантная ЭТ
Согласно данным метаанализа EBCTCG, 5-летнее применение тамоксифена в адъювантном режиме снижает частоту рецидивов на 50% и погодичную смертность от РМЖ на треть у пациенток с гормонопозитивным раком. В исследованиях ATLAS (Adjuvant Tamoxifen: Longer Against Shorter) и aTTom (adjuvant Tamoxifen – To offer more?) продемонстрировано снижение частоты рецидивов и улучшение выживаемости при 10-летнем адъювантном применении тамоксифена. На основании результатов этих исследований в клиническом руководстве ASCO рекомендован тамоксифен в течение 10 лет у пациенток с гормонопозитивным РМЖ I-III стадии. Это относится и к РМЖМ, прогноз при котором хуже.
Женщины, у которых развилась индуцированная химиотерапией аменорея (ИХА), имеют лучший прогноз, чем пациентки, у которых сохранился менструальный цикл. Исследование NASBP B‑30 trial (National Surgical Adjuvant Breast and Bowel Project Protocol) проводилось с целью оценить эффективность 3 разных режимов адъювантной ХТ, содержавших доксорубицин, циклофосфамид и доцетаксел. Вторичной целью исследования было установить наличие корреляции между ИХА и выживаемостью у пациенток в период пременопаузы. Общая выживаемость значимо улучшалась у женщин с ИХА не менее 6 месяцев, независимо от вида ХТ, и, что было неожиданностью, – от гормонального статуса. Эти данные доказывают, что терапевтический эффект ХТ, во всяком случае, какая-то его часть, реализуется благодаря овариальной супресии. Тем не менее, как указывалось выше, у пациенток молодого возраста ХТ сама по себе не может быть надежным методом угнетения функции яичников.
Эффективная супрессия функции яичников стала возможна благодаря появлению синтетических аналогов ГнРГ, у которых в отличие от нативных декапептидов заменены аминокислоты в 6-м и 10-м положениях, что позволило снизить скорость ферментативного расщепления и повысить сродство к соответствующим рецепторам гипофиза.
Наибольшую распространенность приобрели депонированные формы – суспензия и капсулы. Активное действующее вещество в них заключено в биодеградирующую микросферу, обеспечивающую его постепенное поступление в организм. Постепенность выделения действующего вещества обусловливает необходимую продолжительность действия препарата. Преимуществом депонированной формы для внутримышечного или подкожного введения является абсолютно одинаковая интенсивность деградации микросфер в мышцах у всех пациентов, что позволяет говорить о стабильности концентрации действующего вещества в сыворотке крови.
Успешное использование овариальной супрессии (ОС) в лечении распространенного/метастатического РМЖ стало основанием для применения фармакологической кастрации в адъювантном лечении раннего РМЖ.
Анализ результатов 12 исследований, в которых участвовали 3500 пациенток, проведенный авторитетной EBCTCG, показал существенное улучшение 15-летней выживаемости (52 vs 46%; p=0,001) у женщин младше 50 лет, получавших овариальную абляцию, в сравнении с ее отсутствием. Это единственный результат EBCTCG, который оказался «недолговечным» [16]. В клиническом практическом руководстве ESMO по диагностике, лечению и наблюдению первичного РМЖ, изданном в 2011 г., было определено, что применение аналогов ГнРГ вызывает супрессию яичников, достаточную для терапевтического эффекта, такую же, как и овариоэктомия. Авторы руководства указывали, что аналоги ГнРГ следует назначать не менее чем на 2 года, хотя оптимальная длительность лечения не установлена. Комбинация ГнРГ и ИА у пациенток в период пременопаузы не показана вне рамок клинических исследований; наилучшие варианты использования ГнРГ (совместно или последовательно с ХТ) неизвестны. Сходное мнение по этому вопросу имели и эксперты ASCO.
Однако в 2011 г. в официальном журнале ASCO – Journal of Clinical Oncology – появилась публикация, после которой отношение к овариальной абляции (ОА) изменилось [17]. Фактической основой публикации явился отчет группы канадских онкологов в рамках исследовательской инициативы нескольких онкологических организаций (Program in Evidence-based Care, Cancer Care Ontario, Breast Cancer Disease Site Group). Три группы экспертов провели масштабное изучение опубликованных данных для оценки результатов использования ГнРГ в лечении РМЖ. Были проанализированы около 50 авторитетных публикаций, отобранных из более чем 700 реферированных в базах данных MEDLINE (с 1966 до 2009 гг.), EMBASE (1980-2009), библиотеки Кокрановского сообщества (до 2009 г.), материалы ряда американских и канадских профессиональных онкологических организаций [18].
Исследование должно было ответить на 2 вопроса.
1. Каким образом может ОА (ОС) в качестве системной терапии в адъювантном режиме улучшать клинически значимые исходы (безрецидивный период, общую выживаемость, качество жизни, токсичность) в сравнении и/или дополнении к другим видам системной терапии, особенно ХТ и тамоксифеном?
Для получения ответа были изучены всевозможные комбинации этих видов лечения: ОА в сравнении с отсутствием адъювантного лечения; ОА + ХТ против только ХТ и другие, в целом – 9 различных вариантов адъювантной терапии, результаты оценки применения которых были опубликованы. Выводы: рутинное добавление ОА к системной ПХТ, тамоксифену или их сочетанию не рекомендуется.
ОА самостоятельно не рекомендуется как альтернатива любой другой форме системной терапии, кроме специфических случаев, когда пациентки, которым такая системная терапия показана, не могут ее получать по каким-либо причинам (например, из-за непереносимости или желания получать альтернативные варианты системной терапии).
В исследованиях показано, что ОА в адъювантном режиме по эффективности сопоставима с программами CMF и FE50C. Побочные эффекты ОА/ОС нередко переносятся пациентками хуже, чем относительно нетоксичная программа CMF. Однако у женщин, желающих сохранить репродуктивную функцию, применение ОС может быть предпочтительней (обратимость супрессивного эффекта и отсутствие токсического воздействия на пул яйцеклеток в сравнении с ХТ).
2. Какой способ абляции или супресии овариальной функции является лучшим: хирургическая овариэктомия, облучение яичников или фармакологическая супрессия?
Результаты метаанализа свидетельствуют, что метод ОС не влияет на сроки наступления рецидива и смертность. Таким образом, при выборе метода ОА/ОС следует учитывать иные факторы, включая пожелания пациентки и стоимость лечения.
Американская коллегия акушеров и гинекологов, оценивая показания к сальпингоовариэктомии, указывает на ее целесообразность у больных РМЖ с высоким риском рака яичника. В первую очередь, это пациентки с мутациями генов BRCA1 и BRCA2, риск развития рака яичников у которых составляет 20-50%, а билатерального РМЖ – 40-60% [19].
В связи с нерешенными вопросами значения ОА/ОС в адъювантной терапии РМЖ International Breast Cancer Study Group (IBCSG) в 2003 году инициировала 3 многоцентровых рандомизированных исследования по оценке эффективности ОС, ХТ и ИА в адъювантном режиме в пременопаузе на ранних стадиях. Одно из них – PERCHE (Premenopausal Endocrine Responsive Chemotherapy Trial) – было остановлено из-за низкого набора пациенток.
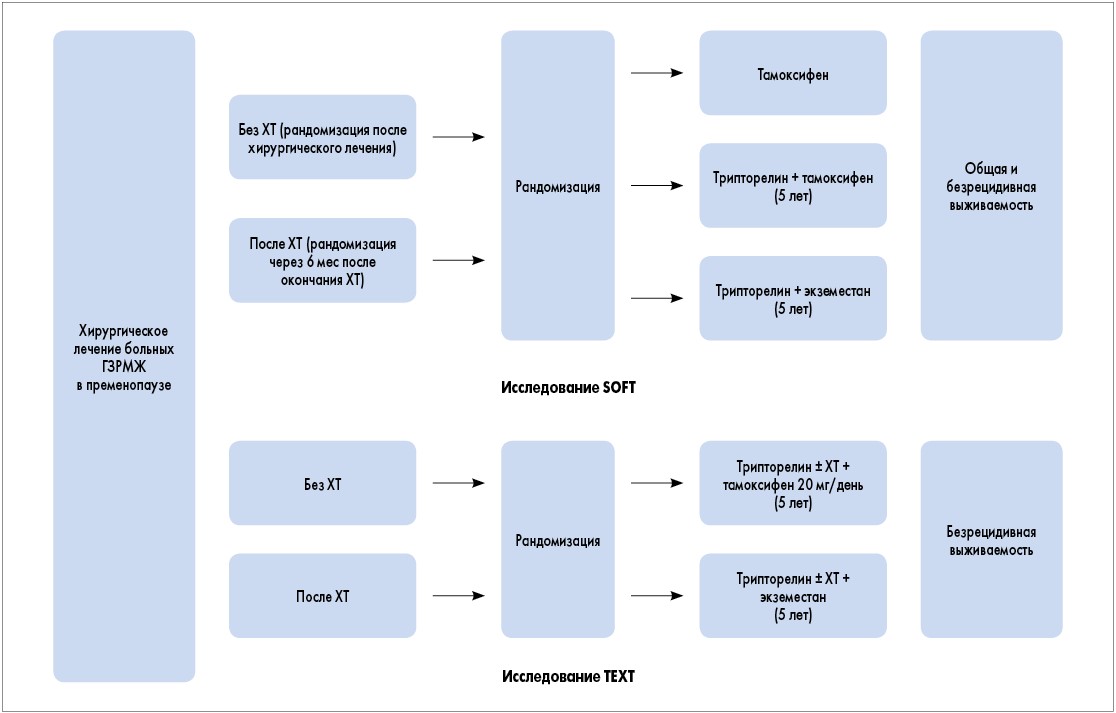
Исследования SOFT (Suppresion of Ovarian Function Trial) и TEXT (Tamoxifen and Exemestan Trial) – это рандомизированные клинические исcледования III фазы. С ноября 2003 по апрель 2011 года в них были включены соответственно 2672 и 3066 женщин в пременопаузе с ранним ГР+ РМЖ; суммарно 4690 пациенток были рандомизированы. Для подавления функции яичников использовали ежемесячные инъекции трипторелина в течение 5 лет (наиболее распространенный выбор), хирургическую или лучевую абляцию. В обоих исследованиях около 55% включенных пациенток получали адъювантную ХТ, которая назначалась и проводилась до рандомизации в соответствии с общепринятыми клинико-морфологическими факторами риска. Дизайн исследований представлен на рис. 2.
Рис. 2. Дизайн исследований SOFT и TEXT
В 2017 г. на конференции в Сан-Антонио были сообщены последние результаты исследования SOFT. Безрецидивная 8-летняя выживаемость в группе пациенток до 35 лет, получавших тамоксифен, составила 78,9%; тамоксифен + ОС – 83,2%; экземестан + ОС – 85,9% [20]. Сочетание ОС и тамоксифена по сравнению с монотерапией тамоксифеном продемонстрировало улучшение безрецидивной выживаемости – первичной конечной точки исследования (р=0,009) – и общей выживаемости (ОР 0,59; 95% доверительный интервал – ДИ – 0,42-0,84). Между тем, сочетание экземестана и ОС значимо не улучшало общую выживаемость по сравнению с тамоксифеном (ОР 0,79; 95% ДИ 0,57-1,09).
Частота развития отдаленных метастазов является важной конечной точкой исследований, в которых изучают адъювантные режимы лечения РМЖ, а также предиктор общей выживаемости. Однако в исследовании SOFT обнаружено расхождение между частотой отдаленных метастазов и общей выживаемостью в группе экземестана + ОС по сравнению с группой тамоксифена + ОС. В ходе 8-летнего наблюдения обнаружено, что хотя число отдаленных метастазов было меньше при использовании экземестана + ОС, чем тамоксифена + ОС, но большее количество смертей от РМЖ было отмечено в 1-й группе. Это заставляет с осторожностью рассматривать отдаленные метастазы в качестве прогностического фактора. Наоборот, применение тамоксифена + ОС имело большее влияние на общую выживаемость, чем на развитие отдаленных метастазов. Подобного рода расхождения нечасто наблюдаются при использовании тамоксифена (например, в метаанализе EBCTCG), хотя и встречались при адъювантной ХТ, например, капецитабином [21]. Такие противоречивые результаты в отношении частоты отдаленного метастазирования и общей выживаемости в двух группах пациенток в исследовании SOFT являются неожиданными, и факторы, их вызывающие, пока не установлены. Очевидно, объяснение следует искать в факторах, влияющих на смертность от РМЖ, поскольку только 9 из 225 смертей участниц исследования были вызваны другими причинами. Высказываются гипотезы, что прерывыстая супрессия эстрогенами, а также увеличение андрогенных прекурсоров под воздействием ИА может приводить к появлению более агрессивных рецидивных опухолей [22]. В фрагменте исследования SOFT (SOFT Estrogen Substudy) изучалась полнота и длительность супрессии овариальной функции. У 116 пациенток определяли содержание гормонов репродуктивной панели высокочувствительным и специфичным методом. В качестве целевого уровня была принята средняя концентрация эстрадиола у женщин в постменопаузе, получавших ИА. Хотя и было зарегистрировано существенное снижение концентрации гормонов, уровень эстрадиола выше порогового значения 2,72 пг/мл имели 17-25% пациенток при каждом измерении в течение 12 месяцев. Клиническое значение этих данных пока не установлено, но потенциально они могут быть свидетельством снижения эффекта ИА, если учесть, что их клиническая эффективность в пременопаузе зависит от полноты эстрогеновой супрессии.
В итоге первичный анализ данных исследования SOFT свидетельствует, что добавление ОС к тамоксифену по сравнению с монотерапией тамоксифеном значимо улучшает безрецидивную выживаемость (первичная конечная точка исследования), так же как и общую выживаемость (вторичная конечная точка). В то же время сочетание экземестана с ОС не улучшало общую выживаемость по сравнению с монотерапией тамоксифеном. Показано также, что не все пациентки достигают адекватной ОС, применяя существующие фармакологические средства. Эффект лечения наиболее выражен у пациенток, получавших адъювантную ХТ.
В 2018 г. на ежегодном съезде ASCO, состоявшемся в Чикаго, были обнародованы данные объединенного анализа 4096 пациенток, участвовавших в исследованиях SOFT/TEXT. Степень различий между изученными режимами ЭТ значительно зависела от исходного риска развития рецидива. При разделении на группы в зависимости от исходного риска отдаленного рецидива учитывали возраст (с интервалом 5 лет), количество пораженных регионарных лимфатических узлов (0; 1-3; ≥4), размер первичной опухоли (≤2 см; >2 см), экспрессию рецепторов эстрогенов, получение адъювантной ХТ. У больных с высоким риском применение экземестана на фоне ОС по сравнению с тамоксифеном + ОС или тамоксифеном в монотерапии увеличивало 8-летнюю выживаемость без отдаленных рецидивов на 10-15%. У пациенток промежуточного риска, большинство из которых получали адъювантную ХТ, различия составили 4-5%. У больных с низким риском рецидива потенциальный эффект добавления ОС по сравнению с монотерапией может быть минимальным, так как даже в группе монотерапии тамоксифеном 8-летняя выживаемость без отдаленных рецидивов превысила 97% [23].
В обнародованном на форуме ASCO‑2018 рандомизированном клиническом исследовании III фазы ASTRRA оценена роль добавления ОС к адъювантной терапии тамоксифеном у молодых женщин с ГР+ РМЖ и индуцированной адъювантной ХТ пременопаузой или восстановленной менструальной функцией. В отличие от предыдущих исследований SOFT и TEXT, в программу ASTRRA включали только пациенток после адъювантной ХТ (т.е. с высоким риском рецидива); 1293 пациентки были рандомизированы, 1282 получали лечение по протоколу. Тамоксифен назначали на 5 лет, в экспериментальной группе добавляли ОС в течение первых 2 лет терапии (это более короткая продолжительность ОС по сравнению с исследованиями SOFT и TEXT, в которых ОС проводилась в течение всех 5 лет лечения). При медиане наблюдения 63 месяца 5-летняя безрецидивная выживаемость составила 91,1% в группе тамоксифена + ОС и 87,5% в группе монотерапии тамоксифеном (ОР 0,686; 95% ДИ 0,483-0,972; р=0,029); 5-летняя общая выживаемость составила 99,4% в группе тамоксифена + ОС и 97,8% в группе монотерапии тамоксифеном (ОР 0,310; 95% ДИ 0,102-0,941; р=0,029). Исследователи пришли к выводу, что добавление ОС к тамоксифену достоверно увеличивает 5-летнюю безрецидивную и общую выживаемость [21].
Использование ГнРГ предотвращает развитие индуцированной ХТ овариальной недостаточности (данные исследований POEMS и TEXT).
Важным вопросом является последовательность использования ОС в адъювантном режиме: одновременно с ХТ или после ее окончания. На IV конференции по РМЖМ, состоявшейся в 2018 г., были доложены результаты лечения при РМЖМ в рамках этих двух режимов, оказавшиеся идентичными. Практическое значение этих данных для молодых женщин сложно переоценить, учитывая роль аналогов ГнРГ в достижении ОС с целью предотвращения токсического действия ХТ на овариальный резерв и профилактики нарушения фертильности.
В 2018 г. были опубликованы результаты рандомизированного исследования III фазы TAILORx (Trial Assigning Individualized Options for Treatment), оценивавшего адъювантную ХТ и ЭТ по сравнению с одной ЭТ у пациенток с гормонозависимым HER2-негативным РМЖ без метастазов в лимфатических узлах (N0) и промежуточным прогнозом по данным анализа 21 гена (тест OncoType Dx). Из 10 273 женщин, включенных в исследование, к его концу под наблюдением находились 9719 пациенток, среди которых 6711 (69%) имели промежуточные результаты OncoType Dx (от 11 до 25) и были случайным образом распределены на 2 указанные выше группы.
Результаты показали, что эффективность ЭТ нисколько не уступает таковой комбинированного лечения. В течение 9 лет в обеих группах больных наблюдались примерно одинаковые показатели:
- выживаемости без прогрессирования (83,3% в группе ЭТ и 84,3% в группе ХТ + ЭТ);
- отсутствия локорегионарного рецидивирования (92,2 против 92,9%);
- отдаленного метастазирования (94,5 против 95,0%).
Удалось выделить когорту больных, которым, скорее всего, нужна профилактическая ХТ. Это женщины моложе 50 лет с риском развития рецидива 16-25 баллов по данным OncoType Dx (р=0,004). Если сумма баллов составляла 16-20, риск отдаленного рецидива у таких пациенток при проведении ХТ был ниже на 2%, если 21‑25 баллов – ниже на 7% [25].
Один из авторов исследования, J.A. Sparano, представляя его результаты на ежегодной конференции ASCO в 2018 г., заключил, что около 70% женщин с гормонозависимым HER2-негативным РМЖ без метастазов в лимфатических узлах могут избежать адъювантной ХТ, ограничившись только ЭТ.
Резюмируя вышесказанное, можно заключить, что область применения ОА/ОС в качестве адъювантной терапии больных в пременопаузе с гормоночувствительным РМЖ ограничивается следующими клиническими ситуациями:
- пациентке показана адъювантная ПХТ, но по ряду причин она не может быть проведена (индивидуальная непереносимость отдельных препаратов, нежелание пациентки);
- желание пациентки сохранить репродуктивную функцию и избежать токсического воздействия ХТ на яичники независимо от рецепторного статуса опухоли (т.е. включая и гормононегативные варианты; вне протоколов донации и криоконсервации яйцеклеток);
- наличие высокого риска развития рака яичника, прежде всего, мутаций BRCA1 и BRCA2, у пациентки-кандидатки на хирургическую овариэктомию;
- высокий риск рецидива опухоли: возраст моложе 35 лет, пременопаузальный статус после ХТ и прочие факторы риска.
К таким факторам эксперты Сент-Галленского консенсуса в 2015 г. добавили также поражение 4 и более лимфатических узлов, низкую степень дифференциации опухоли (G3), повышенный риск рецидива по данным мультигенного анализа [26]. Эта позиция была подтверждена и на Сент-Галленском консенсусе 2017 г. Необходимо отметить, что она поддерживается не всеми онкологами, например, 14 немецких специалистов по РМЖ – членов Arbeitsgemeinschaft Gynaekologische Onkologie (AGO; из них трое – участники Сент-Галленской панели) указывают на отсутствие доказательной базы для такого рода рекомендаций [27].
Во всех остальных случаях проведение ОА/ОС не влияет на результаты лечения (но повышает его стоимость и привносит новые побочные эффекты, ухудшающие качество жизни), и, следовательно, не рекомендуется. Указанные данные нашли отражение в рекомендациях ESMO по лечению первичного РМЖ, опубликованных в 2015 г. [28].
Таким образом, четкое определение показаний к ОА/ОС позволяет оптимизировать лечение, избежать неоправданных побочных эффектов и финансовых затрат.
Неоадъювантная ЭТ
Неоадъювантная ЭТ не является на сегодняшний день общепринятым стандартом лечения. Только некоторые руководства рассматривают ее как опцию у пожилых пациенток с сопутствующей патологией.
Потенциальная польза от неоадъювантной ЭТ обусловлена следующими факторами:
- люминальный РМЖ менее чувствителен к ХТ. По имеющимся на сегодня данным клинических исследований, эффективность неоадъювантной ЭТ не меньше, чем ХТ;
- ЭТ характеризуется лучшей переносимостью, меньшей токсичностью и не требует госпитализации. Это обусловливает и меньшую стоимость курса лечения;
- ЭТ считается методом выбора при лечении гормоночувствительного распространенного РМЖ (кроме случаев наличия висцерального криза).
В небольшом по объему исследовании STAGE, проведенном в Японии, у пациенток в пременопаузе показана эффективность в неоадъювантном режиме гозерелина в сочетании с анастрозолом и тамоксифеном (с уровнем ответа на лечение 70,4 и 50,5% соответственно). В настоящее время продолжаются исследования сочетания ОС, ИА, таргетной терапии и блокаторов контрольных точек [29].
Длительность неоадъювантной ЭТ должна составлять не менее 4-6 месяцев, пролонгированной неоадъювантной ЭТ – до достижения максимального ответа или размера опухоли, позволяющего выполнить ОСО. Неизвестна польза от пролонгации неоадъювантной ЭТ более 12 месяцев, теоретически существует риск развития резистентности. В исследованиях частота прогрессирования заболевания на фоне неоадъювантной ЭТ была невелика – 0,8-12,0%.
Прогноз
В последние годы наблюдается тенденция к увеличению частоты диагностики у женщин в возрасте 25-39 лет метастатического РМЖ (с 1,53 до 2,90 на 100 тыс. населения в 1976 и 2009 гг. соответственно). Это увеличение особенно актуально, поскольку молодой возраст является независимым неблагоприятным фактором плохого прогноза РМЖ [30].
Клинический исход ухудшается у очень молодых женщин в возрасте до 35 лет, причем риск смерти повышается с каждым уменьшением возраста на 1 год [31]. Также очевидно, что влияние возраста на исход заболевания изменяется в зависимости от подтипа РМЖ. В исследовании Sheridan и соавт. (2014) показано, что при HR-позитивном подтипе пациентки молодого возраста имели худший прогноз, чем старшие [32]. Это также было подтверждено в исследовании Azim и соавт. (2012), в котором была зафиксирована низкая безрецидивная выживаемость у молодых пациенток при HR-позитивном/HER2-негативном подтипах [3].
Выводы
РМЖМ имеет ряд особенностей. К ним относятся:
- большая частота неблагоприятных молекулярных вариантов, более высокая стадия к моменту диагностики, и, соответственно, худший исход по сравнению с пациентками старших возрастных групп;
- частота мутаций BRCA1 и BRCA2 (иногда и ТР53) при РМЖМ выше. Различие в факторах риска и генных сигнатурах при РМЖМ позволяет выделить его в отдельную группу. Лучевая, прежде всего маммографическая, диагностика РМЖМ затруднена;
- подходы к лечению РМЖМ соответствуют таковым у пациенток других возрастных групп. В III международном консенсусе ESO-ESMO по РМЖМ (BCY3) указано, что стратегии лечения как раннего, так и распространенного РМЖМ должны основываться на тех же критериях, что и у старших пациенток (характеристики: HR, HER2/neu, стадия заболевания и индекс пролиферации, сопутствующие заболевания и предпочтения пациентки). Многие молодые женщины могут подвергаться «перелечиванию» исключительно по возрастным соображениям;
- особое внимание при планировании лечения РМЖ у молодых женщин должно уделяться сохранению фертильности;
- аблятивная ЭТ и ОС могут приводить к уменьшению минеральной плотности костей, и с целью профилактики остеопороза и предотвращения продолжения болезни возможно применение бисфосфонатов в адъювантном режиме;
- пациентки молодого возраста имеют высокий риск психологического дистресса и требуют психологической помощи.
Список литературы находится в редакции.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 4 (60), 2019 р.