5 лютого, 2020
Біосиміляри: нові можливості в онкогематології
Біологічні препарати, зокрема біосиміляри, змінюють системи охорони здоров’я, покращують якість і подовжують тривалість життя мільйонів пацієнтів у всьому світі. 9-11 жовтня у Києві за підтримки Національного інституту раку, Асоціації онкогематологів України та Всеукраїнської громадської організації «Асоціація допомоги інвалідам та пацієнтам із хронічними лімфопроліферативними захворюваннями» відбулася XI Науково‑практична конференція з міжнародною участю «Діагностика та лікування лімфопроліферативних захворювань». У рамках заходу за сприяння фармацевтичної компанії SANDOZ (підрозділ Novartis) пройшов симпозіум, на якому обговорювалися нові можливості застосування біосимілярів в онкології.
 Медичний радник фармацевтичної компанії SANDOZ Юлія Філіпенко зазначила, що високі витрати на біологічні препарати створюють проблему доступності лікування в усьому світі. Наприклад, понад чверть із 46 країн Європейського Союзу (ЄС) не має достатнього забезпечення доступу до біологічних препаратів для лікування ревматоїдного артриту. У Франції, Німеччині та Великій Британії біологічну терапію отримують лише 10-30% пацієнтів із ревматоїдним артритом. У Канаді та країнах ЄС 19‑24% дерматологів відзначають, що вартість біологічної терапії є основним бар’єром для призначення цих препаратів при псоріазі. При цьому доступ до лікування біологічними препаратами корелює з рівнем економічного розвитку країни: що нижчий показник ВВП на душу населення, то менш доступними є біологічні препарати.
Медичний радник фармацевтичної компанії SANDOZ Юлія Філіпенко зазначила, що високі витрати на біологічні препарати створюють проблему доступності лікування в усьому світі. Наприклад, понад чверть із 46 країн Європейського Союзу (ЄС) не має достатнього забезпечення доступу до біологічних препаратів для лікування ревматоїдного артриту. У Франції, Німеччині та Великій Британії біологічну терапію отримують лише 10-30% пацієнтів із ревматоїдним артритом. У Канаді та країнах ЄС 19‑24% дерматологів відзначають, що вартість біологічної терапії є основним бар’єром для призначення цих препаратів при псоріазі. При цьому доступ до лікування біологічними препаратами корелює з рівнем економічного розвитку країни: що нижчий показник ВВП на душу населення, то менш доступними є біологічні препарати.
Знизити зростання витрат на біологічну терапію допоможе застосування біосимілярів. Завдяки використанню останніх «західні» бюджети на охорону здоров’я до 2025 року можуть зекономити близько 50% коштів, необхідних на біологічні препарати. Розглядаючи нові варіанти лікування як результат наукових досягнень, Європейська комісія зазначає, що присутність біосимілярів на фармацевтичному ринку підвищує конкуренцію, це сприяє поліпшенню доступності біологічної терапії для пацієнтів та зниженню витрат для системи охорони здоров’я ЄС.
Біологічні препарати відрізняються від малих молекул складністю своєї структури, процесом виробництва та виведення на фармацевтичний ринок. Такі лікарські засоби синтезуються живими організмами, що передбачає складний технологічний процес. Останній включає модифікацію клітини хазяїна (наприклад, бактерії, дріжджі, ссавці) для продукції рекомбінантного протеїну, вирощування клітин у контрольованих умовах, екстракцію та очищення (отримання активної речовини) та вироблення стабільної лікарської форми. Живий організм як біологічна система має природну варіабельність, тому будь-якому біологічному продукту властива незначна мінливість, що спостерігається між різними партіями однієї й тієї ж речовини. Важливо, що ця мінливість суворо контролюється регуляторними органами і повинна залишатися у встановленому діапазоні.
Біосиміляр – це біологічний препарат із зіставними з референтним препаратом якістю, ефективністю та безпекою. Лікар і пацієнт можуть очікувати однакового профілю безпеки та ефективності застосування біосиміляра та референтного препарату згідно із затвердженими показаннями. Термін «біосиміляр» вживають стосовно біологічного препарату, який було схвалено згідно з суворими регуляторними принципами ЄС та США. Біосиміляри можуть бути схвалені Управлінням з контролю якості харчових продуктів і лікарських препаратів США лише в тому випадку, якщо немає клінічно значимих відмінностей від референтного продукту щодо якості, безпеки та ефективності. Європейське агентство з лікарських засобів схвалює застосування біосиміляра за умови встановлення подібності до референтного препарату за якісними характеристиками, біологічною активністю, безпекою та ефективністю на підставі комплексної практики порівняння відповідно до вимог Директиви 2001/83/ЄС.
Підхід, застосований до розроблення біосимілярів, ближчий до розроблення оригінального біологічного препарату, ніж до генеричного, як за вартістю, так і за вимогами щодо проведення доклінічних і клінічних досліджень для встановлення подібності.
Підтвердження біологічної подібності полягає у встановленні подібності аналітичними методами (ідентична послідовність амінокислот, високоподібна структура вищого порядку – фолдинг, однакова лінія клітин, високоподібний аналітичний профіль, однакова біологічна функція та відповідні механізми дії), клінічному підтвердженні біологічної подібності (еквівалентні фармакокінетика й фармакодинаміка; порівнянні клінічна ефективність, безпека та імуногенність за чутливими показаннями; однакові режим дозування, лікарська форма та шлях введення) та екстраполяції показань на підставі сукупності даних. При цьому встановлення аналітичної подібності є обов’язковим і не може бути замінене клінічним дослідженням.
Центральною частиною розроблення біосиміляра є оцінювання імуногенності, метою якого є виключення клінічно значимих відмінностей від референтного препарату. Вимоги до дизайну клінічних досліджень ІІІ фази з вивчення біосиміляра є не менш суворими, ніж оригінального лікарського засобу. Популяція пацієнтів у дослідженні має бути збалансована за клінічними та демографічними показниками (однорідна) та чутлива до лікування. Показання, за якими планується дослідження клінічної еквівалентності біосиміляра, мають бути найбільш актуальними для популяції пацієнтів та режиму лікування, за якого найімовірніше можуть виникнути імунні реакції – чутливі показання. Екстраполяція показань потребує наукового обґрунтування і розглядається регуляторними органами у кожному конкретному випадку.
Піонером і світовим лідером із розроблення біосимілярів є компанія SANDOZ (підрозділ Novartis). У 1996 р. SANDOZ запровадила першу у світі програму розроблення біосимілярів і за 10 років отримала європейське схвалення свого першого біосиміляра – рекомбінантного людського гормону росту. У 2015 р. другий біологічний аналог, рекомбінантний людський гранулоцитарно-макрофагальний колонієстимулюючий фактор, став першим біосиміляром, схваленим у США. Сьогодні біосиміляри SANDOZ використовують більш ніж у 75 країнах світу, а сукупний досвід їх застосування налічує понад 250 пацієнто-днів.
 Завідувачка науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку, доктор медичних наук, професор Ірина Анатоліївна Крячок розповіла про розроблення компанією SANDOZ препарату Риксатон – біосиміляра ритуксимабу.
Завідувачка науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку, доктор медичних наук, професор Ірина Анатоліївна Крячок розповіла про розроблення компанією SANDOZ препарату Риксатон – біосиміляра ритуксимабу.
– Питання біосимілярів є сьогодні надзвичайно актуальним, зокрема в онкології, на яку витрачаються найбільші кошти галузі охорони здоров’я. На нещодавньому конгресі Європейського товариства медичної онкології (ESMO) значну увагу приділяли саме біосимілярам.
Певний досвід із застосування біологічно подібних продуктів в Україні допоміг зрозуміти, що генеричний препарат і біосиміляр – дві різні речі. Генерик набагато простіше відтворити, натомість розроблення і виробництво біосиміляра є високотехнологічними і складними процесами.
Щоб бути представленим на ринку і застосовуватися для лікування пацієнтів за схваленими показаннями, біосиміляр має пройти декілька етапів доклінічної та клінічної розробки, починаючи із зіставлення структур первинного й вищого порядку, досліджень in vitro та in vivo, дослідів на моделях у тварин і закінчуючи клінічними дослідженнями І-ІІІ фази. Демонстрація біологічної еквівалентності ґрунтується на відповідності біосиміляра референтному препарату за якістю, ефективністю та безпекою. Ця еквівалентність може бути доведена тільки за принципом сукупності доказів, тобто препарат має бути подібним референтному продукту на кожному етапі.
Біосиміляр ритуксимабу Риксатон продемонстрував відповідність референтному препарату за фізико-хімічними характеристиками (амінокислотна послідовність, 3D-структура, глікановий профіль, структура вищого порядку й теплостійкість), доклінічними профілями фармакокінетики й фармакодинаміки (AUC, Cmax, виснаження В-клітин).
Програма клінічного розроблення препарату Риксатон також включала два дослідження в онкології. У дослідженні I фази GP13-101 JP оцінювали безпеку та фармакокінетику монотерапії біосиміляром Риксатон (призначення 1 раз на тиждень) у пацієнтів із фолікулярною лімфомою.
У міжнародному подвійному сліпому рандомізованому дослідженні ІІІ фази ASSIST-FL раніше не ліковані дорослі пацієнти з фолікулярною лімфомою пізньої стадії (ІІІ або IV за Енн-Арбор) отримували 8 циклів CVP (циклофосфамід, вінкристин, преднізолон) у комбінації з препаратом Риксатон або референтним ритуксимабом з подальшою підтримувальною монотерапією у пацієнтів із відповіддю протягом 2-річного періоду.
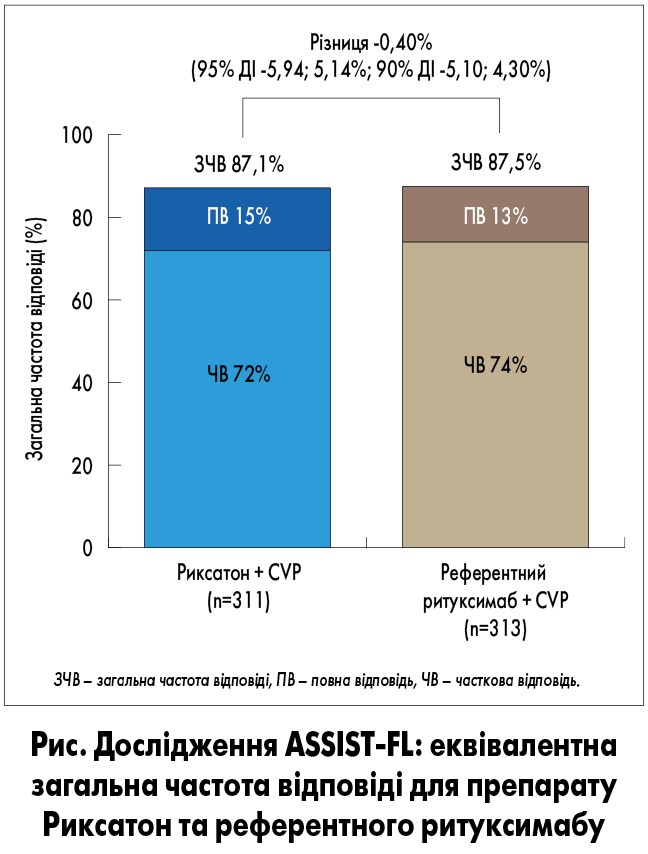 У цьому дослідженні досягнута первинна кінцева точка: загальна частота відповіді була еквівалентною для препарату Риксатон та референтного ритуксимабу (рис.). Різниця за цим показником становила -0,4%, що відповідає попередньо встановленому діапазону еквівалентності. Частота та ступінь тяжкості усіх небажаних подій (НП), серйозних НП та НП, які становили особливий інтерес (зокрема інфузійних реакцій), результати клінічних лабораторних досліджень і життєві показники були аналогічними у двох групах терапії, нових НП, зумовлених прийомом біосиміляра Риксатон, не виявлено. Імуногенність була низькою в обох групах без відмінностей у частоті виникнення нейтралізуючих антитіл при застосуванні препарату Риксатон та референтного засобу.
У цьому дослідженні досягнута первинна кінцева точка: загальна частота відповіді була еквівалентною для препарату Риксатон та референтного ритуксимабу (рис.). Різниця за цим показником становила -0,4%, що відповідає попередньо встановленому діапазону еквівалентності. Частота та ступінь тяжкості усіх небажаних подій (НП), серйозних НП та НП, які становили особливий інтерес (зокрема інфузійних реакцій), результати клінічних лабораторних досліджень і життєві показники були аналогічними у двох групах терапії, нових НП, зумовлених прийомом біосиміляра Риксатон, не виявлено. Імуногенність була низькою в обох групах без відмінностей у частоті виникнення нейтралізуючих антитіл при застосуванні препарату Риксатон та референтного засобу.
Таким чином, результати цього дослідження підтверджують терапевтичну еквівалентність біосиміляра ритуксимабу та референтного ритуксимабу. Розроблення та впровадження біосимілярів, які є подібними за структурою, ефективністю, безпекою та імуногенністю до референтного препарату, дозволяє розширити доступ пацієнтів до біологічної терапії.
Підготувала Руслана Вінницька
4-5-РИК-ОНК-12-19
Інформація для спеціалістів сфери охорони здоров’я
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 4 (60), 2019 р.


