28 березня, 2020
Виразковий коліт і діти – складні питання діагностики та лікування
 Однією з актуальних медико-соціальних проблем дитячої гастроентерології були і залишаються запальні захворювання кишечнику, серед яких виразковий коліт і хвороба Крона є найбільш значущими насамперед через відсутність даних щодо етіології захворювань. Виразковий коліт (ВК) – дифузне запальне захворювання товстої кишки, при якому первинно ушкоджується слизова оболонка прямої кишки з подальшим поширенням процесу у проксимальному напрямку.
Однією з актуальних медико-соціальних проблем дитячої гастроентерології були і залишаються запальні захворювання кишечнику, серед яких виразковий коліт і хвороба Крона є найбільш значущими насамперед через відсутність даних щодо етіології захворювань. Виразковий коліт (ВК) – дифузне запальне захворювання товстої кишки, при якому первинно ушкоджується слизова оболонка прямої кишки з подальшим поширенням процесу у проксимальному напрямку.
ВК виявляють у дітей всіх вікових груп, тобто його перебіг припадає на ті періоди, коли відбувається диференціювання будови внутрішніх органів, формуються поведінкові, інтелектуальні та психологічні особливості дитини, відбувається значна перебудова ендокринної системи організму. Виходячи з наведеного, стає зрозумілим залучення у патологічний процес багатьох систем і органів дитини, що істотно обтяжує перебіг самого ВК і чинить негативний вплив на ефективність його лікування.
Перші описи ВК із зіставленням клінічних проявів захворювання і даних аутопсій наведені K. Rokitansky та S. Wilks (1859). Великий внесок у вивчення ВК зробили Г.А. Алексєєв (1927), A.B. Chron (1925) й особливо Zochart-Mummery (1905), який вперше подав прижиттєвий опис структурних змін товстої кишки на підставі ректросигмоскопії, а також E. Stierlin і R. Kienbock (1913), котрі описали рентгенологічну картину ВК. ВК у дітей вперше охарактеризував H.F. Helmholtz у 1923 р. В Україні фундатором вчення про ВК у дітей стала наша вчителька – академік О.М. Лук’янова.
Захворюваність на ВК у дорослих в усьому світі з кожним роком зростає. Поширеність ВК становить 50-230 випадків на 100 тис. населення, вона вища в північних широтах і у Західній Європі. Щорічний приріст хворих на ВК у світі – 5-20 випадків на 100 тис. населення. Останнім часом у деяких країнах відмічена тенденція до збільшення захворюваності на ВК і в дитячому віці. Захворюваність на ВК дітей у Північній Америці та Європі коливається від 1 до 4 випадків на 100 тис. жителів, що становить приблизно 15-20% від хворих на ВК різного віку.
За сучасними уявленнями ВК розглядається як багатофакторне захворювання, у формуванні якого провідну роль відіграють генетична схильність, дефекти вродженого й адаптаційного імунітету, порушення бар’єрної функції кишечнику, склад мікробіоти, а також фактори навколишнього середовища.
Етіологічні фактори. Досі не встановлено етіологічні фактори, які викликають розвиток ВК. У генезі захворювання обговорювалася роль різних інфекційних агентів. Так, під час епідеміологічних досліджень у Великій Британії виявлено, що епідемічний паротит, перенесений у віці до 2 років, статистично достовірно пов’язаний з більшою частотою пізнішої захворюваності на ВК. Дослідження в Північній Кароліні (США) продемонстрували аналогічні результати: отримана залежність імовірності розвитку ВК від загальної частоти перенесених цими хворими дитячих інфекцій. Вплив різних мікроорганізмів можна розглядати як тригер, що призводить до спотвореної імунної відповіді організму.
Генетичні фактори. Роль генетичних чинників у формуванні ВК визначена на підставі відомих даних про сімейні випадки цієї патології, підтверджених епідеміологічними дослідженнями. Показано, що відносний ризик розвитку ВК у дітей із сімей, де хоча б один із батьків має це захворювання, в 10-15 разів вищий, ніж у загальній популяції.
Є всі підстави вважати, що типи класів HLA І і ІІ фенотипічно визначають ВК – його поширеність, позакишкові прояви, відповідь на проведену терапію та ін. Так, встановлено, що у пацієнтів з алеллю HLA DRB1*0103 діагностуються тяжкі форми захворювання з позакишковими проявами і високим ризиком хірургічного лікування, артропатії 1 типу асоціюються з HLAB*27 і HLAB*35, а 2 типу – з HLAB*44 і MICA*008. Визначено гени, які відповідають за розвиток остеопорозу (IL-b, IL-1ra), за цілість слизової оболонки (CDH1, ECM1) та імунну відповідь (IL-10, NKX 2-3 та ін.).
Більшість клінічних варіантів хвороби пов’язують з генами, що опосередковують імунну відповідь, розпізнавання бактерій, їх процесинг і буферну функцію епітелію. Зокрема, продемонстровано, що варіації генів NOD2, ATG1, IRGM зумовлюють аномалії в розпізнаванні бактерій або їх процесингу, що в свою чергу визначає неадекватність відповіді імунної системи кишечнику і формування в ньому запального процесу.
Кишковий бар’єр. Зростання обсягу інформації щодо патофізіології запальних захворювань кишечнику свідчить про важливу роль у їх розвитку підвищеної кишкової проникності. Відстоюється точка зору про те, що резистентність слизового бар’єра кишечнику, який забезпечує харчову толерантність і захист проти патогенних мікроорганізмів, – ключова ланка патогенезу цих захворювань.
У проведених в останні десятиліття клініко-експериментальних дослідженнях ролі кишкової цитопротекції в патогенезі запальних захворювань кишечнику у дорослих хворих переконливо доведено, що в основі підвищеної проникності слизового бар’єра кишечнику істотна роль належить структурно-функціональним змінам пре- й епітеліального шару бар’єра, зменшенню синтезу слизу, експресії секреторних і мембранозв’язаних муцинів, трефоїлового фактора TTF‑3, що забезпечують густину та в’язкість слизу.
Імунні фактори. На істотну роль імунної системи в патогенезі запальних захворювань кишечнику вказують, насамперед, клініко-лабораторні та морфологічні ознаки останніх: хронічний рецидивний перебіг, наявність позакишкових проявів (артрит, еритема, увеїт та ін.), нейтрофільних перинуклеарних антитіл (pANCA), лімфоїдно-плазматичний характер запального процесу в кишечнику, велика кількість клітин, що продукують імуноглобуліни, у власній пластинці слизової оболонки товстої кишки.
Серед причинних факторів дисбіозу кишечнику найбільшу роль дослідники відводять поліморфізму генів, зокрема NOD2, ATG1, IRGM, що зумовлюють аномалії процесингу бактерій, які активують імунні клітини кишечнику через рецептори їх розпізнавання і запускають цитокіновий каскад.
Фактори ризику. З-поміж тригерних факторів велике значення надають психологічному стресу, стереотипу харчування (переважання в раціоні тваринних жирів, білків, рафінованих вуглеводів), дефіциту вітаміну D, прийому нестероїдних протизапальних препаратів, непереносимості лактози, ранньому штучному годуванні, кишковим інфекціям, патології вагітності тощо.
Клінічні прояви ВК у дитячому віці
ВК характеризується хронічним рецидивним перебігом і незважаючи на типові клінічні прояви – больовий абдомінальний синдром, діарея, кров у калі – має низку особливостей залежно від локалізації вогнища ураження, його глибини, активності запального процесу, гістоморфологічних змін.
У деяких випадках ВК може починатися із позакишкових симптомів (артрити, афтозний стоматит тощо), які відповідають ступеню активності захворювання і негативно впливають на якість життя хворої дитини. При залученні у патологічний процес шкіри на гомілках виявляють ділянки червоного або пурпурового кольору (erithema nodosum); у деяких випадках спостерігаються петехії внаслідок порушення цілості або підвищення проникності ендотелію капілярів та діапедезу еритроцитів.
До позакишкових проявів ВК належить гепатит, частота якого, за нашими даними, складає 4%. Клінічно при ураженні печінки у хворих виявляють пальмарну еритему, телеангіектазії, капілярит, жовтяничність шкіри та слизових оболонок, зміни кольору сечі та калу, збільшення розмірів та ущільнення печінки. Із типових біохімічних синдромів найчастіше має місце синдром цитолізу легкого (рівень трансаміназ у 1,5-2 рази перевищує норму) або середньотяжкого (рівень трансаміназ – 5-9 норм) ступеня.
Важливим клінічним проявом ВК може бути затримка у хворих фізичного (25%) та статевого (18%) розвитку внаслідок синдромів мальдигестії та мальабсорбції, впливу медіаторів запалення на зони росту.
Клінічні ознаки ВК пов’язані з тривалістю патологічного процесу та його активністю.
Ступінь активності запального процесу визначається даними бальної шкали педіатричного індексу активності ВК (Paediatric Ulceretive Colitis Activity Index – PUCAI), ендоскопічних, гістологічних досліджень (табл.).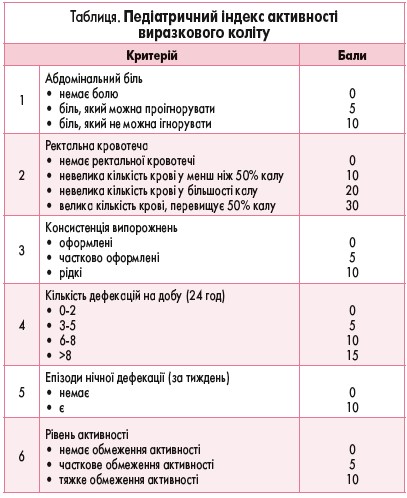
Активність захворювання визначається таким чином:
- тяжкий ступінь (65 балів та більше);
- середній ступінь (35-64 бали);
- легкий ступінь (10-34 бали);
- ремісія (захворювання неактивне; менше 10 балів).
Ускладнення ВК: гостра токсична дилатація товстої кишки (мегаколон); кишкова кровотеча, постгеморагічна анемія; кишкова непрохідність; перфорація; гепатит; перитоніт; рубці, стриктури; малігнізація; парапроктит; первинний склерозивний холангіт.
Діагностика ВК у дітей
Діагноз ВК ґрунтується на даних анамнезу хвороби та життя дитини, фізикального обстеження, результатах лабораторних, інструментальних (передусім ендоскопічного та морфологічного) досліджень у поєднанні з урахуванням активності запального процесу (рівень гемоглобіну, тромбоцитів, С-реактивного білка, альбумінів, кальпротектину, швидкість осідання еритроцитів).
Найбільш інформативними ендоскопічними ознаками ВК вважаються поширене та безперервне ураження товстої кишки з чіткими межами запалення та залученням прямої кишки; наявність вразливості слизової оболонки та її глибокі дефекти, контактна кровоточивість.
Для оцінювання ступеня активності запального процесу, крім якісної оцінки, може бути вирахувано кількісний індекс Rachmilewitz, який включає 4 основних критерії – грануляції, що розсіюють світло, на поверхні слизової оболонки (зернистість); судинний малюнок; кровоточивість слизової оболонки та її пошкодження (ерозії, виразки, фібрин, гній). Бальна оцінка наведених критеріїв дає можливість визначити ступінь активності, а саме – 3 бали відповідають мінімальній, 5 балів – помірній, 10 балів – високій активності запального процесу.
Гістологічними критеріями ураження слизової оболонки товстої кишки є дистрофічні й атрофічні зміни поверхневого епітелію з ділянками виразок, ерозій і мікроерозій, зміна форми крипт, зниження мітотичної активності епітеліоцитів, зменшення кількості чи відсутність келихоподібних клітин, що продукують слиз, нейтрофільна й еозинофільна інфільтрація, зменшення кількості міжепітеліальних лімфоцитів (в основному
Мікроскопічні ознаки можуть бути розподілені на архітектонічні ознаки, аномалії епітелію, ознаки запалення. Архітектонічні ознаки включають звивистість крипт, їх деформацію й атрофію, нерівність поверхні слизової оболонки. До аномалій епітеліальних клітин належать зниження вмісту муцину і панетовська метаплазія. Ознаки запалення включають збільшення кількості лімфоцитів, плазматичних клітин у власній пластинці слизової оболонки, базальний плазмацитоз, базальні лімфоїдні агрегати й еозинофіли у власній пластинці слизової оболонки.
Ультразвукове дослідження товстої кишки є порівняно новим методом візуалізації кишечнику. Зазвичай метод застосовують після проведення рутинного ультразвукового дослідження органів черевної порожнини. Дослідження виконують після шестигодинного голодування з метою зменшення газоутворення у кишечнику. У деяких випадках з метою контрастування й отримання чіткішого зображення дітям віком старше 12 років можна призначати перорально препарати на основі поліетиленгліколю за 30-40 хв до обстеження. Крім того, для детальної візуалізації сигмоподібної кишки можливе застосування гідросонографії з уведенням води у пряму кишку. Для отримання адекватного ультразвукового зображення стінок кишечнику потрібно використовувати високочастотні датчики (10-17 МГц). За допомогою доплерівського дослідження отримують додаткову інформацію щодо запального (підвищення васкуляризації) або стенотичного (відсутність васкуляризації) процесу. Варто зазначити, що ілеоцекальна, висхідна, низхідна та сигмоподібна частини кишечнику у більшості дітей добре візуалізуються. Проте ободова кишка через варіації в анатомії та локалізації візуалізується складно. Ще складніше оцінити структуру прямої кишки через її локалізацію у тазі. Ультразвуковими ознаками ВК вважаються потовщення стінки кишки більше ніж 2,5 мм, відсутність або погана візуалізація шарів стінки кишки, підвищена васкуляризація ділянок кишки, відсутність гаустрації. Додатковими ознаками запалення кишечнику є збільшення розмірів мезентеріальних лімфатичних вузлів (більше 9×4 мм).
В останні роки з метою діагностики запальних захворювань кишечнику педіатри все ширше використовують комп’ютерну та магнітно-резонансну томографію.
Оцінка клінічної активності захворювання за даними педіатричного індексу активності (PUCAI), на жаль, не корелює з ендоскопічними та морфологічними критеріями, тому вважаємо більш обґрунтованими визначення та аналіз вищенаведених лабораторних показників, якщо ендоскопічне обстеження з якихось причин не може бути проведено.
При встановленні діагнозу слід виключити наявність деяких інфекційних хвороб: єрсиніозу, кампілобактеріозу, сальмонельозу, амебіазу, туберкульозу кишечнику, інших запальних захворювань кишечнику (хвороба Крона), поліпів та гемангіом товстої кишки, дивертикульозу кишечнику, які клінічно мають такі самі ознаки, як і ВК.
Основні принципи лікування ВК у дітей
Основною метою лікування ВК є регресування клінічних проявів захворювання, зменшення вираженості запальних змін у товстій кишці, а саме:
- швидке купірування загострення хвороби;
- загоєння слизової оболонки товстої кишки;
- запобігання рецидивам хвороби;
- профілактика ускладнень;
- своєчасне хірургічне лікування при неефективності консервативної терапії;
- покращення якості життя хворої дитини.
В основу принципів дієто- та медикаментозної терапії покладені рекомендації ECCO 2014 та ESPGHAN 2018.
Дієтотерапія (нутритивна підтримка)
Однією з важливих ланок лікування дітей із ВК є корекція метаболічних розладів та адекватне забезпечення енергетичних потреб. При ВК може спостерігатися порушення всмоктування як багатьох нутрієнтів (так звана тотальна мальабсорбція), так і окремих, негативний вплив якого на перебіг захворювання посилює підвищену ексудацію кишечником плазмових білків, запальні й атрофічні зміни слизової оболонки кишечнику, порушення моторики, проникність кишкового бар’єра.
З метою нутритивної підтримки пацієнтів із запальними захворюваннями кишечнику розроблено лікувальні суміші, зокрема «Модулен IBD». Лікувальна суміш «Модулен IBD» – це повноцінна збалансована полімерна суміш на основі 100% казеїнового білка, ізокалорійна при стандартному розведенні (1 мл/1 ккал). Жировий компонент суміші на 25% складається із середньоланцюгових тригліцеридів, що сприяє легкості їх засвоєння, а співвідношення ω6:ω3=11:1 забезпечує протизапальний ефект; суміш не містить лактози, глютену. Особливістю суміші «Модулен IBD» є наявність в її складі протизапального цитокіну – трансформувального фактора росту
Поряд із сумішшю «Модулен IBD» з метою усунення дефіциту білків, жирів, вуглеводів та мінеральних речовин можна використовувати спеціалізовану повноцінну збалансовану суміш «Ресурс® Оптимум». Білковий компонент суміші представлено комбінацією казеїнів і сироваткових білків, які легко розщеплюються та всмоктуються в шлунково-кишковому тракті, що забезпечує необхідний рівень есенціальних амінокислот.
Жировий компонент включає насичені середньоланцюгові тригліцериди з 25% жирів, рапсову та кукурудзяну олію. Есенціальні жирні кислоти становлять 7,9% загальної енергетичної цінності суміші (співвідношення ω6:ω3=4:1). Вуглеводний компонент представлено здебільшого мальдекстрином.
Суміш містить живі бактерії Lactobacullus paracasei, пребіотик (натуральні харчові волокна), вітаміни А, Е, К, С, РР, групи В, біотин, макро- та мікроелементи. Використовується як для зондового, так і перорального харчування дітей старших 7 років, як допоміжне харчування, призначається 2 порції по 250 мл на день.
Медикаментозна терапія
Аміносаліцилати. Перший препарат цього класу лікарських засобів, який був використаний для лікування ВК, – сульфасалазин, синтезований у 1942 р. Сульфасалазин є комбінацією сульфапіридину та 5-аміносаліцилової кислоти (5-АСК). Завдяки фундаментальним дослідженням Arad Khan було показано, що лікувальний ефект сульфасалазину зумовлений дією 5-АСК, а сульфапірин лише забезпечує доставку препарату в товсту кишку.
Механізмом протизапальної дії препаратів 5-АСК є пригнічення синтезу цитокінів (фактора некрозу пухлини – ФНП, інтерлейкінів – ІЛ – ІЛ‑1, ІЛ‑2, ІЛ‑6), лейкотрієнів, тромбоксанів, простагландинів.
Наявність багатьох побічних ефектів сульфасалазину (анемія внаслідок дефіциту фолієвої кислоти, нудота, блювання, гострий панкреатит, олігоспермія, порушення функції нирок та інші), які виникали у 10-50% хворих, спонукали до синтезу «чистих» препаратів 5-АСК, що містили 5-АСК у вигляді мономера месалазину.
За даними експериментальних досліджень, накопичення 5-АСК відрізняється в різних типах клітин товстої кишки. Воно найбільш виражене в епітелії крипт та у 2 рази нижче в ендотелії і клітинах власної пластинки слизової оболонки, включаючи імунні клітини.
Доведено, що пероральний прийом препаратів 5-АСК (месалазину і сульфасалазину) ефективний як терапія першої лінії для індукції при легкій і середньотяжкій активності ВК. Перорально месалазин призначають у дозі від 60 до 80 мг/кг маси тіла на добу (не більше 4,8 г/добу) за 2 прийоми. Ректально препарати 5-АСК призначають у дозі 25 мг/кг до 1 г/добу. Сульфасалазин застосовують у дозі 70-100 мг/кг на добу (максимальна доза 4 г/добу). Максимальна доза пероральних і ректальних препаратів зазвичай не перевищує стандартну дозу для перорального прийому у дорослих більш ніж на 50%, або 6,4 г/добу. Поступове підвищення дози сульфасалазину протягом 7-14 днів може знизити ризик дозозалежних небажаних явищ, таких як головний біль і розлади шлунково-кишкового тракту. Препарати призначають на 8-12 тижнів з поступовим переходом на підтримувальну дозу. Для профілактики рецидивів хвороби залежно від віку рекомендовано не менше 40 мг месалазину на 1 кг маси тіла за 2 прийоми.
Системні кортикостероїди. Дія синтетичних кортикостероїдів схожа із дією природних кортикостероїдів, але вони володіють різним співвідношенням глюкокортикоїдної та мінералокортикоїдної активності. Дія глюкокортикоїдів (ГК) на клітини-мішені реалізується на рівні регуляції транскрипцієнтів, що опосередковується взаємодією ГК зі специфічними глюкокортикоїдними рецепторами. Протизапальна дія ГК зумовлена багатьма факторами: пригніченням активності фосфоліпази А2, зменшенням експресії гена, що кодує циклооксигеназу‑2, стабілізацією клітинних мембран, покращенням мікроциркуляції у вогнищі запалення.
Характерною ознакою ГК є їх імунодепресивна активність, що реалізується шляхом пригнічення різних етапів імунної реакції – гальмування міграції стовбурових клітин кісткового мозку, активності Т- і В-лімфоцитів, інгібування вивільнення цитокінів (ІЛ‑1, ІЛ‑2, інтерферону-γ) із лейкоцитів і макрофагів.
Спектр препаратів ГК достатньо широкий, вони відрізняються за показниками глюкокортикоїдної та мінералокортикоїдної активності, потужністю та тривалістю дії.
Показання до призначення ГК: перорально – при середньотяжкій атаці без системних проявів або у пацієнтів, які не досягли ремісії на тлі терапії оптимальною дозою препаратів 5-АСК та у пацієнтів з тяжкою формою ВК.
Доза преднізолону для перорального прийому становить 1 мг/кг і не має перевищувати у більшості дітей 60 мг на добу. Після перших 2-3 тижнів терапії при визначенні PUCAI від 15 до 30 балів рекомендується продовжити прийом преднізолону в тій самій дозі; при PUCAI >35 балів дозу збільшити до такої, яка використовувалася
Виходячи з досвіду відділення гастроентерології, схема призначення системних ГК відрізняється від вищенаведеної схеми європейських експертів. Так, максимальну дозу ГК призначають з розрахунку 1-1,5 мг/кг на 4-6 тижнів з подальшим щотижневим зниженням дози на 2,5 мг до повної відміни препарату. Така схема призначення дозволяє значно знизити ризик розвитку побічних ефектів, досягти більш стійкої ремісії захворювання.
Під час лікування ГК спостерігаються випадки стероїдорезистентності – збереження активності захворювання при прийомі адекватної дози ГК протягом 7-14 днів. Гормональна стероїдозалежність констатується при досягненні клінічної ремісії на тлі терапії ГК і відновленні симптомів захворювання після зниження дози або повної відміни препарату, а також у тих випадках, якщо терапія стероїдами не припиняється протягом
Прийом ГК може супроводжуватися низкою побічних ефектів – ранніх, пізніх та ефектів від відміни препаратів. Ранні ефекти – «косметичні» прояви, розлади сну, диспепсія, порушення толерантності до глюкози. Пізні ефекти – остеопороз, некроз головки стегнової кістки, підкапсульна катаракта та інші. Ефектами від припинення лікування є гостра адреналова недостатність, артралгії, підвищення артеріального тиску, синдром псевдоревматизму з міалгіями, розвиток інфекційних захворювань.
Побічні ефекти виникають унаслідок порушень водно-електролітного балансу, обміну ліпідів, зниження кишкової абсорбції кальцію, вітаміну D, пригнічення синтезу остеобластів, негативного впливу на головний мозок (гіпокамп).
Імуносупресори. Тіопурини (азатіоприн або 6-меркаптопурин) рекомендуються для підтримання ремісії у дітей з непереносимістю 5-АСК чи у пацієнтів з частими рецидивами (2-3 загострення на рік) або розвитком гормонозалежної форми захворювання на тлі терапії в максимальних дозах. Терапевтичний ефект тіопуринів досягається упродовж 10-14 тижнів лікування. Дозу можна коригувати приблизно до 2,5 мг/кг для азатіоприну або 1-1,5 мг/кг для 6-меркаптопурину (приймають 1 раз на добу). Тіопурини рекомендуються для підтримувальної терапії при гострому тяжкому ВК після індукції ремісії за допомогою ГК.
Біологічна терапія. Прогрес у галузях біології та медицини розширив можливості фармакотерапії при ВК за рахунок застосування біологічної терапії. Біологічна терапія – метод лікування аутоімунних хвороб із використанням лікарських засобів, які блокують ефекти імунної системи.
Першими біологічними препаратами, які стали широко використовувати в клінічній практиці, були інгібітори ФНП, які блокують біологічну активність цього цитокіну в циркуляції та на клітинному рівні. До цього класу генно-інженерних біологічних препаратів належать химерні (інфліксимаб) і людські (адалімумаб) моноклональні антитіла до ФНП, а також розчинні рецептори до ФНП (етанерцепт).
Можливість призначення інфліксимабу розглядається у пацієнтів із хронічним неперервним або гормонозалежним перебігом ВК, що не контролюється застосуванням 5-АСК і тіопуринів. Сьогодні інфліксимаб є препаратом першої лінії біологічної терапії у дітей з ВК і призначається в дозі 5 мг/кг (3 індукційні дози на 2-му
Інфліксимаб призначають при гормонорезистентній формі ВК (стійкості як до перорального, так і внутрішньовенного введення препаратів). Якщо інфліксимаб був призначений під час гострої атаки у пацієнта, який раніше не отримував тіопурини, біологічну терапію можна використовувати як допоміжну для переходу на терапію тіопуринами. У цьому випадку терапію інфліксимабом можна припинити приблизно через 4-8 міс.
Протипоказаннями до призначення інфліксимабу є гіперчутливість, сепсис, абсцес, туберкульоз, опортуністичні інфекції, серцева недостатність середнього та тяжкого ступеня.
Побічні явища можуть виникнути з боку серцево-судинної, респіраторної систем, органів травлення, шкіри, алергічні реакції, лихоманка, міалгії, артралгії тощо.
Адалімумаб можна застосовувати тільки у пацієнтів із втратою відповіді або непереносимістю інфліксимабу. Терапію адалімумабом проводять за схемою: індукційна доза на 0 і 2-му тижнях 120 і 80 мг при масі тіла ≥40 кг або 80 і 40 мг при масі тіла <40 кг, потім – підтримувальна терапія по 40 мг 1 раз на 2 тижні. Препарат вводиться підшкірно. Може знадобитися індивідуальний підбір дози.
Хірургічне лікування. Показаннями до планового хірургічного втручання є:
- тяжкий коліт у дітей 1-го року життя;
- тяжкий і середньотяжкий коліт за відсутності ефекту від базової медикаментозної терапії, в тому числі ГК (гормонорезистентна форма), відсутність відповіді на лікування біологічними препаратами;
- ускладнення ВК (кишкова кровотеча, токсична дилатація ободової кишки, перфорація товстої кишки);
- блискавичний перебіг ВК, тривала атака ВК, ендогенна інтоксикація та крововтрата, які призводять до виснаження хворого, глибоких метаболічних порушень, анемії, загрожують розвитком септичного стану;
- виникнення колоректального раку на тлі ВК.
Психосоціальна підтримка. Психологічна допомога показана всім пацієнтам, оскільки вона підвищує якість життя, полегшує адаптацію до захворювань і запобігає розвитку депресії.
Вакцинація. У дітей із ВК необхідно провести оцінку графіка щеплень. Імунізація живими вакцинами не рекомендована, лише інактивованими вакцинами проти гепатиту В, грипу, правця. Проведення вакцинацій не має перешкоджати призначенню препаратів, необхідних для індукції захворювання.
Література
- Баранов А.А. и др. Язвенный колит у детей: клинические рекомендации. – М., 2016. – 53 с.
- Валуйских Е.Ю., Светова И.О. и др. Полиморфизм генов регуляторов воспаления при болезни Крона и неспецифическом язвенном колите // Бюллетень СО РАМН. – 2009. – 2 (136). – С. 81-88.
- Вялов С.С. Нарушение проницаемости слизистой оболочки как фактор патогенеза функциональных нарушений желудочно-кишечного тракта: обоснование и возможности коррекции // Consilium Medicum. – 2018. – 20 (12). – С. 99-104. DOI: 10.26442/20751753.2018.12.180062.
- Габрусская Т.В. Генетические маркеры воспалительных заболеваний кишечника: роль в патогенезе // Гастроэнтерология Санкт-Петербурга. – 2009. – 4. – С. 7-10.
- Главнов П.В. и др. Язвенный колит и болезнь Крона: современное состояние проблемы этиологии, ранней диагностики и лечения (обзор литературы) // Вестник СПбГУ. – 2015. – Вып. 4. – С. 48-72.
…
79. Wilks S. Morbid Appearances in the intestnes of miss Banks. Medical Times and Gazette. 1859; 2: 264-265.
Повний список літератури знаходиться в редакції.
Тематичний номер «Педіатрія» №1 (52) 2020 р.


