17 січня, 2017
Фармакотерапия в ревматологии: прогнозирование и предупреждение осложнений на основе персонифицированной и доказательной медицины

20-21 октября в г. Киеве состоялась научно-практическая конференция «Прогнозирование и предупреждение осложнений течения и фармакотерапии ревматических заболеваний».
Конференция уже традиционно предоставила возможность ученым и практическим врачам рассмотреть новые рекомендации в области диагностики и лечения ревматических заболеваний, поделиться собственным опытом ведения наиболее трудных пациентов и обсудить междисциплинарные проблемы со специалистами, которые также сталкиваются в своей практике с пациентами ревматологического профиля: педиатрами, кардиологами, дерматологами, гастроэнтерологами, офтальмологами, ортопедами, рентгенологами.
Директор ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, президент Ассоциации кардиологов Украины, президент Ассоциации ревматологов Украины, член-корреспондент НАМН Украины, профессор Владимир Николаевич Коваленко в своем выступлении отметил важную роль междисциплинарного сотрудничества в оптимизации ведения пациентов с ревматическими заболеваниями.
Многие ревматические заболевания, а также побочные эффекты фармакотерапии обусловливают поражение различных органов и систем, поэтому тесное взаимодействие ревматологов с врачами смежных специальностей — требование сегодняшнего дня. Проблема коморбидности, которая на протяжении последних лет постоянно поднимается международными экспертами, уже нашла отражение во многих работах украинских ученых, и данное направление продолжает развиваться.
В числе других актуальных тем, обсуждаемых сегодня на международном уровне, — возможности персонифицированной медицины. Персонифицированный подход к лечению — одно из перспективных направлений в медицине, важный этап ее эволюционного развития и включает в себя эмпирический и стратифицированный подходы. Однако внедрение персонифицированного лечения ограничивается трудностями финансового обеспечения, трактовки генетических исследований и многими другими факторами. В отношении данного направления эксперты иногда высказывают противоположные точки зрения: с одной стороны, рекомендации в ревматологии нацеливают на максимальное уменьшение активности заболевания, с другой — не для всех пациентов популяционные стратегии лечения являются оптимальным подходом. Например, при лечении ревматических заболеваний нередко приходится сталкиваться с неэффективностью метотрексата или его побочными эффектами, из-за которых пациенты вынуждены прекращать терапию. С другой стороны, нельзя не признать, что метотрексат является золотым стандартом в лечении ревматоидного артрита и без него невозможно представить лечение многих больных даже сегодня, когда появились биологические препараты. Поэтому в настоящее время более реальным представляется использование стратифицированного подхода, успех которого зависит от того, насколько точно будет спрогнозирован ответ на терапию. Наиболее известный пример стратифицированного подхода — определение маркеров токсичности препаратов (например, полиморфизма гена метилентетрагидрофолатредуктазы для определения токсичности метотрексата).
Персонифицированный подход основан на определении иммунных биомаркеров у пациентов для прогнозирования достижения максимального эффекта лечения.
В последнее время особое внимание уделяется отличиям между специально спланированными рандомизированными клиническими исследованиями (РКИ) и реальной практикой. Эти отличия определяются большим количеством факторов. Известно, что для участия в клинических исследованиях пациенты отбираются в соответствии со строгими критериями, включая активность, тяжесть и длительность заболевания, комплайентность. При этом чаще всего исключаются больные с определенными коморбидными состояниями, не допускается изменение доз и сроков приема изучаемых препаратов, то есть не учитываются те факторы, которые в реальной практике могут существенно влиять на результаты терапии. Кроме того, при проведении РКИ не принимаются во внимание стоимость лечения и социально-экономические условия, которые в реальной жизни могут иметь важное значение. В перспективе перечисленные недостатки РКИ будут устраняться, и, надо полагать, характеристики пациентов, включаемых в исследования, будут более приближены к тем, которые мы чаще всего встречаем в повседневной практике. Это будет следующим шагом в развитии персонифицированной медицины.
Нельзя забывать, что принцип «Не навреди!» сохраняет свою актуальность для современной медицины, и врач должен уметь выстроить схему лечения с учетом индивидуальных особенностей и потребностей пациента, одновременно соблюдая рекомендации, основанные на доказательной медицине. Чтобы достичь главной цели в лечении пациентов ревматологического профиля, не следует упускать из виду такие простые, доступные и вместе с тем эффективные мероприятия, как изменение образа жизни, пищевых привычек и т. д. Больше внимания необходимо также уделять обучению пациентов, профилактике осложнений терапии, коррекции депрессивных расстройств, улучшению комплайенса.
Профессор В.Н. Коваленко отметил, что для украинских ревматологов с каждым годом все актуальнее становятся вопросы ведения пациентов, получающих биологические препараты (БП). Являясь высокоэффективными средствами в лечении ревматических заболеваний, БП могут оказывать негативное влияние на сердечно-сосудистую, нервную, кроветворную системы, а также повышать риск развития инфекционных осложнений. В связи с этим вопросы оптимизации биологической терапии у больных ревматологического профиля следует обсуждать более активно. Главной целью лечения этих пациентов является обеспечение полноценной активной жизни, поэтому украинские специалисты, несмотря на все трудности последних лет, стараются внедрять в клиническую практику все современные терапевтические технологии, использующиеся в мире.
Темой, неразрывно связанной с применением БП, является использование биосимиляров. Возможностям и рискам, сопряженным с внедрением биосимиляров в клиническую практику, был посвящен доклад доктора медицинских наук, профессора Олега Петровича Борткевича (отдел некоронарогенных болезней сердца и клинической ревматологии ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины).
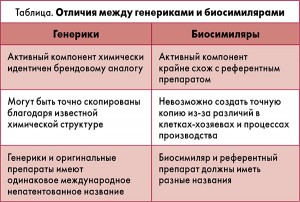
– С появлением на фармацевтическом рынке биосимиляров все чаще возникают вопросы о возможности замены БП в процессе лечения пациентов. Однако на сегодняшний день однозначные ответы на эти вопросы пока не получены. Процесс производства БП крайне сложен и не допускает ни малейших отклонений от стандартов производств. Структура молекулы каждого БП является уникальной, а на ее качество может влиять множество факторов, в том числе и самые незначительные модификации технологического процесса. Процесс создания биосимиляра фундаментально отличается от такового инновационного препарата, и этот факт признан руководствами регуляторных органов. Согласно определению Европейского агентства по оценке лекарственных препаратов (ЕМА), Управления по контролю за продуктами питания и лекарственными средствами США (FDA) и Всемирной организации здравоохранения (ВОЗ) биосимиляры — это препараты крайне сходные с референтными БП в соответствии с представленными данными о качестве, эффективности и безопасности, и к этим характеристикам при регистрации биосимиляров предъявляются очень жесткие требования. Более того, одновременно с процедурой регистрации биосимиляра заявитель должен предоставить план управления рисками в соответствии с требованиями ЕС. Во всех случаях производители биосимиляров должны также исследовать их на иммуногенность с результатами длительного наблюдения за наличием антител в определенные интервалы. Сложность при этом заключается в том, что иммуногенный потенциал биологически полученных молекул сложно предвидеть с помощью химического или структурного анализа и доказать эквивалентность биосимиляров оригинальным БП возможно только с помощью клинических исследований и путем осуществления фармаконадзора за их оборотом. Таким образом, биосимиляры не могут быть идентичными референтным препаратам из-за особенностей их разработки и производства. Важно понимать, что биосимиляры не являются генерическими препаратами (табл.).
Профессор О.П. Борткевич отметил, что БП, как правило, имеют несколько механизмов действия и во многих случаях эти механизмы не полностью определены и поняты, что делает очень сложным вопрос о возможности их взаимозаменяемости даже в пределах одной группы. Биосимиляры, созданные разными производителями, не идентичны ни оригинальному препарату, ни друг другу. В связи с этим вопрос о взаимозаменяемости БП и биосимиляров может решаться только в соответствии с указаниями регуляторных органов, однако четкая позиция по данному вопросу пока не выработана.
Эксперты FDA считают, что биосимиляр взаимозаменяем только в следующих случаях: 1) если ожидается, что он обеспечит такой же клинический результат, что и референтный препарат у любого пациента; 2) регулярная замена препарата (оригинального на подобный и наоборот) не повышает риск согласно критериям безопасности и эффективности по сравнению с приемом оригинального препарата. Очевидно, что эти критерии недостаточно четкие. Что касается ЕМА, то решения экспертов не содержат рекомендаций по взаимозаменяемости оригинальных БП и биосимиляров.

В настоящее время даже не ясно, может ли взаимозаменяемость быть продемонстрирована клинически. Исследования по замене препаратов в ходе лечения сложны в техническом и этическом плане, и данных в этой области крайне мало. Однако существуют данные, свидетельствующие о том, что немедицинское переключение ингибиторов фактора некроза опухоли α (ФНО) у стабильных пациентов с ревматоидным артритом (РА) повышает вероятность потери контроля над симптомами в течение одного года (D.C. Wolf et al., 2015). Наблюдение за пациентами с ювенильным РА показало, что длительность терапии последующим БП меньше по сравнению с предыдущим, при этом в 19% случаев замена одного БП на другой обусловлена немедицинскими причинами, то есть не первичной или вторичной неэффективностью и не побочными эффектами терапии (J. Wipff et al., 2014). В 2016 году на Европейской неделе гастроэнтерологии в Вене были представлены результаты рандомизированного двойного слепого исследования эффективности переключения с оригинального ингибитора ФНО инфликсимаба на биосимиляр у пациентов с ревматическими заболеваниями, воспалительными заболеваниями кишечника (ВЗК) и псориазом. У данных больных на протяжении года оценивали безопасность терапии, исходы, иммуногенность, соотношение цена/эффективность лечения. Оказалось, что у пациентов, получавших биосимиляр, чаще наступало ухудшение течения заболевания. Таким образом, на современном этапе наука не располагает убедительными данными в поддержку замены любых БП, включая биосимиляры.

Эксперты Британского общества ревматологии и Британского общества гастроэнтерологии не рекомендуют переключение пациентов с оригинального БП, который хорошо переносится, на биосимиляр до тех пор, пока не будут получены убедительные данные, подтверждающие безопасность таких переключений. Что касается позиции Американского колледжа ревматологов, то его эксперты считают, что существующее на сегодняшний день большое количество биосимиляров вызывает сомнения по поводу безопасного частого (повторного) переключения. Педиатрическая группа ESPGAN Porto по ВЗК отмечает, что нельзя переключать ребенка с ремиссией, достигнутой на определенном препарате, на биосимиляр до тех пор, пока не будут проведены клинические исследования эффективности и безопасности таких переключений при заболеваниях данной группы. Таким образом, вопрос переключения с оригинальных БП на биосимиляры требует дальнейшего более тщательного изучения. Лечащий врач может принимать решение об изменении режима терапии только после тщательной оценки особенностей ответа пациента на утвержденный БП.
В ходе конференции были рассмотрены многие важные вопросы, касающиеся медикаментозной терапии ревматических заболеваний: от аспектов применения нестероидных противовоспалительных препаратов (НПВП) при остеоартрозе до выбора БП у пациентов с РА, псориатическим артритом и анкилозирующим спондилитом.
Доктор медицинских наук, профессор Андрей Михайлович Гнилорыбов (ГУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины») в докладе, посвященном вопросам применения НПВП, отметил, что наиболее распространенными побочными эффектами НПВП являются диспепсии, а также эрозии/язвы, кровотечения/перфорации в различных отделах желудочно-кишечного тракта (ЖКТ). Вопросы гастропротекции при длительном приеме НПВП продолжают сохранять свою актуальность, и на сегодняшний день предлагается несколько путей снижения риска побочных эффектов такой терапии. В их числе — применение ингибиторов циклооксигеназы‑2 (ЦОГ‑2), которые считаются более безопасными в отношении влияния на ЖКТ; одновременный прием ингибиторов протонной помпы (ИПП); предварительная подготовка, включающая эрадикацию H. Pylori. Очевидно, однако, что этих мер недостаточно, чтобы обеспечить приемлемую безопасность терапии НПВП, особенно когда речь идет о пациентах с желудочно-кишечными кровотечениями в анамнезе. На это обращают внимание и эксперты Американского колледжа врачей, которые отмечают целесообразность приема комбинации ингибиторов ЦОГ‑2 и ИПП с целью снижения риска повторных кровотечений (Ann. Intern. Med., 2010). Снизить риск побочных эффектов НПВП-терапии возможно также путем назначения неселективного НПВП с гастропротекторными свойствами (стимуляция синтеза оксида азота) — амтолметин гуацила.
Вопросы ведения пациентов с подагрой и коморбидными состояниями рассмотрел в своем докладе заведующий кафедрой пропедевтики внутренней медицины № 2 Национального медицинского университета им. А.А. Богомольца, доктор медицинских наук Виталий Евгеньевич Кондратюк.
Докладчик отметил, что распространенность подагры увеличивается с возрастом, поэтому у большинства пациентов к моменту установления диагноза уже имеются сопутствующие заболевания. Кроме того, поскольку гиперурикемия является значимым фактором риска развития сердечно-сосудистых заболеваний (ССЗ), для пациентов с подагрой характерна высокая частота развития артериальной гипертензии, аритмий, венозных тромбозов, инфаркта миокарда. В целом в структуре коморбидности подагры доминируют артериальная гипертензия, хроническая болезнь почек и ожирение.
Установлено, что риск развития кардиоваскулярных осложнений у пациентов с подагрой в 3,1 раза превышает таковой у пациентов с РА и остеоартрозом (Meek et al., 2014). С другой стороны, наличие ССЗ является фактором риска развития гиперурикемии и подагры. В исследованиях установлена взаимосвязь артериальной гипертензии, метаболического синдрома и хронической почечной недостаточности с нарушениями обмена мочевой кислоты. Кроме того, гиперурикемия может быть обусловлена приемом препаратов, которые используют в лечении ССЗ: некоторых бета-адреноблокаторов (пропранолол, атенолол, метопролол, тимолол) и диуретиков (фуросемид, тиазидные диуретики), ацетилсалициловой кислоты (низкие дозы снижают почечную экскрецию уратов). На уровень мочевой кислоты влияют также некоторые НПВП (пироксикам).
Нельзя также забывать о взаимодействии некоторых препаратов кардиологической группы с препаратами, применяющимися при подагре, в частности с аллопуринолом. Так, ингибиторы ангиотензинпревращающего фермента могут увеличивать риск аллергических реакций на аллопуринол; прием фуросемида сопряжен с повышением оксипуринола в плазме крови и может потребовать повышения дозы аллопуринола; при одновременном приеме аллопуринола и теофилина повышается период полураспада последнего.
Таким образом, при ведении пациентов с подагрой, помимо рутинного контроля уровня мочевой кислоты в крови и коррекции гиперурикемии, следует фокусировать внимание на коморбидных состояниях, их влиянии на прогноз пациента, а также на возможном взаимодействии препаратов.
Заведующая кафедрой внутренней медицины № 2 ГВУЗ «Тернопольский государственный медицинский университет им. И.Я. Горбачевского МЗ Украины», доктор медицинских наук, профессор Светлана Ивановна Смиян в своем выступлении обозначила роль ревматолога в ведении пациентов с Лайм-боррелиозом с ревматическими проявлениями.
Профессор С.И. Смиян охарактеризовала болезнь Лайма как сложное иммуноопосредованное мультисистемное заболевание, которое является инфекционным по происхождению и воспалительным или «ревматическим» по своей сути. Фактически болезнь Лайма — уникальная модель для изучения инфекционной этиологии ревматических заболеваний.
Выделяют несколько вариантов и типов течения болезни Лайма в зависимости от того, какие органы и системы поражены. Суставной вариант диссеминированной стадии болезни Лайма клинически может протекать по артралгическому и артритическому типам с преимущественным вовлечением крупных и средних суставов. Артралгический тип характеризуется летучими болями в суставах без объективных признаков их поражения. При артритическом типе выявляются болезненность при движении в суставах с ограничением объема движений, достаточно часто отмечается поражение периартикулярных структур (тендиниты, тендовагиниты, миозиты, фасцииты, периферическая энтезопатия). Хронический артрит, формирующийся на фоне суставного варианта болезни Лайма, достаточно трудно поддается лечению. Нередко заболевание протекает по типу моно- или олигоартрита. Без адекватного лечения развивается стойкий артрит.
Стойкие суставные симптомы существенно ухудшают качество жизни пациентов, и роль ревматолога (при условии своевременного направления к нему пациента) заключается в правильном выборе эффективного симптоматического лечения ревматических проявлений: противоболевой и противовоспалительной терапии.
Заседания научно-практической конференции включили большое число интересных лекций и клинических случаев, содержание которых чрезвычайно трудно отразить в рамках одного обзора. На страницах следующих номеров газеты читайте более подробное освещение актуальных проблем ведения пациентов с ревматическими заболеваниями и коморбидными состояниями.
Подготовила Наталья Очеретяная