16 січня, 2017
Выбор комбинированной антигипертензивной терапии для пациентов с поражением органов-мишеней: что есть и чего нет в Европейских рекомендациях по лечению артериальной гипертензии?

Последняя редакция рекомендаций Европейского общества гипертензии и Европейского общества кардиологов (ESH/ESC, 2013 г.) служит ориентиром для выбора терапии артериальной гипертензии (АГ) на основании доказательной медицины. Однако, когда на приеме у врача – пациент с коморбидностью, сочетанием поражений сердца, почек, церебральных сосудов и других органов-мишеней, решение иногда приходится искать, скрупулезно анализируя мнения экспертов и доказательную базу, поскольку для целого ряда клинических ситуаций не проводилось специальных рандомизированных исследований.

Возможности оптимизации антигипертензивной терапии блокаторами ренин-ангиотензиновой системы (РАС) с позиций нескольких экспертных обществ и с учетом результатов последних клинических исследований представил заведующий кафедрой терапии и нефрологии, проректор по научной работе Харьковской медицинской академии последипломного образования, доктор медицинских наук, профессор Александр Викторович Бильченко.
Огромный интерес участников конгресса вызвал интерактивный клинический разбор, в котором профессор А.В. Бильченко обобщил доказательные подходы к оценке рисков и выбору антигипертензивной терапии с учетом результатов суточного мониторирования артериального давления (АД), поражения органов-мишеней и сопутствующих заболеваний.
Клинический пример
Пациентка К., 58 лет, служащая. Обратилась с жалобами на головные боли и повышенную утомляемость. Страдает АГ в течение 6 лет. Перенесла транзиторную ишемическую атаку (ТИА) 2 года назад на фоне стрессов и повышения АД до максимальных цифр 192/110 мм рт. ст. Со слов больной был зарегистрирован пароксизм фибрилляции предсердий (ФП). В последние месяцы в условиях домашнего контроля уровень АД обычно составлял 150-160/90-94 мм рт. ст. В настоящее время не курит, хотя имеет стаж курения 20 лет до 10 сигарет в сутки. Рост 159 см, вес 81 кг, индекс массы тела – 32. Окружность талии – 104 см. Офисное АД на момент осмотра – 162/88 мм рт. ст. Частота сердечных сокращений – 72 уд/мин.
Результаты амбулаторного суточного мониторирования АД (АМАД). В дневные часы: средние значения систолического АД (САД) и диастолического АД (ДАД) выше нормы. Максимальные цифры САД – 176 мм рт. ст., ДАД – 106 мм рт. ст. Удельный вес САД выше нормы в дневной период – 66%, ДАД выше нормы – 55%. Значения вариабельности САД выше нормы, ДАД – в пределах нормы. В ночные часы: средние значения САД и ДАД – выше нормы. Максимальные цифры САД – 167 мм рт. ст., ДАД – 104 мм рт. ст. Удельный вес САД выше нормы в ночной период – 97%, ДАД выше нормы – 70%. Значения вариабельности САД и ДАД в пределах нормы. Суточный ритм АД: для САД и ДАД – нарушение суточного ритма по типу «недостаточная степень ночного снижения»: САД по типу «night-peaker» (-1,1% – <0); ДАД по типу «non-dipper» (9,7% – >0 и <10).
По данным эхокардиографии, у пациентки в наличии гипертрофия миокарда левого желудочка (МЛЖ). Индекс массы МЛЖ (ИММЛЖ) – 125,26 г/м2.
Результаты лабораторных анализов: общий холестерин – 6,7 ммоль/л; триглицериды – 4,0 ммоль/л; липопротеиды низкой плотности (ЛПНП) – 4,0 ммоль/л; мочевая кислота плазмы крови – 436,7 мкмоль/л; гликемия натощак (венозная кровь) – 6,6 ммоль/л; HbA1c – 6,4%. Скорость клубочковой фильтрации, рассчитанная по формуле CKD-EPI 2009, – 77 мл/мин; креатинин – 73,8 мкмоль/л; соотношение альбумин/креатинин в моче – 55 мг/г. Гематокрит, электролиты крови (К+, Na+) в пределах нормы. Неврологический статус без нарушений.
Принимает ежедневно лизиноприл 20 мг/сут, Гинко Билоба 2 капсулы в день, ацетилсалициловую кислоту 75 мг/сут.
Таким образом, у больной – АГ 2 степени, состояние после перенесенной ТИА.
Избыточная маса тела (ИМТ) – 32. Окружность талии – 104 см.
Замаскированная неконтролируемая гипертензия – нарушение суточного ритма по типу «недостаточная степень ночного снижения»: САД по типу «night-peaker» (-1,1% – <0); ДАД по типу «non-dipper» (9,7% – >0 и <10) на фоне терапии антигипертензивными препаратами.
Гипертрофия МЛЖ – ИММЛЖ 125,26 г/м2.
Дислипидемия – общий холестерин 6,7 ммоль/л, триглицериды – 4,0 ммоль/л, ЛПНП – 4,0 ммоль/л.
Бессимптомная гиперурикемия – мочевая кислота плазмы 436,7 мкмоль/л.
Преддиабет – гликемия натощак (венозная кровь) 6,6 ммоль/л; HgA1c 6,4%.
Профессор А.В. Бильченко предложил аудитории ответить на следующие вопросы:
– как в данном случае оценить кардиоваскулярный риск?
– правильно ли проводится лечение пациентки?
– как можно оптимизировать антигипертензивную терапию?
Ответ на первый вопрос можно найти в новых рекомендациях Европейского общества кардиологов (ЕОК) по профилактике сердечно-сосудистых заболеваний 2016 г., согласно которым к категории очень высокого риска относятся лица с сердечно-сосудистыми заболеваниями (ССЗ), задокументированными клинически или методами визуализации. Клинически документированные ССЗ включают предшествовавший инфаркт миокарда, коронарную или артериальную реваскуляризацию, инсульт или ТИА, аневризму аорты или заболевания периферических артерий. ССЗ, задокументированные с помощью визуализации, включают атеросклеротические бляшки при коронарографии или ультразвуковом исследовании сонных артерий. В соответствии с этими критериями пациентку К. следует отнести к категории очень высокого риска, так как она перенесла ТИА. Таким образом, лечение АГ, назначенное терапевтом (лизиноприл), нельзя считать адекватным, поскольку пациентам с высоким и очень высоким риском показана комбинированная терапия.
Далее докладчик прокомментировал клиническое значение гипертрофии ЛЖ (ГЛЖ) у данной пациентки и риски, связанные с развитием ФП. В данном случае ГЛЖ подтверждена данными эхокардиографии, несмотря на то что индекс Соколова-Лайона, вычисленный по электрокардиограмме (амплитудам зубцов RV5, 6 и SV1, 2), равен 25 мм, что ниже порогового уровня (35 мм). Докладчик объяснил это низкой чувствительностью индекса Соколова-Лайона к выявлению ГЛЖ.
Рекомендации ESH/ESC 2013 г. по выбору антигипертензивных препаратов для больных с АГ и ГЛЖ отдают приоритет сартанам, ингибиторам ангиотензинпревращающего фермента (АПФ) и антагонистам кальция на основании доказанных классовых эффектов (уменьшение ГЛЖ примерно на 10% в ходе терапии). Вместе с тем только для лосартана доказана способность вызывать максимальный регресс ГЛЖ (на 15%) и снижать связанный с ней риск внезапной смерти в ходе классического исследования LIFE с длительностью терапии 4,8 года.
Лосартан – единственный блокатор РАС, который имеет специальное показание – снижение риска инсульта и смертности у больных АГ с ГЛЖ. Причем это показание утверждено регуляторным органом с самыми жесткими требованиями к доказательной базе – Управлением по контролю за продуктами питания и лекарственными средствами США (FDA).
Для пациентки К. лосартан является оптимальным основным компонентом комбинированной терапии, поскольку она уже перенесла ТИА и, вероятно, эпизод ФП, что свидетельствует о высоком риске развития инсульта, не исключая фатального.
По данным рандомизированных исследований, АГ ответственна за большее количество случаев ФП по сравнению с другими факторами риска, часто встречающимися в популяции (P. Zamani, R.J. Verdino, 2015). В рекомендациях ESH/ESC 2013 г. для предупреждения развития ФП у больных с АГ рекомендованы сартаны, ингибиторы АПФ, β-блокаторы и антагонисты минералокортикоидных рецепторов.
На самом деле в классе блокаторов рецепторов ангиотензина (БРА) убедительные доказательства профилактики ФП имеются только для лосартана. Значительное преимущество последнего в предотвращении ФП по сравнению с β-блокатором атенололом было продемонстрировано в ранее упоминавшемся исследовании LIFE – риск первого эпизода аритмии снижался на 33%. В ряде дальнейших исследований с телмисартаном (PRoFESS и TRANSCEND) не удалось показать эффективность в предотвращении развития ФП. Кандесартан и валсартан также не предотвращали рецидивирование пароксизмальной ФП в исследованиях CAPRAF, GISSI-AF и ANTIPAF.
Вывод авторов рекомендаций ESH/ESC 2013 г.: «Таким образом, учитывая разнородные данные крупных рандомизированных исследований, следует подчеркнуть, что данная рекомендация основывается на результатах исследования LIFE и, соответственно, относится к приоритетному использованию лосартана у больных с АГ и гипертрофией МЛЖ с целью предотвращения развития ФП».
Продолжая анализ клинического случая, профессор А.В. Бильченко отметил, что у пациентки выявлена дислипидемия и бессимптомная гиперурикемия. Ранее, по результатам Фремингемского исследования, эксперты заключили, что гиперурикемия не является значимым популяционным фактором риска, однако прогностическое значение гиперурикемии в отношении риска развития инсульта показало недавно опубликованное популяционное исследование, в котором были проанализированы данные 155 322 человек в возрасте от 40 до 73 лет (61% – женщины). Повышение риска нефатального инсульта у женщин с верхним квартилем значений концентрации мочевой кислоты составило 1,24 (p=0,01), у мужчин – 1,26 (p<0,0001) (K. Kamei, 2016).
Учитывая эти данные, пациентке К. желательно включить в комплексную терапию препарат, снижающий урикемию.
Доказано, что антигипертензивные препараты могут влиять на обмен мочевой кислоты, и, по мнению ряда экспертов ESC, лосартан и антагонисты кальция обладают более выраженным антигипертензивным эффектом за счет урикозурического эффекта (C. Cerezo, L.M. Ruilope, 2012).
Это не вошло в рекомендации по АГ, потому что ранее гиперурикемия не считалась значимым фактором риска. Таким образом, в случае пациентки К. лосартан является оптимальным блокатором РАС еще и потому, что снижает уровень мочевой кислоты (это было показано в целом ряде исследований, например Nishida et al., 2013).
Согласно результатам АМАД у данной пациентки выявили неконтролируемую гипертензию на фоне приема лизиноприла с нарушением суточного ритма САД по типу «night-peaker» и ДАД по типу «non-dipper».
По данным основанного на информации из баз данных 11 стран популяционного исследования с участием 9691 пациента, которым проводилось АМАД, выявляемость «замаскированной» АГ на фоне антигипертензивной терапии составила 30% (S.S. Franklin et al., 2015).
На последнем конгрессе ЕОК (Рим, 2016 г.) эксперты использовали уточняющий термин «замаскированная неконтролируемая АГ», который подчеркивает, что может выявляться повышенное среднесуточное АД, даже несмотря на то что на фоне антигипертензивной терапии достигается целевой уровень офисного АД.
Комментируя проблему неконтролируемой АГ, докладчик процитировал ведущего эксперта Нормана Каплана, который представил собственную точку зрения в мартовском выпуске журнале Американского общества гипертензии: «…Всем больным АГ необходимо проведение внеофисного измерения АД с учетом разницы АД при различных видах измерения, причем чем больше разница, тем большего внимания требуют больные» (N.M. Kaplan, 2016).
В связи с тем, что из всех методов измерения АМАД имеет большое прогностическое значение, различные международные рекомендации (но не ESH/ESC 2013 г.) настоятельно предлагают использовать амбулаторное измерение АД для постановки диагноза АГ. Например, последняя редакция рекомендаций NICE по ведению гипертензии у взрослых (2011 г.) предлагает выполнять АМАД у всех лиц с повышенным офисным АД.
В Украине на сегодняшний день это вряд ли осуществимо. Более реалистично выглядит алгоритм, предложенный канадскими экспертами (L. Cloutier et al., 2015), в котором важная роль отводится регулярным самоизмерениям АД в домашних условиях при невозможности проведения суточного мониторирования.
В связи с существенными суточными колебаниями АД, которые АМАД обнаруживает у многих пациентов, возникает закономерный вопрос: влияет ли время приема гипотензивных препаратов на их эффективность? Увеличивается число доказательств связи ночного АД с риском развития сосудистых событий. Рандомизированное контролируемое исследование у 448 больных с сахарным диабетом (СД) 2 типа и АГ, которых наблюдали в среднем в течение 5,4 года, продемонстрировало драматическое снижение сердечно-сосудистого риска более чем на 50%, если хотя бы один из гипотензивных препаратов назначался в вечернее время. На основании этих данных Американская диабетическая ассоциация (АДА) в новых стандартах помощи пациентам с СД, опубликованных в январе 2016 г., впервые указала на то, что «следует рассматривать возможность назначения одного из антигипертензивных препаратов в вечерние часы». В то же время, как отметил докладчик, для больных без СД еще не получено убедительных доказательств пользы такого подхода.
Исследования по изучению влияния различных гипотензивных комбинаций на суточный профиль АД сейчас активно ведутся в Японии. Комбинация лосартана с гидрохлортиазидом является там самой популярной, и именно она продемонстрировала хорошие результаты в отношении контроля ночного и утреннего АД. Так, в исследовании MAPPY терапия с использованием 50 мг лосартана и 12,5 мг гидрохлортиазида, по данным суточного мониторирования, позволила достичь контроля изолированной утренней АГ у 81,8% больных (H. Kai et al., 2015). Как показало еще одно японское исследование, эта комбинация особенно эффективна для контроля ночного АД у пациентов с абдоминальным ожирением (C. Ibuki et al., 2014), что актуально и для пациентки из клинического примера.
В исследовании SALT-VAT пациентов переводили с фиксированной комбинации лосартан/гидрохлортиазид на комбинацию валсартан/гидрохлортиазид и обратно. Несмотря на то что повышение среднесуточного АД при переходе на комбинацию с валсартаном было незначительным, при пересчете на риск развития инсульта и смерти эти 3-4 мм рт. ст. являются прогностически значимыми (рис.).
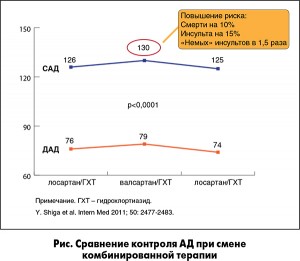
На основании вышеизложенного профессор А.В. Бильченко рекомендовал следующую коррекцию терапии у пациентки К.:
1. Назначить фиксированную комбинацию 50 мг лосартана + 12,5 мг гидрохлортиазида (ЛОЗАП® Плюс) по 1 таблетке утром (дополнительным преимуществом фиксированной комбинации является улучшение приверженности).
2. Рассмотреть целесообразность назначения в качестве третьего компонента гипотензивной терапии амлодипина по 5 мг для приема вечером.
3. Продолжить прием ацетилсалициловой кислоты в дозе 75 мг/сут.
4. Назначить аторвастатин в дозе 40 мг/сут (при хорошей переносимости – 80 мг/сут) в связи с очень высоким сердечно-сосудистым риском у больной.
5. Начать терапию метформином с 500 мг 2 р/сут и при хорошей переносимости увеличить дозу до 1000 мг 2 р/сут для предотвращения развития СД 2 типа в соответствии со стандартами АДА‑2016.
В связи с выявленной замаскированной АГ через 3 мес после коррекции терапии пациентке К. показано повторное амбулаторное суточное мониторирование для контроля эффективности, даже если будет достигнуто целевое значение офисного АД.
Подготовил Дмитрий Молчанов


