13 січня, 2017
Аневризми коронарних артерій: аналіз клінічних випадків
Аневризми коронарних артерій (АКА) – доволі рідкісна патологія коронарних судин, за якої спостерігається локальне розширення просвіту коронарних артерій на 50% і більше щодо проксимального сегмента. Згідноз результатами досліджень A.S. Daoud і співавт. АКА виявлено в 1,4% випадків під час аутопсій 694 хворих у віці старше 16 років. Найбільш часто АКА виявляють у правій коронарній артерії (ПКА), далі – у стовбурі лівої коронарної артерії (ЛКА), у правій міжшлуночковій гілці (ПМШГ) і огинаючій гілці (ОГ) ЛКА. Крім того, АКА можуть бути множинними [5].
Найбільш повною та поширеною є така класифікація АКА [1, 4, 6]:
1. Локальні аневризми:
1.1. вроджені;
1.2. набуті як результат атеросклерозу, запалення, травми, неоплазії, артеріовенозної фістули.
2. Пов’язані з розшаруванням:
2.1. первинні;
2.2. при розшаровуючих аневризмах грудного відділу аорти.
3. Дифузна артеріовенозна фістула.
Найбільш часто АКА мають атеросклеротичну етіологію [1, 2]. Другими за частотою є аневризми вродженого походження [4, 6]. Доволі часто зустрічаються АКА після запальних захворювань, таких як синдром Кавасакі [3]. В літературних джерелах описані випадки АКА травматичного походження після спроби проведення ангіопластики [2].
Суперечливими є світові дані щодо клінічної значущості цієї патології. Відомо, що перебіг захворювання здебільшого безсимптомний, тож зазвичай його виявляють випадково. Проте аневризми призводять до підвищеного ризику виникнення інфаркту міокарда. Описано випадки стенокардії у дітей, єдиною причиною розвитку якої були множинні АКА [7]. Рідко, але трапляються випадки розриву АКА з розвитком гемоперикарду і тампонади серця, що завершуються смертю пацієнта.
У Національному інституті серцево-судинної хірургії ім. М.М. Амосова НАМН України (далі – Інститут) накопичено чималий досвід стосовно виявлення та лікування АКА. У період з 2000 по 2016 р. на базі Інституту виконано 3846 стентувань коронарних артерій, із них – 6 ендопротезувань з приводу АКА (0,16%). Усі випадки відрізнялися за клініко-ангіографічною картиною.
Клінічний випадок № 1
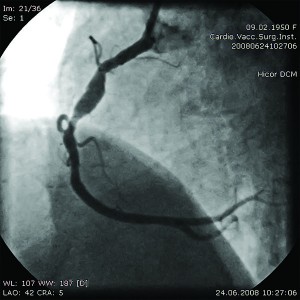
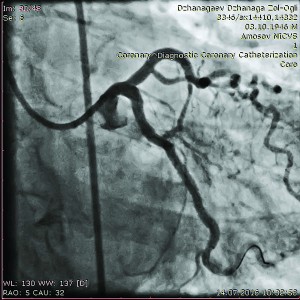
Пацієнтка С., 58 років, звернулася в Інститут для обстеження з приводу болі в грудній клітці без чіткого зв’язку з фізичним навантаженням (тривалість анамнезу близько 4 місяців) та неконтрольованим підвищенням артеріального тиску (АТ). Електрокардіограма (ЕКГ) ознак гіпоксії міокарда не виявила. За результатами навантажувальних проб (тредміл-тест) встановлено дрібновогнищеві зміни передньої та задньої стінок лівого шлуночка (ЛШ). Під час ЕхоКГ-обстеження зафіксовано гіпокінезію задньої стінки ЛШ. Зважаючи на вищеописані дані, хворій рекомендовано проведення коронаровентрикулографії (КВГ). Дані КВГ: тип кровопостачання серця збалансований; у середній третині ПМШГ ЛКА виявлено 50-70% стеноз (рис. 1);
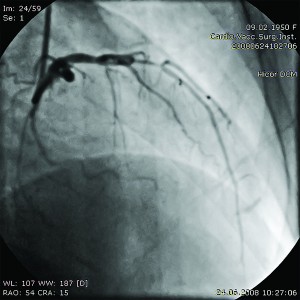 Рис. 1. Коронарограма ЛКА у пацієнтки С. до стентування ПМШГ ЛКА у правій косій проекції з краніальним відхиленням
Рис. 1. Коронарограма ЛКА у пацієнтки С. до стентування ПМШГ ЛКА у правій косій проекції з краніальним відхиленнямв ОГ ЛКА значимих стенозів не виявлено; ПКА – аневризма середньої третини (рис. 2);
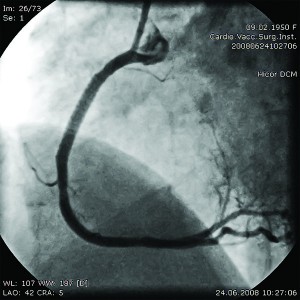
при лівій вентрикулографії виявлено гіпокінезію задньої стінки ЛШ. Зважаючи на клініко-ангіографічні дані, хворій виконано ендопротезування ПМШГ ЛКА і ПКА. В ПМШГ ЛКА після предилатації балоном-катетером 2,0×9,0 мм імплантовано стент-систему Taxus 2,75×32 мм (12-14 атм) (рис. 3).
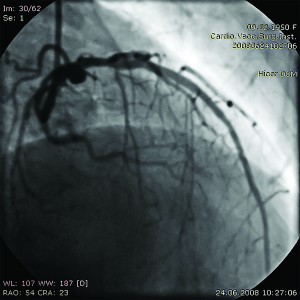 Рис. 3. Коронарограма ЛКА у пацієнтки С. після стентування ПМШГ ЛКА у правій косій проекції з краніальним відхиленням
Рис. 3. Коронарограма ЛКА у пацієнтки С. після стентування ПМШГ ЛКА у правій косій проекції з краніальним відхиленнямАневризму ПКА ендопротезовано стент-системою Graft Master 3,5×26 мм (12 атм) з гарним ангіографічним результатом (рис. 4).
Одразу після коронарного втручання хвора отримала навантажувальну дозу клопідогрелю. Надалі пацієнтці рекомендовано прийом клопідогрелю по 75 мг/добу протягом року та ацетилсаліцилової кислоти (АСК) 100 мг/добу пожиттєво з обов’язковою корекцією АТ і рівня ліпідів крові.
Клінічний випадок № 2
У серпні 2008 р. в Інститут поступив пацієнт О., 22 роки, з діагнозом ішемічної хвороби серця (ІХС) та перенесеним інфарктом міокарда в анамнезі. На момент госпіталізації хворий скарг не мав. За 2 тижні до цього пацієнт був доправлений у районну лікарню зі скаргами на різкий біль у ділянці серця, який тривав кілька годин, з попереднім діагнозом гострого коронарного синдрому (ГКС). Зі слів хворого ці скарги з’являлися періодично протягом кількох останніх днів.
Пацієнту було виконано низку стандартних досліджень, у тому числі ЕКГ, ЕхоКГ. На ЕКГ зареєстровано синусовий ритм із частотою серцевих скорочень (ЧСС) 90 уд/хв. Електрична вісь серця – не відхилена. Зафіксовано зміни у вигляді дугоподібного підйому над ізолінією сегмента S-T у відведеннях V2-V3 (різко виражена елевація +9-15 мм); у відведеннях I, AVL, V4-V5 – помірно виражена елевація.
Під час виконання ЕхоКГ виявлено виражену гіпокінезію передньої стінки та верхівки ЛШ, фракція викиду (ФВ) становила 50%. На підставі цього діагностовано перенесений інфаркт міокарда передньої стінки ЛШ.
Пацієнта було направлено в Інститут для проведення додаткових діагностично-лікувальних заходів.
Після докладного збору анамнестичних даних стало відомо, що рік тому в пацієнта спостерігалися епізоди підвищення температури тіла до фебрильних цифр, що погано піддавалися антипіретичній терапії та були резистентні до антибіотиків, а також висипання на тілі, які були розцінені як алергічна реакція на медикаменти, та артралгії. З приводу вищеописаних скарг пацієнт був госпіталізований у центральну районну лікарню з діагнозом «гостре респіраторне вірусне захворювання, тяжкий перебіг, гіпертермічний синдром; атопічний дерматит; ексудативний перикардит». В аналізах крові прискорена ШОЕ до 64 мм/год, лейкоцитоз до 14,4×1012/л з паличкоядерним зсувом до 17%, С-реактивний білок +++, результат аналізу на антистрептолізин-О крові – негативний. За результатами загального аналізу сечі – лейкоцитурія, за показниками ЕхоКГ – ознаки ексудативного перикардиту. Пацієнту проведено антибактеріальну терапію, терапію глюкокортикостероїдами, на тлі якої спостерігалась певна позитивна динаміка.
Хворого було виписано за місцем проживання з рекомендаціями повторного огляду через місяць. Однак у зв’язку з відсутністю скарг він протягом року до лікарів не звертався.
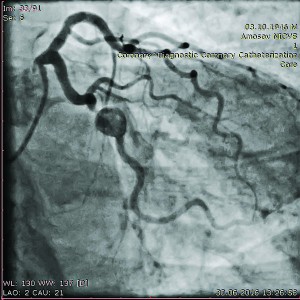
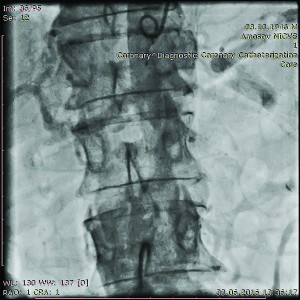
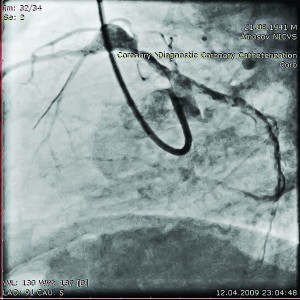
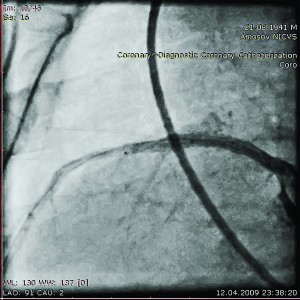
В Інституті пацієнтові виконано комплекс діагностичних процедур. На ЕКГ виявлено синусовий ритм із ЧСС 86 уд/хв, незначну елевацію сегмента S-T у відведеннях V2-V3 (+2-3 мм). Під час ЕхоКГ зафіксовано помірну гіпокінезію передньої стінки і верхівкового сегмента ЛШ. ФВ ЛШ – 52%. При проведенні КВГ виявлено аневризму ПМШГ ЛКА, а також зниження скоротливості передньо-бокового та верхівкового сегментів ЛШ. При цьому збережено гарний кровотік коронарними артеріями (рис. 5, 6).
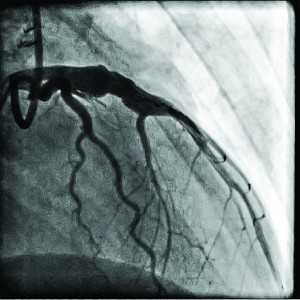 Рис. 5. Коронарограма пацієнта О. з аневризмою проксимального відділу ПМШГ ЛКА у правій косій проекції з краніальним відхиленням до стентування
Рис. 5. Коронарограма пацієнта О. з аневризмою проксимального відділу ПМШГ ЛКА у правій косій проекції з краніальним відхиленням до стентування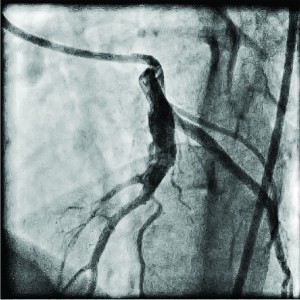 Рис. 6. Коронарограма пацієнта О.
Рис. 6. Коронарограма пацієнта О.з аневризмою проксимального відділу
ПМШГ ЛКА у лівій косій проекції з
краніальним відхиленням до стентування
На підставі даних анамнезу, результатів ЕКГ, ЕхоКГ, КВГ пацієнту встановлено діагноз «хвороба Кавасакі, що ускладнена аневризмою ПМШГ ЛКА і, як наслідок, перенесеним інфарктом міокарда».
Враховуючи розміри та локалізацію аневризми, було прийнято рішення виконати ендопротезування ПМШГ ЛКА з імплантацією стент-графту в проксимальний відділ артерії з метою закриття «вхідних воріт» утворення для запобігання рецидиву інфаркту міокарда. Для збереження кровотоку в значущих 1-й септальній і 1-й діагональній гілках – виконати ендопротезування дистальної частини аневризми ПМШГ ЛКА з використанням металевих («непокритих») стентів.
Під час проведення втручання проксимальну частину аневризми було закрито системою стент-графт JOSTENT GraftMaster 3,5×16,0 мм, середню – з використанням двох «непокритих» стентів Driver 4,5×24,0 мм, Driver 3,0×15,0 мм. На контрольних ангіограмах зафіксовано значне зниження надходження контрастної речовини в порожнину аневризми, формування основного ходу ПМШГ ЛКА при збережених бокових гілках.
Пацієнта виписано на другий день після операції під спостереження кардіолога за місцем проживання і рекомендовано прийом АСК 100 мг/добу і клопідогрелю – 75 мг/добу. Через місяць виконано контрольну коронарографію, результати якої показали повне виключення порожнини аневризми з кровообігу зі збереженням гарного кровотоку по ЛКА (рис. 7, 8). Хворого виписано з рекомендаціями пожиттєвого прийому АСК 100 мг/добу і клопідогрелю 75 мг/добу протягом 1 року.
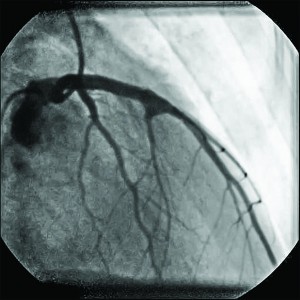 Рис. 7. Коронарограма ЛКА у пацієнта О.
Рис. 7. Коронарограма ЛКА у пацієнта О.у правій косій проекції з краніальним
відхиленням через місяць після стентування
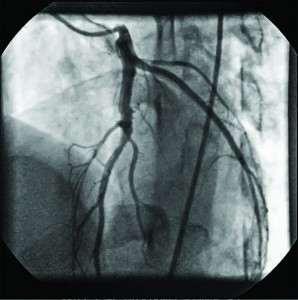 Рис. 8. Коронарограма ЛКА у пацієнта О.
Рис. 8. Коронарограма ЛКА у пацієнта О.у лівій косій проекції з краніальним
відхиленням через місяць після стентування
Клінічний випадок № 3
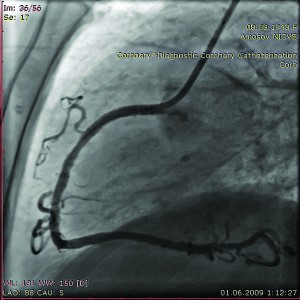
Цей клінічний випадок є яскравим прикладом АКА атеросклеротичного генезу в поєднанні з некардіальною аневризмою судини. У червні 2016 р. в Інститут було госпіталізовано хворого Д., 69 років, зі скаргами на загрудинні болі під час фізичного навантаження. Пацієнт страждає на ІХС протягом останніх трьох років. Результати ЕКГ виявили дрібновогнищеві зміни задньо-бокової стінки ЛШ. При ЕхоКГ встановлено гіпокінезію задньої стінки ЛШ, ФВ при цьому збережена і становить 56%. Крім того, при ультразвуковій діагностиці (УЗД) виявлено аневризму інфраренального відділу аорти діаметром 6,2 см із пристінковим тромбозом. Пацієнт має також супутній цукровий діабет 2 типу в стадії компенсації. За результатами КВГ, ПМШГ ЛКА – прохідна, 30% стеноз у проксимальній третині та інрамуральний хід з компресією до 70% у середній третині; 90% стеноз середньої третини ОГ ЛКА та відразу за ним – мішковидна аневризма судини зі сповільненим кровотоком у дистальному руслі артерії (рис. 9);
ПКА – прохідна, в проксимальній третині виявлено 30% стеноз та аневризматичне розширення гілки гострого краю в середній та дистальній частинах (рис. 10);
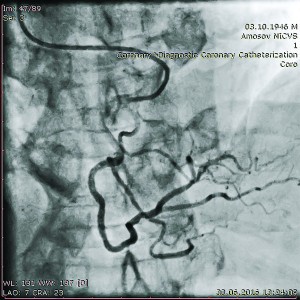 Рис. 10. Коронарограма пацієнта Д.
Рис. 10. Коронарограма пацієнта Д.з аневризматичним розширенням
гілки гострого краю ПКА в лівій косій
проекції
скоротливість ЛШ – збережено. Під час аортографії низхідної частини аорти виявлено інфраренальну аневризму 65 мм у діаметрі (рис. 11).
За даними КТ, у пацієнта нижче відходження ниркових артерій виявлено аневризму аорти з максимальним діаметром 60 мм, протяжністю 125 мм до рівня біфуркації, з масивними напівциркулярними й циркулярними пристінковими масами та максимальним діаметром просвіту 40 мм; довжина проксимальної шийки аневризми – 10 мм, діаметр – 25 мм; ознак екстравазації контрастної речовини немає. Під час консультації з хірургами відділення патології аорти прийнято рішення виконати поетапне лікування хворого. З метою уникнення геморагічних ускладнень першим етапом проведено хірургічне усунення аневризми інфраренального відділу аорти за допомогою протезу. Після видалення дренажів другим етапом пацієнтові виконано ендопротезування ОГ ЛКА: після предилатації субтотального стенозу середньої третини артерії балоном-катетером 2,5×10,0 мм (12 атм) імплантовано стент-систему GraftMaster 3,5×26,0 мм (18 атм) з гарним ангіографічним результатом. Порожнина аневризми «виключена» з коронарного кровотоку (рис. 12).
Пацієнту після отримання навантажувальної дози клопідогрелю (600 мг) рекомендовано прийом цього препарату в дозі 75 мг/добу протягом року та АСК 100 мг/добу пожиттєво.
Клінічний випадок № 4
У 2009 р. в Інститут був госпіталізований пацієнт Д., 67 років, з діагнозом аортального стенозу ІV ступеня з кальцинозом 3+, аневризматичним розширенням висхідної аорти та ІХС. Під час ЕхоКГ виявлено комбіновану ваду серця з перевагою стенозу (градієнт систолічного тиску на аортальному клапані становив 75 мм рт. ст., зворотний тік +, кальциноз +++), двостулковий аортальний клапан, аневризматичне розширення висхідної аорти до 4,5 см, ФВ ЛШ – 48%. Під час КВГ, окрім ураження аортального клапана, виявлено аневризму проксимальної третини ПМШГ ЛКА, 50% стеноз перед аневризмою, видимих атеросклеротичних звужень у басейнах інших коронарних артерій немає, тиск у легеневій артерії – 35 мм рт. ст. (рис. 13).
Після консультування з хірургами відділення хірургічного лікування набутих вад серця прийнято рішення першим етапом виконати ендопротезування аневризми ПМШГ ЛКА. Після предилатації 50% стенозу проксимальної третини артерії балоном-катетером 2,5×20,0 мм виконано стентування зони звуження і аневризми ендопротезом Graftmaster 3,0×19,0 мм. На контрольній ангіограмі – дисекція артерії по дистальному краю стенту, у зв’язку з чим імплантовано додатковий стент CHRONO 3,0×16,0 мм (12 атм) (рис. 14).
Пацієнтові після отримання навантажувальної дози клопідогрелю (600 мг) рекомендовано прийом цього препарату в дозі 75 мг/добу та АСК 100 мг/добу протягом 3 міс з наступним протезуванням аортального клапана та корекцією звуження висхідної аорти.
Клінічний випадок № 5
Цей клінічний випадок є яскравим прикладом поєднання атеросклеротичного звуження і АКА. Пацієнтка Я., 65 років, поступила в Інститут з діагнозом «ІХС, стенокардія напруги ІІІ ФК, гіпертонічна хвороба ІІ Б, стан після стентування ПМШГ ЛКА (2004 р.)». Під час КВГ виявлено 70% стеноз середньої третини ПКА та аневризму проксимальної третини артерії (рис. 15).
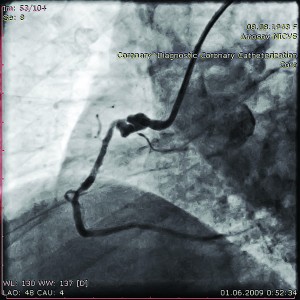 Рис. 15. Ангіограма ПКА у пацієнтки Я.
Рис. 15. Ангіограма ПКА у пацієнтки Я.з аневризмою устя ПКА та 70% стенозом
середньої третини ПКА до стентування
Пацієнтці після предилатації 70% стенозу середньої третини ПКА балоном-катетером 2,5×14 мм (10 атм) виконано ендопротезування артерії стент-системою Multi-Link Vision 3,0×15,0 мм (12 атм) і стентування АКА стент-системою GraftMaster 3,0×26,0 мм (18 атм) (рис. 16, 17).
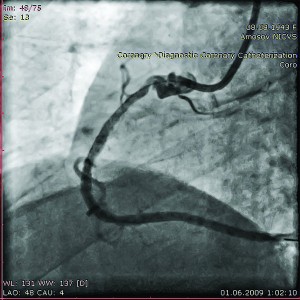 Рис. 16. Ангіограма ПКА у пацієнтки Я.
Рис. 16. Ангіограма ПКА у пацієнтки Я.з аневризмою устя ПКА після
ендопротезування 70% стенозу середньої
третини ПКА
Після отримання навантажувальної дози клопідогрелю (600 мг) рекомендовано прийом цього препарату в дозі 75 мг/добу протягом 1 року та АСК 100 мг/добу пожиттєво.
Клінічний випадок № 6
Доволі рідкісним виявився випадок пацієнта В., 58 років, у якого при КВГ діагностували аневризму середньої третини ПКА. Клінічно хворий скаржився на напади загрудинного болю під час фізичного навантаження. ЕКГ показала дрібновогнищеві зміни у ІІІ відведенні, за результатами ЕхоКГ встановлено гіпокінезію задньої стінки ЛШ. Зважаючи на клініко-ангіографічну картину, прийнято рішення виконати ендопротезування. Стентування аневризми середньої третини ПКА виконано з використанням стент-систем GraftMaster 3,5×19 мм та 3,5×16 мм (18 атм). Контрольна ангіограма показала, що порожнину аневризми виключено з кровотоку. Хворому призначено навантажувальну дозу клопідогрелю (600 мг) одноразово і рекомендовано прийом цього препарату 75 мг/добу і АСК 100 мг/добу. Під час виписки було виконано ЕКГ, яка показала, що дрібновогнищеві зміни відсутні, а при ЕхоКГ гіпокінезію задньої стінки ЛШ визначено не було.
Таким чином, АКА, як правило, самостійно не є небезпечними для пацієнта, однак в деяких випадках, безумовно, погіршують прогноз, особливо в поєднанні з атеросклеротичними ураженнями коронарного русла. Це пов’язано насамперед із неможливістю адекватної колатеральної підтримки з боку артерії, кровотік у якій скомпроментований наявністю аневризматичного розширення. Крім того, наявність АКА підвищує ризик тромбоутворення в цій ділянці з подальшою дисемінацією дистального коронарного русла. Знижений кровотік нижче місця аневризми може не забезпечувати адекватного кровопостачання відповідної анатомічної ділянки. У зв’язку з цим пацієнти з АКА потребують більш ретельного спостереження з метою раннього виявлення та лікування атеросклеротичних стенозів коронарних артерій. Таке спостереження має передбачати обов’язкове виконання контрольної коронарографії не рідше одного разу на рік.
Література
1. Абугов С.А., Сулимов В.А., Удовиченко А.Е. Аневризмы коронарных артерий: три клинических случая. Грудная и сердечно-сосудистая хирургия, 2004, № 6, с. 36.
2. Бабунашвили А.М., Дундуа Д.П., Карташов Д.С. Развитие аневризмы ствола левой коронарной артерии после коронарной ангиопластики. Грудная и сердечно-сосудистая хирургия, 1998, № 3, с. 73.
3. Белозеров Ю.М., Брегель Л.В., Дзизинский А.А., Субботин В.М. Внезапная сердечная смерть при болезни Кавасаки. РМЖ, 2009, № 1, с. 44.
4. Внутренние болезни по Тинсли Р. Харрисону / Под ред. Э. Фаучи, Ю. Браунвальда и др. В 2-х томах. Пер. с англ. – М.: Практика – Мак-Гроу-Хилл (совместное издание), 2002, с. 186-188.
5. Daoud A.S., Pankin D., Tulgan H., Florentin R.A. Aneurysms of coronary artery: report of the ten cases and review of the literature. Am. J. Cardiol., 1963, 11, 228.
6. Eshchar Y., Yanini J.H., Deutsch V., Neufeld H.N. Arteriosclerotic aneurism of the coronary artery. Chest, 1977, 72, 374.
7. McMastin D.E., Stoke A.J., Franch R.H. Multiple coronary aneurisms in a child with angina pectoris. N Engl J Med 1974; 290: 669.