10 грудня, 2016
Магнитно-резонансная томография и ее диагностические возможности в кардиологии
Подобие проявлений при целом ряде патологических состояний и практикующаяся до сих пор постановка окончательного диагноза на основании клинических симптомов очень часто приводят к диагностическим ошибкам. Неправильная диагностика лежит в основе несвоевременного назначения или применения «некорректной» терапии, что в свою очередь влияет на прогноз пациента. При этом на сегодняшний день практическая медицина располагает достаточно большим арсеналом эффективных методов диагностики (и в первую очередь инструментальных), которые позволяют в большинстве случаев избежать диагностических ошибок.
Одним из таких методов является магнитно-резонансная томография (МРТ) – один из самых эффективных методов диагностики в различных отраслях медицины. Данный метод широко применяется для диагностики различных патологий головного и спинного мозга, позвоночника, суставов, органов брюшной полости и малого таза. МРТ позволяет с высокой точностью определить анатомические особенности различных органов и тканей, но в большинстве случаев применяется как метод уточняющей диагностики.
К преимуществам МРТ традиционно относят неинвазивность, отсутствие лучевой нагрузки, многоплоскостное сканирование с возможностью постобработки данных, отображение движущейся крови с функцией оценки скорости и характера кровотока, высокую контрастность мягких тканей [2, 5].
За последние годы отмечается увеличение спроса на исследование сердечно-сосудистой системы с помощью МРТ. МРТ сердца обладает уникальной способностью одновременного получения не только анатомических, но и функциональных характеристик приобретенных и врожденных заболеваний сердца, а с недавнего времени используется также для оценки жизнеспособности миокарда [2, 30].
Вместе с тем широкое внедрение МРТ сердца в клиническую практику сдерживают высокая стоимость оборудования и эксплуатации, специальные требования к помещениям, дефицит высококвалифицированных медицинских кадров. По этим причинам экспертная МРТ-диагностика сердечной патологии доступна, как правило, лишь в крупных специализированных центрах.
Доказано, что для существенного повышения информативности диагностики заболеваний сердца недостаточно лишь грамотного методологического подхода и правильной интерпретации полученных результатов. Для этого необходимо еще правильное применение данного метода, что определяется степенью информированности врачей клинических специальностей о возможностях и месте МРТ сердца в арсенале диагностических методов.
В основе МРТ лежит феномен ядерного магнитного резонанса (ЯМР) – возможность поглощать или испускать энергию радиочастотных импульсов ядрами некоторых веществ (чаще всего водорода), находящихся в магнитном поле, при совпадении частоты импульсов с частотой вращения ядер.
Явление ЯМР в твердых телах и жидкостях впервые успешно наблюдали в 1946 году две группы физиков, работающих независимо друг от друга в Гарвардском (E.M. Purcell, R. Pound и H. Torrey) и Стэндфордском университетах (F. Bloch, W.W. Hansen и М. Packard) [10, 31]. Мир по заслугам оценил их вклад в этой области – за свои работы F. Bloch и E.M. Purcell в 1952 году были удостоены Нобелевской премии по физике [32].
На ранних этапах МРТ использовалась в основном для исследования молекулярной структуры вещества. Началом использования данного метода в клинической практике принято считать 1973 год, когда в журнале «Nature» была опубликована статья P.C. Lauterbur «Создание изображения с помощью индуцированного локального взаимодействия: примеры на основе магнитного резонанса» [17, 32].
Именно P.C. Lauterbur принято считать пионером в получении МР-изображений. Исследователю удалось получить первые изображения с использованием метода реконструкции по проекциям, который он назвал зойматографией (от греческого, зойматография – то, что связывает, упряжка). Этот термин, который позднее был заменен на «ядерно-магнитно-резонансная томография», отражает идею получения изображения внутренних частей объекта с помощью линейных градиентов магнитного поля.
Сам термин «ЯМР-томография» использовался в течение достаточно длительного времени, однако в 1986 году в связи с развитием радиофобии у людей после Чернобыльской аварии он был заменен на «магнитно-резонансная томография».
Именно P.C. Lauterbur изобрел, как использовать градиент магнитного поля, который позволяет определять происхождение радиоволн, излучаемых ядрами объекта исследования. Эта информация позволяет воссоздать двумерную картину организма [21].
Интересно, что первый магнитно-резонансный томограф, созданный P.C. Lauterbur, до сих пор находится в Нью-Йоркском университете в Стоуни-Брук.
Продолжателями исследований применения МРТ для медицинских целей стали шведские исследователи E. Оdeblad и G. Lindstrom, которые опубликовали первые результаты регистрации ЯМР на живых клетках из вырезанных тканей животных [29].
В конце 1960-х годов J. Hutchinson из Абердинского университета (Шотландия) начал изучать магнитно-
резонансный и электронный парамагнитный резонанс in vivo на мышах [21, 32].
В 1967 году A. Ganssen получил патент на ЯМР – прибор для исследования кровотока в теле человека [13]. Прибор был предназначен для измерения ЯМР-сигнала от текущей крови на разных участках кровеносного сосуда с помощью нескольких небольших катушек, позволяющих рассчитать скорость кровотока в сосуде. Этот прибор можно считать первым МР-томографом, хотя он и не был предназначен для получения изображений [21].
В конце 70-х годов профессор физики Ноттингемского университета P. Mansfield усовершенствовал математические алгоритмы получения изображения, благодаря чему стало возможным не только получение более четкого изображения, но и, что самое главное, уменьшение длительности проведения сканирования с нескольких часов до нескольких секунд.
В 1975 году P. Mansfield и A.А. Maudsley создали линейный метод, с помощью которого в 1977 году получили первое in vivo изображение человека – поперечный срез пальца. А в 1978 году P. Mansfield представил первое изображение брюшной полости [21].
Именно благодаря работам P.C. Lauterbur и P. Mansfield стало возможным использование данного метода в медицине для получения изображений целого организма, за что в 2003 году авторы стали лауреатами Нобелевской премии [32].
В последние годы МРТ также стала одним из ведущих методов неинвазивной диагностики в кардиологии. Воздействие электромагнитного поля позволяет в первую очередь рассмотреть состояние не только мягких тканей, но и сосудов. МРТ является одним из важнейших методов, применяемых для диагностики широкого спектра патологий сердечно-сосудистой системы. Данный метод позволяет диагностировать или уточнить степень нарушений при врожденных и приобретенных пороках сердца, выявлять опухоли, тромбы и другие образования в сердце. Применение МРТ позволяет получить важную информацию при ишемической болезни сердца (ИБС) и кардиомиопатиях (КМП).
МРТ является безопасным для обычного пациента методом диагностики, при условии соблюдения соответствующих правил техники безопасности. Несмотря на то что сильное магнитное поле не является вредным само по себе, имплантированные медицинские устройства, которые содержат металл, могут испортиться или работать не корректно.
Абсолютными противопоказаниями для проведения МРТ-исследования являются:
1) установленный искусственный водитель ритма;
2) ферромагнитные или электронные имплантаты;
3) большие металлические имплантаты;
4) первый триместр беременности.
Требуется осторожность при выполнении МРТ-исследования с контрастом у больных с:
• гемопоэтической анемией;
• индивидуальной непереносимостью компонентов контрастного средства – КС (почти в 2% случаев может быть развитие побочных реакций при внутривенном (в/в) введении КС, которые обычно легко купируются с помощью медикаментозных средств);
• хронической болезнью почек – единственным серьезным осложнением МРТ при введении высоких доз гадолиния является развитие нефрогенного системного фиброза у пациентов с исходными нарушениями функции почек. Тщательное обследование функции почек до введения контраста сводит к минимуму риск этого очень редкого, однако серьезного осложнения;
• беременность в любом сроке – так как КС проникает через плацентарный барьер.
Благодаря быстрому техническому прогрессу, совершенствованию оборудования и программного обеспечения МРТ-метод продолжает развиваться и находить новые сферы применения в диагностике болезней сердца и сосудов.
Наиболее качественные и информативные исследования возможны с применением томографов напряженностью магнитного поля не ниже 1,5 Тл, имеющих современное программное обеспечение. Применяемые для исследования сердца программные комплексы можно разделить на две группы. К первой относятся исследования, при которых сигнал от быстро текущей крови будет низкой интенсивности (образы с «темной кровью»). Эти изображения выполняются для оценки анатомии магистральных сосудов и камер сердца [1, 2].
Примером таких импульсных последовательностей (ИП) являются:
1. «Спиновое эхо» (spinecho, SE) – наиболее часто используемая ИП, которую предложили еще H.Y. Carr и E.М. Purcell на заре МРТ. Изображения, полученные с помощью SE ИП, как правило, менее чувствительны к неоднородностям магнитного поля и парамагнетикам и характеризуются меньшими геометрическими искажениями, т.е. соответственно более резкими контурами. В кардиовизуализации SE ИП используется для оценки морфологии сердца и магистральных сосудов. Единственным недостатком SE ИП является относительно большое время сканирования.
2. Турбо спин-эхо с задержкой дыхания (TSE, FSE, breath hold).
3. «Инверсия-восстановление» (Inversion Recovery, IR) – преимуществом IR ИП является получение сильного контраста между тканями, имеющими разное время T1 релаксации. Существуют разные виды IR ИП:
• FLAIR (Fluid Attenuation Inversion Recovery) – используется для удаления сигнала от свободной воды;
• STIR (Short T1 Inversion Recovery) – ИП, чувствительная к стационарным (не движущимся) жидкостям;
• PSIR (Phase-sensitive Inversion Recovery) – подавление сигнала от миокарда. Режим инверсии (CE-IR) с отсроченной регистрацией МР-сигнала позволяет достичь оптимальной контрастности нормального и патологически измененного миокарда путем подавления сигнала от нормального миокарда после в/в усиления (визуализация некроза, рубцовой ткани). Недостаток этих последовательностей в том, что
дополнительный инвертирующий радиочастотный импульс увеличивает продолжительность сканирования.
Ко второй группе ИП относятся исследования, при которых сигнал от движущейся крови будет высокой интенсивности – так называемые образы со «светлой кровью», которые обеспечиваются градиентными последовательностями (GRE), дающими возможность получения кино-МРТ [1, 2].
«Кино-режим» – при проведении динамической МРТ осуществляется функциональная оценка сердечной деятельности, для которой используется новый режим получения изображения со сбалансированной устойчивой прецессией (b-SSFP). Позволяет производить точный анализ локальной функции (экскурсия стенки сердца и изменение ее толщины), получать количественную характеристику желудочков и всей сердечной мышцы, описывать аномальный кровоток (например, усиление кровотока через суженное отверстие аортального клапана у пациентов с обструктивной формой гипертрофической КМП (ГКМП) и, как следствие, митральной регургитации). Кино-МРТ версии имеют оригинальные названия у разных фирм – производителей оборудования: Turbo FLASH (SIEMENS), fast SPGR (General Electric) и TFE/FFE (Philips), параметры таких последовательностей настраиваются с учетом сердечного ритма и способности пациента к задержке дыхания. Последние разработки GRE последовательностей отличает высокая дифференцировка миокарда и кровяного бассейна: true FISP (SIEMENS), balanced FFE (Philips) или FIESTA (General Electric).
4. «Фазово-контрастная МРТ» (Phase-Сontrast, PC) – дает изображения скорости кровотока, и сигнал содержит как амплитудную, так и фазовую информацию. При этом чувствительность к потоку определяется силой градиента. Преимущество PC МРТ – полное подавление стационарных тканей (нет скорости – нет сигнала). Однако у данной методики существует и недостаток – фазовую чувствительность можно получить только вдоль одной оси одновременно. Поэтому данная методика может применяться для уточнения степени тяжести сопутствующей клапанной патологии сердца.
5. «Динамическая МРТ в режиме реального времени» – метод обладает значительным потенциалом для описания влияния дыхательных движений на заполнение камер сердца (выявление пациентов с рестриктивным типом кровотока, что характерно для рестриктивной КМП и констриктивного перикардита).
6. Магнитно-резонансная ангиография (MP-ангиография) – показывает 3D изображение органа и позволяет визуализировать кровеносные сосуды даже без применения контрастного вещества.
Роль МРТ как метода исследования сердечно-сосудистой системы значительно возросла в связи с появлением и распространением методик с отсроченным контрастированием миокарда. Широкое использование КС для выполнения МРТ сердца началось с конца 90-х годов [33]. В настоящее время в клинической практике применяется целый ряд низкомолекулярных внеклеточных парамагнитных КС для в/в введения на основе гадолиния: Gd-DTPA (магневист), GD-DTPA-BMA (омнискан), гадоверсетамид (опти-марк), Gd-DOTA (дотарем), GD-DO3A (прохэнс).
Механизм отсроченного контрастирования миокарда базируется на двух принципах. Во-первых, хелаты
гадолиния являются внеклеточными контрастными агентами, которые по структуре своей инертны и не могут проникать через неповрежденную мембрану миоцитов. Во-вторых, в неповрежденном миокарде миоциты плотно прилегают друг к другу таким образом, что основной объем (около 85%) составляет внутриклеточное пространство. В неповрежденном миокарде основная часть КС, введенного в/в, остается в сосудистом русле и лишь незначительная его часть выходит в интерстициальное пространство. За счет перераспределения и выведения почками концентрация КС уже в первые минуты быстро снижается. Поэтому количество молекул гадолиния, задерживающихся в здоровом миокарде, сравнительно невелико. При остром повреждении кардиомиоцитов происходит нарушение целостности клеточных мембран, что позволяет контрастному препарату диффундировать в то пространство, которое ранее было внутриклеточным [15, 18, 22-24].
Накопление КС в некротической и рубцовой ткани обусловлено увеличением в этих участках относительного объема внеклеточного пространства. Вследствие этого увеличивается объем распределения внеклеточного КС, которое не только содержится в более высокой концентрации, но и дольше выводится [8, 14, 18].
Методология МРТ сердца с отсроченным контрастированием гадолинием заключается в том, что через 10-20 мин после в/в введения контрастного препарата (0,1-0,2 ммоль/кг) выполняется Т1-взвешенная МР-ИП с синхронизацией с электрокардиографией (ЭКГ). Различают раннюю фазу контрастирования, при которой можно выявить гиперваскуляризацию в очагах активного воспаления или очаги микрососудистой обструкции (первые 1-3 мин введения гадолиния) и позднюю фазу (10-20 мин), при которой видны зоны некроза и фиброза.
На сегодняшний день МРТ широко применяется для диагностики различных видов патологий сердечно-сосудистой системы. Однако следует подчеркнуть, что метод МРТ в ряде случаев используется лишь на втором этапе диагностики сердечно-сосудистых заболеваний, после выполнения лабораторных и других инструментальных методов исследования. Чаще всего МРТ применяется в тех случаях, когда возникает необходимость в уточнении патологических изменений [4, 5].
Патология клапанного аппарата. У таких пациентов МРТ часто применяется при необходимости уточнения результатов эхокардиографии (ЭхоКГ). Проведение МРТ сердца позволяет не только обнаружить пораженный клапан, но и определить анатомические и функциональные особенности работы клапанного аппарата, выявить, как поражение клапана отразилось на окружающих тканях и функционировании органа в целом. Проведение МРТ дает важнейшую информацию у пациентов с онкологической патологией, подвергшихся лучевой и химиотерапии. У таких больных проведение МРТ-исследования позволяет не только диагностировать степень поражения клапанного аппарата, но и прогнозировать возможность и успех хирургического лечения.
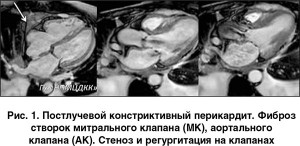
Новообразования. В настоящее время МРТ считается наиболее предпочтительным методом диагностики опухолей сердца. Основные преимущества МРТ – высокое пространственное разрешение, широкое поле исследования, высокое отличие МР-сигнала между движущейся кровью и камерами сердца без необходимости применения контрастных агентов, возможность мультипланарной реконструкции. Кроме того, с помощью применения КС возможно четкое определение границ опухоли (в том числе при выходе за пределы стенки миокарда) и степени ее васкуляризации [19].
Выявление тромбов. Для выявления тромбов МРТ сердца и сосудов может быть назначена у пациентов, перенесших инфаркт миокарда, или с фенотипом КМП с дилатацией. Своевременная диагностика
внутрисердечных тромбов имеет особое значение из-за риска возникновения смертельных осложнений в случае их отрывов [4].
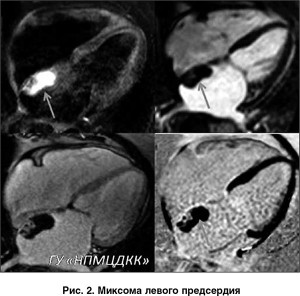
Ишемическая болезнь сердца. Первые работы, посвященные отсроченному контрастированию, были связаны с изучением изменений миокарда (острых и хронических) именно у больных с ИБС. В экспериментальном исследовании на собаках R.J. Kim и соавт. показали высокую сопоставимость результатов МРТ с отсроченным контрастированием и данных аутопсии по выявлению острого инфаркта миокарда (ОИМ) [16].
В настоящее время возможности МРТ в диагностике ИБС довольно широки. Контрастирование препаратами гадолиния позволяет в режиме реального времени проводить наблюдение за тем, в каких местах миокарда снижено кровоснабжение, оценивать способность к сокращению. Особенно высоки возможности МРТ в выявлении небольших субэндокардиальных инфарктов и поражения папиллярных мышц левого желудочка (ЛЖ) [12].
МРТ с отсроченным контрастированием позволяет не только выявлять, но и дифференцировать острые и хронические повреждения миокарда. Так, у больных с ОИМ область поражения выглядит как гиперинтенсивный участок, часто неоднородной структуры, с нечеткими границами, возможно утолщение стенок на фоне отека. Для хронического поражения и постинфарктного кардиосклероза (ПИКС) характерным является очень четкий контур пораженного участка, сочетающийся с истончением стенки и/или усилением трабекулярности субэндокардиальных отделов миокарда.
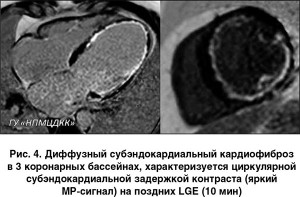
Для ишемического поражения миокарда (ОИМ, ПИКС) характерны следующие признаки:
1) контрастный препарат накапливается в сегментах миокарда, соответствующих бассейнам коронарных артерий;
2) накопление контрастного препарата всегда имеет субэндокардиальный или трансмуральный характер.
Большое прогностическое значение имеет МРТ с отсроченным контрастированием, проводимое для оценки жизнеспособности миокарда. Данная методика является одной из самых информативных в оценке состояния миокарда при ИБС. С помощью болюсного контрастирования гадолиний-содержащими препаратами и применения GRE последовательностей имеется возможность наблюдать за интенсивностью контрастного усиления миокарда практически в режиме реального времени. Наблюдая за динамикой контрастирования, можно точно и быстро определить зону, опаздывающую с накоплением контрастного препарата, что документирует снижение перфузии в конкретном участке. Также имеется возможность оценки сократительной способности в зоне интереса.
Точная количественная оценка зон фиброза и жизнеспособной ткани позволяет не только оценить необходимость и возможный эффект реваскуляризации, но и судить об электрофизиологической стабильности миокарда, прогнозируя развитие жизненно опасных нарушений ритма.
Кардиомиопатии. На сегодняшний день МРТ выходит на лидирующие позиции в диагностике различного вида КМП.
Гипертрофическая КМП. Характер контрастирования миокарда у больных с ГКМП отличается разнообразием: у одного пациента могут встречаться зоны как трансмурального, так и не трансмурального, как субэпикардиального, так и субэндокардиального контрастирования (рис. 5). Выраженность контрастного усиления возрастает со степенью гипертрофии и обратно пропорциональна функции ЛЖ. Вместе с тем наличие и объем участков отсроченного контрастирования коррелируют не только с толщиной миокарда и систолической дисфункцией, но и с развитием желудочковых аритмий – основной причиной развития внезапной сердечно-сосудистой смерти у таких пациентов.
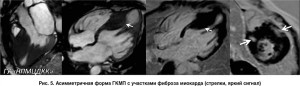
Полагают, что очаговая задержка вымывания гадолиния при ГКМП происходит потому, что миофибриллы при данной патологии расположены беспорядочно и в них имеется расширенное интерстициальное пространство. По другим данным, в основе контрастирования лежит повышенное содержание коллагена в гипертрофированном миокарде [3, 28].
Отличительной особенностью контрастирования миокарда при ГКМП является несоответствие областям распределения коронарного кровотока (так называемый неишемический тип контрастирования), контрастирование миокарда при данной КМП носит фрагментарный характер с множественными фокусами, расположенными преимущественно в средних сегментах желудочковой стенки, а также в месте соединения перегородки со свободной стенкой правого желудочка (ПЖ) [9, 15].
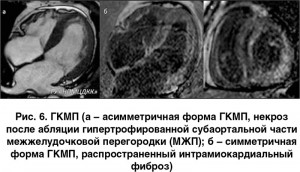
Аритмогенная дисплазия правого желудочка (АДПЖ). В настоящее время постановка диагноза АДПЖ основана на выявлении не только клинических, функциональных и электрофизиологических, но и (благодаря МРТ) морфологических признаков [34]. В 1994 году Европейским кардиологическим обществом, а также Международной федерацией кардиологов был приняты рекомендации по диагностике АДПЖ, куда были включены большие и малые критерии, в том числе на основании данных МРТ [27]. Данные критерии были высокоспецифичными, однако их чувствительность, согласно анализу существующих публикаций, оказалась недостаточно высокой. В 2010 году опубликованы пересмотренные критерии диагностики АДПЖ, основанные преимущественно на количественной оценке объема и функции ПЖ, что позволило повысить их специфичность в диагностике данной КМП [25]. МРТ сердца с контрастированием способно выявить структурные и функциональные изменения, специфические для данного заболевания: констатировать наличие локальных аневризм ПЖ, тотальную или сегментарную дилатацию наружной стенки правого ПЖ, его региональную гипокинезию, и, наконец, напрямую отобразить замещение соединительно-жировой тканью наружной стенки миокарда ПЖ. Хотя этот признак пока не входит в основные критерии современной диагностики АДПЖ, однако именно выявление участков миокардиального фиброза в стенках желудочков может быть тем дополнительным критерием, который склоняет чашу весов в сторону диагноза АДПЖ.
Обструктивная кардиомиопатия. Обструктивная КМП – наименее распространенная форма миокардиальной дисфункции. Фенотип данной КМП может быть как идиопатическим, так и являться следствием системных заболеваний соединительной ткани, инфильтративных заболеваний миокарда (в первую очередь амилоидоз), болезней накопления (болезнь Фабри, болезни накопления гликогена) и т.д.
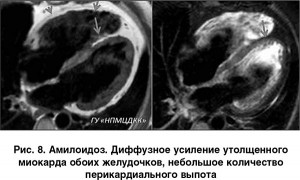
МРТ-картина данного заболевания включает в себя деформацию и уменьшение полости ЛЖ и (или) ПЖ сердца, гипертрофию их стенок, недостаточность митрального или трехстворчатого клапана и, как следствие, дилатацию предсердий. МРТ с поздним контрастированием выявляет негомогенное диффузное или субэндокардиальное накопление КС в миокарде на фоне выраженной гипертрофии. Характер накопления отличается от такового при всех остальных заболеваниях сердца. Как правило, у больных с амилоидозом сложно правильно определить время инверсии, что создает впечатление диффузного гиперконтрастирования [20].
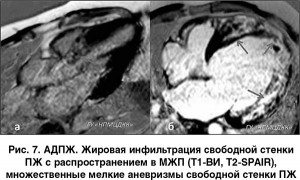
Накопление контрастного препарата описано также для других болезней накопления, в частности, нарушений накопления гликогена (болезнь Данона и LAMB-КМП). Контрастный препарат накапливается в таких случаях в наиболее утолщенных сегментах миокарда, чаще в базальных сегментах боковой стенки и МЖП. Накопление может быть интрамиокардиальным или трансмуральным [6].
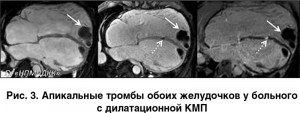
Дилатационная КМП (ДКМП). МРТ является методом выбора в случаях проведения дифференциальной диагностики ДКМП и кардиомегалии другой этиологии [26].
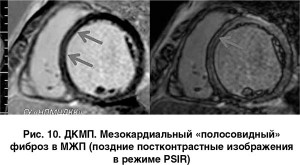
Очаги накопления контрастного препарата, которые могут быть отмечены в миокарде больных с ДКМП, как правило, имеют линейную форму и располагаются интрамиокардиально (рис. 10). Области накопления контраста на LGE отражают местную дегенерацию миокарда, зоны фиброза или некроза. Их вид и расположение не соответствуют бассейнам коронарных артерий и их ветвей, что позволяет дифференцировать ДКМП от ишемической КМП. Кроме того, МРТ с контрастированием является одним из ведущих методов дифференциальной диагностики ДКМП и воспалительных заболеваний миокарда.
Миокардиты. При воспалительных процессах в миокарде симптоматика неспецифична, что нередко осложняет диагностику. МРТ сердца с контрастированием позволяет дать не только объективную картину кардиальной дисфункции, но и выявить точную локализацию очага воспаления.
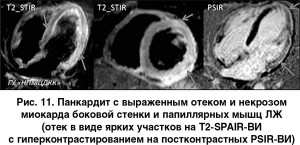
Механизмы, лежащие в основе контрастирования очагов воспаления при миокардите, схожи с патофизиологией накопления контрастного препарата при ишемическом повреждении. Воспаление миокарда сопровождается (в острую фазу) отеком тканей и клеток, а в дальнейшем – повреждением сарколеммных мембран и некрозом кардиомиоцитов. Отек миокарда в острую фазу поражения проявляется несколькими симптомами: наиболее точно он оценивается как утолщение миокарда на кино-МРТ, повышение интенсивности МР-сигнала от пораженных сегментов на Т2-ВИ, накопление контрастного препарата в участках поражения в раннюю и в отсроченную фазы, вследствие изменения объемов внеклеточной и внутриклеточной жидкости [11]. Наиболее информативным для диагностики миокардита является наличие характерных изменений сразу в двух из этих режимов: чувствительность составила 76%, специфичность – 95,5%, а диагностическая точность – 85%. 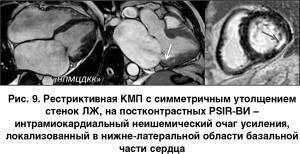
Для поражения сердца воспалительной природы характерны:
1) локализация очагов никогда не совпадает с бассейнами коронарных артерий;
2) как правило, накопление контрастного препарата бывает менее ярким, чем при ишемическом поражении и отличается меньшей четкостью контуров;
3) накопление контрастного препарата редко имеет субэндокардиальный характер, наиболее типично субэпикардиальное или интрамуральное контрастирование.
Основным показанием для проведения МРТ является выявление объективных признаков поражения сердца и клинических проявлений, возникших de novo после перенесенной вирусной инфекции. МРТ сердца также следует проводить лицам с загрудинной болью, повышением уровней тропонинов и отсутствием
гемодинамически значимых стенозов венечных сосудов при коронарографии – т.е. с инфарктоподобным течением заболевания. У таких больных МРТ-признаки воспаления миокарда наблюдают приблизительно в 30% случаев. Согласно Объединенному консенсусу экспертов Американской ассоциации сердца, Американской коллегии кардиологов, Североамериканского общества магнитно-резонансной томографии и Американской коллегии радиологов по применению МРТ для диагностики заболеваний сердечно-сосудистой системы, принятому в 2010 году, повторное проведение МРТ в период между первой и второй неделей от инициального исследования показано в том случае, если при первичном исследовании отсутствуют МР-критерии миокардита, однако сохраняются клинические симптомы, или присутствует только один МР-признак [7].
Для хронической фазы миокардита характерно формирование зон поствоспалительного фиброза, что проявляется на МРТ в виде отсроченного контрастирования в участках рубцового изменения миокарда.
Принципиальное значение имеет проведение повторных МРТ-исследований, которые позволяют оценить эффективность фармакологической терапии и дают возможность клиницистам в определенной мере прогнозировать исход заболевания.
Таким образом, применение МРТ сердца существенно повышает точность диагностики у пациентов с различными заболеваниями сердечно-сосудистой системы. Технические достижения в области МРТ
позволяют не только визуализировать структурные изменения миокарда, регистрировать аномальное движение его стенок, но и с высокой точностью рассчитывать такие параметры, как объемы камер сердца и масса миокарда. Более того, уникальные диагностические возможности МРТ сердца позволяют предоставлять не только анатомическую, но и функциональную информацию о сердце.
Уже не вызывает сомнений, что эффективность терапевтического и особенно хирургического лечения пациентов с целым рядом заболеваний сердечно-сосудистой системы может быть выше и безопаснее при правильном обследовании больных с помощью МРТ.
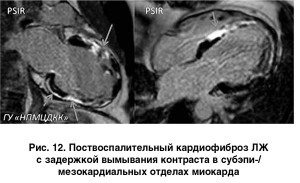
Особую роль методика МРТ сердца с отсроченным контрастированием гадолинием играет в уточнении этиологии КМП. МРТ сердца помогает выявить отек, инфильтрацию, фиброзные и воспалительные изменения в миокарде, что дает МРТ преимущества перед другими методами диагностики.
Известно, что биопсия миокарда, которая рассматривается как «золотой стандарт» в диагностике некоронарогенных поражений миокарда, также имеет ограничения и не всегда оправдывает всех возложенных на нее надежд. За последние 20 лет именно опыт МРТ показал, что участки патологических изменений в миокарде при КМП и миокардитах часто локализуются субэпикардиально или интрамурально и практически недоступны для биопсии, выполняемой из ПЖ.
МРТ позволяет не только выполнять виртуальную биопсию миокарда у таких пациентов, но и повысить точность и информативность эндомиокардиальной биопсии у больных с некоронарогенными болезнями миокарда. Можно надеяться, что более широкое применение МРТ и разработка и внедрение ее новых методик позволят еще больше расширить диагностические возможности данного метода в кардиологии.
Литература
1. Марусина М.Я., Казначеева А.О. Современные виды томографии: учебное пособие. – СПб.: СПбГУ ИТМО, 2006. – 132 с.
2. Силин А.Ю., Лесняк В.Н. Магнитно-резонансная томография сердца в клинической практике // Клиническая практика. – 2013. – № 1. – С. 67-76.
3. Синицын В.Е., Мершина Е.А., Ларина О.М. Возможности магнитно-резонансной томографии в диагностике кардиомиопатии // Клин. и эксперимент. хир. журн. им. акад. Б.В. Петровского. – 2014. – № 1. – С. 54-63.
4. Стукалова О.В. Магнитно-резонансная томография сердца с отсроченным контрастированием – новый метод диагностики заболеваний сердца // REJR. – 2013. – Том 3. – № 1. – С. 7-17.
5. Федьків С.В. Магнітно-резонансна томографія як сучасний метод візуалізації в кардіології // Серцева недостатність. – 2013. – № 2. – С. 5-13.
6. Шрейдер Е.В., Базаева Е.В., Стукалова О.В. и др. Болезнь накопления гликогена: синдром Данона // Кардиология. – 2012. – № 1. – С. 91-96.
7. ACCF/ACR/AHA/NASCI/SCMR2010 Expert Consensus Documenton Cardiovascular Magnetic Resonance. A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents // J. Am. Coll. Cardiol. – 2010. – Vol. 55(23). – P. 2614-2662.
8. Adzamli I.K., Jolesz F.A., Bleier A.R. et al. The effect of gadolinium DTPA on tissue water compartments in slow- and fast-twitch rabbit muscles // Magn. Reson. Med. – 1989. – No. 11. – P. 172-181.
9. Amano Y.1., Takayama M., Takahama K., Kumazaki T. Delayed hyper-enhancement of myocardium in hypertrophic cardiomyopathy with asymmetrical septal hypertrophy: comparison with global and regional cardiac MR imaging appearances // J. Magn. Reson.Imaging. – 2004. – Vol. 20, N4. – P. 595-600.
10. Bloch F., Hansen W.W., Packard M. Nuclear Induction // Physical. Review. – 1946. – Vol. 69. – P. 127.
11. Friedrich M.G., Sechtem U., Schulz-Menger J. et al. International Consensus Group on Cardiovascular Magnetic Resonance in Myocarditis Cardiovascular magnetic resonance in myocarditis: a JACC white paper. / J. Am. Coll. Cardiol. – 2009. – Vol. 53(17). – P. 1475-1487.
12. Ganame J., Messalli G., Masci P.G. Time course of infarct healing and left ventricular remodeling in patients with reperfused ST segment elevation myocardial infarction using comprehensive magnetic resonance imaging // Eur. Radiol. – 2011. – Vol. 21. – P. 693-701.
13. Ganssen A. Bundesrepublik Deutschland – DeutschesPatentamt: Patentschrift 1566 148. Elektromagnetische Hochfrequenzspulefur Diagnostike in richtung. Patentiertfur Siemens AG, Berlin und Munchen. Erfinder: AlexanderGanssen. Anmeldetag 10.3.1967; Offenlegungstag 2.4.1970; Bekanntmachungstag: 17.10.1974.
14. Innoue S., Murakami Y., Ochiai K. et al. The contributory role of interstitial water in GD-DTPA-enhanced MRI in myocardial infarction // J. Magn. Reson. Imaging. 1999. – No. 9. – Р. 215-219.
15. Kim R.J., Judd R.M. Gadolinium-enhanced magnetic resonance imaging in hypertrophic cardiomyopathy: in vivo imaging of the pathologic substrate for premature cardiac death? // J. Am. Coll. Cardiol. – 2003. – Vol. 41, № 9. – P. 1568-1572.
16. Kim R.J., Wu E., Rafael A., Parker M.A. The use of contrast enhanced magnetic resonance imaging to identify reversible myocardial dysfunction // N. Engl. J. Med. – 2000. – Vol. 343. – P. 1445-1453.
17. Lauterbur P.C. Image Formation by Induced Local Interactions: Examples of Employing Nuclear Magnetic Resonance // Nature. – 1973. – Vol. 242 (5394). – P. 190-191.
18. Lima J.A., Judd R., Bazille A. et al. Regional heterogenity of human myocardial infarcts demonstrated by contrast-enhanced MRI: potential mechanisms // Circulation. 1995. – V. 92. – P. 1117-1125.
19. Lombardi M., Bartolozzi C. MRI of the Heart and Vessels. Milan, 2004.
20. Maceira A.M., Joshi J., Prasad S.K. et al. Cardiovascular magnetic resonance in cardiac amyloidosis // Circulation. – 2005. – Vol. 111. – P. 186-193.
21. Magnetic resonance. A peer-reviewed, critical introduction / 20-03 Early applications in medicine and biology // http://www.magnetic-resonance.org/ch/20-03.html.
22. Mahrholdt H., Goedecke C., Wagner A. et al. Multimedia article. Cardiovascular magnetic resonance assessment of human myocarditis: a comparison to histology and molecular pathology // Circulation. – 2004. – Vol.109. – P. 1250-1258.
23. Mahrholdt H., Wagner A., Judd R.M. et al. Delayed enhancement cardiovascular magnetic resonance assessment of non-ischaemic cardiomyopathies // Eur. Heart J. – 2005. – Vol. 26, № 15. – P. 1461-1474.
24. Mahrholdt H.,. Wagner A., Deluigi C.C. еt al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis // Circulation. – 2006. – Vol. 114, № 15. – P. 1581-1590.
25. Marcus F.I., McKenna W.J., Sherrill D. et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the Task Force criteria // Eur. Heart. J. – 2010. – Vol. 31. – P. 806-814.
26. McCrohon J.A., Moon J.C., Prasad S.K. et al. Differentiation of heart failure related to dilated cardiomyopathy and coronary artery disease using gadolinium-enhanced cardiovascular magnetic resonance // Circulation. – 2003. –
Vol. 108. – P. 54-59.
27. McKenna W.J., Thiene G., Nava A. et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology // Br. Heart. J. – 1994. – Vol. 71. – P. 215-218.
28. Moon J.C., Reed E., Sheppard M.N. et al. The histologic basis of late gadolinium enhancement cardiovascular magnetic resonance in hypertrophic cardiomyopathy // J. Am. Coll. Cardiol. – 2004. – Vol. 43, № 12. – P. 2260-2264.
29. Odeblad E., Lindstrom G. Some preliminary observations on the proton magnetic resonance in biological samples // Acta. Radiol. – 1955. – Vol. 43. – P. 469-476.
30. Poustchi-Amin M., Gutierrez F.R., Brown J.J. et al. Performing cardiac MR imaging: an overview // Magn. Reson. Imaging. Clin. N. Am. – 2003. – Vol. 11(1). – P. 1-18.
31. Purcell E.M., Torrey H.C., Pound R.V. Resonance Absorption by Nuclear Magnetic Moments in a Solid // Phys. Rev. – 1946. – Vol. 69. – P. 37.
32. Rinck P.A. (2014). The history of MRI; in: Magnetic Resonance in Medicine, 8th edition; http://magnetic-resonance.org/ch/20-04.htm.
33. Schneider G., Fries P., Ahlhelm F. et al. Contrast-enhanced cardiac MR imaging // Eur. Raiol. – 2003. – Vol. 13 (Suppl. 3). – Р. N11-N18.
34. Sen-Chowdhry S., Syrris P., Ward D. et al. Clinical and genetic characterization of families with arrhythmogenic right ventricular dysplasia/cardiomyopathy provides novel insights into patterns of disease expression / Circulation. – 2007. – Vol. 115. – P. 1710-1720.


