26 вересня, 2016
Лікування і профілактика тромбозів: як не поповнити статистику кровотеч?
У цьому номері ми вирішили обговорити питання, пов’язані з підвищенням ризику кровотеч на фоні антитромботичної терапії. Це дуже важливі питання, оскільки ми дедалі частіше призначаємо нашим пацієнтам пероральні антикоагулянти довгостроково, наприклад з метою зниження ризику розвитку інсульту при фібриляції передсердь або попередження повторних венозних тромбоемболій.
Слово модератора рубрики
Член-кореспондент НАМН України, президент Української асоціації з невідкладної кардіології, керівник відділу реанімації та інтенсивної терапії Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» НАМН України, доктор медичних наук, професор Олександр Миколайович Пархоменко:
 – Розробка і впровадження в клінічну практику нових пероральних антикоагулянтів (НОАК), які характеризуються кращою переносимістю та більшою безпекою, відкрили нам нові можливості щодо профілактики тромбоемболічних ускладнень, але ризик виникнення кровотеч при застосуванні будь-яких антитромботичних препаратів неминуче зростає, і навіть найбільш сучасні засоби не є винятком. Отже, перш ніж призначити пацієнту з високим ризиком розвитку тромбоемболічних ускладнень довгострокову антикоагулянтну терапію, лікар повинен оцінити ризик кровотеч (для цього розроблено шкали HAS-BLED, ATRIA и ORBIT-AF) і продумати, який саме антикоагулянт слід застосовувати залежно відстан у пацієнта і низки інших факторів. Наприклад, рішення про призначення варфарину має прийматися тільки у разі можливості проведення лабораторного моніторингу з метою контролю міжнародного нормалізованого відношення (МНВ). Безумовно, найбільш зручним та безпечним порівняно з лікуванням варфарином є застосування НОАК, і вибір серед препаратів цієї групи слід робити з урахуванням багатьох моментів: ступеня ризику розвитку геморагічних ускладнень, стану ниркової функції тощо. Усі НОАК мають прийнятний профіль безпеки, але є деякі нюанси, про які слід пам’ятати. Наприклад, критерієм вибору НОАК і його дози є кліренс креатиніну, оскільки порушення функції нирок впливає на фармакокінетику антикоагулянтів (більшою мірою – дабігатрану, меншою – ривароксабану і апіксабану) і зумовлює збільшення ризику кровотеч. Ривароксабан тільки на 30% виводиться нирками, що дозволяє призначати цей препарат при нирковій недостатності від середнього до тяжкого ступеня. Ще сьогодні у процесі лікування антикоагулянтами пацієнтів високого ризику розвитку тромбоемболічних ускладнень постає багато питань: як підібрати препарат для хворих з високим геморагічним ризиком, що робити, якщо пацієнту одночасно показана терапія антиагрегантами й антикоагулянтами та ін. Зазначені питаннями розглянемов наступному номері, а в цій публікації пропонуємо клінічний випадок, який демонструє , що успіху лікуванні складних пацієнтів визначається наявністю знань щодо сучасних рекомендацій і професіоналізмом лікаря.
– Розробка і впровадження в клінічну практику нових пероральних антикоагулянтів (НОАК), які характеризуються кращою переносимістю та більшою безпекою, відкрили нам нові можливості щодо профілактики тромбоемболічних ускладнень, але ризик виникнення кровотеч при застосуванні будь-яких антитромботичних препаратів неминуче зростає, і навіть найбільш сучасні засоби не є винятком. Отже, перш ніж призначити пацієнту з високим ризиком розвитку тромбоемболічних ускладнень довгострокову антикоагулянтну терапію, лікар повинен оцінити ризик кровотеч (для цього розроблено шкали HAS-BLED, ATRIA и ORBIT-AF) і продумати, який саме антикоагулянт слід застосовувати залежно відстан у пацієнта і низки інших факторів. Наприклад, рішення про призначення варфарину має прийматися тільки у разі можливості проведення лабораторного моніторингу з метою контролю міжнародного нормалізованого відношення (МНВ). Безумовно, найбільш зручним та безпечним порівняно з лікуванням варфарином є застосування НОАК, і вибір серед препаратів цієї групи слід робити з урахуванням багатьох моментів: ступеня ризику розвитку геморагічних ускладнень, стану ниркової функції тощо. Усі НОАК мають прийнятний профіль безпеки, але є деякі нюанси, про які слід пам’ятати. Наприклад, критерієм вибору НОАК і його дози є кліренс креатиніну, оскільки порушення функції нирок впливає на фармакокінетику антикоагулянтів (більшою мірою – дабігатрану, меншою – ривароксабану і апіксабану) і зумовлює збільшення ризику кровотеч. Ривароксабан тільки на 30% виводиться нирками, що дозволяє призначати цей препарат при нирковій недостатності від середнього до тяжкого ступеня. Ще сьогодні у процесі лікування антикоагулянтами пацієнтів високого ризику розвитку тромбоемболічних ускладнень постає багато питань: як підібрати препарат для хворих з високим геморагічним ризиком, що робити, якщо пацієнту одночасно показана терапія антиагрегантами й антикоагулянтами та ін. Зазначені питаннями розглянемов наступному номері, а в цій публікації пропонуємо клінічний випадок, який демонструє , що успіху лікуванні складних пацієнтів визначається наявністю знань щодо сучасних рекомендацій і професіоналізмом лікаря.
Венозний тромбоемболізм (ВТЕ) – третє за частотою захворювання серцево-судинної системи із загальною захворюваністю щороку 1-2 випадки на 1 тис. дорослого населення, у похилому віці зазначений показник може сягати 1 на 100 осіб [1, 2]. Це захворювання характеризується блискавичним розвитком, тяжкістю перебігу, труднощами своєчасної діагностики, високою летальністю і несприятливим віддаленим прогнозом. Згідно зі статистичними даними летальність при ТЕЛА визначається не тільки ступенем обструкції легеневої артерії (ЛА), а й у значній мірі своєчасністю діагностики та надання медичної допомоги. Так, за умови відсутності адекватної терапії цей показник становить щонайменше 40%, а при ТЕЛА високого ризику може сягати 70%. Завдяки накопиченим значному клінічному досвіду та науковим знанням щодо патогенезу тромбоутворення, в останнє десятиріччя відбувся кардинальний перегляд підходів до профілактики і стратегії лікування ВТЕ та ТЕЛА. Так, у ході проведення великої кількості рандомізованих клінічних досліджень (РКД) було доведено, що за умови раціонального профілактичного призначення антикоагулянтів у 2–3 рази можна знизити ймовірність розвитку тромбоемболічних ускладнень, а при своєчасно розпочатій тромболітичній (ТЛТ) та/або антикоагулянтній терапії летальність внаслідок ТЕЛА становить менше 10%. Численні РКД довели, що ТЛТ у пацієнтів високого ризику призводить до швидкого відновлення кровообігу в ЛА. В одному із найбільших РКД доведено також, що вже через три години після введення рекомбінантного тканинного активатора плазміногену суттєво зменшується середня площа правого шлуночка (ПШ) в кінці діастоли. З іншого боку, ТЛТ супроводжується високим ризиком виникнення кровотеч, особливо при наявності факторів, які сприяють їх розвитку. Так, за даними метааналізу РКД, загальна кількість масивних кровотеч при ТЛТ у хворих з ТЕЛА становить 13%, а внутрішньочерепних/фатальних – 1,8%. Виділяють окрему групу осіб, у яких ризик розвитку кровотечі є дуже високим: це пацієнти віком понад 75 років та з масою тіла <50 кг та або кліренсом креатиніну <50 мл/хв. Лікування цих так званих крихких пацієнтів із ТЕЛА, особливо якщо вони нещодавно перенесли шлунково-кишкові кровотечі, є дуже складним клінічним завданням, яке потребує особливих підходів до ТЛТ і призначення антикоагулянтів.
 Клінічний приклад лікування пацієнтки з тромбоемболією легеневої артерії (ТЕЛА) надано завідувачем кафедри кардіології і функціональної діагностики Харківської медичної академії післядипломної освіти, доктором медичних наук, професором Вірою Йосипівною Цілуйко (у співавторстві з Л.М. Яковлевою, д.м.н., професором кафедри).
Клінічний приклад лікування пацієнтки з тромбоемболією легеневої артерії (ТЕЛА) надано завідувачем кафедри кардіології і функціональної діагностики Харківської медичної академії післядипломної освіти, доктором медичних наук, професором Вірою Йосипівною Цілуйко (у співавторстві з Л.М. Яковлевою, д.м.н., професором кафедри).
Клінічний випадок
Наводимо приклад з нашого досвіду лікування пацієнтки Д., 76 років, яка знаходилася у КЗОЗ «Харківська міська клінічна лікарня № 8» з 20.03 по 04.04.2015 р. При надходженні до стаціонару головною скаргою пацієнтки була задишка при мінімальному фізичному навантаженні, у тому числі під час розмови. Вона зазначила, що помірна задишка при фізичному навантаженні турбує її вже декілька років, але два дні тому раптово знизилася толерантність до навантаження. Хвора також скаржилася на посилене серцебиття, виражену загальну слабкість.
При аналізі анамнестичних даних встановлено, що хвора тривалий час страждала тиреотоксикозом, у 1976 р. їй було проведено струмектомію. На сьогодні – медикаментозний еутиреоз (приймає препарат L-тироксину). У 1980 р. вона проходила курс медикаментозного лікування з приводу варикозного розширення і тромбозу вен гомілок. Встановлено також, що понад тридцять років пацієнтка страждає артеріальною гіпертензією. Максимальний зареєстрований рівень артеріального тиску (АТ) до призначення терапії становив 180/100 мм рт. ст. У 2008 р. в неї було діагностовано фібриляцію передсердь. При ретроспективній оцінці вже на той час ризик тромбоемболічних ускладнень за шкалою CHA2DS2-VASс становив 3 бали, тому хворій були призначені антикоагулянти. За період з 2008 по 2010 р. вона брала участь у клінічному дослідженні апіксабану у порівнянні з варфарином (який саме препарат отримувала – невідомо, тому що дослідження було сліпим), потім їй був призначений варфарин. У 2011 р. пацієнтка перенесла ішемічний інсульт у вертебро-базилярному басейні. В подальшому вона продовжувала отримувати варфарин, але внаслідок порушення когнітивних функцій адекватного контролю міжнародного нормалізованого відношення (МНВ) не було.
У грудні 2012 р. в пацієнтки розвинулася виражена задишка, яка посилювалася у горизонтальному положенні, виникло запаморочення. 24.12.2012 р. вона булла госпіталізована до КЗОЗ «Харківська міська клінічна лікарня № 8». Під час проведення ехокардіографічного (ЕхоКГ) дослідження у порожнині лівого передсердя (ЛП) було виявлено утворення розміром 4,0×3,0 см, підвищеної ехогенності, яке флотувало у кровотоці і, можливо, прикріплювалося до міжпередсердної перегородки. З метою уточнення діагнозу 08.01.2013 р. в Інституті загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України пацієнтці була проведена черезстравохідна ЕхоКГ. Заключення: тромб вушка і 2/3 ЛП. За результатами коронароангіографії: гіпоплазія правої коронарної артерії та штопороподібна звивистість правої та лівої коронарних артерій без ознак їх атеросклеротичного ушкодження. Враховуючи неможливість адекватного контролю МНВ, варфарин був відмінений та призначений ривароксабан за схемою, яка рекомендована для лікування тромбозів: 15 мг двічі на добу протягом трьох тижнів, надалі – 20 мг/добу.
При проведенні контрольної черезстравохідної ЕхоКГ (лютий 2013 р.) тромбу в ЛП не виявлено. У червні 2013 р., на прохання родичів пацієнтки з економічних міркувань ривароксабан був відмінений, відновлено прийом варфарину, доза якого була підібрана під контролем МНВ (на той час ризик розвитку тромбоемболічних ускладнень становив уже 6 балів за CHA2DS2-VASс). 01.02.2015 р. пацієнтка була госпіталізована до хірур-гічного стаціонару з клінікою гострої шлунково-кишкової кровотечі. Рівень гемоглобіну за 01.02.2015 р. становив 96 г/л, еритроцитів – 3,0×1012/л. За результатами фіброгастродуоденоскопії у стравоході, шлунку та дванадцятипалій кишці патологічних змін не виявлено. При проведенні комп’ютерної томографії (КТ) органів черевної порожнини (ОЧП) встановлено наявність циркулярного нерівномірного потовщення стінки термінального відділу клубової кишки до 16 мм протяжністю 20 см зі звуженням просвіту кишки на зазначеному рівні. Виявлена також інфільтрація прилеглої жирової клітковини, яка за ходом ниркової фасції поширювалася на заочеревинний простір. Встановлено діагноз: хвороба Крона. За даними виписки, у стаціонарі пацієнтці проводилася комплексна консервативна терапія, було відмінено варфарин і рекомендовано у подальшому утримуватися від прийому антикоагулянтів. 20.03.2015 р. При об’єктивному огляді хворої на момент госпіталізації у стаціонар стан був розцінений як тяжкий. Шкірні покриви бліді, ціаноз губ, набухання і пульсація вен шиї. При перкусії над легенями легеневий звук, при аускультації – дихання везикулярне. Частота дихальних рухів – 24/хв. Границі відносної серцевої тупості: верхня – у III міжребер’ї, права – на 2 см вправо від правого краю грудини у IV міжребер’ї, ліва – на 1 см вліво по середньо-ключичній лінії у V міжребер’ї. При аускультації серця тони аритмічні (миготлива аритмія), акцент II тону над ЛА. ЧСС 152 уд/хв, пульс 92 уд/хв, АТ 88/56 мм рт. ст. При пальпації живіт м’який, печінка виступає на 2 см з-під краю правої реберної дуги, болюча при пальпації. Помірний набряк лівої гомілки. Сатурація кисню (SaO2) становила 93%.
Таким чином, враховуючи скарги на виражену задишку при мінімальному фізичному навантаженні, яка розвинулася раптово, дані об’єктивного огляду (пульсація вен шиї, розширення границь відносної серцевої тупості вправо, акцент ІІ тону над ЛА при аускультації, артеріальна гіпотензія, набряк лівої гомілки), наявність ТЕЛА у пацієнтки Д. була дуже вірогідною. Згідно з існуючими рекомендаціями ми оцінили наявність факторів ризику ТЕЛА у нашої пацієнтки.
На сьогодні ВТЕ розглядають як результат взаємодії факторів ризику, які пов’язані із соматичним статусом пацієнта, і факторів, які є наслідком зовнішніх впливів.
У пацієнтки Д. було щонайменше чотири доведених фактори ризику: перенесений епізод ВТЕ і тромбозу вушка ЛП в анамнезі, похилий вік, варикозне розширення вен гомілок та ожиріння (ІМТ становив 34 кг/м). На нашу думку, наявність хвороби Крона у пацієнтки потребує подальшого уточнення з обов’язковим проведенням ендоскопічного обстеження і пункційної біопсії. А описана за допомогою КТ ОЧП рентгенологічна картина більше відповідає наявності злоякісної пухлини клубової кишки, що може бути незалежним вагомим фактором ризику розвитку ТЕЛА.
При оцінці клінічної вірогідності ТЕЛА за переглянутим Женевським алгоритмом наша пацієнтка отримала 13 балів, що свідчить про високу імовірність зазначеного захворювання. За клінічною оцінкою прогнозу ТЕЛА за шкалою індексу тяжкості PESI пацієнтка отримала 160 балів (вік – 76 балів, ЧСС >110 уд/хв – 20 балів, систолічний АТ >90 мм рт. ст. – 30 балів), віднесена до V класу, що свідчить про дуже високий ризик ранньої смерті у стаціонарі або протягом 30 діб.
При високій вірогідності ТЕЛА, наявності шоку або гіпотензії, яка булла зареєстрована у нашої пацієнтки при госпіталізації, диференційну діагностику необхідно проводити з кардіогенним шоком, гострою дисфункцією стулкових клапанів, тампонадою серця або розшаруванням стінки аорти. У цих випадках головним діагностичним тестом є ЕхоКГ, яка зазвичай дає змогу виявити непрямі ознаки гострої легеневої гіпертензії і перевантаження правих камер серця, якщо причиною гемодинамічних порушень є гостра ТЕЛА.
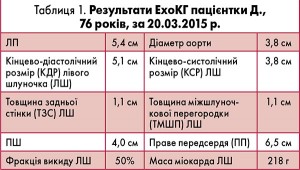
При ЕхоКГ-обстеженні (табл. 1) виявлені дилатація ЛП та правих камер серця, наявність систолічного згладжування міжшлуночкової перегородки, недостатність трикуспідального клапана (60%), значна легенева гіпертензія (середній тиск в ЛА >65 мм рт. ст.). Таким чином, у пацієнтки є ознаки дисфункції ПШ, що, за даними метааналізу, в пацієнтів з ТЕЛА високого ризику асоціюється зі збільшенням ризику ранньої смерті більш ніж у два рази.
Необхідно зазначити, що, на жаль, ЕхоКГ-критерії дисфункції ПШ в опублікованих дослідженнях суттєво відрізняються. На сьогодні не існує загальноприйнятих критеріїв її діагностики, тому нормотензивних пацієнтів з ТЕЛА можна віднести до групи низького ризику тільки за умови абсолютно нормальних результатів ЕхоКГ.
З іншого боку, ознаки перевантаження або дисфункції ПШ можуть бути наслідком супутніх захворювань серця або легень,тому при підозрі на ТЕЛА високого ризику ЕхоКГ з діагностичною метою проводять лише при відсутності можливості ургентного проведення мультиспіральної КТ з візуалізацією ЛА або інвазивної ангіопульмонографії. Електрокардіографічні (ЕКГ) зміни при ТЕЛА можуть бути як відсутніми, так і проявлятися порушеннями серцевого ритму (синусова тахікардія або миготлива аритмія), відхиленням електричної осі серця вправо або поворотом ПШ вперед (SI/QIII), порушенням внутрішньошлуночкової провідності (найчастіше в системі правої ніжки пучка Гіса) та ін. Водночас низькі чутливість і специфічність ЕКГ-ознак при ТЕЛА не дають змоги широко використовувати цей метод для діагностики захворювання.
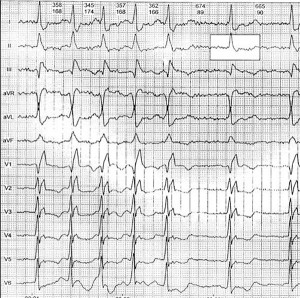
На серії ЕКГ пацієнтки за період з 2008 по 2015 р. були зареєстровані миготлива аритмія та повна блокада правої ніжки пучка Гіса. На ЕКГ за 20.03.2015 р. (рис.) – миготлива аритмія (R-R = 345-665 мс), повна блокада правої ніжки пучка Гіса (комплекс QRS 114 мс, морфологія комплексу rsR у відведенні V1), елевація сегмента ST у відведеннях III та V1, можуть бути ознаками перевантаження ПШ об’ємом. Непрямі ознаки гіпертрофії міокарда ЛШ.
Мультиспіральна КТ з візуалізацією ЛА є золотим стандартом діагностики ТЕЛА. Так, у дослідженні PIOPED II чутливість зазначеного методу становила 83%, специфічність – 96%. При проведенні нашій пацієнтці КТ-ангіографії з контрастуванням ЛА (20.03.2015 р.) у лівій і правій ЛА виявлені масивні тромби і тромб-наїзник. В усіх дольових, більшості сегментарних і субсегментарних гілках ЛА визначалися дефекти контрастування, які частково та в деяких артеріях повністю перекривали просвіт судин. Пацієнтці було проведено доплер-ультразвукове дослідження судин нижніх кінцівок, виявлений тромбоз v.v. suralis лівої гомілки.
Невідкладно були визначені рівень гемоглобіну, який становив 147 г/л, еритроцитів – 4,81×1012/л і лейкоцитів – 7,5×109/л. Рівень креатиніну у сироватці крові становив 133 мкмоль/л. Оскільки вік пацієнтки понад 75 років, швидкість клубочкової фільтрації розраховували за формулою Кокрофта – Голта, значення показника становило 42 мл/хв.
Таким чином, з урахуванням наявності у пацієнтки артеріальної гіпотензії, оцінки дуже високого ризику за шкалою індексу тяжкості PESI, ознак дисфункції ПШ за даними ЕхоКГ, результатів мультиспіральної КТ з контрастуванням нами встановлений такий клінічний діагноз: тромбофлебіт вен лівої гомілки. Тромбоемболія легеневої артерії (18.03.2015 р.), ризик високий. Гіпертонічна хвороба, III стадія, III ступінь. Гіпертензивне серце (гіпертрофія лівого шлуночка). Ризик дуже високий. Фібриляція передсердь, постійна форма. CHA2DS2-VASc – 6 балів. HAS-BLED – 5 балів. Хронічна хвороба нирок 3 ст. СН IIA зі збереженою систолічною функцією лівого шлуночка, IV функціональний класс (NYHA). Наслідки перенесеного ішемічного інсульту (2011 р.). Відповідно до рекомендацій, вибір стратегії і тактики лікування при ТЕЛА залежить від встановленого ризику. При високому ризику показана тактика реперфузії. Невідкладно мають бути призначені антикоагулянтна терапія (клас рекомендацій І, рівень доказів С) і ТЛТ (клас рекомендацій І, рівень доказів В). Можуть використовуватися стрептокіназа, урокіназа або тканинний активатор плазміногену. В рекомендаціях акцентовано, що у хворих з ТЕЛА, яка являє безпосередню загрозу для життя, абсолютні протипоказання для ТЛТ можна розглядати як відносні. Хірургічна або ендоваскулярна емболектомія, якщо вони є доступними, рекомендовані при наявності абсолютних протипоказань до ТЛТ або при її неефективності (клас рекомендацій І, рівень доказів С та клас рекомендацій ІІа, рівень доказів С відповідно). Абсолютним протипоказанням для ТЛТ є наявність шлунково-кишкової кровотечі протягом місяця або кровотеча, яка триває. Пацієнтка Д. перенесла кровотечу понад місяць тому; за даними клінічного огляду і результатами лабораторних показників у неї немає активної кровотечі. В той же час хвора належить до групи «крихких» пацієнтів з точки зору ризику розвитку кровотеч: вік понад 75 років і кліренс креатиніну <50 мл/хв.
Згідно з існуючими рекомендаціями тканинний активатор плазміногену (альтеплазе) при ТЕЛА високого ризику необхідно вводити у дозі 10 мг болюсно, у подальшому – по 90 мг протягом 2 год або за прискореною схемою, при якій сумарна доза препарату становить 50 мг, але вводиться упродовж 15 хв. У дослідженні W. Chen і співавт. порівнювали два способи введення альтеплазе: 100 мг протягом 2 год і 50 мг упродовж 2 год у хворих з ТЕЛА високого ризику. В обох групах отримали статистично співставне зменшення дисфункції ПШ за даними ЕхоКГ і обструкції ЛА за результатами КТ. В групі редукованої дози альтеплазе спостерігали тенденцію до нижчої частоти кровотеч, причому особлива перевага зареєстрована у пацієнтів з масою тіла <65 кг (14,8% на противагу 41,2%, р=0,049).
Для лікування нашої пацієнтки ми обрали альтеплазе, але редуковану дозу: 10 мг препарату вводили внутрішньовенно (в/в) протягом 2 хв, потім – 65 мг в/в краплинно упродовж 2 год. Таким чином, сумарна доза препарату становила 75 мг. Еноксапарин був призначений у дозі 65 мг 2 рази на добу (маса тіла пацієнтки 85 кг, вік понад 75 років, отже, рекомендована доза – 0,75 мг/кг маси тіла). У відділенні реанімації пацієнтка отримувала таке лікування: пантопразол у дозі 40 мг в/в, метилурацил по 0,5 мг тричі на добу, оксигенотерапію, високе бинтування ніг еластичними бинтами.
21.03.2015 р. стан пацієнтки нормалізувався, зменшилась задишка, показники гемодинаміки стабілізувалися, за даними ЕхоКГ розміри ПШ і ПП зменшилися і становили 3,8 та 4,5 см відповідно. Знизився середній тиск у ЛА, який становив <50 мм рт. ст. Отже, оцінка результатів ЕхоКГ до і наступного дня після ТЛТ є надійним критерієм ефективності терапії, яка проводиться. Пацієнтка була переведена до кардіологічного відділення, у якому вона 5 діб отримувала еноксапарин у дозі 65 мг двічі на добу підшкірно. З 25.03.2015 р. був призначений ривароксабан по 15 мг 2 рази на добу протягом 21 дня, потім – 20 мг/добу. Підставою для нашого вибору антикоагулянта для лікування пацієнтки були результати дослідження EINSTEIN PE, у якому ривароксабан за вищезазначеною схемою був призначений хворим з об’єктивно підтвердженою ТЕЛА порівняно з варфарином. Найважливішим результатом дослідження було зниження кількості масивних кровотеч на 51,0% у групі ривароксабану порівняно з групою варфарину. Окрім того, на сьогодні відсутні будь-які дані, які свідчили б про необхідність корекції дози і с хем призначення ривароксабану у «крихких» пацієнтів при ТЕЛА.
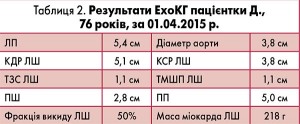
У відділенні хворій був призначений вільний руховий режим, продовжено бинтування ніг і прийом пантопразолу та метилурацилу. В подальшому з метою контролю ритму був призначений бісопролол у дозі 2,5 мг/добу, для контролю АТ – валсартан по 160 мг/добу і торасемід по 5 мг/добу, а також аторвастатин у дозі 20 мг/добу. Лабораторні показники, які моніторували раз в три дні, були стабільними. При контрольному ЕхоКГ-обстеженні через 11 днів (табл. 2) зберігаються дилатація ЛП та ПП, незначна легенева гіпертензія. Пацієнтка виписана зі стаціонару у задовільному стані, рекомендовані постійна антикоагулянтна терапія (CHA2DS2-VASc – 6 балів), консультація судинного хірурга та проктолога.
Таким чином, лікування ТЕЛА у пацієнтів з високим ризиком виникнення кровотеч, до яких належать також пацієнти похилого віку з кліренсом креатиніну <50 мл/хв або масою тіла <65 кг, потребує індивідуального підходу до вибору доз тромболітичних і антикоагулянтних агентів, а також ретельного контролю безпеки терапії, яка проводиться.
Список літератури знаходиться в редакції.