25 вересня, 2016
Актуальные вопросы кардиологии и кардиохирургии
2 июня в ГУ «Институт сердца МЗ Украины» (г. Киев) прошла Вторая научно-практическая конференция «Актуальные вопросы кардиологии и кардиохирургии». В рамках конференции состоялся сателлитный симпозиум, в ходе которого были рассмотрены некоторые актуальные вопросы в области кардиологии, а именно – современные аспекты ведения пациентов с ишемической кардиомиопатией (ИКМП) и современные подходы к профилактике прогрессирования хронической болезни почек (ХБП).
 « Какие критерии можно использовать сегодня при оценке целесообразности проведения реваскуляризации у пациента с ишемической болезнью сердца (ИБС) и как оптимизировать медикаментозное лечение при наличии рефрактерной стенокардии?» – эти вопросы рассмотрел в своем докладе заведующий кафедрой функциональной диагностики Национальной медицинской академии последипломного образования им. П.Л. Шупика, доктор медицинских наук, профессор Олег Иосифович Жаринов:
« Какие критерии можно использовать сегодня при оценке целесообразности проведения реваскуляризации у пациента с ишемической болезнью сердца (ИБС) и как оптимизировать медикаментозное лечение при наличии рефрактерной стенокардии?» – эти вопросы рассмотрел в своем докладе заведующий кафедрой функциональной диагностики Национальной медицинской академии последипломного образования им. П.Л. Шупика, доктор медицинских наук, профессор Олег Иосифович Жаринов:
– ИКМП характеризуется дисфункцией миокарда, возникшей вследствие ишемического повреждения (с или без перенесенного инфаркта миокарда). Этот синдром проявляется дисфункцией левого желудочка (ДЛЖ) и является наиболее частой причиной развития сердечной недостаточности (СН). При ИКМП преимущественно наблюдается многососудистое поражение или ишемическое повреждение обширного участка миокарда.
Прогноз при данном синдроме определяется величиной фракции выброса (ФВ) ЛЖ и количеством пораженных сосудов и более неблагоприятен по сравнению с большинством других форм систолической ДЛЖ.
У пациентов со стабильной ИБС решение о выполнении реваскуляризации основывается на ангиографических и клинических критериях, а целью реваскуляризации является улучшение прогноза выживания пациентов и/или качества их жизни. Перед тем как принять такое решение, врач должен оценить вероятность достижения обозначенных целей. В метаанализе 1994 г., включившем 7 клинических исследований, проведенных в период 1972-1984 гг., показано, что в целом выполнение аортокоронарного шунтирования (АКШ) у пациентов со стабильной формой ИБС не обеспечивает улучшения прогноза по сравнению с медикаментозной терапией.
Однако в подгруппе пациентов с ИБС и ДЛЖ наблюдалось значимое снижение смертности, кроме того, у данной категории больных сохраняется шанс на значительное улучшение сократимости ЛЖ после восстановления коронарного кровотока.
Наиболее крупным в истории изучения ИКМП является исследование STICH, результаты которого были опубликованы в 2011 году. В этом исследовании частота случаев смерти от всех причин была сопоставимой в группах медикаментозной терапии и АКШ, однако анализ вторичных критериев эффективности (смерть от всех причин или госпитализация, обусловленная СН, смерть от всех причин или госпитализация из-за сердечно-сосудистых причин; смерть от всех причин или потребность в реваскуляризации) продемонстрировал лучшие результаты в группе АКШ. Совсем недавно получены результаты 10-летнего наблюдения участников исследования STICH, которые свидетельствуют об увеличении продолжительности жизни пациентов после АКШ (разница отмечалась, начиная с 1,4 года). Эти данные являются убедительным аргументом в пользу выполнения АКШ у пациентов с ИКМП с признаками СН.
Следует также отметить, что в современной клинике, по сути, не существует нижнего порога ФВ ЛЖ при оценке целесообразности проведения реваскуляризации.
Тем не менее ИКМП не является однозначным показанием к выполнению реваскуляризации миокарда: существует несколько важных моментов, которые следует принимать во внимание. В частности, вероятность улучшения ФВ ЛЖ после реваскуляризации миокарда у пациентов с ИКМП может зависеть от количества пораженных сосудов, а также от наличия и объема жизнеспособного миокарда.
Наиболее благоприятное влияние реваскуляризации на прогноз наблюдается при трех- или двухсосудистом поражении (особенно при поражении передней межжелудочковой ветки левой коронарной артерии) и при наличии обширного участка ишемизированного миокарда. На вопрос о том, можно ли использовать объем жизнеспособного миокарда в качестве критерия при отборе пациентов с ИКМП для процедуры реваскуляризации, пока что нет однозначного ответа. У больных с большим объемом жизнеспособного миокарда в целом прогноз выживания лучше по сравнению с низкой жизнеспособностью миокарда, однако на сегодня не получены достаточно убедительные доказательства, которые позволили бы рассматривать данный показатель как однозначный критерий при решении вопроса о направлении на реваскуляризацию. Благоприятного влияния реваскуляризации на прогноз выживания можно ожидать у пациентов с сопутствующим сахарным диабетом (СД), у которых симптомы ИКМП, как правило, более выражены, и у которых имеются действительно веские основания для проведения АКШ или стентирования артерий.
В ходе выступления лектор озвучил современные рекомендации, на которые следует ориентироваться при решении вопроса о проведении реваскуляризации миокарда у пациентов с ИКМП, в частности – рекомендации Европейского общества кардиологов 2016 г. по лечению пациентов с СН, в которых подробно описаны показания к коронаровентрикулографии (КВГ) при данном синдроме. В этом документе указывается, что КВГ рекомендована пациентам со стенокардией, у которых медикаментозная терапия неэффективна и у которых возможно проведение реваскуляризации миокарда. Кроме того, показаниями к выполнению КВГ являются симптомные желудочковые аритмии или перенесенный эпизод остановки сердца с успешной реанимацией. КВГ следует рассматривать также у пациентов с СН и умеренной/ высокой претестовой вероятностью ИБС и наличием ишемии по результатам неинвазивных стресс-тестов (Ponikowski). При выборе оптимального способа реваскуляризации необходимо учитывать не только выраженность атеросклероза субэпикардиальных артерий, но и состояние дистального русла и коллатерального кровотока. Согласно европейским рекомендациям 2014 г. (Windecker) реваскуляризация абсолютно показана пациентам со стенозом ствола левой коронарной артерии или его эквивалентом (проксимальный стеноз левой передней нисходящей и огибающей артерии). Однако для пациентов с СН эта рекомендация преимущественно основана на мнении экспертов.
На основании результатов исследования STICH (в которое не включали пациентов со стволовыми поражениями и стенокардией III-IV функциональных классов – ФК) АКШ также рекомендовано пациентам с СН и ФВ ЛЖ ≤35%, поражением левой передней нисходящей артерии или многососудистым поражением для снижения риска смерти и госпитализаций из-за сердечно-сосудистых причин (Ponikowski, 2016).
Сегодня АКШ является методом выбора у пациентов с трехсосудистым поражением или гемодинамически значимым стенозом ствола ЛКА. ДЛЖ – веский дополнительный аргумент в пользу выполнения АКШ при наличии соответствующих изменений анатомии коронарного русла и клинических симптомов, поскольку именно для пациентов со сниженной ФВ ЛЖ получены наиболее убедительные доказательства благоприятного влияния реваскуляризации на прогноз выживания.
Независимо от того, как решается вопрос о выполнении реваскуляризации у пациентов с ИБС, не следует забывать о других неотъемлемых аспектах их лечения – модификации образа жизни, контроле факторов риска и оптимальной медикаментозной терапии, которая направлена на снижение выраженности симптомов и улучшение прогноза. Согласно современным европейским рекомендациям по лечению стабильной ИБС (2013) для улучшения прогноза при этом заболевании следует назначить ацетилсалициловую кислоту, статины и рассмотреть при необходимости вопрос о применении ингибиторов ангиотензинпревращающего фермента (ИАПФ) либо блокаторов рецепторов ангиотензина ІІ (БРА). Для устранения симптомов стенокардии в качестве препаратов первой линии рекомендованы нитраты короткого действия; бета-адреноблокаторы (ББ)/недигидропиридиновые антагонисты кальция (АК); дигидропиридиновые АК (при брадикардии/наличии противопоказаний или непереносимости ББ); комбинация ББ/дигидропиридиновые АК (при III-IV ФК стенокардии).
Однако в ряде случаев препаратов первой линии лечения оказывается недостаточно для эффективного устранения симптомов стенокардии. Рефрактерная стенокардия – распространенная проблема, которую приходится решать не только у пациентов с противопоказаниями (или отказами) к реваскуляризации, но и у больных, перенесших АКШ/стентирование. В этих ситуациях возникает вопрос об оптимизации терапии путем подключения средств второй линии.
Одним из таких препаратов является ранолазин – инновационный антиангинальный препарат, первый ингибитор позднего тока ионов натрия. Основным механизмом действия ранолазина является селективная блокада позднего тока натрия в клетку, уменьшение перегрузки кардиомиоцитов кальцием, снижение напряжения стенки миокарда в диастолу, улучшение его метаболизма.
Антиангинальный и антиишемический эффекты ранолазина связаны с уменьшением напряжения миокарда в диастолу и улучшением кровотока ишемизированных зон миокарда. При этом ранолазин не вызывает клинически значимых изменений частоты сердечных сокращений или артериального давления (АД), а прекращение его приема не сопровождается развитием синдрома отмены.
В европейском руководстве по лечению стабильной стенокардии ранолазин позиционируется как препарат с достаточно высоким классом рекомендаций (ІІа), что подразумевает рассмотрение этого препарата (скорее – ДА, чем НЕТ) в большинстве случаев. Для сравнения: класс рекомендаций у триметазидина – ІІв (может быть рассмотрен в отдельных клинических ситуациях).
Ранолазин – препарат, который обладает хорошей доказательной базой в лечении стабильной стенокардии: его антиангинальная и антиишемическая эффективность была продемонстрирована в рандомизированных контролируемых исследованиях MARISA, CARISA, ERICA. В исследовании MERLIN TIMI 36 ранолазин применяли у пациентов с инфарктом миокарда без подъема ST или нестабильной стенокардией; при этом наблюдали ряд положительных эффектов, включая снижение частоты случаев рецидивов ишемии и возникновения случаев желудочковой тахикардии в первые 7 дней после развития события.
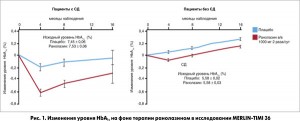
Есть данные, которые демонстрируют дополнительные преимущества ранолазина у пациентов с нарушениями углеводного обмена и СД 2 типа. Так, в исследовании TЕRISA максимальные преимущества терапии ранолазином наблюдались у пациентов с более высоким исходным уровнем HbA1c; в исследовании MERLIN-TIMI 36 в подгруппе больных СД 2 типа также отмечен более выраженный антиишемический эффект ранолазина; кроме того, выявлена способность препарата снижать уровень HbA1c (исследования CАRISA и MERLIN-TIMI 36) (рис. 1).
Таким образом, сегодня мы можем влиять на эффективность антиангинальной и антиишемической терапии у пациентов с ИБС, назначая ранолазин в дополнение к базовому лечению или в качестве альтернативы препаратам первой линии терапии стабильной стенокардии при их непереносимости.
 Доктор медицинских наук, профессор Ирина Алексеевна Дударь (ГУ «Институт нефрологии НАМН Украины») посвятила свое выступление проблемам, связанным с лечением и профилактикой ХБП:
Доктор медицинских наук, профессор Ирина Алексеевна Дударь (ГУ «Институт нефрологии НАМН Украины») посвятила свое выступление проблемам, связанным с лечением и профилактикой ХБП:
– ХБП широко распространена во всем мире (816%, по данным разных авторов) и все чаще развивается у лиц молодого возраста, приводя к ранней инвалидизации и создавая дополнительное финансовое бремя для экономики всех стран. Затраты, связанные с потерей трудоспособности и высокой смертностью среди пациентов с ХБП, а также с проведением диализного лечения у больных с терминальной стадией почечной недостаточности, ощутимы даже для стран с высокоразвитой экономикой. Проблемы, связанные с ХБП, волнуют сегодня не только нефрологов, но и кардиологов. Нарушение функции почек рассматривается в настоящее время как один из значимых факторов сердечно-сосудистого (СС) риска, и появившийся несколько лет назад термин «кардиоренальный континуум» уже стал привычным для врачей.
По мере прогрессирования ХБП и перехода от микроальбуминурии (МА) к протеинурии увеличивается и риск развития СС-заболеваний, которые являются самой частой причиной смерти пациентов, не доживших до терминальной стадии заболевания. По данным пятилетнего наблюдения Keith и соавт. (2004), только 1,3% пациентов с ХБП 3 стадии доживают до того момента, когда им показана заместительная терапия, при этом в 24% случаев смерть наступает от СС-причин. Таким образом, высокий СС-риск на фоне ХБП – еще одна причина актуализации вопроса эффективной профилактики прогрессирования этого заболевания и создания в нефрологии нового направления, получившего название ренопротекторной терапии. Наиболее значимыми факторами риска развития и прогрессирования ХБП являются СД и артериальная гипертензия (АГ).
Очевидно, что эффективность профилактики прогрессирования ХБП во многом зависит от того, насколько рано пациентам с СД и АГ назначается терапия, благоприятно влияющая на функцию почек. Соответственно, своевременное выявление у этих больных альбуминурии любой степени выраженности – важный момент, который, к сожалению, часто остается вне поля зрения врачей, особенно при бессимптомном или малосимптомном течении ХБП. С другой стороны, у пациентов с уже установленной ХБП необходимо контролировать уровень АД и добиваться его снижения и удержания на уровне целевых значений ≤130/80 мм рт. ст.
Обязательным компонентом лечения пациентов с ХБП являются блокаторы ренин-ангиотензиновой системы (РАС) – ИАПФ и БРА, которые следует применять уже на начальных стадиях развития заболевания, что отражено в современных международных рекомендациях по лечению АГ, СД и ХБП. Назначение блокаторов РАС при ХБП – патогенетически обоснованное лечение, главной целью которого является воздействие на механизмы прогрессирования поражения почек. Речь идет прежде всего об эффективной блокаде ангиотензина ІІ: известно, что активация этого гормона, помимо множества других неблагоприятных эффектов, вызывает спазм отводящих почечных артериол, что приводит к повышению внутриклубочкового давления, гиперфильтрации белка и, как следствие, – нарастанию протеинурии.
При наличии СД ситуация усугубляется потерей тонуса приводящих артериол вследствие длительной гипергликемии, и тогда внутриклубочковая гипертензия достигает максимальных значений, а патология почек прогрессирует еще более стремительно даже при отсутствии системной гипертензии. Доказано, что выраженная и длительная протеинурия оказывает токсическое действие на эпителий почечных канальцев, вызывает ремоделирование интерстиция и воспалительную реакцию. Блокада ангиотензина II способствует устранению спазма отводящих артериол, уменьшает внутриклубочковую гипертензию, тормозит развитие склероза почечных клубочков и интерстиция.
При выборе блокатора РАС для лечения пациентов с ХБП следует учитывать, что БРА могут более эффективно блокировать тканевую РАС и, соответственно, обеспечивать более полную блокаду локального (почечного) ангиотензина ІІ. Кроме того, у пациентов с высоким уровнем креатинина и низкими значениями скорости клубочковой фильтрации (СКФ) необходимо принимать во внимание тот факт, что многие ИАПФ имеют преимущественно почечный путь выведения, тогда как у большинства представителей группы БРА основной путь выведения – через печень. Немаловажным преимуществом БРА является и лучшая переносимость, что обусловливает более высокую приверженность пациентов к лечению и снижает риск самостоятельной отмены приема препаратов. В частности, в крупном метаанализе (общее количество пациентов почти 110 тыс.) показано, что 29% больных самостоятельно прекращают антигипертензивную терапию уже в первый год, а наибольшая длительность приема препаратов наблюдается при назначении БРА (T.A. Burke et al., 2006).
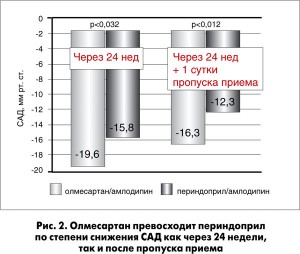
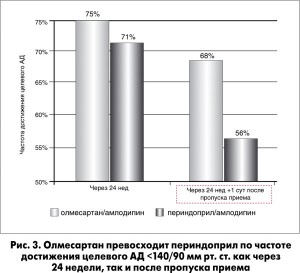
Из представителей группы БРА особое внимание привлекают представители последнего поколения, к которым относится олмесартан – препарат, который продемонстрировал превосходство в отношении выраженности антигипертензивного эффекта даже по сравнению с валсартаном и телмисартаном (Fabia et al., 2007). Более того, для олмесартана зарегистрирована самая низкая частота отказов пациентов от лечения (Mancia et al., 2011). В недавнем исследовании J. Redon и соавт. (2016) показано, что олмесартан превосходит широко применяемый ИАПФ периндоприл по степени снижения систолического АД (САД) и частоте достижения целевого АД у пациентов с СД 2 типа (рис. 2, 3), у которых, как и у пациентов с ХБП, чрезвычайно трудно достичь необходимого антигипертензивного эффекта. Важно, что в этом исследовании преимущество олмесартана сохранялось как через 24 недели лечения, так и после пропуска приема препаратов (1 сут).
На протяжении последних лет опубликованы данные рандомизированных контролируемых исследований, подтверждающие нефропротекторные свойства БРА, которые максимально выражены у больных СД с диабетической нефропатией.
Нефропротекторный эффект олмесартана у пациентов с СД 2 типа был продемонстрирован в масштабном плацебо-контролируемом исследовании ROADMAP (2011), которое включало 4447 больных с СД 2 типа без МА (длительность СД – приблизительно 6 лет, средний уровень СКФ – 85 мл/мин).
Первичной конечной точкой исследования было время до первого появления МА. В процессе наблюдения, которое продолжалось до 4 лет, было показано, что олмесартан достоверно снижает частоту развития МА на 23% по сравнению с плацебо, и данный эффект не зависит от степени снижения АД. Среднее время до появления МА у пациентов в группе олмесартана составило 722 дня (против 576 дней в группе плацебо).
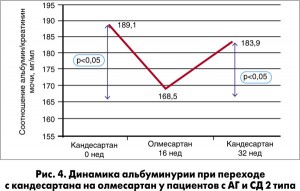
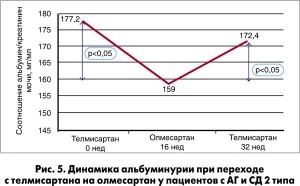
В более позднем исследовании, проведенном H. Daikuhara (2014), показано, что перевод пациентов с АГ и СД 2 типа с кандесартана или телмисартана на олмесартан сопровождается уменьшением показателя альбуминурии, нормализованной по креатинину (соотношение альбумин/креатинин в разовой порции мочи) (рис. 4, 5). Олмесартан также доказал преимущество в обеспечении ренопротекторного эффекта по сравнению с другими БРА у пациентов с ХБП недиабетической этиологии и сопутствующей АГ. Так, в исследовании Takashi Ono и соавт. (2013) на фоне приема олмесартана наблюдалось более выраженное снижение систолического АД и протеинурии по сравнению с лосартаном, кандесартаном и валсартаном уже с первого месяца лечения.
В настоящее время большое внимание уделяется изучению механизмов, с помощью которых антигипертензивные препараты оказывают важные протекторные эффекты, не зависящие от снижения АД. В этом отношении особый интерес представляют экспериментальные данные, свидетельствующие о способности олмесартана выраженно снижать уровни маркеров неспецифического воспаления; в частности IL‑1β и наиболее значимого цитокина при ХБП – TNF-α (R.F. de Araujo et al., 2014). Иммуновоспалительные реакции, опосредованные этими цитокинами, наблюдаются не только при ХБП, но и при ХСН (L.G. Bongartz, 2005; S.D. Anker, 2004) и являются одной из причин ухудшения прогноза у пациентов с этими заболеваниями.
Учитывая, что для пациентов с ХБП характерен высокий СС-риск, нельзя не принимать во внимание и данные Управления по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) 2012 г., согласно которым олмесартан снижает такие важные показатели, как частота развития инфаркта миокарда, инсульта и уровень смертности у пациентов с АГ. Более того, в пятилетнем исследовании, проведенном в Тайване, показаны преимущества олмесартана в снижении риска общей смерти по сравнению с кандесартаном, ирбесартаном и валсартаном (J. Hypertension, 2014).
Следует отметить, что у пациентов с нарушенной функцией почек достижение целевого уровня АД – непростая задача, решение которой требует назначения не менее двух, а иногда – трех и даже четырех антигипертензивных средств. Одной из широко используемых у пациентов с АГ и ХБП антигипертензивных комбинаций является комбинация блокатора РАС и тиазидного (или тиазидоподобного) диуретика. Сочетание представителей этих групп позволяет, с одной стороны, усилить антигипертензивный эффект терапии, с другой – устранить отеки, возникающие на фоне ХБП. С этой точки зрения важно, что олмесартан можно назначать в составе фиксированной комбинации с гидрохлортиазидом (ГХТЗ), причем данная комбинация выпускается с различными дозировками олмесартана и ГХТЗ (20/12,5 мг; 20/25 мг соответственно). Преимущества сочетанного применения олмесартана с ГХТЗ перед комбинацией лосартан/ГХТЗ были продемонстрированы в исследовании Rump и соавт. (2006). Авторы исследования сделали вывод о более выраженном снижении и большей частоте достижения целевых значений АД у пациентов, принимавших комбинацию олмесартан/ГХТЗ (доза ГХТЗ составляла 12,5 мг) по сравнению с комбинацией лосартан/ГХТЗ.
Таким образом, согласно данным современных исследований эффективная ренопротекция может дифференцировать течение ХБП и замедлить прогрессирование этого заболевания. У пациентов, нуждающихся в эффективной ренопротекции, – с ХБП, АГ, СД, диабетической нефропатией – олмесартан можно рассматривать в качестве оптимальной терапии для профилактики и снижения выраженности поражения почек, эффективного контроля АД и воздействия на дополнительные механизмы прогрессирования кардиоренального континуума.
Подготовила Наталья Очеретяная