14 вересня, 2016
Органопротекторні ефекти фіксованої комбінації валсартану з амлодипіном та її вплив на прозапальні й метаболічні показники у пацієнтів із гіпертонічною хворобою
Гіпертонічна хвороба (ГХ) – найпоширеніше неепідемічне захворювання у світі. В Україні, як і в більшості європейських держав, приблизно третина дорослого населення хворіє на ГХ (Коваленко В.М., Корнацький В.М., 2015). Головною проблемою лікування пацієнтів із ГХ залишається забезпечення ефективного контролю артеріального тиску (АТ), тобто досягнення та підтримання його на рівні <140/90 мм рт. ст.
Саме зниження АТ per se є першочерговою умовою для запобігання розвитку ускладнень ГХ – мозкового інсульту, інфаркту міокарда та смерті. Результати численних рандомізованих досліджень свідчать, що для досягнення цільового рівня АТ більш ніж половина пацієнтів із ГХ потребують комбінованої терапії. Так, у дослідженні НОТ встановлено, що для зниження діастолічного АТ до <85 мм рт. ст. 68% хворих потрібно приймати ≥2 антигіпертензивні препарати (Hansson L. et al., 1998). В основі сучасної комбінованої терапії лежить поєднання блокаторів ренін-ангіотензинової системи (РАС) з діуретиками чи антагоністами кальцію (Mancia G. et al., 2013). Комбінація препаратів цих класів доповнює антигіпертензивну ефективність кожного з них, а також покращує профіль безпеки (знижує частоту і вираженість побічних явищ) за рахунок синергізму та комплементарності їхньої дії. Останнім часом поряд із комбінацією РАС з діуретиками все більше застосовують інгібітори ангіотензинперетворювального ферменту і блокатори рецепторів ангіотензину ІІ (БРА) в поєднанні з антагоністами кальцію, переважно з амлодипіном. Ширше застосування такого поєднання зумовлене появою фіксованих комбінацій цих антигіпертензивних препаратів. Так, у метааналізі А. Gupta та співавт. (2010) показано низку переваг фіксованих комбінацій над вільним поєднанням антигіпертензивних препаратів: збільшення прихильності пацієнтів до лікування на 21%, зменшення кількості побічних явищ, а також тенденцію до більш ефективного контролю АТ. Крім того, органопротекторні властивості комбінації блокатора РАС та антагоніста кальцію, встановлені в дослідженні ACCOMPLISH, в якому також продемонстровано переваги застосування зазначеної комбінації над поєднанням блокатора РАС із діуретиком в контексті профілактики розвитку серцево-судинних ускладнень, створюють передумови для її пріоритетного застосування (Jamerson K. et al., 2008).
Одна з перших таких комбінацій – фіксована комбінація валсартану з амлодипіном. Антигіпертензивні, метаболічні, органопротекторні та прогнозмодифікуючі ефекти препаратів, які входять до складу зазначеної комбінації, добре вивчені в масштабних клінічних дослідженнях (Viberti G. et al., 2002; Julius S. et al., 2004; NAVIGATOR Study Group et al., 2010; Shishido T. et al., 2011). Проте властивості фіксованої комбінації цих антигіпертензивних препаратів залишаються недостатньо вивченими. Особливо це стосується її впливу на показники запалення низької градації та структурний стан міокарда лівого шлуночка (ЛШ) і функцію нирок у пацієнтів із ГХ. Мета дослідження – оцінити вплив фіксованої комбінації БРА валсартану з антагоністом кальцію амлодипіном на вуглеводний обмін, активність медіаторів системного запалення, структурні показники ЛШ та функціональний стан нирок у пацієнтів із ГХ.
Матеріали і методи
У дослідження були включені 43 пацієнти з ГХ І і ІІ стадії, 1 ступеня (10 осіб) та 2 ступеня (33 особи), середній вік яких становив 55,9±1,5 року (19 (44,2%) чоловіків). Переважна більшість пацієнтів мали надмірну масу тіла (n=21) і ожиріння (17 осіб), тільки у 5 хворих індекс маси тіла був у межах норми. До моменту включення в дослідження переважна більшість пацієнтів (38 осіб) отримували антигіпертензивну терапію, проте лікування було неефективним.
Після 7-денного безмедикаментозного періоду проводили комплексне обстеження, яке включало вимірювання офісного АТ, добове моніторування АТ (ДМАТ), ехокардіографічне дослідження, забір венозної крові для визначення показників системного запалення, пуринового, вуглеводного і ліпідного метаболізму. Пацієнтам призначали фіксовану комбінацію валсартану з амлодипіном (Діфорс, компанія «Фарма Старт», Україна) в дозі 80/5 мг/добу з підвищенням до 160/5 мг/добу в разі недосягнення цільового АТ (<140/90 мм рт. ст.) за даними офісного вимірювання через 1 міс терапії.
Лікування тривало 6 міс, контроль офісного АТ здійснювали через 1; 3 та 6 міс. Повторні лабораторні й інструментальні дослідження проводили по завершенні лікування.
ДМАТ виконували для оцінки характеристик циркадного ритму АТ за допомогою монітора ABPM‑04 (Meditech, Угорщина) відповідно до стандартного протоколу: вимірювання АТ кожні 15 хв у період денної активності (7:00-22:00) і кожні 30 хв під час нічного сну (22:00-7:00).
Рівні високочутливого С-реактивного білка (СРБ) у крові та альбуміну в добовому аналізі сечі визначали за імунотурбідиметричним методом. Для визначення концентрації інтерлейкіну (ІЛ) 6 та фактора некрозу пухлини (ФНП) застосовували імуноферментний метод. Концентрацію глюкози, глікозильованого гемоглобіну (HbА1с), креатиніну в плазмі крові визначали з використанням відповідних тест-систем. Усі біохімічні тести проводили на біохімічному автоматичному аналізаторі Biosystems A25 (Іспанія). Вміст базального імунореактивного інсуліну визначали радіоімунним методом із використанням стандартних ІРМА-наборів (Immunotech, Чехія).
Інсулінорезистентність оцінювали за індексом НОМА-IR, який розраховували за формулою:
Індекс НОМА-IR = інсулін (мкОд/мл) × глюкоза (ммоль/л) / 22,5.
Функціональний стан нирок оцінювали за швидкістю клубочкової фільтрації (ШКФ), яку розраховували за формулою CKD-EPI, використовуючи електронний калькулятор (https://www.kidney.org/professionals/kdoqi/ gfr_calculator) (Levey A. S. et al., 2009). Структурно-функціональні показники ЛШ досліджували методом ехокардіографії в режимах М- і секторального сканування на приладах Sonoline SL‑1 та Sonoline-Omnia (Siemens, Німеччина) за загальноприйнятою методикою. Масу міокарда ЛШ (ММЛШ) розраховували за формулою Penn Convention:
ММЛШ = 1,04 × ((КДР ЛШ + ТЗС ЛШ + ТМШП)3 – КДР ЛШ3) – 13,6,
де КДР ЛШ– кінцеводіастолічний розмір ЛШ; ТЗС ЛШ – товщина задньої стінки ЛШ; ТМШП – товщина міжшлуночкової перегородки. Індекс ММЛШ (ІММЛШ) вираховували як відношення ММЛШ до площі поверхні тіла.
Критеріями гіпертрофії ЛШ були показники ІММЛШ >125 і >110 г/м2 у чоловіків і жінок відповідно.
Відносну товщину стінки (ВТС) ЛШ розраховували за формулою:
ВТС ЛШ = ТЗС ЛШ / КДР ЛШ × 2.
Критерієм концентричного типу ремоделювання ЛШ було значення ВТС ≥0,42.
Статистичну обробку результатів проводили за допомогою програми SPSS, версія 13. Усі невідомі, які підлягали аналізу, підпорядковувалися нормальному розподіленню за результатом тесту Колмогорова – Смирнова для однієї вибірки. При порівняльному аналізі використовували критерій Стьюдента. Усі значення наведено у вигляді (M±m), де М – середнє арифметичне значення показника, m – стандартна помилка середньої величини. Різницю між сукупностями порівнюваних даних вважали достовірною при р<0,05.
Результати та обговорення
Через 3 міс терапії комбінацією валсартану з амлодипіном у 32 (74,4%) пацієнтів досягнуто цільового рівня офісного АТ (<140/90 мм рт. ст.), через 6 міс – у 31 (73%) хворого. При цьому 12 пацієнтів приймали Діфорс 80, решта – Діфорс 160. Протягом періоду спостереження відзначено стабільний антигіпертензивний ефект комбінації валсартану з амлодипіном (рис. 1), про що свідчить зниження систолічного АТ (САТ) на 15,8% і діастолічного АТ (ДАТ) на 15,3% наприкінці лікувального періоду (p<0,001 для обох показників) порівняно з початковими рівнями. Аналіз динаміки АТ у групі пацієнтів із ГХ 2 ступеня (33 особи) продемонстрував ще більш виражений антигіпертензивний ефект комбінації валсартану з амлодипіном: зниження САТ на 38,1 мм рт. ст. (21,8%), ДАТ – на 17,8 мм рт. ст. (16,9%).
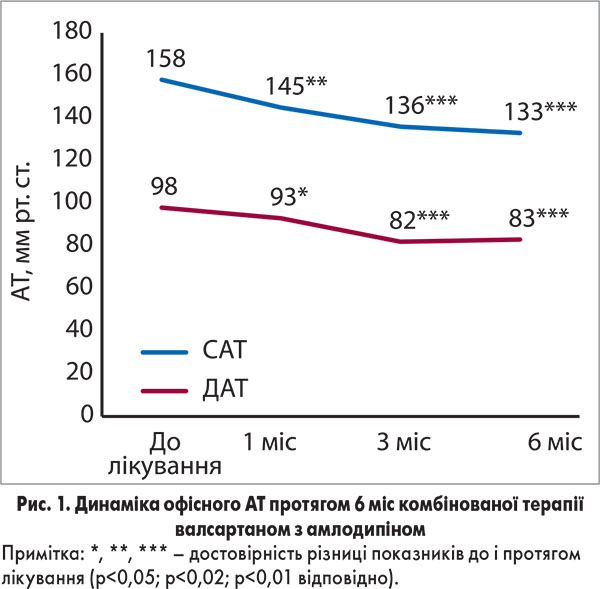
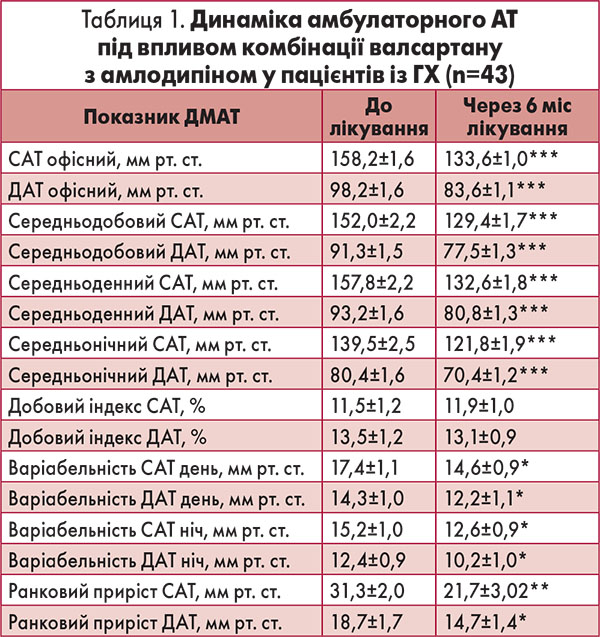
Результати амбулаторного ДМАТ підтверджують високу антигіпертензивну ефективність фіксованої комбінації валсартану з амлодипіном. Лікування протягом 6 міс в середньому по групі сприяло нормалізації показників середньодобового, денного та нічного АТ. Встановлено достовірне зниження середньодобового САТ і ДАТ за рахунок дії препарату як у денний, так і в нічний період (табл. 1).
Комбіноване лікування не впливало на нормальні показники ДМАТ, проте сприяло відновленню його нормального двофазного ритму в пацієнтів із недостатнім вихідним зниженням САТ вночі (non-dipper), кількість яких на початку дослідження становила 14 осіб.
Трансформацію добового ритму типу dipper через 6 міс лікування відзначено в 7 пацієнтів цієї групи, при цьому добовий показник САТ в середньому підвищився з 4,93±0,8 до 8,0±1,1% (p=0,009), ДАТ – з 8,4±1,1 до 12,3±1,4% (p=0,01). На початку дослідження в 3 пацієнтів відзначали надмірне зниження САТ в нічні години: добовий показник становив 23,1±1,0%. Через 6 міс лікування він знизився до 17,6±1,4% (р=0,02). Під впливом терапії спостерігали достовірне зменшення варіабельності АТ у денний і нічний періоди, а також зниження ранкового приросту САТ на 30,7% (p<0,001) та ДАТ на 21,4% (p<0,01).
Встановлений антигіпертензивний ефект фіксованої комбінації валсартану з амлодипіном зіставний із даними попередніх робіт. У низці рандомізованих досліджень застосування валсартану з амлодипіном у фіксованій комбінації в різних дозах було значно ефективніше за монотерапію кожним із компонентів та сприяло досягненню цільового АТ у 71-80% хворих із помірною і тяжкою артеріальною гіпертензією (Allemann Y. et al., 2008; Чазова И. Е., Мартынюк Т. В., 2013).
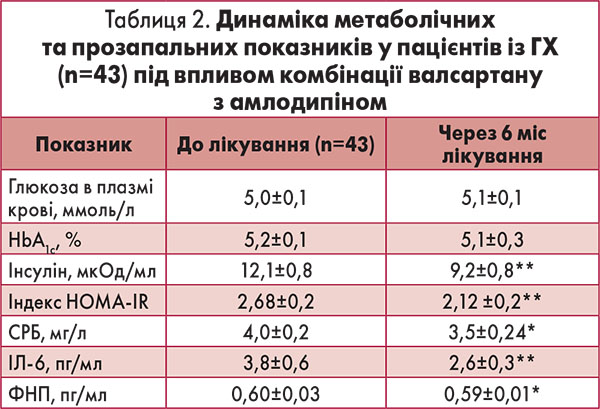
Висока антигіпертензивна ефективність цієї комбінації зумовлена різними механізмами дії валсартану й амлодипіну, що мають синергічний ефект. Валсартан через блокаду АТ1-рецепторів запобігає реалізації негативних ефектів ангіотензину ІІ, викликаючи вазодилатацію та збільшення натрійурезу, а вазодилативні властивості амлодипіну реалізуються через зменшення трансмембранного току іонів кальцію в непосмуговані клітини судин (Kjeldsen S. E. et al., 2007). Аналіз динаміки вуглеводного метаболізму під впливом тривалої терапії фіксованою комбінацією валсартану з амлодипіном свідчив про покращення чутливості тканин до інсуліну, яке проявлялося зниженням вмісту останнього в крові на 24% (р=0,02) та зниженням індексу НОМА-IR з 2,68±0,2 до 2,12±0,2 (р=0,04). Рівень глюкози у плазмі крові та HbA1с протягом лікування достовірно не змінився (табл. 2).
Позитивну динаміку з боку показників вуглеводного обміну зареєстровано переважно в пацієнтів із вихідною інсулінорезистентністю, критерієм якої був показник індексу НОМА-IR ≥2,77; їхня кількість на початку лікувального періоду становила 16 осіб. У цій групі під впливом комбінації валсартану з амлодипіном відбулася нормалізація індексу НОМА-IR з 3,54±0,2 до 2,70±0,3 (р=0,01) на тлі зменшення вмісту в крові інсуліну з 15,1±0,8 до 11,5±1,1 мкОд/мл. Рівні глюкози в плазмі крові (5,4±0,1 проти 5,3±0,2 ммоль/л) та HbA1с (5,6±0,2 проти 5,3±0,1%) за період лікування не зазнали достовірних змін (р>0,05 для обох показників).
Сприятливий метаболічний профіль досліджуваної комбінації перш за все зумовлений властивостями валсартану, який як монотерапія сприяє покращенню чутливості тканин до інсуліну та запобігає розвитку цукрового діабету (ЦД), що продемонстровано в рандомізованому плацебо-контрольованому дослідженні NAVIGATOR у пацієнтів із порушеною толерантністю до глюкози (NAVIGATOR Study Group et al., 2010). І хоча, за даними більшості досліджень, амлодипін є нейтральним щодо впливу на вуглеводний обмін, в частині робіт показано зниження інсулінорезистентності на тлі застосування цього препарату (Fogari R. et al., 2006b; Elliott W. J., Meyer P. M., 2007). R. Fogari та співавт. (2008b) продемонстрували більш суттєве покращення чутливості тканин до інсуліну під впливом комбінації валсартану з амлодипіном, ніж на тлі монотерапії цими антигіпертензивними препаратами.
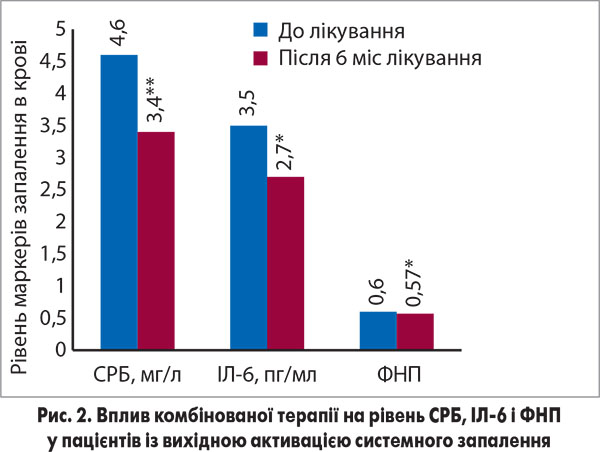
Одна з характерних рис ГХ – активація запалення низької градації, що є невід’є мною патогенетичною ланкою атеросклерозу. Вважається, що системне запалення є зв’язувальною ланкою між артеріальною гіпертензією й атеросклерозом (Cachofeiro V. et al., 2009; Міщенко Л. А., 2012). Це пояснює інтерес до аспекту впливу антигіпертензивних препаратів на активність запалення низької градації, який вивчено і в проведеному нами дослідженні. Переважна більшість включених у дослідження пацієнтів із ГХ, а саме 35 осіб, мали ознаки активації хронічного запалення (критерій – рівень СРБ >3 мг/л). Аналіз впливу комбінованої терапії на показники системного запалення проводили у 20 пацієнтів, які не отримували розувастатину. Під впливом лікування спостерігали достовірне зниження рівня маркера запалення СРБ на 12,5% (р=0,03) і рівня ІЛ‑6 у плазмі крові на 31,6% (р=0,03). Суттєве зниження вмісту в крові СРБ, ІЛ‑6 і ФНП відбулось у 16 хворих із вихідною активацією маркерів запалення низької градації (рис. 2).
Більшість досліджень свідчать про здатність БРА, в тому числі валсартану, пригнічувати активність медіаторів запалення низької градації, натомість дані щодо амлодипіну носять суперечливий характер (Yasunari K. et al., 2004; Shishido T. et al., 2011), хоча амлодипін, як і валсартан, в експериментальних та клінічних роботах зумовлював покращення функції ендотелію та зменшення інтенсивності оксидативних процесів, що має сприяти зниженню активності системного запалення.
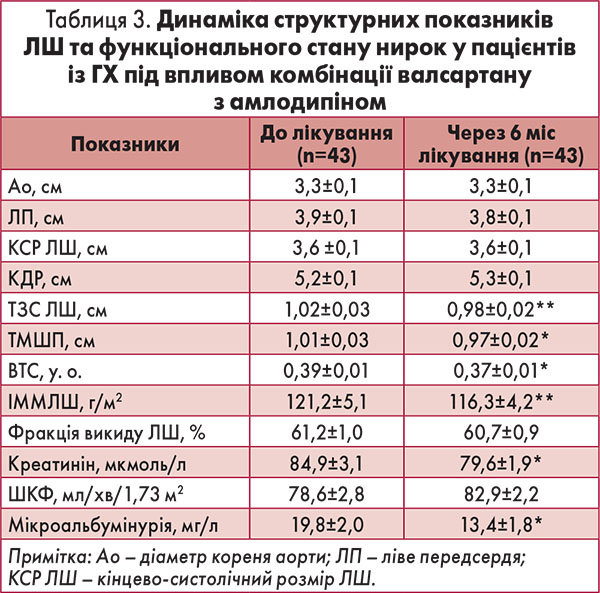
Ця теоретична передумова реалізується в пригніченні запалення низької градації під впливом комбінації валсартану з амлодипіном як у нашій роботі, так і в дослідженні за участі хворих на ЦД 2 типу, де показано зниження рівня прозапального цитокіну ФНП водночас зі зменшенням оксидативного стресу та покращенням функції ендотелію (Fogari F., 2008a). Ефективний контроль АТ на тлі комбінованої терапії створив сприятливі гемодинамічні умови для покращення структурних показників серця та функціонального стану нирок в обстежених. При первинному обстеженні нормальну геометрію ЛШ відзначали в 14, концентричне ремоделювання ЛШ – у 6 учасників, гіпертрофію ЛШ діагностовано у 23 пацієнтів. Через 6 міс комбінованої терапії кількість пацієнтів із гіпертрофією ЛШ зменшилася до 20 осіб, з концентричним ремоделюванням ЛШ – до 1 особи, у 22 хворих ІММЛШ і відносна товщина його стінки відповідали нормі (табл. 3).
У середньому по групі ІММЛШ знизився на 4 (9,7%) (р=0,007) за рахунок зменшення товщини стінок ЛШ. Розміри порожнин лівого передсердя та ЛШ, а також показник систолічної функції ЛШ протягом лікування залишилися незмінними. Найбільш виражену динаміку ІММЛШ спостерігали в пацієнтів із вихідною гіпертрофією ЛШ: 141,6±6,6 г/м2 на початку лікування і 133,8±4 г/м2 наприкінці (р=0,009), а ТМШП та ТЗС ЛШ зменшилися з 1,11±0,03 до 1,05±0,03 см (р=0,02) та з 1,1±0,03 до 1,04±0,03 (р=0,002) відповідно. Загальновідомі кардіопротекторні властивості БРА й антагоністів кальцію знаходять підтвердження в дослідженнях із комбінаціями представників цих груп препаратів. Як у проведеній нами роботі, так і у двох клінічних дослідженнях у пацієнтів із ГХ на фоні ЦД встановлено достовірне зниження ІММЛШ на тлі тривалої комбінованої терапії валсартаном з амлодипіном за рахунок зменшення товщини стінок ЛШ (Fogari R., 2006a). Достовірне зниження ІММЛШ, який оцінювали за допомогою магнітно-резонансної томографії, продемонстровано також у пацієнтів із ГХ з гіпертрофією ЛШ під впливом комбінації валсартану з амлодипіном (Bruder O. et al., 2011).
Поряд із покращенням структурних характеристик серця під впливом валсартану з амлодипіном відзначено також позитивний ефект на функціональний стан нирок. Загалом по групі відбулося зниження рівня креатиніну крові й екскреції альбуміну із сечею, проте зростання ШКФ не було достовірним.
Позитивний нефропротекторний ефект комбінації зареєстровано в пацієнтів із вихідним зниженням ШКФ. З 28 пацієнтів цієї групи у 6 ШКФ була в межах 30-59 мл/хв/1,73 м2, у решти – 60-89 мл/хв/1,73 м2. Під впливом терапії відзначено зниження рівня креатиніну в крові з 92,43±3,9 до 82,1±2,6 мкмоль/л (р=0,001) на фоні зростання ШКФ з 69,2±2,4 до 78,5±2,6 мл/хв/1,73 м2 (р=0,001) та зменшення екскреції альбуміну із сечею на 38,4% – з 25,8±3,8 до 15,9±2,6 мг/л (р=0,004).
У дослідженнях MARVAL та Val-Mets продемонстровано зменшення вираженості мікроальбумінурії у хворих на ЦД з метаболічним синдромом (Viberti G. et al., 2002; Shishido T. et al., 2011). Нефропротекторні властивості валсартану проявлялися зростанням ШКФ і регресом мікроальбумінурії та в комбінації з амлодипіном в обстежених нами пацієнтів зі зниженою функцією нирок.
Результати поодиноких спостережень також свідчать про антипротеїнуретичні властивості комбінації БРА й антагоністів кальцію, причому додавання манідипіну та амлодипіну до БРА в цих роботах посилювало дію кандесартану та телмісартану відповідно щодо зменшення вираженості альбумінурії в пацієнтів із ГХ і ЦД (Fogari R. et al., 2007a).
Це може бути результатом більш ефективного контролю АТ за допомогою комбінованої терапії, з одного боку, а також наслідком зниження інтрагломерулярного тиску за рахунок збалансованої дилатації як аферентної, так і еферентної артеріол – з іншого: валсартан компенсує відсутність впливу амлодипіну на еферентну артеріолу (Fogari R. et al., 2007b).
У проведеному нами дослідженні, як і в інших клінічних роботах, препарат продемонстрував хорошу переносимість. Транзиторний головний біль відзначено в одного, легкий набряк гомілок – у 2 пацієнтів, проте ці прояви не потребували відміни терапії (Poldermans D. et al., 2007; Чазова И. Е., Мартынюк Т. В., 2013).
Висновки
1. Фіксована комбінація валсартану з амлодипіном (препарат Діфорс виробництва компанії «Фарма Старт», Україна) зумовлює виражений антигіпертензивний ефект протягом доби, коригує порушений циркадний ритм АТ і зменшує його варіабельність у денний і нічний періоди. При тривалому застосуванні цієї комбінації в 73% пацієнтів із ГХ вдалося досягти цільового рівня АТ.
2. Комбінована терапія валсартаном з амлодипіном (препарат Діфорс) сприяє підвищенню чутливості тканин до інсуліну, про що свідчить зниження індексу НОМА-IR за рахунок зменшення рівня базального інсуліну в крові на 24% через 6 міс лікування.
3. Валсартан у комбінації з амлодипіном (препарат Діфорс) пригнічує активність системного запалення, що проявляється зниженням вмісту в крові маркера запалення СРБ на 12,5% та його медіатора ІЛ‑6 на 31,5%, що в комплексі зі зниженням АТ і сприятливим метаболічним профілем може зумовлювати позитивний вплив на стан судинної стінки та сповільнювати прогресування атеросклерозу в пацієнтів із ГХ.
4. Фіксована комбінація валсартану з амлодипіном (препарат Діфорс виробництва компанії «Фарма Старт», Україна) покращує структурні характеристики ЛШ і сприяє регресу його гіпертрофії: під впливом терапії відбулося достовірне зниження ІММЛШ на 9,7% за рахунок зменшення товщини стінок ЛШ, що привело до зниження кількості пацієнтів із концентричним типом ремоделювання ЛШ.
5. Збільшення ШКФ на 9,3 мл/хв/1,73 м2 та зменшення екскреції альбуміну із сечею на 38,4% у пацієнтів із вихідною зниженою функцією нирок засвідчує нефропротекторний потенціал фіксованої комбінації валсартану з амлодипіном у пацієнтів із ГХ.
Список літератури знаходиться в редакції.
Український медичний часопис, 2016, 10 квітня.
DIFO-PUB-032016-002
Медична газета «Здоров’я України 21 сторіччя» № 15-16 (388-389), серпень 2016 р.