4 липня, 2016
С чего начинаются сосудистые катастрофы?
В помощь практическому врачу
В настоящее время в клинической практике большое значение придается нарушению функции эндотелия сосудов в развитии и прогрессировании заболеваний сердечно-сосудистой системы.
Эндотелий – тонкая полупроницаемая мембрана, отделяющая кровоток от глубинных структур сосуда, которая непрерывно вырабатывает огромное количество важнейших биологически активных веществ. Учитывая то, что эндотелий сосудов продуцирует более 30 гуморально-активных веществ, его выделили в самостоятельный эндокринный (паракринный) орган. Эндотелий состоит из триллиона эндотелиоцитов, выстилающих внутреннюю поверхность сосудов, и является самым крупным эндокринным органом.
Клетки эндотелия обладают как метаболическими свойствами, так и функциями синтеза, продуцируя следующие факторы:
– факторы вазодилатации: оксид азота (NO), простациклин;
– факторы вазоконстрикции: эндотелин-1 (ЭТ-1), ангиотензинпревращающий фермент (АПФ), тромбоксан А2, лейкотриены, свободные радикалы;
– факторы прокоагуляции: фактор Виллебранда, тромбоксан А2, тромбопластин, фактор V, фактор активации тромбоцитов, ингибитор активатора плазминогена;
– антитромботические факторы: гепарин, антитромбин, простациклин, тромбомодулин, активатор плазминогена.
Наряду с этим эндотелий продуцирует межклеточные вещества (коллаген, фибронектин и др.),
факторы роста, воспалительные медиаторы (интерлейкин 1, 6, 8 и др.). Эндотелий сосудов участвует и в обмене липидов с помощью рецепторов липопротеинов низкой плотности и липопротеинлипазы.
При развитии сосудистых катастроф в роли главного «актера» в этой «драме» выступает NO, который участвует в регуляции просвета сосудов, скорости кровотока, ремоделирования стенок сосудов, реологии крови и стабильности атеросклеротической бляшки. NO образуется из аминокислоты L-аргинина под влиянием ферментов – NО-синтаз (нейрональной, индуцибельной, эндотелиальной). Роль эндотелиальной NO-синтазы (eNOS) хорошо изучена в клинических условиях. Значительное снижение экспрессии eNOS приводит к эндотелиальной дисфункции (ЭД) сосудистого русла и, как следствие, к повышению общего периферического сосудистого сопротивления и снижению перфузии миокарда (А.Е. Березин, 2015). Что касается результатов клинических исследований при нарушении экспрессии индуцибельной синтазы (iNOS), то они противоречивы.
Эндотелий выполняет 4 важные функции:
1. Регуляция тонуса сосудов. Эндотелий поддерживает нормальное артериальное давление (АД), приводит к сужению сосудов, когда необходимо ограничить кровоток, или расширяет их в активно функционирующем органе, нуждающемся в увеличении кровообращения.
2. Расширение и восстановление сети кровеносных сосудов. Эндотелиальные клетки делятся и образуют новые капилляры, через которые в ткани входят стволовые клетки и возобновляют поврежденный орган.
3. Регуляция свертывания крови. Эндотелий предупреждает образование тромбов в норме и активирует процесс свертывания крови при повреждении сосудов.
4. Активно участвует в местном воспалении, пропускает из крови через стенку сосудов в ткани защитные антитела и лейкоциты, осуществляя тем самым защитные механизмы выживания.
Согласно современным представлениям о кардиоваскулярном континууме, сохраненная функция эндотелия – это форпост, который длительное время сдерживает развитие патологических процессов, приводящих к сосудистым катастрофам. Таким образом, сегодня у нас появилась новая цель в профилактике сердечно-сосудистых осложнений – лечение ЭД.
Дисфункция эндотелия – это дисбаланс между продукцией вазодилатирующих, ангиопротекторных, антипролиферативных и вазоконстрикторных, протромботических, пролиферативных факторов.
Основными факторами, стимулирующими клетки эндотелия, являются: 1) изменение скорости кровотока; 2) циркулирующие и/или «внутристеночные» нейрогормоны; 3) факторы тромбоцитарного происхождения.
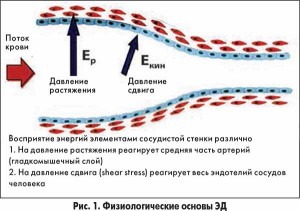
При изменении скорости кровотока увеличивается давление (напряжение) сдвига на сосудистую стенку (рис. 1), что отрицательно влияет на функцию эндотелия. В ответ на повышение давления сдвига происходит парадоксальная реакция эндотелия с преобладанием синтеза вазоконстрикторов, протромбогенных веществ, прокоагулянтов, фактора стимуляции роста, провоспалительных и прооксидантных биологически активных веществ.
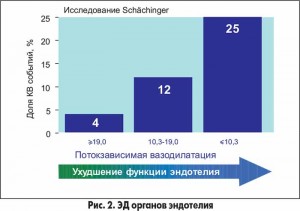
На сегодня доказано наличие прямой корреляционной связи между степенью ЭД и частотой кардиоваскулярных событий: чем больше выражена ЭД, тем чаще развиваются сосудистые катастрофы (рис. 2).
В числе факторов риска развития ЭД: гиперхолестеринемия, курение, частые стрессовые ситуации, нарушения углеводного обмена, пожилой возраст, ожирение. Важнейшим фактором риска развития ЭД является хроническая гиперактивация ренин-ангиотензин-альдостероновой системы, поэтому среди заболеваний с выраженной ЭД – артериальная гипертензия (АГ), ишемическая болезнь сердца – ИБС (острая и хроническая формы), легочная гипертензия, хроническая сердечная недостаточность (ХСН), миокардит, сахарный диабет.
Основные проявления ЭД:
1) нарушение биодоступности NO (считается, что именно это обстоятельство играет ключевую роль в развитии ЭД под влиянием факторов риска возникновения ИБС):
• подавление экспрессии/инактивация еNOS и снижение синтеза NO;
• уменьшение количества рецепторов на поверхности эндотелиальных клеток (в частности, мускариновых), раздражение которых в норме приводит к образованию NO;
• повышение деградации NO: разрушение NO происходит прежде, чем вещество достигнет своего места действия (так действует, например, супероксидный анион, один из продуктов оксидативного стресса);
2) повышение активности АПФ на поверхности эндотелиальных клеток;
3) повышение выработки клетками эндотелия ЭТ-1 и других вазоконстрикторных субстанций;
4) нарушение целостности эндотелия – деэндотелизация.
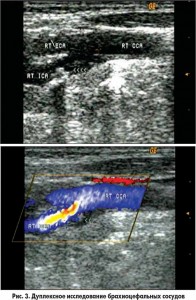
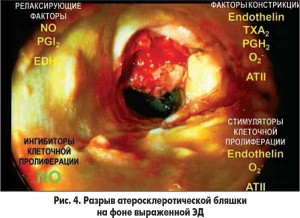
Роль ЭД в развитии функциональной окклюзии сосудов представлена на рисунке 3. При дуплексном сканировании брахиоцефальных сосудов выявлена старая мономорфная, кальцифицированная атеросклеротическая бляшка, которая вызывала сужение просвета сонной артерии на 72%. Однако причиной ишемического инсульта с летальным исходом послужил тромб, который образовался на более молодой, негомогенной, некальцифицированной бляшке, находящейся дистальнее старой. Молодая атеросклеротическая бляшка образовалась в результате завихрения потока крови после прохождения через старую бляшку. Это завихрение разрушило слой эндотелия сонной артерии, привело к «облысению» стенки сосуда. В результате прямого воздействия вазоконстрикторов и липидов сыворотки крови в указанном месте сформировалась молодая бляшка с нестабильной покрышкой, что и привело к образованию тромба на ней с почти полной окклюзией сонной артерии. Этим объясняется тот факт, что примерно в 50% случаев при аутопсии обнаруживают тромбы не на старой бляшке, угрожающей окклюзией, а на молодой.
Разрыв атеросклеротической бляшки обычно происходит на фоне выраженной ЭД (рис. 4).
Клиницисту нет необходимости определять состояние функции эндотелия у кардиологических пациентов. Априори доказано, что у пациентов с АГ, ИБС, миокардитом, ХСН, цереброваскулярной патологией и другими заболеваниями имеет место ЭД. Лечащему врачу важно это знать и включать в схему лечения таких пациентов препараты, способные улучшать функцию эндотелия.
Классификация эндотелиопротекторов:
– заместительные органические протекторные вещества (стабильные аналоги простациклина, нитровазодилататоры);
– стимуляторы синтеза эндотелиальных вазодилататоров, ингибиторы или антагонисты эндотелиальных вазоконстрикторов (ингибиторы АПФ, сартаны);
– антиоксиданты (витамины Е и С);
– мембранопротекторы (статины, эссенциальные фосфолипиды);
– L-аргинин.
Препараты, улучшающие функцию эндотелия сосудов
1. Ингибиторы АПФ. Доказана высокая эффективность рамиприла и периндоприла в связывании АПФ, расположенного на эндотелии сосудов. Именно эти препараты продемонстрировали способность влиять на выживаемость после инфаркта миокарда, что послужило основанием для включения их в протоколы лечения пациентов с ишемической болезнью сердца.
2. Бета-адреноблокаторы: только вазодилатирующие препараты (небиволол, карведилол) оказывают положительное влияние на функцию эндотелия.
3. Сартаны.
4. Антагонисты кальция (например, лерканидипин, амлодипин).
5. Статины (плейотропный эффект).
6. Стимулятор (субстрат) NOS – L-аргинин (Тивортин).
Клинические эффекты L-аргинина как донатора NO с позиций доказательной медицины
В исследованиях доказано, что применение L-аргинина способствует повышению толерантности к физической нагрузке у пациентов с ИБС по данным пробы с 6-минутной ходьбой и при велоэргометрической нагрузке (P. Clarkson et al.,1996; A.J. Maxwell et. al., 2000). Применение инфузий L-аргинина у пациентов с ИБС показало увеличение диаметра просвета сосуда в стенозированном сегменте на 24-30% (A.J. Maxwell et al., 2000; J.O. Parker et al., 2002). Установлены также положительные эффекты L-аргинина (снижение уровня диастолического АД) при добавлении к стандартной терапии АГ (S.G. West et al., 2005).
Особенно ценной в клинической практике является способность L-аргинина влиять на центральное аортальное давление, уменьшая таким образом гемодинамическую нагрузку на церебральные, коронарные и почечные артерии. Следует отметить, что D-аргинин не обладает таким выраженным влиянием на ЭД.
В рандомизированном двойном слепом плацебо-контролируемом исследовании доказано позитивное влияние L-аргинина на гемодинамику и толерантность к физической нагрузке у пациентов с легочной гипертензией. Установлено значительное повышение концентрации L-цитруллина в плазме крови таких пациентов на фоне приема L-аргинина, указывающее на усиление продукции NО, а также снижение на 9% среднего легочного АД.
В 2009 г. V. Bai и соавт. представили результаты метаанализа 13 рандомизированных исследований, в которых изучали влияние L-аргинина на функцию эндотелия сосудов при гиперхолестеринемии, стабильной стенокардии, заболеваниях периферических артерий, ХСН. Как показали результаты метаанализа, применение L-аргинина даже короткими курсами существенно увеличивает эндотелийзависимую вазодилатацию плечевой артерии по сравнению с плацебо, что является показателем улучшения функции эндотелия.
Мы имеем определенный опыт лечения пациентов с ХСН ишемического генеза и анемическим синдромом (АС), который развивался у наших больных на фоне кардиоренального синдрома. Эти данные представляют интерес в связи с тем, что у пациентов пожилого возраста с ХСН и АС развивается более выраженная ЭД по сравнению с больными с ХСН без АС.
В нашем исследовании у пациентов с ХСН II функционального класса (ФК) с сохраненной фракцией выброса левого желудочка (ФВ ЛЖ) и АС уровень ЭТ-1 превышал таковой в группе сравнения (без АС) в 1,5 раза. У больных с ХСН ІІІ-IV ФК, систолической дисфункцией ЛЖ и АС уровень ЭТ-1 увеличивался в 2 раза по сравнению с контрольной группой. Пациенты получали базисную терапию ХСН в соответствии с существующим протоколом; на фоне этого лечения мы проводили коррекцию АС и ЭД (рис. 5).
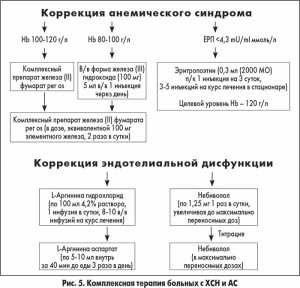
Через 3 мес лечения уровень ЭТ-1 достоверно снизился на 37,2% у больных с ХСН и АС с сохраненной ФВ ЛЖ. При наличии систолической дисфункции ЛЖ уровень ЭТ-1 снизился менее выраженно – на 15,2%. Проспективное наблюдение за этими пациентами в течение 5 лет показало, что выживаемость больных, которые лечились по разработанной нами схеме, существенно (52,9±0,03%) увеличилась. Полученные результаты позволяют утверждать, что активная терапия ЭД способствует более быстрому уменьшению ФК ХСН (Г.В. Дзяк и соавт., 2012).
В заключение отметим, что наиболее простой и доступный способ профилактики ЭД – это умеренные физические нагрузки: физическая зарядка по утрам, неспешная размеренная ходьба, прогулки перед сном. Однако кардиологические пациенты, у которых имеет место выраженная ЭД, усугубляющаяся уже существующим сердечно-сосудистым заболеванием, нуждаются в ее медикаментозной коррекции. Включение L-аргинина в схему терапии таких пациентов будет способствовать более эффективному восстановлению эндотелиальной функции и замедлению прогрессирования кардиоваскулярного континуума.




