30 червня, 2016
Электрическая нестабильность миокарда и комплексный подход к профилактике жизнеугрожающих аритмий у постинфарктных больных
Желудочковые тахикардии (ЖТ) с риском трансформации в фибрилляцию желудочков (ФЖ), возникающие в первые часы и дни при инфаркте миокарда (ИМ), и даже после успешных реперфузионных вмешательств, ассоциируются с высоким риском внезапной смерти и существенно ухудшают прогноз.
 Член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, доктор медицинских наук, профессор Александр Николаевич Пархоменко представил современный взгляд на механизмы и условия развития электрической нестабильности миокарда при остром коронарном синдроме (ОКС), а также прокомментировал возможности профилактики внезапной аритмической смерти у данной категории больных.
Член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, доктор медицинских наук, профессор Александр Николаевич Пархоменко представил современный взгляд на механизмы и условия развития электрической нестабильности миокарда при остром коронарном синдроме (ОКС), а также прокомментировал возможности профилактики внезапной аритмической смерти у данной категории больных.
Желудочковые нарушения ритма часто становятся причиной внезапной смерти больных в раннем и отдаленном постинфарктном периоде, несмотря на оптимальное лечение. Жизнеугрожающие аритмии могут возникать не только в результате ишемии и гибели миокарда, но и при успешной реперфузионной терапии. В зоне высокого риска находятся также пациенты с ОКС без элевации сегмента ST. По данным анализа четырех крупных рандомизированных исследований, развитие ЖТ у пациентов с ОКС без подъема сегмента ST повышает вероятность смерти в первые 30 дней в 11 раз, а ранняя трансформация ЖТ в ФЖ с остановкой кровообращения увеличивает этот риск в 68 раз (S.M. Al-Khatib et al., 2002). Знания механизмов и факторов риска развития аритмий важны не только для электрофизиологов и врачей отделений реанимации и интенсивной терапии, которые имеют дело с пациентами в острой фазе ИМ, но и для кардиологов, которые ведут больных после события.
В аритмогенезе при ишемии или реперфузионном повреждении миокарда участвует множество факторов на клеточном и молекулярном уровнях: нарушение функции натриевых каналов, перегрузка клетки кальцием, альфа- и бета-адренергическая активация и др. В результате локальных метаболических сдвигов сокращается длительность потенциала действия и период реполяризации кардиомиоцитов. Неоднородность характеристик ионных токов и различие фаз потенциалов действия между эпи- и эндокардиальными слоями миокарда создают условия для развития ЖТ и ФЖ под воздействием любого триггерного стимула.
В 1974 г. известный голландский электрофизиолог Н. Wellens предложил концепцию электрической нестабильности сердца. Он предположил, что в поврежденном миокарде формируется субстрат развития аритмий, который проявляется при действии определенных стимулов, и его можно выявить, провоцируя электрической стимуляцией во время электрофизиологического исследования.
ЖТ и ФЖ у пациентов с ОКС могут возникать в первые 24 ч (к ним относятся и ранние реперфузионные аритмии) и в более поздние сроки. Аритмии, возникающие со вторых суток, обусловлены уже не только действием ишемии, но и началом формирования устойчивого аритмогенного субстрата в миокарде, поэтому имеют большее значение для прогноза.
Для развития ЖТ факторами риска являются выраженность ишемии (определяемая подъемом или депрессией сегмента ST на электрокардиограмме), перенесенный ИМ в анамнезе и наличие хронического обструктивного заболевания легких. Для ФЖ дополнительно к перечисленным факторам имеет значение наличие артериальной гипертензии – АГ (S.M. Al-Khatib et al., 2002).
Это объясняется развитием гипертрофии и фиброза миокарда под действием длительной АГ. Участки фиброза становятся субстратом неоднородной возбудимости миокарда.
В основе развития поздних желудочковых аритмий лежит механизм re-entry – повторного входа возбуждения в одни и те же участки миокарда. По мере заживления зоны инфаркта и формирования рубца меняется только форма волны re-entry: из субэпикардиальной в первые 2-3 нед она становится трансмуральной в последующие 4-8 нед.
Н. Wellens в 1970-х годах описал индукцию ЖТ при инвазивной программируемой электрической стимуляции желудочков сердца (ПСЖС). В дальнейшем этот протокол электрофизиологического исследования стали использовать не только для верификации механизма аритмии у пациентов, которые перенесли остановку кровообращения и были реанимированы, но и с целью идентификации больных острым ИМ (ОИМ) с высоким риском возникновения спонтанной устойчивой ЖТ, у которых еще не было приступов аритмии (R. Denniss et al., 1986). Было показано, что наличие индуцированной ЖТ во время ПСЖС является независимым предиктором развития спонтанной жизнеугрожающей аритмии и смерти. В конце 1990-х – начале 2000-х гг. данный метод стали применять за рубежом для отбора пациентов высокого риска и имплантации им кардиовертеров-дефибрилляторов (КД) с целью профилактики внезапной аритмической смерти. Медикаментозная терапия зачастую не помогает улучшить прогноз у таких больных. В исследовании MUSTT было убедительно доказано, что у пациентов, которым имплантировали КД на основании результатов электрофизиологического исследования, достоверно улучшается выживаемость в последующие 5 лет, чего не происходит на фоне медикаментозной антиаритмической терапии без установки КД (A.E. Buxton et al., 1999).
По нашим наблюдениям, процент индуцированных стойких мономорфных ЖТ у пациентов, перенесших ОИМ, перед выпиской из стационара (на второй неделе) и через 2-3 года после события совпадает (А.Н. Пархоменко и соавт., 2001). Это свидетельствует о том, что субстрат будущих аритмий и риска внезапной смерти закладывается в первые дни заживления зоны инфаркта, в период раннего постинфарктного ремоделирования полости сердца и формирования рубца. Таких больных, а это около 25-30% от общей популяции пациентов с ИМ, можно и следует выделять для проведения активной терапии, направленной на предотвращение формирования постоянного аритмогенного субстрата и возникновения эпизодов опасных нарушений ритма в будущем.
Согласно нашим данным больные, у которых развивается ранняя постинфарктная дилатация сердца (в первые 10 дней) с конечно-диастолическим желудочковым индексом >100 мл/м2, наиболее уязвимы для формирования электрической нестабильности миокарда (А.Н. Пархоменко и соавт., 1996). Это объясняет, почему терапия ингибиторами ангиотензинпревращающего фермента (ИАПФ), которые влияют на процессы ремоделирования сердца, может предотвращать смертельные исходы в отдаленном периоде ИМ. Дилатация сопровождается гипертрофией миокарда и фиброзом, который нарушает гомогенность проведения. Простейший метод выявления негомогенности реполяризации миокарда, которая создает условия для развития ЖТ, – это оценка дисперсии интервала QT по данным обычной ЭКГ. Увеличение дисперсии свидетельствует о возможной электрической нестабильности миокарда.
В ходе анализа дисперсии QT по данным цифровой ЭКГ обнаружен высокий показатель гетерогенности реполяризации у постинфарктных пациентов с резидуальной ишемией, которая выявлялась при проведении нагрузочных проб с добутамином. Поэтому для снижения риска электрической нестабильности и формирования постоянного аритмогенного субстрата необходимо как можно раньше, в идеале в первые 2-3 недели после ИМ, устранить причину ишемии (стеноз коронарной артерии), в том числе при необходимости – хирургическими методами.
Ранняя ФЖ у пациентов с ОИМ считается относительно более благоприятной, чем поздняя. Однако при электрофизиологическом исследовании через 1-2 нед у пациентов, у которых в первые сутки ИМ развивалась ФЖ с остановкой кровообращения, индуцированная мономорфная ЖТ регистрировалась в 70% случаев. Это свидетельствует о том, что риск повторения жизнеугрожающей аритмии сохраняется, несмотря на оптимальную медикаментозную терапию антиаритмическими препаратами и бета-блокаторами, назначенную после первого эпизода. Аритмогенный субстрат сформировался, и любой триггерный фактор может запустить ЖТ/ФЖ. Таким триггером может служить стресс, прекращение или пропуск приема лекарств, электролитные нарушения.
В нашем исследовании показано, что у пациентов с постинфарктными спонтанными желудочковыми аритмиями, особенно со стойкими ЖТ и ФЖ, нарушается соотношение холестерина и фосфолипидов клеточных мембран, повышается концентрация продуктов перекисного окисления (А.Н. Пархоменко и соавт., 1995). Это обосновывает раннее назначение гипохолестеринемической терапии статинами у пациентов с ИМ.
Также активно исследуются антиаритмические эффекты препаратов метаболической терапии. Наиболее изученным в этом отношении у пациентов с ИМ является биофлавоноид кверцетин, известный в Украине как препарат Корвитин отечественного производителя (БХФЗ). Установлено, что стойкая мономорфная ЖТ в 5 раз реже индуцируется у пациентов, получающих инфузионную терапию Корвитином в ранние сроки развития ОИМ. Предотвращение формирования аритмогенного субстрата в результате метаболической терапии ассоциируется с улучшением отдаленного прогноза на протяжении 5 лет наблюдения (рис. 1, 2).
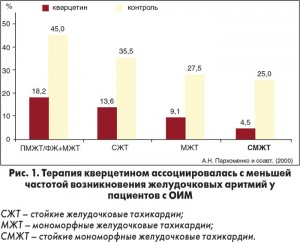
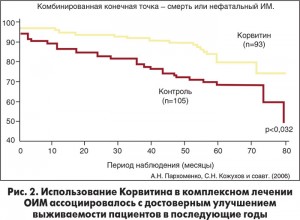
Таким образом, можно выделить два основных направления ведения пациентов с ИМ и высоким риском развития жизнеугрожающих аритмий:
1) как можно более раннее восстановление кровотока – реваскуляризация миокарда (фармакологическим или интервенционным методом) для уменьшения размеров повреждения сердца;
2) раннее назначение препаратов, которые не являются антиаритмическими по своему основному эффекту, но влияют на процессы постинфарктного ремоделирования сердца, механизмы формирования стойкого аритмогенного субстрата и внезапной кардиальной смерти.
Такими свойствами обладают препараты нескольких классов:
• ИАПФ, антагонисты альдостерона (предотвращают ремоделирование и фиброзирование миокарда);
• бета-адреноблокаторы (уменьшают активность симпатической нервной системы и оказывают антиишемическое действие);
• электролиты (калий и магний, особенно у пациентов с гипокалиемией и гипомагниемией);
• статины (нормализуют соотношение содержания холестерина и фосфолипидов в клеточных мембранах, снижают риск жизнеугрожающих аритмий у пациентов высокого риска с электрической нестабильностью миокарда);
• антитромботические и антитромбоцитарные препараты (уменьшают риск ретромбозов);
• омега-3-полиненасыщенные жирные кислоты (обладают антиаритмическими свойствами, однако данные в отношении предупреждения внезапной кардиальной смерти противоречивы);
• препараты метаболической терапии (кверцетин).
Комплексный подход к лечению пациентов с ИМ позволяет уменьшить частоту применения антиаритмических препаратов, которые обладают проаритмогенным эффектом и могут повышать риск развития жизнеугрожающих аритмий. Целесообразным является включение в схему лечения инновационного лекарственного средства – внутривенной формы кверцетина (Корвитин), который обладает доказанным влиянием на биодоступность оксида азота и активность эндотелиальной NO-синтазы, что обусловливает проявление его защитных и репаративных свойств.
Подготовил Дмитрий Молчанов


