30 травня, 2016
Артериальная гипертензия и сахарный диабет: пути повышения эффективности лечения
Сегодня артериальная гипертензия (АГ) получила статус неинфекционной эпидемии, охватившей все страны мира: АГ страдает около четверти населения земного шара. В сочетании с такими распространенными факторами риска, как дислипидемия, ожирение, курение, гиподинамия, сахарный диабет (СД), АГ является причиной не менее 70-75% инсультов, 80-90% острых форм ишемической болезни сердца (ИБС) и в большинстве стран остается ведущей причиной смерти [1, 2].
Более 40 лет назад американские ученые G. Evans и G. Rose определили АГ как такой уровень артериального давления (АД), при котором «лечебные воздействия оказывают гораздо больше пользы, чем вреда» [3]. С тех пор эксперты многократно пересматривали пороговые значения АД, постепенно уменьшая их с уровня 160/95 до 140/90 мм рт. ст. В связи со снижением границ нормального уровня АД распространенность заболевания возросла и, несмотря на длительную стабильность контрольного значения АД, продолжает увеличиваться. В Украине насчитывается около 12 млн больных АГ; количество лиц с АГ в США составляет 24-31%, в странах Европы – 37-55% [4-6].
Глобальную проблему для здравоохранения представляет и СД, распространенность которого удваивается каждые 10-15 лет. По прогнозам специалистов, к 2030 г. этой патологией будет страдать каждый 15-20-й житель планеты [7], а общая численность пациентов с СД составит более полумиллиарда человек. Около 90% случаев диабета представлены СД 2 типа, при этом наблюдается тенденция к омоложению заболевания [8, 9].
Являясь реальной угрозой здоровью и качеству жизни людей, СД остается одной из наиболее распространенных хронических неинфекционных болезней XXI ст. Его медико-социальная значимость обусловлена высоким риском развития макро- и микрососудистых осложнений, особенно при наличии сопутствующих кардиоваскулярных заболеваний, прежде всего АГ [10]. Сосудистые осложнения СД – поражения магистральных сосудов сердца, головного мозга, нижних конечностей, почек – приводят к стойкой утрате трудоспособности и значительно увеличивают риск фатальных катастроф. Как правило, у подавляющего большинства пациентов, имеющих и СД 2 типа, и АГ, развитие эссенциальной АГ предшествует нарушениям углеводного обмена; при этом риск возникновения СД 2 типа на фоне АГ увеличивается в 2,7 раза [11-15]. Сопутствующая АГ – важнейший фактор риска формирования и прогрессирования диабетических микро- и макроангиопатий. При сочетании СД и АГ в 3-5 раз возрастает риск развития фатальной ИБС, в 3-4 раза – инсульта, в 20 раз – гангрены нижних конечностей, в 20-25 раз – уремии, в 10-20 раз – полной потери зрения.
Широкий спектр осложнений, ассоциирующихся с СД, объясняет большой интерес к проблеме врачей всех медицинских специальностей [7, 10]. Однако важно понимать, что сопутствующая диабету АГ является модифицируемым фактором риска осложнений, т. е. поддается коррекции при адекватной терапии. Стабильный контроль уровня АД с достижением его целевых значений существенно снижает вероятность появления тяжелых осложнений, позволяет сохранить трудоспособность пациентов и значительно увеличить продолжительность их жизни. Для больных СД целевым считается уровень АД <140/80 мм рт. ст.; при наличии цереброваскулярной патологии, ретинопатии, микроальбуминурии и других мощных факторов риска осложнений этот показатель должен составлять <130/80 мм рт. ст. [10].
Основными требованиями к медикаментозной антигипертензивной терапии являются метаболическая нейтральность препаратов (отсутствие или положительное влияние на углеводный и липидный обмен), отсутствие нефро- и гепатотоксичности, наличие органопротекторных свойств. Начинать антигипертензивную терапию больных АГ с СД 2 типа рекомендуется при значении систолического АД (САД) ≥140 мм рт. ст. У большинства таких пациентов требуется назначение комбинированной антигипертензивной терапии с обязательным включением ингибитора ангиотензинпревращающего фермента (ИАПФ) или блокатора рецепторов ангиотензина II (БРА) в связи с их нефропротекторными эффектами. Следует избегать одновременного приема 2 блокаторов ренин-ангиотензин-альдостероновой системы (РААС) – ИАПФ, БРА, прямого ингибитора ренина алискирена в разных комбинациях – ввиду возможности развития побочных эффектов. Комбинировать блокатор РААС рекомендуется с антагонистом кальция и тиазидным или тиазидоподобным диуретиком. Назначение β-блокаторов целесообразно у больных ИБС и пациентов с хронической сердечной недостаточностью (ХСН) [16].
АГ при СД 2 типа является составляющей метаболического синдрома (МС), описанного в 1988 г. G. M. Reaven [17]. Понятие «метаболический синдром» объединяет основные признаки – АГ, СД 2 типа или нарушение толерантности к глюкозе, инсулинорезистентность (ИР), дислипидемию (гипертриглицеридемию, гиперхолестеринемию со снижением уровня холестерина липопротеинов высокой плотности – ХС ЛПВП), абдоминальное ожирение, – а также новые дополнительные критерии: неалкогольную жировую болезнь печени, гиперурикемию, микроальбуминурию (МАУ), повышенное содержание в крови прокоагулянтов (фибриногена, ингибитора активатора плазминогена 1 и др.).
Все эти патологические состояния являются следствием одной причины – сниженной чувствительности периферических тканей к инсулину, то есть ИР. Последняя имеет место не только при МС, но и при других патологических или физиологических состояниях: инфекционных процессах, поликистозе яичников, хронической почечной недостаточности, беременности, старении. ИР встречается только у 10% лиц без метаболических нарушений и значительно чаще наблюдается при метаболических расстройствах: у 84% больных СД 2 типа и у 58% пациентов с эссенциальной АГ, у 63% лиц с гиперурикемией и у 84% пациентов, у которых отмечается гипертриглицеридемия, в 88% случаев на фоне низкого уровня ХС ЛПВП и у 66% лиц с нарушенной толерантностью к глюкозе [17]. В условиях МС частота выявления ИР достигает 95%.
ИР – ключевое патогенетическое звено СД 2 типа. Наиболее важное клиническое значение имеет потеря чувствительности к инсулину клеток мышечной, жировой и печеночной тканей [18]. В результате ИР снижается поступление глюкозы из крови в миоциты; при отсутствии чувствительности к антилиполитическому действию инсулина в жировой ткани накапливаются свободные жирные кислоты, поступающие в печень и служащие субстратом для образования атерогенных липопротеинов очень низкой плотности (ЛПОНП), а также способствующие развитию неалкогольной жировой болезни печени. ИР гепатоцитов ассоциируется со снижением синтеза гликогена, активацией его расщепления до глюкозы (гликогенолиза) и продукцией глюкозы (глюконеогенезом), что сопровождается повышением уровня гликемии [19]. ИР может предшествовать развитию СД 2 типа и выявляться у ближайших родственников пациентов с данной патологией, не имеющих нарушений углеводного обмена. Это предположительно указывает на то, что феномен ИР имеет прочную генетическую основу [20].
Достаточно долго ИР может компенсироваться избыточной продукцией инсулина β-клетками поджелудочной железы (гиперинсулинемией), что позволяет сохранить углеводный обмен в норме. Гиперинсулинемия считается маркером ИР и предвестником СД 2 типа. Истощение инсулинсекреторной способности клеток поджелудочной железы приводит к клинической манифестации СД. Гипергликемия усиливает ИР периферических тканей и подавляет секреторную функцию инсулинпродуцирующих клеток. Механизм усиления ИР под влиянием гипергликемии получил название глюкозотоксичности [9, 11, 14].
Гиперинсулинемия как маркер ИР имеет прочную (независимо от массы тела) связь с эссенциальной АГ: у пациентов с высокой концентрацией инсулина в плазме крови можно прогнозировать развитие АГ в ближайшее время. Механизмом повышения АД при гиперинсулинемии считают способность инсулина активировать симпатическую нервную систему (СНС), реабсорбцию Na и жидкости в почечных канальцах и внутриклеточное накопление Na и Са (повышение чувствительности сосудистых рецепторов к действию сосудосуживающих факторов); оказывать митогенные эффекты и стимулировать пролиферацию гладкомышечных клеток сосудов, что ведет к ремоделированию сосудистой стенки – ее утолщению и повышению жесткости. Активация СНС при гиперинсулинемии сопровождается увеличением сердечного выброса и повышением периферического сосудистого сопротивления, в результате чего возрастают показатели АД и ЧСС [21].
Длительное время оставался открытым вопрос, почему у здорового человека инсулин проявляет себя как вазодилататор и при внутривенном болюсном введении не повышает уровень АД [22]. Результаты молекулярно-биологических исследований показали, что инсулин может по-разному действовать на эндотелий сосудов, вызывая либо их расширение, либо спазм. Инсулин связывается с соответствующими рецепторами на поверхности клеток эндотелия и может действовать двумя различными путями. Один из них ассоциирован с активацией субстрата инсулиновых рецепторов 1 и 2 (IRS‑1 и IRS‑2) и фосфатидилинозитол‑3-киназы, что приводит к повышению секреции оксида азота (NO), вазодилатации, антиатерогенным эффектам и инсулинзависимому транспорту глюкозы в клетки. Другой путь – реализация митогенных эффектов инсулина (миграция и пролиферация гладкомышечных клеток, усиление синтеза эндотелиальных сосудосуживающих факторов и повышение АД) через каскад посредников – протеинкиназ Ras, Raf, MEK и МАРК. Установлено, что при ИР первый путь оказывается блокированным, резистентным к инсулину. В результате этого, с одной стороны, отсутствует эффект дополнительного образования NO, то есть нарастает эндотелиальная дисфункция; с другой – высокая активность протеинкиназного механизма способствует прогрессирующему ремоделированию сосудистой стенки и отложению в ней липопротеинов, а также дальнейшему повышению АД.
Тем не менее, несмотря на тесную связь ИР и АГ, феномен ИР с компенсаторной гиперинсулинемией выявляется не у всех пациентов с АГ. Это обусловлено тем, что с ИР тесно коррелирует именно эссенциальная форма АГ, наследственно детерминированная, в то время как вторичные формы АГ с ИР не связаны. Кроме того, не у всех лиц с ИР развивается АГ. Предполагается, что ИР может формироваться при длительном течении АГ. Это может быть обусловлено эффектами ангиотензина II (АТ II), который одновременно активирует систему МАРК и дозозависимо ингибирует комплекс IRS‑1 и IRS‑2, реализующий транспорт глюкозы в клетки и синтез NO [23, 24]. Таким образом, гиперактивация СНС и связанной с ней важнейшей нейрогуморальной РААС способствует развитию резистентности тканей к антигипертензивному и антиатерогенному действию инсулина, нарушению транспорта глюкозы в клетки и развитию или прогрессированию СД 2 типа. При сочетании АГ и СД 2 типа, являющихся отражением общего патофизиологического феномена – синдрома ИР, наблюдается взаимное отягощение течения указанных заболеваний.
Сегодня имеются убедительные доказательства прямой корреляции между степенью ИР и атерогенностью липидного спектра крови, активацией факторов плазменного звена гемостаза, выраженностью абдоминального ожирения, толщиной стенки сонной артерии и даже уровнем летальности от ИБС [25]. Известно и прямое негативное влияние избытка инсулина на сосудистую стенку: способность усиливать отложение липидов, вызывать пролиферацию и миграцию гладкомышечных клеток и фибробластов [26].
Гиперинсулинемия, развивающаяся в ответ на инсулинорезистентность, и гипергликемия оказывают повреждающее действие на эндотелий сосудов, что приводит к снижению образования эндотелиальных вазодилататоров и дезагрегантов, повышению чувствительности эндотелиальных рецепторов к констрикторным стимулам. Одновременно наблюдается гипертрофия гладкомышечных клеток, увеличивается доля фиброзного компонента в адвентиции сосудов. Описанные события демонстрируют наличие эндотелиальной дисфункции, значимость которой в патофизиологии различных заболеваний, прежде всего кардиоваскулярных, неоспорима. И формирование концепции сосудистого здоровья в первую очередь связано с ключевой ролью эндотелиальной дисфункции в механизмах повреждения (ремоделирования) жизненно важных органов, состояние которых влияет на прогноз.
Сочетание АГ и СД 2 типа предполагает наличие комбинации мощных триггеров эндотелиальной дисфункции – напряжения сдвига и оксидативного стресса, характерных для АГ, и гипергликемии, гликозилирования различных клеточных белков, гиперинсулинемии и дислипидемии, ассоциированных с СД 2 типа. Поскольку СД представляет собой классическую модель масштабного поражения сосудистого русла (подобного поражения сосудов не происходит ни при одном другом заболевании), неудивительно, что его сочетание с АГ считается одним из самих прогностически неблагоприятных вариантов сердечно-сосудистой коморбидности. В связи с этим кардиоваскулярная патология является основной причиной смерти больных СД 2 типа.
Повреждение эндотелиальных клеток происходит в несколько этапов: вначале повышается их синтетическая активность; затем нарушается баланс секреции факторов, регулирующих сосудистый тонус, систему гемостаза (процессы тромбообразования/тромболизиса, фибринообразования/фибринолиза), механизмы системного воспалительного ответа, пролиферации, апоптоза, межклеточных взаимодействий. Одновременно увеличивается проницаемость эндотелия для различных компонентов плазмы. В дальнейшем отмечаются истощение и гибель эндотелия с замедлением его регенерации.
В клинической практике нарушение функционального состояния эндотелия диагностируется с помощью определения биохимических и функциональных маркеров. К первым относятся повышение содержания в крови биологически активных веществ, образуемых эндотелием, – фактора Виллебранда, эндотелина‑1, тканевого активатора плазминогена, молекул адгезии (Е- и Р-селектинов, VCAM‑1) и др.
Для оценки функционального состояния эндотелия, прежде всего степени эндотелийзависимой вазодилатации (ЭЗВД), обеспечиваемой секрецией NO, используют пробу с реактивной гиперемией. Исследование проводят утром натощак в положении пациента лежа на спине линейным ультразвуковым датчиком с частотой 5-12 МГц. Перед исследованием измеряется АД. В исходном состоянии определяется диаметр плечевой артерии, далее на плечо накладывается манжета сфигмоманометра и нагнетается воздух до уровня, превышающего исходный показатель САД на 50 мм рт. ст. Давление в манжете сохраняется в течение 5 мин, затем из нее резко выпускается воздух. В течение 5 мин после этого измеряется диаметр артерии, а максимальная его величина принимается за конечный результат. Степень ЭЗВД вычисляется как соотношение максимального диаметра плечевой артерии после проведения пробы к таковому до пробы в процентах (в норме ≥10%). Расширение плечевой артерии после ее пережатия обусловлено выделением NO эндотелием.
Исследования последних лет убедительно доказали ключевую роль эндотелия в развитии сердечно-сосудистых заболеваний (прежде всего ИБС). Сегодня активно изучаются причины дисфункции эндотелия и возможности ее коррекции. Эндотелиальная дисфункция может быть следствием недостаточного запаса L-аргинина (единственного физиологического предшественника оксида азота) в организме, нарушения экспрессии eNOS (фермента образования оксида азота), ускорения метаболизма NO (при повышенном образовании свободных радикалов), комбинации указанных факторов.
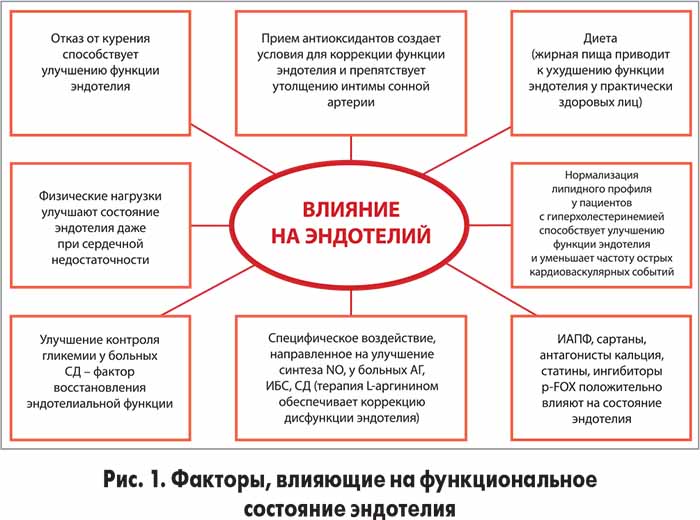
Существует множество возможностей для улучшения функций эндотелия. К ним относят мероприятия по коррекции образа жизни, включающие рациональную диету, адекватную физическую активность, нормализацию массы тела, исключение курения. Весомый вклад в регуляцию функций эндотелия вносят антиоксидантная, гипогликемическая, гиполипидемическая и антигипертензивная терапия (рис. 1).
Большой интерес представляет изучение роли дополнительного включения L-аргинина в схему лечения больных. Результаты исследований по использованию L-аргинина в комплексной терапии АГ, ИБС и СД 2 типа свидетельствуют о его положительном влиянии на функциональное состояние эндотелия и клинический статус пациентов.
У больных с АГ на фоне назначения L-аргинина отмечаются уменьшение выраженности головной боли и шума в ушах, снижение метеочувствительности, повышение эффективности базисной терапии. У пациентов со стенокардией уменьшается интенсивность боли в сердце и количество приступов, а также суточная потребность в нитроглицерине. У пациентов с церебральным атеросклерозом и лиц с поражением сосудов головы и шеи, кроме перечисленных эффектов, улучшаются память и настроение. При патологии сосудов нижних конечностей увеличивается дистанция безболевой ходьбы и улучшается заживление трофических язв.
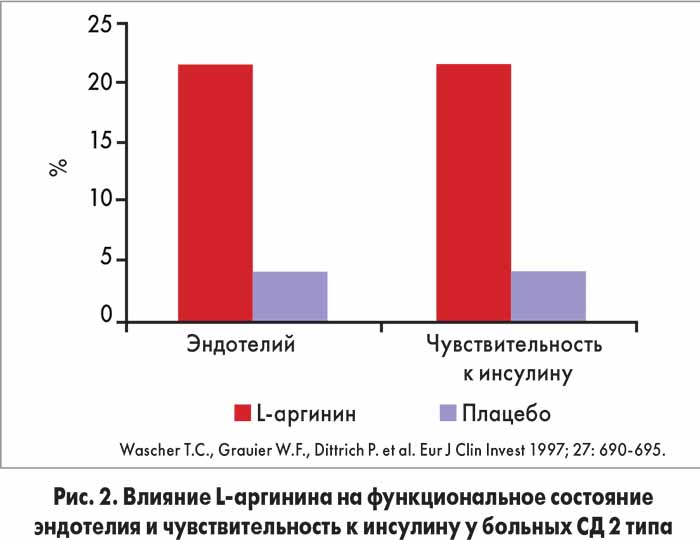
Имеются данные о положительном влиянии L-аргинина на чувствительность тканей к инсулину (рис. 2).
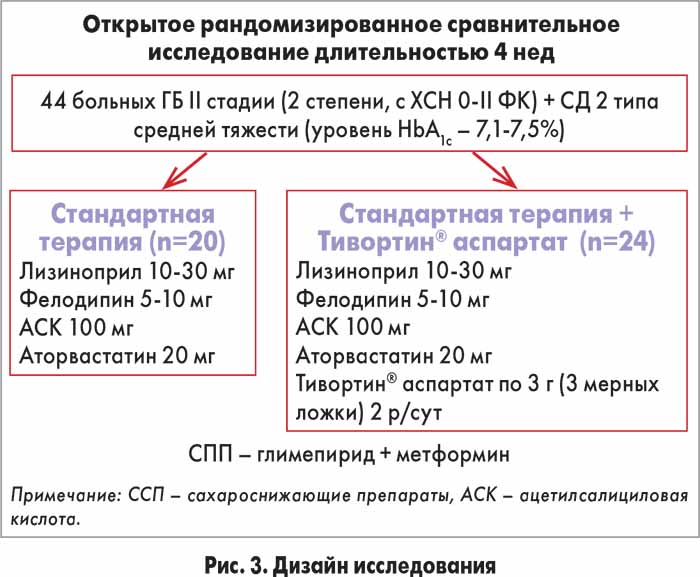
Учитывая актуальность проблемы коррекции эндотелиальной дисфункции у больных АГ в сочетании с СД 2 типа, было проведено исследование с целью изучить влияние 4-недельной терапии препаратом Тивортин® аспартат («Юрия-Фарм») на клинический статус, степень ЭЗВД, степень суточной альбуминурии (САУ) и индекс ИР (HOMA-IR) у пациентов с гипертонической болезнью (ГБ) II стадии 2 степени в сочетании с СД 2 типа средней степени тяжести (в состоянии субкомпенсации).
В исследовании приняли участие 44 больных (14 мужчин и 30 женщин) в возрасте 45-57 лет без инфаркта/инсульта в анамнезе с ХСН не выше II функционального класса (ФК) (тест с 6-минутной ходьбой ≥301 м) и сохраненной фракцией выброса левого желудочка, нормальными уровнями креатинина и билирубина в крови, показателем HbA1c 7,1-7,5%, без протеинурии. Все больные выполняли рекомендации по коррекции образа жизни (диета, исключение курения и приема алкоголя, повышение физической активности). Пациенты 1-й группы получали стандартную терапию, пациентам 2-й группы дополнительно был назначен Тиворин® аспартат. Дизайн исследования представлен на рисунке 3.
Через 8 нед терапии устойчивого уровня АД <140/80 мм рт. ст. в 1-й группе достигли 13 (65%) больных, во 2-й – 19 (79%). Кроме того, в группе, получавшей Тивортин® аспартат, на незначительные головные боли жаловались только 2 (8,3%) участника, в то время как в группе стандартного лечения – 7 (35%) пациентов.
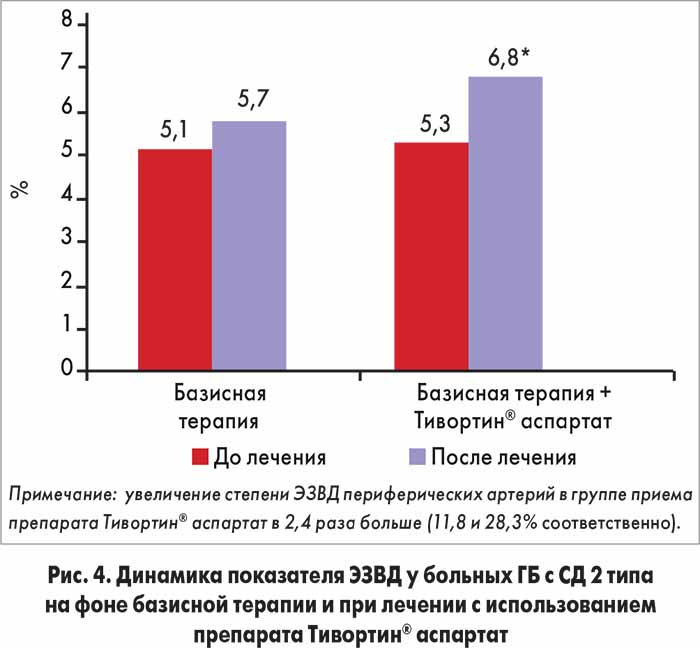
Степень ЭЗВД в группе больных, получавших базисную терапию, увеличилась на 11,3%, в группе дополнительного приема препарата Тивортин® аспартат – 28,3% (разница в 2,4 раза) (рис. 4).
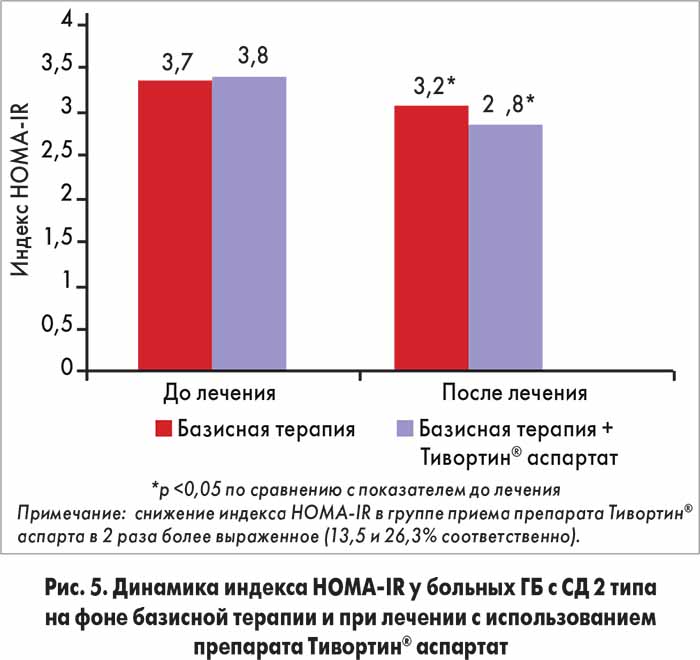
Динамика индекса HOMA-IR на фоне приема препарата Тиворин® аспартат в 2 раза превышала аналогичный показатель в группе больных, получавших базисное лечение, что свидетельствовало о дополнительном снижении ИР (рис. 5).
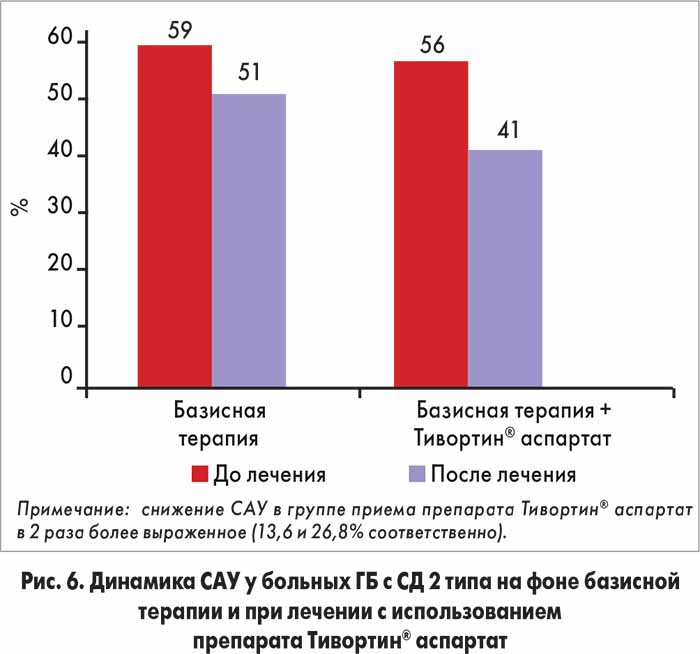
Пациентов с протеинурией в исследование не включали, однако у большинства участников была диагностирована МАУ. Учитывая, что величина САУ является маркером эндотелиальной дисфункции с поражением почек, динамика этого показателя представляла не меньший интерес. По окончании 8-й недели терапии в обеих группах наблюдалось незначительное снижение САУ; у пациентов, получавших Тивортин® аспартат, данный показатель уменьшился более значимо – в 2 раза (рис. 6).
Результаты исследования свидетельствуют о том, что включение в схему лечения больных ГБ с СД 2 типа препарата Тивортин® аспартат, назначаемого перорально (по 3 мерных ложки 2 р/сут в течение 28 дней), способствует более значимому улучшению клинического состояния, увеличению степени ЭЗВД плечевых артерий и снижению таких показателей, как индекс HOMA-IR и САУ, по сравнению с динамикой аналогичных параметров у пациентов, получающих стандартную терапию.
АГ в сочетании с СД 2 типа представляет один из самых прогностически неблагоприятных вариантов коморбидной патологии. Для повышения эффективности лечения этой категории больных необходимы строгое выполнение рекомендаций по коррекции образа жизни и комплексная патогенетически обоснованная терапия, включающая не только антигипертензивные, гиполипидемические и сахароснижающие препараты, но и корректоры эндотелиальной дисфункции, лежащей в основе возникновения повреждений жизненно важных органов.
Список литературы находится в редакции.
| Медична газета «Здоров’я України 21 сторіччя» № 8 (381), квітень 2016 р. |