3 березня, 2016
Тромбозы в практике кардиолога: диагностика, лечение, профилактика
В этом номере мы начинаем подробное обсуждение проблем, связанных с лечением и профилактикой тромбозов.
Первая тема – венозные тромбозы – была выбрана не случайно. 170 лет назад Рудольф Вирхов описал патогенез венозного тромбоза. Этот термин впервые прозвучал в 1846 году на собрании научного кружка в г. Берлине, один из участников которого и Р. Вирхов стали издавать новый научно-практический журнал «Архив патологической анатомии, физиологии и клинической медицины».
Журнал издается и сегодня под названием «Архив Вирхова по патологической анатомии, физиологии и клинической медицине» (Virchow’s Archiv fur pathologische Anatomie und Physiologie und klinische Medezin).
О том, что изменилось за 170 лет, какие знания накоплены в области патогенеза венозных тромбозов и о состоянии проблемы лечения и профилактики венозных тромбоэмболических осложнений (ВТЭО) в Украине и в мире мы попросили рассказать члена-корреспондента НАМН Украины, члена правления Европейского общества кардиологов, вице-президента Ассоциации кардиологов Украины, руководителя отдела реанимации и интенсивной терапии Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, доктора медицинских наук, профессора Александра Николаевича Пархоменко.
– Александр Николаевич, что изменилось в состоянии проблемы венозных тромбозов с того момента, когда ее впервые озвучил Р. Вирхов?
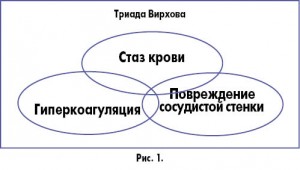
– Наверное, нельзя дать однозначный ответ на вопрос, как далеко мы продвинулись за прошедшие 170 лет в области понимания и, главное, – профилактики венозных тромбозов. С одной стороны, мы по сей день используем триаду Вирхова для объяснения патогенеза венозного тромбоза, согласно которой повышение риска тромбозов и тромбоэмболий связано с нарушением целостности сосудистой стенки, замедлением кровотока и изменением свойств крови (рис. 1).
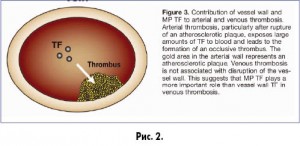
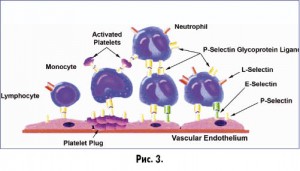
С другой – это учение развилось благодаря прогрессу в области детального понимания процесса свертывания крови, который сегодня рассматривается как проферментно- ферментный каскад, запускающийся с участием десятков белков и реакций. Возникло понятие о внутренней и внешней системах свертывания крови, дополняющих друг друга. Изучена роль тканевого фактора (тканевого тромбопластина) в активации внешней системы свертывания крови, которая запускается в ответ на повреждение кровеносного сосуда. Мы знаем, что взаимодействие тканевого тромбопластина с активированным фактором свертывания крови VII приводит к образованию комплекса, активирующего фактор свертывания крови Xа, который в свою очередь стимулирует образование тромбина из протромбина. Благодаря развитию молекулярной биологии нам известно, что при венозных тромбозах главным источником тканевого тромбопластина являются микрочастицы плазмы крови (рис. 2), выделяющиеся из активированных нейтрофилов, моноцитов и содержащие большое количество компонентов, включая биологически активные: микроРНК, разнообразные биологически активные пептиды, факторы адгезии клеток. Установлено, что в развитии венозных тромбозов, в отличие от артериальных, главную роль играет активация клеток крови, в том числе моноцитов, экспрессия молекул адгезии клеток и повышенная секреция провоспалительных цитокинов, стимулирующих продукцию белков острой фазы воспаления (рис. 3).
Но намного ли мы приблизились к полному пониманию того, что приводит к запуску процессов, которые нарушают равновесие и активируют процесс тромбообразования? Мне кажется, нет. Мы и сегодня не всегда можем ответить на многие вопросы, например, почему при наличии одних и тех же факторов риска тромбоз развивается не у каждого, кто их имеет?
Изменилась ли кардинально ситуация в области своевременной диагностики, лечения и профилактики ВТЭО? Судя по данным статистики заболеваемости и смертности от ВТЭО, мы только в начале пути к достижению этих целей. У нас есть высокотехнологичное диагностическое оборудование и антикоагулянты, но статистические данные западных стран свидетельствуют, что люди продолжают умирать от недиагностированных и нелеченных ВТЭО. Так, в Европе остаются недиагностированными около 60% случаев тромбоэмболии легочной артерии – ТЭЛА (Konstantinides, 2014). В европейских странах ежегодно регистрируются до 100 тыс. случаев этого заболевания, а уровень смертности при нелеченной ТЭЛА колеблется, по данным разных авторов, от 40% (при немассивном поражении легочных сосудов) до 70% (при массивной ТЭЛА).
Если экстраполировать европейскую статистику заболеваемости ТЭЛА на население Украины, то количество случаев ТЭЛА в нашей стране должно составлять не менее 120 тыс. в год, т.е. как минимум в 2,5 раза больше, чем инфарктов миокарда! Учитывая огромное количество факторов риска, определяющих реализацию триады Вирхова, ВТЭО могут развиться у большого количества пациентов, которых наблюдают терапевты, кардиологи, неврологи, пульмонологи, хирурги, акушеры-гинекологи.
Так, в США около 4 млн госпитализированных пациентов хирургического профиля и 8 млн госпитализированных пациентов, получающих медикаментозное лечение, имеют средний и высокий риск развития ВТЭО (Samuel Z. Goldhaber, 2012).
Однако ТЭЛА остается незнакомым термином для большинства населения, а врачи не проявляют должной настороженности в отношении этого осложнения.
К сожалению, мы даже не используем в полной мере те возможности, которые имеем, например, антикоагулянты, история внедрения которых началась еще в 1916 году – с того момента, когда студент медицинского факультета Университета Джона Хопкинса Джей Маклин открыл гепарин.
Здесь хотелось бы сделать небольшое отступление и вспомнить, что несколько десятилетий понадобилось для создания низкомолекулярных гепаринов (НМГ). Потребность в НМГ возникла в связи с недостаточным антитромбиновым эффектом нефракционированного гепарина (НФГ), который, связываясь с антитромбином ІІІ, блокирует только свободно циркулирующий тромбин и не действует на тромбин, находящийся внутри тромба. НМГ, полученные путем химической или ферментативной деполимеризации цепей полисахаридов стандартного гепарина, обладают более низким средним молекулярным весом, что обусловливает их более высокую биодоступность и селективность по отношению к Ха фактору. Последнее свойство обеспечивает снижение риска развития гепарин-индуцированной тромбоцитопении. При этом чем меньше средний молекулярный вес НМГ, тем более целевое воздействие на Ха фактор оказывает препарат, и, следовательно, он более безопасен в отношении риска возникновения кровотечений. В структуре молекул НМГ имеются также полисахаридные цепи, не обладающие антикоагулянтной активностью, – гликозаминогликаны, модулирующие активность НМГ и оказывающие проангиогенное действие, защищая гликокаликс эндотелия сосудов от повреждения.
Появление НМГ значительно упростило использование парентеральных антикоагулянтов, избавив врачей от необходимости регулярно проводить определение времени свертывания крови или активированного частичного тромбопластинового времени. На сегодняшний день НМГ широко используют при лечении тромбоза глубоких вен и ТЭЛА. Однако структура и свойства препаратов этой группы отличаются между собой, в связи с чем различаются их эффекты. Поэтому, прежде чем назначить НМГ, врач должен тщательно продумать выбор препарата из этой группы, а также взвесить риски, связанные с применением генерика или биосимиляра.
В настоящее время самое большое количество рандомизированных клинических исследований по изучению профилактики ВТЭО проведено с применением НМГ, в частности эноксапарина. НМГ являются наиболее изученными и рекомендуемыми в кардиологической, хирургической и акушерской практике. У пациентов со средней или высокой вероятностью ТЭЛА терапию НМГ начинают уже в процессе диагностики, не дожидаясь окончательного подтверждения диагноза, и продолжают не менее 5 дней. Примерно на такой же срок (не менее 5-7 дней) НМГ рекомендовано назначать и с целью первичной профилактики ВТЭО у хирургических пациентов или пациентов, подвергающихся операциям на сосудах. В терапевтической практике у больных с длительным ограничением подвижности этот срок может быть увеличен.
Параллельно с внедрением и усовершенствованием гепаринов осуществлялась работа по созданию пероральных антикоагулянтов, первым и единственным представителем которых долгое время (почти 50 лет) был варфарин. 100 лет понадобилось для того, чтобы после обнаружения антитромботических свойств ферментов слюны пиявки (1884 г., физиолог Джонн Берри Хайкрафт) воспроизвести рекомбинантный гирудин методом генной инженерии. Сегодня в клиническую практику внедрен прямой ингибитор тромбина – дабигатран, а также ингибиторы Ха фактора ривароксабан, апиксабан, эдоксабан – новые пероральные антикоагулянты, появление которых предоставило новые возможности в длительной профилактике ВТЭО.
Безусловно, антикоагулянтная терапия – это лечение уже состоявшегося тромбоза или профилактика у пациентов с высоким тромбогенным потенциалом. Какой путь нам предстоит пройти, чтобы до конца понять все причины увеличения этого потенциала и запуска всех механизмов тромбоза – можно только предполагать. Но уже сегодня мы могли бы предотвратить десятки тысяч ВТЭО и смертей от этих осложнений, если бы умели сложить цельный портрет пациента с учетом всех рисков и своевременно назначить профилактическую терапию.
– Как в реальной практике можно определить пациентов, которым необходима оценка риска ВТЭО и профилактика этих осложнений?
– Отбор пациентов для стратификации риска ВТЭО в первую очередь проводится на основании общеизвестных факторов риска, к которым относятся: хроническая сердечная недостаточность, хронические заболевания легких, травмы нижних конечностей, острые системные и онкологические заболевания, тромбофлебит нижних конечностей, хирургические операции, прием эстроген-содержащих препаратов. Нельзя упускать из поля зрения и такие факторы, как длительное ограничение подвижности (в эту категорию входят и те пациенты, которые придерживаются постельного режима >3 дней с выходом в туалет), беременность (беременные в свою очередь разделяются на группы высокого, среднего и низкого риска), возраст старше 60 лет, характер работы.
– Какие шкалы используются в настоящее время для оценки риска ВТЭО?
– У госпитализированных терапевтических больных сегодня применяется шкала Падуа (в модификации Кучера), которая подразумевает балльную оценку таких факторов риска, как наличие активного рака, анамнез предыдущих ВТЭО, ограниченная подвижность, известная тромбофилия, травма и/или операция (до 1 мес), возраст ≥70 лет, сердечная недостаточность, инфаркт миокарда и/или инсульт, острое инфекционное или ревматическое заболевание, ожирение (индекс массы тела >30 кг/м2), продолжение использования заместительной гормональной терапии или оральных контрацептивов. В соответствии с этой шкалой высокий риск развития ВТЭО имеют больные, которым присвоено 4 и более балла.
У пациентов хирургического профиля риск развития ВТЭО оценивают с помощью шкалы Caprini, у беременных используется количественная оценка риска, предложенная D. Schoenbeck.
Однако большинство практикующих врачей не умеют определять риск развития ВТЭО у больных и в реальной практике не применяют указанные шкалы. Очевидно, нам следует максимально упростить алгоритм определения пациентов, нуждающихся в оценке риска развития ВТЭО. Для этого необходимо акцентировать внимание врачей на ведущем факторе риска у больных, который наиболее распространен в их клинической практике (активный рак – для онколога, длительная иммобилизация – для терапевта, прием контрацептивов – для гинеколога и т.д.). Кроме того, следует адаптировать анкеты для стратификации риска под специализацию врача или отделения, в котором оказывают помощь пациенту. Это одна из задач, которую предстоит выполнить в ходе работы над созданием обновленных национальных междисциплинарных рекомендаций по первичной профилактике ВТЭО. Другой актуальной задачей является создание паспорта пациента с высоким тромботическим риском, что позволило бы устранить часто имеющее место расхождение во мнении специалистов различного профиля о целесообразности тромбопрофилактики у конкретного пациента при том или ином заболевании.
– Что предшествовало началу работы над новыми национальными рекомендациями?
– Этому предшествовало проведение проекта «Территория безопасности» на протяжении 2013-2014 гг. по инициативе Ассоциации ангиологов и сосудистых хирургов Украины при содействии Ассоциации кардиологов, сердечных и сосудистых хирургов г. Киева и Украинской ассоциации специалистов по неотложной кардиологии. В рамках данного проекта практикующие врачи из разных городов Украины оценивали риск развития ВТЭО у госпитализированных пациентов хирургического и терапевтического профиля и назначали им соответствующую профилактику. Результаты проекта продемонстрировали низкую осведомленность врачей в отношении факторов риска возникновения ВТЭО, неумение оценивать этот риск, недостаточное знание современных схем антикоагулянтной профилактики, отсутствие контроля над длительностью профилактики. С другой стороны, отмечена низкая доступность одного из важных диагностических и прогностических маркеров венозного тромбоэмболизма – Д-димера (продукт протеолиза фибрина и фибриногена).
В настоящее время мультидисциплинарной группой экспертов в области терапии, кардиологии, сосудистой хирургии, анестезиологии, пульмонологии, неврологии, гинекологии, фармакологии под эгидой МЗ Украины проводится работа над созданием национального клинического руководства и унифицированного клинического протокола по диагностике и лечению ТЭЛА, а также готовятся обновленные национальные рекомендации по профилактике ВТЭО под эгидой целого ряда профильных ассоциаций и обществ специалистов. Надеюсь, что новые документы станут значимым шагом на пути к развитию и практической реализации идеологии профилактики и лечения ВТЭО в Украине.
Подготовила Наталья Очеретяная