17 лютого, 2016
Медикаментозная терапия хронической сердечной недостаточности у детей

Медикаментозная терапия является одной из самых эффективных лечебных стратегий. Лекарственные средства, применяемые в педиатрической практике, как правило, назначаются эмпирически на основе данных, полученных у взрослых пациентов. Ранее считалось, что механизм действия препаратов аналогичен у детей и взрослых, а необходимую дозу рассчитывали, исходя из массы тела. Однако фармакологический ответ на прием лекарственных средств в зависимости от возраста может принципиально отличаться, поскольку растущий организм ребенка по сравнению со взрослыми имеет свои особенности в рецепторном аппарате тканей и органов, механизмах всасывания и процессах экскреции, качественном и количественном составе белковых фракций плазмы крови и др., а изменения фармакокинетических и фармакодинамических процессов значительно влияют на чувствительность к препаратам, что может приводить к развитию нежелательных побочных реакций, характерных только для детской популяции. Кроме того, лекарственные средства способны оказывать специфическое воздействие на физическое и когнитивное развитие ребенка, иммунное и половое созревание.
Сердечная недостаточность (СН) – сложный патофизиологический синдром, который развивается у детей в результате заболеваний сердечно-сосудистой системы (кардиомиопатий – КМП, миокардитов, врожденных пороков сердца – ВПС, метаболических нарушений), а также влияния медикаментозной терапии (например, применения антрациклинов) и др., ассоциирующийся с высоким уровнем заболеваемости и смертности, что является тяжелым бременем как для семьи, так и для общества в целом. Современная медикаментозная терапия в педиатрии базируется в основном на рекомендациях по лечению СН у взрослых пациентов, несмотря на отсутствие убедительных доказательств влияния на выживаемость детей. В данной статье рассмотрены основные классы препаратов, применяющиеся для лечения хронической СН (ХСН) в педиатрической практике, клинические данные по целесообразности их использования, вопросы безопасности и мониторинга в процессе терапии.
Ингибиторы ангиотензинпревращающего фермента (ИАПФ)
ИАПФ относятся к препаратам первой линии для лечения больных с ХСН.
Изучение эффективности указанного класса лекарственных средств у новорожденных детей с СН вследствие перегрузки объемом началось в конце 1980-х годов после публикации результатов первых исследований, в которых были продемонстрированы убедительные доказательства преимуществ ИАПФ и блокаторов β-адренергических рецепторов у взрослых лиц с ХСН. В дальнейшем в рандомизированных клинических исследованиях (РКИ) с участием взрослых пациентов неоднократно было подтверждено, что ИАПФ в оптимальных дозировках улучшают клиническое течение и повышают выживаемость больных с ХСН; у детей преимущественно изучались показатели гемодинамики [1-7].
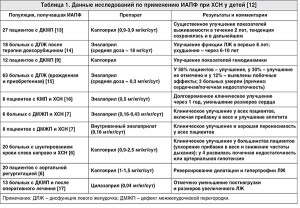
В ретроспективных исследованиях [8, 9] было отмечено благоприятное влияние ИАПФ на выживаемость детей с дилатационной кардиомиопатией (ДКМП) и ХСН, однако в других исследованиях [10, 11] преимуществ ИАПФ в отношении выживаемости в педиатрической популяции не выявлено. Результаты основных исследований по применению ИАПФ у детей с СН суммированы в таблице 1. Следует отметить, что ряд исследований проведены ретроспективно с использованием суррогатных маркеров оценки клинических исходов.
В обзоре К. Momma [18] обобщены данные 4 небольших нерандомизированных клинических исследований, посвященных применению ИАПФ у 49 детей с врожденными пороками сердца (ВПС) с шунтированием крови слева направо и СН. Эффекты ИАПФ на ренин-ангиотензин-альдостероновую систему (РААС) у педиатрических пациентов были подобны таковым у взрослых больных. У большинства пациентов на фоне лечения и каптоприлом, и эналаприлом наблюдалось улучшение. Выявлено, что у педиатрических больных с СН ИАПФ снижают аортальное давление и общее периферическое сосудистое сопротивление (ОПСС), почти не влияют на легочное сосудистое сопротивление и уменьшают давление в левом и правом предсердии; у детей со значительным ДМЖП и выраженной легочной гипертензией ИАПФ облегчают антеградный кровоток из ЛЖ и тем самым уменьшают сброс через ДМЖП; у детей с ДЛЖ, митральной и аортальной регургитацией на фоне применения ИАПФ отмечено небольшое увеличение фракции выброса (ФВ) ЛЖ, фракции укорочения ЛЖ и системного кровотока. Причем указанные положительные эффекты, как правило, сохраняются при длительном наблюдении.
Кроме того, на фоне лечения ИАПФ зарегистрированы случаи ухудшения функции почек и артериальной гипотензии, особенно у недоношенных младенцев. Указанные побочные эффекты обычно выявляются в первые 5 дней от начала терапии ИАПФ или после повышения дозы препарата; в большинстве случаев улучшение наблюдалось после снижения дозы или отмены ИАПФ. Тем не менее в небольшом количестве случаев может развиться почечная недостаточность и наступить летальный исход. Однако следует отметить, что большинство пациентов до участия в исследовании имели существенные нарушения гемодинамики, поэтому степень влияния ИАПФ на развитие указанных неблагоприятных исходов остается неясной. Среди других побочных эффектов зарегистрирован один случай нейтропении и кашля, разрешившихся после отмены лекарственного средства [15].
Для предупреждения выраженной артериальной гипотензии лечение ИАПФ начинают со стартовой дозы с последующим постепенным повышением до целевой [18]. Каптоприл назначается перорально, обычно каждые 8 ч, суточная доза для детей – 0,3-1,5 мг/кг; эналаприл – перорально, 1-2 раза в день, в суточной дозе 0,1-0,5 мг/кг. Эналаприлат вводят внутривенно 1-3 раза в день, по 0,01-0,05 мг/кг на одну инфузию.
В соответствии с результатами клинических исследований, посвященных применению ИАПФ при СН у детей, К. Momma обобщил показания к назначению этого класса препаратов [18]:
1) ИАПФ следует включать в комплексную терапию при дисфункции миокарда;
2) лечение ИАПФ эффективно при легкой и умеренной степени клапанной недостаточности;
3) ИАПФ необходимо назначать при выраженном шунтировании крови слева направо, если показанное хирургическое лечение откладывается.
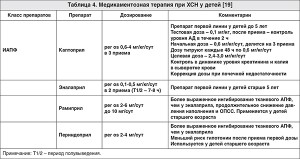
Наиболее изученными ИАПФ в терапии СН у детей являются «классические» каптоприл и эналаприл, которым следует отдавать предпочтение в лечении ХСН в педиатрической популяции (табл. 2) [1].

Имеются данные, подтверждающие эффективность рамиприла и лизиноприла у детей с артериальной гипертензией (АГ), однако использование указанных препаратов при СН в педиатрической практике недостаточно изучено, кроме того, не опубликованы результаты исследований, посвященных применению периндоприла у детей. Несмотря на широкое использование ИАПФ, не было получено данных о влиянии указанного класса лекарственных средств на выживаемость детей с симптоматической ХСН [19]. В РКИ [20], в котором изучали 57 случаев мышечной дистрофии Дюшенна, установлено, что дополнительное назначение периндоприла замедляет прогрессию ремоделирования ЛЖ в сравнении с группой плацебо. Однако в другом исследовании [21], включившем детей с КМП, вызванной антрациклинами, выявленные благоприятные эффекты эналаприла были незначительными (табл. 3).
Практические рекомендации [19]
При тяжелой СН терапию ИАПФ необходимо начинать после стабилизации симптомов СН путем назначения диуретиков и после отмены препаратов, обеспечивающих инотропную поддержку. Дозу лекарственного средства повышают через 3-10 дней в условиях специализированного стационара и более постепенно в амбулаторных условиях. У большинства детей препаратом первой линии является каптоприл, а в старшем возрасте – эналаприл (табл. 4). Каптоприл используется в форме таблеток, которые растворяются в точном объеме воды для получения дозируемой суспензии. В более старшем возрасте при стабильной гемодинамике может рассматриваться вопрос о применении ИАПФ длительного действия, в частности рамиприла или периндоприла, что позволяет повысить приверженность к лечению. При увеличении уровня креатинина на 50% и более от исходного значения необходима оценка водного баланса организма и пересмотр диуретической терапии, рекомендуется снижение дозы или отмена ИАПФ [15].
С особой осторожностью указанные лекарственные средства используют в первые 4 мес жизни, поскольку в этом возрасте чаще развивается почечная дисфункция [15], и, следовательно, повышают дозу при тщательном контроле. На фоне приема ИАПФ у пациентов отмечается незначительное снижение систолического артериального давления (САД). В ряде случаев уровень АД снижается больше, чем на 5-10% от исходных значений, в связи с чем необходим мониторинг динамики этого показателя в течение 2 ч после приема первой дозы препарата [4]. Выявлено, что большее снижение уровня АД наблюдается у пациентов с повышенным уровнем ренина и гипонатриемией [23, 24].
При лечении ИАПФ проводится мониторирование:
– клинического состояния, уровня АД во время титрования;
– функции почек: уровня креатинина и калия в сыворотке крови на протяжении 2 нед после начала терапии;
– нежелательных явлений (головокружение, симптомы гипотонии, кашель).
Побочные эффекты при приеме ИАПФ:
– кашель, связанный с блокадой разрушения брадикинина и некоторых других нейромедиаторов в слизистой оболочке бронхов;
– азотемия (при снижении скорости клубочковой фильтрации (СКФ) <30 мл/ч);
– гиперкалиемия за счет калийсберегающего эффекта;
– артериальная гипотензия вследствие вазодилатации и быстрого воздействия ИАПФ на циркулирующие нейрогормоны;
– ангионевротический отек, нейтропения и тромбоцитопения (редко).
Абсолютные противопоказания к назначению ИАПФ: двусторонний стеноз почечных артерий и ангионевротический отек.
Блокаторы рецепторов ангиотензина II [25]
Опубликованных данных по применению блокаторов рецепторов ангиотензина II у детей очень мало, и они в основном посвящены АГ в указанной популяции пациентов. Так, в одном клиническом исследовании [26] с участием детей с АГ изучены фармакокинетические свойства ирбесартана, в другом [27] представлена оценка эффективности применения лозартана при АГ в педиатрии. Однако данных, касающихся эффективности указанного класса препаратов при ХСН в педиатрической практике, опубликовано не было. Кроме того, блокаторы ангиотензиновых рецепторов в связи с очевидными преимуществами блокады РААС (табл. 5) можно рассматривать в качестве препаратов выбора у детей с систолической ДЛЖ и непереносимостью ИАПФ аналогично их применению у взрослых пациентов (класс рекомендаций IIa, уровень доказательств C) [22].
Бета-адреноблокаторы
Лекарственные средства, блокирующие β-адренергические рецепторы, в настоящее время рекомендуются в качестве обязательной терапии у взрослых больных с ХСН и систолической ДЛЖ при отсутствии непереносимости и противопоказаний. Это объясняется тем, что β-адреноблокаторы уменьшают патофизиологическое воздействие постоянной активации симпатико-адреналовой системы, снижают частоту сердечных сокращений (ЧСС) и улучшают диастолическое наполнение желудочков. Тем не менее эффективность данной терапии у детей, включая пациентов со структурно нормальным сердцем, до сих пор недостаточно изучена.
Если ИАПФ широко используются в клинической практике для лечения больных с ХСН, то вопрос применения β-адреноблокаторов в педиатрии остается дискуссионным, поскольку убедительные данные в пользу назначения β-адреноблокаторов отсутствуют. Имеются веские доказательства того, что указанные препараты снижают ЧСС и уровень АД, улучшают ФВ желудочков по данным эхокардиографии (ЭхоКГ). Однако отчетливой ассоциации применения β-адреноблокаторов с улучшением функционального статуса не отмечено [28].
Для лечения взрослых пациентов с ХСН рекомендуется использовать один из трех β-адреноблокаторов, доказавших свою эффективность в крупных рандомизированных исследованиях: бисопролол, метопролола сукцинат замедленного высвобождения (SR/XL), карведилол (класс рекомендаций I, уровень доказательств А). Кроме того, Европейское общество кардиологов (ESC) [33] и Ассоциация кардиологов Украины [34] рекомендуют для лечения больных с ХСН применять небиволол (класс рекомендаций I, уровень доказательств А). Следует подчеркнуть, что использование атенолола и метопролола тартрата для лечения пациентов с ХСН противопоказано (уровень доказательств А) [35, 36].
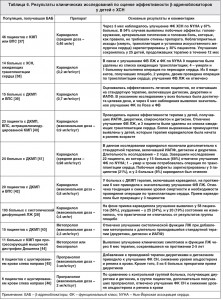
В педиатрической практике при СН, как правило, применяются пропранолол и карведилол – неселективный (β1-, β2-) антагонист β-адренорецепторов без внутренней симпатомиметической активности, но с дополнительным свойством β1-блокады, опосредующей периферическую вазодилатацию. Карведилол – наиболее изученный β-адреноблокатор, который используется у детей с СН и наличием сопутствующих заболеваний (табл. 6). Препарат снижает преднагрузку на сердце, тормозит нейрогормональную вазоконстрикторную активацию, обладает длительным гипотензивным и антиангинальным действием, замедляет пролиферацию гладкомышечных клеток, имеет антиоксидантные свойства, что обеспечивает его максимальный кардиопротекторныйэффект [34].
В 2009 г. был опубликован систематический обзор Кокрановского сотрудничества [47], в котором были представлены результаты 3 рандомизированных контролируемых клинических исследований (n=203), посвященных оценке эффективности терапии β-адреноблокаторами при СН в педиатрической практике. В 2 небольших исследованиях, включавших 20 и 22 пациента соответственно, установлено улучшение клинического статуса больных с ХСН. В то же время в крупном исследовании с участием 161 пациента не отмечено преимуществ карведилола по сравнению с плацебо по влиянию на композитную точку – клинические исходы СН (в 56% случаев наблюдалось улучшение и в группе плацебо, и в экспериментальной группе, р=0,74). Однако в исследуемых популяциях выявлены существенные различия в схемах лечения (выбор β-адреноблокатора, дозировки препаратов, длительность терапии), возрастном диапазоне участников и состоянии больных (этиология и степень тяжести СН; разнородность исследуемой популяции). Кроме того, методы и оценка исходов значительно отличались и не были стандартизованы, что делало невозможным проведение сравнения полученных результатов. Таким образом, в настоящее время накоплено недостаточно данных, позволяющих рекомендовать или отказаться от применения β-адреноблокаторов у детей с ХСН. Необходимы дальнейшие исследования, в которых будет более четко определена популяция, стандартизированы методики оценки терапии и установлены рекомендации в отношении применения указанного класса препаратов для лечения ХСН у детей. Кроме того, следует определить схему дозирования β-адреноблокаторов с учетом фармакокинетических характеристик последних.
Условия использования β-адреноблокаторов при ХСН [1]:
– на фоне применения постоянных доз ранее назначенной терапии (ИАПФ + диуретики, возможно, + дигоксин);
– при стабильном состоянии (без внутривенной инотропной поддержки, без признаков выраженных застойных явлений).
Принципы терапии β-адреноблокаторами
– Подобно рекомендациям по лечению ХСН у взрослых пациентов назначение β-адреноблокаторов целесообразно рассмотреть у детей с симптоматической систолической ДЛЖ (класс рекомендаций IIa, уровень доказательств B) [22].
– Терапию β-адреноблокаторами при ХСН следует начинать осторожно с низкой начальной дозы с последующим постепенным ее увеличением (табл. 7). Стартовая доза составляет 0,05 мг/кг каждые 12 ч; фармакокинетика данной группы препаратов у детей младше 4 лет позволяет вводить лекарственное средство каждые 8 ч [19].
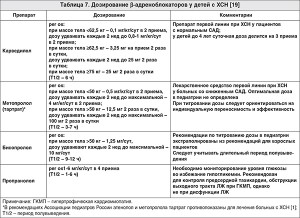
– У детей старшего возраста со стабильным гемодинамическим статусом начало лечения β-адреноблокатором можно рассмотреть вскоре после достижения целевой дозы ИАПФ [19].
– С особой осторожностью следует начинать терапию β-адреноблокатором после инотропной поддержки миокарда.
– Дозы увеличивают медленно (при условии хорошей переносимости лечения не чаще одного раза в две недели, а при сомнительной переносимости и чрезмерном снижении уровня АД – раз в месяц) до достижения оптимальной целевой.
– Как и при терапии ИАПФ, необходимо помнить, что у каждого больного – индивидуальная оптимальная дозировка β-адреноблокатора.
– Большинство больных, принимающих β-адреноблокаторы, могут начинать лечение и наблюдаться в амбулаторных условиях.
В начале терапии и в процессе титрования дозы могут развиться преходящие нарушения: артериальная гипотония, брадикардия и/или усугубление СН, которые требуют своевременного выявления и устранения. Поэтому целесообразно придерживаться следующей тактики:
– контроль за симптомами СН, признаками застоя жидкости, величиной диуреза, динамикой массы тела пациента, уровнем АД, ЧСС, ФВ ЛЖ по данным ЭхоКГ в первые 2 нед лечения;
– при нарастании симптомов СН в первую очередь следует повышать дозу диуретиков и/или временно снизить дозу β-адреноблокаторов. После стабилизации состояния терапия β-адреноблокатором возобновляется со стартовой дозы;
– при развитии артериальной гипотонии следует снизить дозу вазодилататоров; только при неэффективности указанной меры показано временное снижение дозы β-адреноблокатора (до стабилизации уровня АД); в зависимости от клинической ситуации рассмотреть вопрос включения в комплекс терапии стероидных гормонов;
– при возникновении брадикардии – снизить дозу или прекратить прием препаратов, снижающих ЧСС; при необходимости возможно временное уменьшение дозы β-адреноблокатора либо полная отмена в случае крайней необходимости;
– после достижения стабильного состояния следует возобновить лечение и/или продолжить титрование дозы β-адреноблокаторов до целевых терапевтических.
Если при декомпенсации СН больному необходима инотропная поддержка, то средством выбора считают сенситизаторы кальция (левосимендан), поскольку их гемодинамические эффекты не зависят от степени блокады β-адренорецепторов.
В случаях обострения ХСН на фоне длительного приема β-адреноблокаторов следует оптимизировать другую терапию (диуретики, ИАПФ, сердечные гликозиды), снизить дозу β-адреноблокаторов, избегая полной отмены данной группы препаратов – последняя может приводить к ухудшению течения ХСН, поэтому отменять β-адреноблокаторы нужно лишь при невозможности продолжить лечение в соответствии с вышеуказанными принципами [49]. После стабилизации состояния лечение β-адреноблокаторами должно быть возобновлено, начиная с меньших доз [50].
Предостережения
– Карведилол с осторожностью используют в комбинации с сердечными гликозидами (возможно чрезмерное замедление атриовентрикулярной (AB) проводимости).
– С осторожностью карведилол назначают пациентам с сахарным диабетом (СД), поскольку препарат может маскировать или ослаблять симптомы гипогликемии (особенно тахикардию). У больных с ХСН и СД применение указанного лекарственного средства может сопровождаться колебаниями гликемии.
Побочные эффекты
В рандомизированных двойных слепых плацебо-контролируемых исследованиях, проведенных у взрослых пациентов с ХСН, установлена в целом хорошая переносимость β-адреноблокаторов. Побочные эффекты при лечении β-адреноблокаторами были связаны с блокадой адренергических рецепторов и включали головокружение, брадикардию и артериальную гипотензию. Головокружение чаще возникало на начальном этапе терапии и в период коррекции доз и обычно исчезало спонтанно или после адаптации сопутствующего лечения.
Противопоказания к назначению β-адреноблокаторов при ХСН:
– острая и хроническая СН в стадии декомпенсации (IV ФК по NYHA), требующая применения инотропных средств;
– бронхиальная астма и тяжелая патология бронхов;
– клинически значимые нарушения функции печени;
– выраженная артериальная гипотензия;
– выраженная брадикардия (<50 уд/мин);
– нарушения проводимости: AВ-блокады II и III степени, синдром слабости синусового узла (при отсутствии постоянного кардиостимулятора);
– повышенная чувствительность к карведилолу или другим компонентам препарата.
Диуретики
Мочегонные средства считаются необходимым компонентом терапии у большинства больных с ХСН и признаками задержки жидкости в организме. Непосредственного влияния на функциональное состояние сердечной мышцы они не оказывают, однако способствуют улучшению работы ослабленного и патологически измененного миокарда в результате уменьшения объема циркулирующей крови. Благодаря двум основным эффектам диуретиков – способности увеличивать объем выделяемой мочи и экскрецию натрия – указанный класс препаратов на протяжении многих лет широко применяется как у детей, так и у взрослых пациентов с симптомами и признаками гипергидратации, что обусловлено быстрым и выраженным улучшением клинического состояния больных. Снижение пред- и постнагрузки, уменьшение количества внеклеточной жидкости приводят к улучшению функционального состояния внутренних органов, устранению периферических отеков. Под влиянием диуретиков существенно снижается давление в малом круге кровообращения, улучшается вентиляция легких, что ведет к уменьшению одышки и гипоксии, благоприятно сказывается на функции сердца и других органов, на состоянии обменных процессов в организме. В то же время влияние мочегонных средств на выживаемость и прогрессирование заболевания остается недостаточно изученным.
Следует отметить, что у большинства пациентов с СН при необходимости назначения мочегонных препаратов предпочтение отдается петлевым диуретикам как наиболее мощным агентам. Так, в ходе ретроспективного анализа [50] медикаментозной терапии при острой форме декомпенсированной СН на основании данных базы PHIS (The Pediatric Health Information System, США) за 2001-2010 гг., включавшей 1773 больных, установлено, что диуретики применялись в 90,1% случаев, из них в 98,4% случаев – фуросемид.
Наиболее важной проблемой при лечении диуретиками является влияние на уровень электролитов. Мочегонные препараты нарушают электролитный гомеостаз, существенно изменяя концентрацию калия, магния, натрия и кальция. Последствия большинства указанных изменений остаются дискуссионными.
В систематическом обзоре Кокрановского сотрудничества (2012) [51] была представлена оценка преимуществ и неблагоприятных эффектов диуретиков в лечении пациентов с ХСН. Авторы проанализировали результаты 14 двойных слепых РКИ (525 участников), в которых диуретики в виде монотерапии сравнивали либо с плацебо (7 исследований), либо с другими препаратами, применяемыми для лечения пациентов с ХСН, – ИАПФ, дигоксином (7 испытаний). Общую смертность оценивали на основании данных 3 из 7 плацебо-контролируемых исследований (n=202). Установлено, что указанный показатель среди больных, получавших диуретики, был значительно ниже по сравнению с группой плацебо (отношение шансов 0,3; 95% доверительный интервал 0,07-0,83; р=0,02). Продемонстрировано, что при назначении мочегонных средств 1 тыс. пациентов с ХСН можно предотвратить около 80 летальных исходов в течение периода наблюдения. В двух РКИ (n=169) отмечалось снижение частоты госпитализаций в связи с ухудшением течения СН у больных, принимавших диуретики (ОШ 0,07; 95% ДИ 0,01-0,52; p=0,01). Результаты четырех РКИ, в которых сравнивали мочегонные средства с другими препаратами для лечения ХСН (n=91), позволили установить, что диуретики на 28-33% повышали толерантность к физической нагрузке у пациентов с ХСН (взвешенная разница средних 0,72; 95% ДИ 0,40-1,04; р<0,0001). Данные нескольких небольших исследований продемонстрировали, что в сравнении с плацебо лечение традиционными диуретиками больных с ХСН способствует снижению риска смерти и уменьшению частоты госпитализаций в связи с ухудшением течения СН. По сравнению с другими препаратами для лечения пациентов с ХСН диуретики могут повышать толерантность к физической нагрузке, однако в связи с рядом ограничений (небольшой масштаб и продолжительность включенных в анализ исследований – 4-24 нед, средний возраст участников 59 лет и др.) необходимы дальнейшие исследования для подтверждения преимуществ диуретиков при ХСН.
Принципы терапии:
– диуретики следует назначать больным с признаками задержки жидкости, обусловленной желудочковой дисфункцией (стадия C СН), с целью достижения эуволемического состояния (класс рекомендаций I, уровень доказательств C);
– доза диуретика подбирается индивидуально с учетом возраста (табл. 8), стадии СН, выраженности отечного синдрома, эффекта от ранее применявшихся доз;
– терапию начинают с низкой эффективной дозировки, которая постепенно повышается до исчезновения симптомов. Впоследствии целесообразно отменять препарат тоже постепенно до наименьшей необходимой дозы диуретика;
– во время лечения необходимо контролировать уровень АД, электролитов (калий, натрий) в сыворотке крови и функцию почек;
– у пациентов с недостаточным ответом на петлевые диуретики можно рассмотреть вопрос о добавлении тиазидного диуретика.
Петлевые диуретики
Фуросемид – наиболее известный мощный петлевой диуретик, обладающий быстрым и выраженным мочегонным эффектом. Действие препарата начинается через 1 ч после приема и продолжается 4-6 ч; фуросемид назначается из расчета 2 мг/кг массы тела. Форма для внутривенного введения выпускается в ампулах по 2 мл 1% раствора, дозирование– 1 мг/кг массы, эффект наступает через 10-15 мин и длится 2-3 ч.
Следует отметить, что транспорт фуросемида к фармакологической мишени – клеткам восходящего (толстого) сегмента петли Генле – осуществляется в ассоциации с альбумином, сродство к которому у данного препарата очень велико. Именно поэтому при снижении концентрации альбумина в сыворотке крови, особенно выраженном при нефротическом синдроме и печеночно-клеточной недостаточности, эффективность фуросемида уменьшается, и с целью увеличения экскреции мочи требуется повышение дозы препарата. Так, у больных с наличием сопутствующей почечной недостаточности дозу фуросемида увеличивают до 5 мг/кг.
Этакриновая кислота по диуретическим свойствам незначительно отличается от фуросемида, хотя по химической структуре это единственный диуретик, молекула которого не содержит остатков сульфомоильной кислоты [52]. Данное средство обладает наибольшей ототоксичностью среди петлевых диуретиков, поэтому этакриновую кислоту следует назначать только при интерстициальном нефрите, вызванном вышеперечисленными препаратами, либо в случае аллергических реакций на сульфаниламиды [53]. При развитии рефрактерности к фуросемиду может быть обоснованным временный перевод пациента на прием этакриновой кислоты.
Почти все побочные эффекты петлевых диуретиков связаны с мочегонным действием, и прежде всего с водно-электролитными нарушениями. Бесконтрольное применение указанных препаратов может привести к потерям большого количества натрия, что чревато гипонатриемией и уменьшением объема внеклеточной жидкости. К клиническим проявлениям относят: артериальную гипотонию, снижение СКФ, тромбоэмболические осложнения, а при наличии сопутствующего поражения печени – печеночную энцефалопатию. Гипокалиемия и гипомагниемия могут осложняться развитием аритмий, особенно у больных, принимающих сердечные гликозиды. Возможно развитие гипокальциемии, однако последняя редко становится причиной судорог. Ототоксичность проявляется шумом в ушах, снижением слуха вплоть до глухоты, системным головокружением, чувством заложенности в ушах. Снижение слуха в большинстве случаев обратимо. Ототоксичность чаще возникает в результате быстрого внутривенного введения данного препарата, реже – приема внутрь [53]. К другим побочным эффектам относят сыпь, фотосенсибилизацию, парестезии, угнетение кроветворения, расстройства желудочно-кишечного тракта.
Петлевые диуретики противопоказаны при выраженном дефиците натрия, гиповолемии, аллергии к препаратам, содержащим сульфонамидную группу (относится только к содержащим указанную группу диуретикам), при анурии, рефрактерной к обычным дозам петлевых диуретиков.
Данные клинических исследований у взрослых пациентов с ХСН свидетельствуют о более благоприятном влиянии на клиническое течение и исходы ХСН петлевого диуретика торасемида в сравнении с фуросемидом, однако эффективность торасемида в детской популяции недостаточно изучена.
Тиазидные диуретики обладают менее выраженным эффектом, поскольку они действуют только в кортикальном сегменте петли Генле. Следует отметить, что указанные препараты неэффективны при лечении больных с почечной недостаточностью.
Гидрохлоротиазид
Начинают применение с дозы 1 мг/кг/сут, максимальная доза – 2,5 мг/кг/сут, поддерживающая доза – 12,5 мг/сут, однократно для детей школьного возраста. Эффект наступает через 1-2 ч и продолжается 6-12 ч.
Побочные явления: электролитный дисбаланс (гипокалиемия, гипонатриемия, гипокальциемия, гипомагниемия), уменьшение минутного объема кровообращения, метаболический алкалоз. Возможно развитие метаболических нарушений: гипергликемия, гиперурикемия; аллергических реакций. Для коррекции гипокалиемии назначается богатая калием диета и/или препараты, содержащие калий [1].
Антагонисты минералокортикоидных рецепторов (антагонисты альдостерона)
Доказано, что антагонисты альдостероновых рецепторов, назначенные дополнительно к стандартной терапии, у взрослых пациентов с ХСН III и IV ФК по NYHA (ишемического и неишемического генеза) и выраженной систолической ДЛЖ (ФВ ЛЖ ≤35%) повышают выживаемость и снижают частоту госпитализаций больных [54-56]. Данных о влиянии спиронолактона или других антагонистов альдостероновых рецепторов на исходы лечения детей с ХСН очень мало.
В клинической практике обычно применяется спиронолактон. Селективный антагонист минералокортикоидных рецепторов эплеренон в настоящее время не рекомендован для использования у детей, поскольку отсутствуют данные, подтверждающие эффективность и безопасность указанного препарата в детской популяции.
Спиронолактон – слабый диуретик, частично потому, что его эффекту противостоит компенсаторное увеличение концентрации альдостерона [57]. Часто применяются другие, более мощные калийсберегающие препараты. Однако эффекты спиронолактона за счет антагонизма альдостерона имеют значение по многим причинам. Данный препарат позволяет поддерживать концентрацию калия в сыворотке крови в нормальном диапазоне у пациентов с повышенной экскрецией указанного электролита. Как и другие калийсберегающие диуретики, спиронолактон часто используется в сочетании с другими мочегонными средствами для получения синергических эффектов. Большое значение имеют прямые кардиальные эффекты данного диуретика, которые, по-видимому, способствовали снижению уровня смертности в исследовании RALES (Randomized Aldactone Evaluation Study) [54].
Применение антагонистов минералокортикоидных рецепторов у детей:
– подобно рекомендациям по лечению ХСН у взрослых больных использование антагонистов минералокортикоидных рецепторов следует рассмотреть у детей с ДЛЖ (класс рекомендаций I, уровень доказательств C) [22];
– спиронолактон назначается пациентам дополнительно к стандартной терапии, включающей ИАПФ и β-адреноблокатор, если указанное лечение не приводит к улучшению желудочковой функции или реверсированию ремоделирования ЛЖ [19];
– использовать антагонисты минералокортикоидных рецепторов следует в низких дозах, при отсутствии гиперкалиемии и выраженной почечной дисфункции [1];
– начальная доза спиронолактона составляет 1 мг/кг/сут в 1-2 приема и целевая – максимум 2 мг/кг/сут, хорошо переносится большинством больных (табл. 9) [58]. Стартовая доза для подростков – 25 мг/сут; максимальная – 50 мг/сут однократно;
– у пациентов, получающих спиронолактон с ИАПФ, возможно развитие гиперкалиемии, особенно при скомпрометированной функции почек. Поэтому уровень калия в сыворотке крови и состояние функции почек необходимо оценить до начала терапии, через 7-14 дней после начала лечения и при последующей терапии. Особое внимание необходимо проявить, если пациенты получают препараты калия;
– гинекомастия у мальчиков – необратимый побочный эффект терапии спиронолактоном, в связи с чем необходимо проводить тщательный мониторинг.
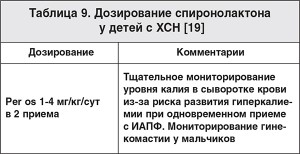
Принимать спиронолактон рекомендуется в утренние часы, во время максимального циркадного подъема уровня альдостерона.
Побочные эффекты
– гиперкалиемия – повышение уровня калия в крови >5,5 ммоль/л;
– ухудшение функции почек (повышение уровня креатинина в крови >220 мкмоль/л).
Хотя существует потенциальный риск развития тяжелой гиперкалиемии (уровень калия ≥6,0 мэкв/л) при использовании антагонистов минералокортикоидных рецепторов, особенно в сочетании с ИАПФ или антагонистом рецепторов к ангиотензину II, данный риск невысокий у пациентов с нормальной функцией почек. Так, в исследованиях RALES [54] и EPHESUS [59], в которые больные с уровнем креатинина в сыворотке крови >2,5 мг/дл или калия >5,0 ммоль/л не включались, не выявлено случаев смерти вследствие гиперкалиемии почти у 4 тыс. пациентов, принимавших антагонисты альдостерона. Отмечено небольшое, но статистически значимое увеличение уровня калия в сыворотке крови у больных, рандомизированных для приема спиронолактона, по сравнению с плацебо, однако уровень калия в сыворотке крови оставался в пределах нормального диапазона в обоих исследованиях. Анализ динамики концентрации уровня калия в сыворотке крови в исследовании RALES показал, что тяжелая гиперкалиемия (>6 ммоль/л) выявлена только у 10 (1%) из 841 пациентов, получавших плацебо, и у 14 (2%) из 822 больных, принимавших спиронолактон, с незначительным различием между группами [60]. Прекращение лечения потребовалось только у одного пациента, получавшего плацебо, и трех больных, принимавших спиронолактон [60].
Тот факт, что в указанных исследованиях не зарегистрировано случаев смерти вследствие гиперкалиемии, может быть частично объяснен тщательным контролем уровня калия в сыворотке крови и коррекцией дозы антагониста минералокортикоидных рецепторов согласно данному показателю. Однако в нескольких работах, посвященных применению антагонистов альдостерона, отмечена высокая частота серьезных побочных реакций, в основном гиперкалиемии и ухудшения функции почек, что, по-видимому, обусловлено более широким применением препаратов и недостаточным мониторированием биохимических показателей [61]. Поэтому очень важен грамотный подход при назначении указанных лекарственных средств. Необходимо учитывать, что пациенты с СД имеют более высокий риск развития гиперкалиемии и ухудшения функции почек. Важно также отметить, что в исследовании RALES практически все больные получали петлевые диуретики, лечение которыми продолжалось при добавлении спиронолактона. Фоновый прием диуретика защищает от гиперкалиемии, а снижение дозировки или отмена мочегонных средств могут ассоциироваться с задержкой жидкости и декомпенсацией СН, поскольку спиронолактон в рекомендованных низких дозах оказывает лишь незначительное диуретическое действие.
Таким образом, при длительной терапии антагонистами альдостерона необходим мониторинг клинических и лабораторных показателей с целью раннего выявления побочных эффектов.
Противопоказания к назначению антагонистов альдостерона [57]:
– уровень калия в плазме крови >5,0 ммоль/л;
– уровень креатинина в крови >220 мкмоль/л
(∼2,5 мг/дл);
– гипокалиемия вследствие приема диуретиков или гиперкалиемия на фоне применения препаратов калия;
– состояния, сопровождающиеся гиперкальциемией и гипонатриемией.
Лекарственные взаимодействия
Применение комбинации антагонистов альдостерона с ИАПФ и другими калийсберегающими диуретиками может привести к развитию гиперкалиемии.
Сочетание нестероидных противовоспалительных препаратов с калийсберегающими средствами обусловливает повышение риска развития гиперкалиемии у пациентов с нарушенной функцией почек.
Спиронолактон может увеличивать концентрацию дигоксина в сыворотке крови и повышать риск развития побочных эффектов вследствие применения данного препарата. Спиронолактон в сочетании с непрямыми антикоагулянтами (производными кумарина) снижает эффективность последних.
Сердечные гликозиды
Дигоксин является одним из старейших лекарств, применяемых для лечения СН. Несмотря на более чем 200-летнюю историю использования, роль дигоксина и других сердечных гликозидов при СН по-прежнему остается предметом дискуссий. Сторонники применения дигоксина утверждают, что мягкий положительный инотропный эффект при приеме данного средства внутрь помогает предупредить декомпенсацию ХСН и улучшить симптомы низкого сердечного индекса; оппоненты – что непрерывное положительное инотропное влияние дигоксина фактически ускоряет гибель клеток миокарда.
Эффекты сердечных гликозидов многогранны и суммированы в таблице 10.

В отношении эффективности сердечных гликозидов при ХСН необходимо отметить, что в клинических ситуациях препараты данного класса могут проявлять себя по-разному (в зависимости от характера основного ритма). Так, при мерцательной аритмии за счет замедления атриовентрикулярного проведения снижение ЧСС достигает высокой степени, что сопровождается уменьшением потребности миокарда в кислороде, несмотря на положительный инотропный эффект. При синусовом ритме отрицательный хронотропный эффект дигоксина слабый и, в итоге, повышение сократимости сопровождается увеличением потребности миокарда в кислороде, гипоксией миокарда и провоцированием аритмий, что особенно опасно у пациентов с ишемической этиологией ХСН. При тяжелой ХСН лечение вазодилататорами и адреностимуляторами может привести к повышению сердечного выброса и почечного кровотока, а значит, и к увеличению почечного клиренса дигоксина.
Наиболее назначаемым сердечным гликозидом является дигоксин благодаря фармакокинетическим характеристикам, альтернативным способам введения, а также распространенным методам измерения концентрации в сыворотке крови. Кроме того, дигоксин является единственным препаратом из класса сердечных гликозидов, который оценивался в плацебо-контролируемых клинических исследованиях у больных с ХСН. Основные результаты клинической эффективности дигоксина при СН получены в популяции взрослых пациентов с ХСН и признаками обострения заболевания [63].
В рандомизированном двойном слепом плацебо-контролируемом исследовании DIG (Digitalis Investigation Group trial) [64] установлено, что у больных с СН с систолической ДЛЖ и синусовым ритмом длительная терапия дигоксином (до 0,25 мг/сут) существенно не влияла на уровень смертности, однако приводила к достоверному снижению частоты госпитализаций, связанных с обострением ХСН. Ретроспективный анализ исследования DIG [65], включавший данные 3782 пациентов мужского пола с ФВ ЛЖ <45%, показал наличие прямой зависимости между концентрацией дигоксина в плазме крови и уровнем общей смертности. Установлено, что при использовании дигоксина у мужчин с ФВ ЛЖ <45% оптимальные значения концентрации дигоксина в плазме крови должны составлять 0,5-0,8 нг/мл.
W.B. Hood и соавт. [66] в 2014 г. опубликовали результаты систематического обзора РКИ, посвященных оценке эффективности и безопасности сердечных гликозидов у больных с ХСН с синусовым ритмом, различной степенью тяжести и продолжительностью заболевания. В анализ вошло 13 РКИ (n=7896), в которых сердечные гликозиды сравнивали с плацебо в лечении пациентов с ХСН. Уровень смертности на фоне терапии сердечными гликозидами оказался сопоставимым с таковым в контрольной группе, хотя лечение данными препаратами ассоциировалось с более низкой частотой госпитализаций и меньшим риском ухудшения течения заболевания. В крупномасштабном исследовании, в котором большинство участников принимали ИАПФ, отмечено существенное повышение уровня смертности от кардиальных причин на фоне применения сердечных гликозидов (возможно, вследствие аритмий). Тем не менее следует подчеркнуть, что результаты были получены в исследованиях, проведенных до начала широкого применения β-адреноблокаторов, антагонистов рецепторов ангиотензина II и антагонистов альдостерона для лечения СН. Таким образом, данные систематического обзора позволили заключить, что сердечные гликозиды полезны для лечения больных с ХСН и нормальным синусовым ритмом. Однако для установления оптимальных доз сердечных гликозидов и уточнения преимуществ данных препаратов для лечения пациентов с ХСН в эру β-адреноблокаторов и других препаратов, доказавших эффективность в лечении больных с ХСН, необходимы дальнейшие исследования.
Следует отметить, что рандомизированные контролируемые клинические исследования, посвященные применению дигоксина у детей с СН, не проводились, а в небольших исследованиях по оценке гемодинамических эффектов дигоксина у детей с СН с шунтированием крови слева направо получены противоречивые данные [67-69]. Несмотря на отсутствие доказательной базы, дигоксин по-прежнему широко используется в стандартной терапии у детей с СН [70].
Данных, подтверждающих пользу от применения дигоксина у детей со структурно-нормальным сердцем и систолической дисфункцией, нет, поэтому дигоксин не рекомендуется рутинно использовать у детей с СН [19].
Применение дигоксина и сердечных гликозидов у детей:
– дигоксин не рекомендуется при бессимптомной ДЛЖ у детей, поскольку влияния данного препарата на выживаемость у взрослых пациентов с ХСН и сниженной ФВ ЛЖ не выявлено (класс рекомендаций I, уровень доказательств C) [22];
– дигоксин может применяться для облегчения симптомов у детей с симптоматической ДЛЖ и сниженной ФВ ЛЖ (класс рекомендаций IIa, уровень доказательств C) [22].
Для лечения пациентов с СН на фоне ВПС назначается доза насыщения дигоксина (табл. 11) и далее – поддерживающая доза, при ДКМП– только поддерживающая доза (грудные дети – 10-12 мкг/кг; дети старше года – 8-10 мкг/кг) [1].

В настоящее время у больных с ХСН дигоксин применяется в низких дозах (при массе тела >55 кг – до 0,25 мг/сут, <55 кг – до 0,125 мг/сут). В указанных дозах препарат действует преимущественно как нейрогуморальный модулятор, оказывает слабое положительное инотропное действие и не выраженное проаритмическое влияние [71].
Дигоксин часто назначается одновременно с карведилолом у детей с тяжелой ХСН. Следует отметить наличие клинически значимого лекарственного взаимодействия указанных препаратов: карведилол повышает концентрацию дигоксина в сыворотке крови у детей. Поэтому если данные препараты сочетаются (например, с целью контроля аритмии), необходимо снизить дозу дигоксина для предупреждения гликозидной интоксикации [72].
Перед началом лечения дигоксином и в процессе терапии следует измерять уровень калия в плазме крови и оценивать состояние функции почек. При почечной недостаточности необходимо пропорционально снизить суточную дозу дигоксина.
Противопоказания к назначению дигоксина:
– AВ-блокада II и III степени (без постоянного кардиостимулятора); возможность возникновения синдрома слабости синусового узла;
– синдром Вольфа-Паркинсона-Уайта;
– непереносимость дигоксина.
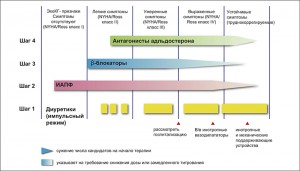
На рисунке представлена схема пошаговой медикаментозной терапии при ХСН у детей согласно рекомендациям Канадского кардиоваскулярного общества (2013).
Назначение β-блокаторов может рассматриваться у пациентов, принимающих ИАПФ, с бессимптомным стойким умеренным снижением ФВ ЛЖ (ФВ <40%), особенно если этиологическим фактором является ишемическая болезнь сердца. Градиент цвета на стрелках для каждого класса препаратов указывает на необходимость более низкой целевой дозы или более медленного, чем обычно, повышения вследствие тяжелой СН с выраженной систолической дисфункцией. Сужение стрелок указывает на то, что меньшее количество больных перенесет назначение данного препарата на указанной стадии. Следует обратить внимание на предпочтительное использование импульсного режима лечения диуретиками, который необходимо чаще применять по мере усиления симптомов. Красные стрелки указывают моменты времени, в которые может потребоваться госпитализация и назначение дополнительной поддерживающей терапии.
Заключение
Проведение медикаментозной терапии у детей с СН является сложной задачей в сравнении с популяцией взрослых пациентов ввиду целого ряда причин. С одной стороны, это обусловлено гетерогенностью этиологического фактора, особенностями течения СН у детей, а с другой – особенностями фармакокинетических и фармакодинамических характеристик лекарственных средств, что требует особого подхода к дозированию препаратов и мониторингу безопасности терапии. Кроме того, отсутствуют соответствующие РКИ, проведенные в педиатрической популяции, а имеющиеся клинические данные, как правило, получены на небольшой выборке. Поэтому решение о назначении терапии при СН у детей должно приниматься индивидуально для каждого пациента с оценкой пользы и возможных осложнений. Именно такой подход позволит оптимизировать фармакотерапию и повысить качество лечения пациентов с СН в педиатрической практике.
Литература
1. Федеральные клинические рекомендации по оказанию медицинской помощи детям с хронической сердечной недостаточностью / Министерство здравоохранения Российской Федерации, Союз педиатров России, ассоциация детских кардиологов России. – М., 2015. – 20 с.
2. Rheuban K.S., Carpenter M.A., Ayers C.A., Gutgesell H.P. Acute hemodynamic effects of converting enzyme inhibition in infants with congestive heart failure // J. Pediatr. – 1990. – Vol. 117. – P. 668-670.
3. Montigny M., Davignon A., Fouron J.C. et al. Captopril in infants for congestive heart failure secondary to a large ventricular left-to-right shunt // Am. J. Cardiol. – 1989. – Vol. 63. – P. 631-633.
4. Scammell A.M., Arnold R., Wilkinson J.L. Captopril in treatment of infant heart failure: a preliminary report // Int. J. Cardiol. – 1987. – Vol. 16. – P. 295-301.
5. Shaddy R.E., Teitel D.F., Brett C. Short-term hemodynamic effects of captopril in infants with congestive heart failure // Am. J. Dis. Child. – 1988. – Vol. 142. – P. 100-105.
6. Shaw N.J., Wilson N., Dickinson D.F. Captopril in heart failure secondary to a left to right shunt // Arch. Dis. Child. – 1988. – Vol. 63. – P. 360-363.
7. Sluysmans T., Styns-Cailteux M., Tremouroux-Wattiez M. et al. Intravenous enalaprilat and oral enalapril in congestive heart failure secondary to ventricular septal defect in infancy // Am. J. Cardiol. – 1992. – Vol. 70. – P. 959-962.
8. Lewis A.B., Chabot M. The effect of treatment with angiotensin-converting enzyme inhibitors on survival of pediatric patients with dilated cardiomyopathy // Pediatr. Cardiol. – 1993. – Vol. 14. – P. 9-12.
9. Stern H., Weil J., Genz T. et al. Captopril in children with dilated cardiomyopathy: acute and long-term effects in a prospective study of hemodynamic and hormonal effects // Pediatr. Cardiol. – 1990. – Vol. 11. – P. 22-28.
10. Kantor P.F., Abraham J.R., Dipchand A.I. et al. The impact of changing medical therapy on transplantation-free survival in pediatric dilated cardiomyopathy // J. Am. Coll. Cardiol. – 2010. – Vol. 55. – P. 1377-1384.
11. Burch M., Siddiqi S.A., Celermajer D.S. et al. Dilated cardiomyopathy in children: determinants of outcome // Br. Heart J. – 1994. – Vol. 72. – P. 246-250.
12. Cardiac Failure in Children / Sean Beggs, Angus Thompson , Rose Nash, Anna Tompson, Gregory Peterson: 17th Expert Committee on the Selection and Use of Essential Medicines. – Geneva, 2009. – 31 р.
13. Lewis A.B., Chabot M. The effect of treatment with angiotensin-converting enzyme inhibitors on survival of pediatric patients with dilated cardiomyopathy // Pediatr. Cardiol. – 1993. – Jan. – Vol. 14(1). – Р. 9-12.
14. Lipshultz S.E., Lipsitz S.R., Sallan S.E., Simbre V.C., 2nd, Shaikh S.L., Mone S.M. et al. Long-term enalapril therapy for left ventricular dysfunction in doxorubicin-treated survivors of childhood cancer // J. Clin. Oncol. – 2002, Dec 1. – Vol. 20 (23). – P. 4517-4522.
15. Leversha A.M., Wilson N.J., Clarkson P.M., Calder A.L., Ramage M.C., Neutze J.M. Efficacy and dosage of enalapril in congenital and acquired heart disease // Arch. Dis. Child. – 1994. – Vol. 70(1). – P. 35-39.
16. Eronen M., Pesonen E., Wallgren E.I., Tikkanen I., Fyhrquist F., Andersson S. Enalapril in children with congestive heart failure // Acta Paediatr. Scand. – 1991, May. – Vol. 80(5). – P. 555-558.
17. Hazama K., Nakazawa M., Momma K. Effective dose and cardiovascular effects of cilazapril in children with heart failure // Am. J. Cardiol. 2001 Oct 1; 88(7): 801-5.
18. Momma K. ACE inhibitors in pediatric patients with heart failure // Paediatr. Drugs. – 2006. – Vol. 8. – P. 55-69.
19. Kantor P.F., Lougheed J., Dancea A. et al. Presentation, Diagnosis, and Medical Management of Heart Failure in Children: Canadian Cardiovascular Society Guidelines // Canadian J. Cardiol. – 2013. – Vol. 29, Issue 12. – P. 1535-1552.
20. Duboc D., Meune C., Pierre B. et al. Perindopril preventive treatment on mortality in Duchenne muscular dystrophy: 10 years' follow-up // Am Heart J. – 2007. – Vol. 154. – P. 596-602.
21. Silber J.H., Cnaan A., Clark B.J. et al. Enalapril to prevent cardiac function decline in long-term survivors of pediatric cancer exposed to anthracyclines // J. Clin. Oncol. – 2004. – Vol. 22. – P. 820-828.
22. Kirk R., Dipchand A.I., Rosenthal D.N. et al. The International Society for Heart and Lung Transplantation Guidelines for the management of pediatric heart failure: Executive summary // J. Heart and Lung Transplantation. – 2014. – Vol. 33, Issue 9. – P. 888-909.
23. Scammell A.M. and Arnold R. The effect of the first dose of captopril on blood pressure in infants in heart failure // Int. J. Cardiol. – 1989. – Vol. 22. – P. 377-379.
24. Robinson B., Heise C.T., Moore J.W., Anella J., Sokoloski M. and Eshaghpour E. Afterload reduction therapy in patients following intraatrial baffle operation for transposition of the great arteries // Pediatr. Cardiol. – 2002. – Vol. 23. – P. 618-623.
25. Pitt B., White H., Nicolau J. et al. Eplerenone reduces mortality 30 days after randomization following acute myocardial infarction in patients with left ventricular systolic dysfunction and heart failure // J. Am. Coll. Cardiol. – 2005. – Vol. 46. – P. 425-431.
26. Sakarcan A., Tenney F., Wilson J.T., Stewart J.J., Adcock K.G., Wells T.G. et al. The pharmacokinetics of irbesartan in hypertensive children and adolescents // J. Clin. Pharmacol. 2001, Jul. – Vol. 41(7). – P. 742-749.
27. Shahinfar S., Cano F., Soffer B.A., Ahmed T., Santoro E.P., Zhang Z. et al. A double-blind, dose-response study of losartan in hypertensive children // Am. J. Hypertens. – 2005, Feb. – Vol. 18(2 Pt 1). – P. 183-190.
28. Shaddy R.E., Boucek M.M., Hsu D.T., Boucek R.J., Canter C.E. et al. Carvedilol for children and adolescents with heart failure: a randomized controlled trial // JAMA. – 2007. – Vol. 298. – P. 1171-1179.
29. Swedberg K., Cleland J., Dargie H. et al. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005) // Eur. Heart J. – 2005. – Vol. 26. – P. 1115-1140.
30. Hunt S.A, Abraham W.T., Casey D.E.Jr. et al. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure) // J. Am. Coll. Cardiol. – 2005. – Vol. 46. – P. e1-e82.
31. Jessup M., Abraham W.T., Casey D.E. et al. 2009 Focused Update: ACCF/ AHA Guidelines for the Diagnosis and Management of Heart Failure in Adults: A Report of the American College of Cardiology Foundation / American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation // J. Am. Coll. Cardiol. – 2009. – Vol. 53(15). – P. 1343-1382.
32. Dickstein K., Cohen-Solal A., Filippatos G. et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008 // Eur. Heart J. – 2008. – Vol. 29. – P. 2388-2442.
33. Task Force Members, Dickstein K., Cohen-Solal A., Filippatos G. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM) // Eur. Heart J. – 2008. – Vol. 29(19). – P. 2388-2442.
34. Воронков Л.Г., Амосова К.М., Багрій А.Е. та ін. Рекомендації Асоціації кардіологів України з діагностики, лікування та профілактики хронічної серцевої недостатності у дорослих. – Київ, 2009. – С. 4-22.
35. Воронков Л.Г. Хроническая сердечная недостаточность и хроническое обструктивное заболевание легких // Серцева недостатність. – 2010. – № 1. – С. 12-19.
36. Амосова К.М. Практикум з внутрішньої медицини. – К.: Український медичний вісник, 2010. – 416 с.
37. Bruns L.A., Chrisant M.K., Lamour J.M., Shaddy R.E., Pahl E., Blume E.D. et al. Carvedilol as therapy in pediatric heart failure: an initial multicenter experience // J. Pediatr. – 2001, Apr. – Vol. 138(4). – P. 505-511.
38. Azeka E., Franchini Ramires J.A., Valler C., Alcides Bocchi E. Delisting of infants and children from the heart transplantation waiting list after carvedilol treatment // J. Am. Coll. Cardiol. – 2002, Dec 4. – Vol. 40(11). – P. 2034-2038.
39. Laer S., Mir T.S., Behn F., Eiselt M., Scholz H., Venzke A. et al. Carvedilol therapy in pediatric patients with congestive heart failure: a study investigating clinical and pharmacokinetic parameters // Am. Heart J. – 2002, May. – Vol. 143 (5). – P. 916-922.
40. Lee K.J. M.B., Dipchand A.I., Russell J.L., Benson L.N. Carvedilol in Heart Failure Management: A Paediatric Experience // Canadian Journal of Cardiology. – 2001. – Vol. 17 (Suppl.C). – P. 100C.
41. Rusconi P., Gomez-Marin O., Rossique-Gonzalez M., Redha E., Marin J.R., Lon Young M. et al. Carvedilol in children with cardiomyopathy: 3 year experience at a single institution // J. Heart Lung Transplant. – 2004, Jul. – Vol. 23 (7). – P. 832-838.
42. Blume E.D., Canter C.E., Spicer R., Gauvreau K., Colan S., Jenkins K.J. Prospective single arm protocol of carvedilol in children with ventricular dysfunction // Pediatr. Cardiol. – 2006, May-Jun. – Vol. 27(3). – P. 336-342.
43. Shaddy R.E., Tani L.Y., Gidding S.S., Pahl E., Orsmond G.S., Gilbert E.M. et al. Beta-blocker treatment of dilated cardiomyopathy with congestive heart failure in children: a multi-institutional experience // J. Heart Lung Transplant. – 1999, Mar. – Vol. 18(3) – P. 269-274.
44. Ishikawa Y., Bach J.R., Minami R. Cardioprotection for Duchennes muscular dystrophy // Am. Heart J. – 1999, May. – Vol. 137(5). – P. 895-902.
45. Buchhorn R., Bartmus D., Siekmeyer W., Hulpke Wette M., Schulz R., Bursch J. Beta-blocker therapy of severe congestive heart failure in infants with left to right shunts. Am J Cardiol. 1998 Jun 1; 81(11): 1366-8.
46. Buchhorn R., Hulpke Wette M., Hilgers R., Bartmus D., Wessel A., Bursch J. Propranolol treatment of congestive heart failure in infants with congenital heart disease: The CHF-PRO-INFANT Trial. Congestive heart failure in infants treated with propanol. Int J Cardiol. 2001 Jul; 79(2-3): 167-73.
47. Frobel A.K., Hulpke-Wette M., Schmidt K.G., L?er S. Beta-blockers for congestive heart failure in children // Cochrane Database Syst. Rev. – 2009. – Jan 21; (1): CD007037. doi: 10.1002/14651858.CD007037.pub2.
48. Waagsrein F., Caidahl K., Wallentin I. et al. Long-term beta blockade in dilated cardiomyopathy: effects of short- and long-term metoprolol treatment followed by withdrawal and readministration of metoprolol // Circulation. – 1989. – Vol. 80(3). – P. 551-563.
49. Gattis W.A., O'Connor C.M., Leimberger J.D. et al. Clinical outcomes in patients on beta-blocker therapy admitted with worsening chronic // Am. J. Cardiol. -2003. – Vol. 91(2). – P. 169-174.
50. Moffett B.S. National Prescribing Trends for Heart Failure Medications in Children // Congenital Heart Disease. – 2015. – Vol. 10. – P. 78-85.
51. Faris R.F., Flather M., Purcell H., Poole-Wilson P.S., Coats A.J. Diuretics for heart failure. Cochrane Database of Systematic Reviews. – 2012 Feb 15; 2: CD003838.
52. Воронков Л.Г. Хроническая сердечная недостаточность. – К.: Морион, 2002. – 136 с.
53. Клінічна фармакологія: підручник / колектив авторів: за ред. О.Я. Бабака, О.М. Біловола, І.С. Чекмана. – К.: Медицина, 2008. – 768 с.
54. Effectiveness of spironolactone added to an angiotensin-converting enzyme inhibitor and a loop diuretic for severe chronic congestive heart failure (the Randomized Aldactone Evaluation Study [RALES]) // Am. J. Cardiol. – 1996. – Vol. 78. – P. 902-907.
55. Pitt B., Zannad F., Remme W.J. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators // N. Engl. J. Med. – 1999. – Vol. 341. – P. 709-717.
56. Pitt B., White H., Nicolau J. et al. Eplerenone reduces mortality 30 days after randomization following acute myocardial infarction in patients with left ventricular systolic dysfunction and heart failure // J. Am. Coll. Cardiol. – 2005. – Vol. 46. – P. 425-431.
57. Клиническая фармакология по Гудману и Гилману / Под общей редакцией А.Г. Гилмана, редакторы Дж. Хардман и Л. Лимберд. Пер. с англ. – М.: Практика. – 2006. – 1648 с.
58. Buck M.L. Clinical experience with spironolactone in pediatrics / Ann. Pharmacother. – 2005. – Vol. 39. – P. 823-828.
59. Pitt B., Remme W., Zannad F. et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction // N. Engl. J. Med. – 2003. – Vol. 348. – P. 1309-1321.
60. Vizzardi E., Regazzoni V., Caretta G. et al. Mineralocorticoid receptor antagonist in heart failure: Past, present and future perspectives // IJC Heart & Vessels. – 2014. – Vol. 3. – P. 6-14.
61. McMurray J.V., Adamopuolos S., Anker S.D. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012 // Eur. Heart J. – 2012. – V. 33. – P. 1787-1847.
62. Eichhorn E.J., Gheorghiade M. Digoxin // Prog. in Card. Dis. – 2002. – Vol. 44. – P. 251-256.
63. Gheorghiade M., St Clair J., St Clair C., Beller G.A. Hemodynamic effects of intravenous digoxin in patients with severe heart failure initially treated with diuretics and vasodilators // J. Am. Coll. Cardiol. – 1987. – Vol. 9. – P. 849-857.
64. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure // N. Engl. J. Med. – 1997. – Vol. 336. – P. 525-533.
65. Rathore S.S., Curtis J.P., Wang Y. et al. Association of serum digoxin concentration and outcomes in patients with heart failure // JAMA. – 2003. – Vol. 289 (7). – P. 871-978.
66. Hood W.B. Jr, Dans A.L., Guyatt G.H. et al. Digitalis for treatment of heart failure in patients in sinus rhythm // Cochrane Database Syst Rev. 2014 Apr 28;4: CD002901. 67.
67. Kimball T.R., Daniels S.R., Meyer R.A., Hannon D.W., Tian J., Shukla R. et al. Effect of digoxin on contractility and symptoms in infants with a large ventricular septal defect // Am. J. Cardiol. – 1991. – Vol. 68. – P. 1377-1382.
68. Seguchi M., Nakazawa M., Momma K. Further evidence suggesting a limited role of digitalis in infants with circulatory congestion secondary to large ventricular septal defect // Am. J. Cardiol. – 1999. – Vol. 83. – P. 1408-1411, A8.
69. Beggs S., Thompson A., Nash R. et al. 17th Expert Committee on the Selection and Use of Essential Medicines Geneva, March 2009 Cardiac Failure in Children.
70. Малая Л.Т. Хроническая сердечная недостаточность / Л.Т. Малая, Ю.Г. Горб. – Х.: Торсинг, 2002. – 768 с.
71. Ratnapalan S., Griffiths K., Costei A.M., Benson L., Koren G. Digoxin-carvedilol interactions in children // J. Pediatr. – 2003. – Vol. 142(5). – P. 572-574.