17 лютого, 2016
Печінкова дисфункція у хворих із серцевою недостатністю

Печінка – багатофункціональний орган, робота якого впливає на забезпечення процесів життєдіяльності. Система печінкового кровообігу є унікальним засобом компенсації різних порушень гемодинаміки (у тому числі серцевої недостатності – СН) завдяки подвійному кровопостачанню з портальної вени та печінкової артерії. Печінка має найскладнішу систему кровопостачання серед усіх органів. 75-85% крові, що надходить у печінку, становить венозна кров із ворітної вени, яка акумулює венозну кров із селезінки, шлунка, тонкого та товстого кишечнику, жовчного міхура і підшлункової залози; лише 25% – оксигенована кров із печінкової артерії. Печінковий кровоплин становить 800-1200 мл/хв, що дорівнює 100 мл/хв на 100 г маси печінки. І хоча частка останньої – лише 2,5% від загальної маси тіла, печінка отримує 25% крові від об’єму серцевого викиду. Особливості автономної регуляції печінкового кровообігу забезпечують стабільність об’єму циркулюючої крові. У 1981 р. цей унікальний механізм був названий W.W. Lautt печінковою артеріальною буферною відповіддю (HABR) [1]: при зниженні тиску в печінковій артерії спостерігається її дилатація і навпаки – печінкова артерія звужується при зростанні в ній тиску. Згідно із запропонованою W.R. Ezzat, W.W. Lautt у 1987 році метаболічною теорією [2] описаний процес опосередковується через аденозин, який вимивається зі стінок печінкових судин. У разі зменшення кровоплину в системі портальної вени менше аденозину вимивається із судинних стінок, останній накопичується у них і впливає на вазодилатацію [1, 3]. Фізіологічна значущість HABR полягає у запобіганні впливу змін у системі ворітних судин на функцію печінки (кліренс) та попередженні кисневої недостатності (менш важливо, оскільки печінка отримує значно більше кисню, ніж потребує). Крім того, існує думка, що ступінь гіпоксемії завдяки компенсаторним можливостям печінки також не корелює зі ступенем її ураження. Отже, короткочасне, навіть значне погіршення гемодинаміки не має пошкоджувального ефекту на печінку [1]. Щодо оксиду азоту, то його вплив на печінковий кровоплин не доведений, хоча він є важливим регулятором тонусу судин [1]. За даними одного з досліджень, ознаки ішемічного гепатиту спостерігались у пацієнтів при зниженні систолічного артеріального тиску (САТ) до рівня ≤75 мм рт. ст. протягом щонайменше 15 хв [4].
Патогенез ураження печінки при СН
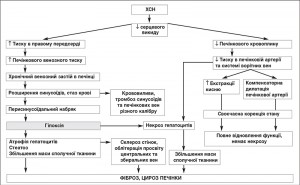
При хронічній СН (ХСН) основним чинником ураження печінки є пасивний венозний застій, який спричиняє хронічне венозне повнокров’я печінки, призводить до зниження швидкості хвилинного кровоплину та механічного блоку відтоку крові з центральних вен печінкових дольок. А це зумовлює жирову інфільтрацію печінки, перипортальний фіброз і перивентрикулярний склероз, який поширюється углиб печінкової дольки та порушує архітектоніку органа [3, 5, 6].
У разі прогресування СН розвивається кардіальний цироз печінки. Венозний застій є водночас і компенсаторним механізмом, який сприяє розвантаженню великого кола кровообігу та полегшенню роботи правого шлуночка серця (ПШ). Печінка є резервуаром для депонування крові. У хворих з ХСН маса крові, що депонується в печінці, вдвічі більша, ніж у здорових осіб. Під час морфологічного аналізу зразків застійної печінки виявлено розширення і повнокров’я сублобулярних вен, центральних вен і прилеглих синусоїдів, розширення просторів Діссе, атрофію гепатоцитів, центролобулярні некрози, часто з розвитком жирової дистрофії [3, 5-8].
Ішемія призводить до гострого центролобулярного некрозу печінки. Цей патологічний процес був вперше описаний у 1833 р. на основі дослідження гістологічного матеріалу печінки, отриманого від пацієнтів із СН [9]. У 1951 р. Sherlock описав клінічні та лабораторні зміни при цьому стані [10], а в 1979 р. Bynum і співавт. запропонували термін «ішемічний гепатит», враховуючи схожість клінічних проявів з вірусним гепатитом [11]. Згодом J. Henrion і співавт. запропонували замінити термін «ішемічний гепатит» на «гіпоксичний гепатит». Отже, вчені зробили акцент на тому, що завдяки унікальним компенсаторним можливостям лише сукупність пошкоджувальних факторів (венозний застій, ішемія внаслідок зниження печінкового кровоплину й артеріальна гіпоксемія) може спричинити некроз гепатоцитів [12] (рис. 1).
Клініка застійної гепатопатії
Клінічно виділяють застійну гепатопатію, ішемічний гепатит, кардіальний фіброз і цироз печінки як етапи одного патологічного процесу. Хворі із застійною печінкою часто не висловлюють скарг, які б свідчили про порушення функції печінки. Рідко пацієнти скаржаться на тупий, малоінтенсивний, ниючий біль у правому підребер’ї внаслідок розтягування капсули печінки (більш характерний для гострого застою). Специфічними проявами є гепатомегалія і периферичні набряки, спричинені правошлуночковою недостатністю, симптом Плеша, або гепатоюгулярний рефлюкс (при натисненні на ділянку проекції печінки посилюється набухання шийних вен). Спленомегалія, як правило, відсутня. Асцит виникає вже на пізніх стадіях захворювання, у середньому у чверті хворих із ХСН. При вираженій трикуспідальній недостатності може спостерігатись систолічна пульсація печінки. Жовтяниця зустрічається рідко. Якщо ХСН розвивається на фоні стенозу тристулкового клапана, констриктивного перикардиту, рестриктивної кардіоміопатії, а також при легеневій гіпертензії, може виявлятись пресистолічна пульсація печінки. Портальна гіпертензія на початкових стадіях розвитку патологічного процесу відсутня, оскільки портальні тракти не залучені у фіброзний процес. Зазначений стан характеризується відсутністю градієнта заклинювання в печінкових і портальних венах, однаковим тиском у портальній та двох порожнистих венах, тому не розвивається портокавальна колатеральна циркуляція – немає варикозного розширення вен стравоходу, телеангіектазій, пальмарної еритеми, які властиві цирозам іншого походження. Тому кровотечі з вен стравоходу виникають рідко. Типовою відмінністю є зменшення розмірів печінки після проведеного лікування. Асцит є проявом тяжкої декомпенсації серцевої діяльності та виявляється при значному підвищенні центрального венозного тиску (ЦВТ), що є наслідком вираженого зменшення серцевого викиду. У пацієнтів із ХСН поява асциту часто супроводжується підвищенням рівня лактатдегідрогенази (ЛДГ), на відміну від асциту вірусної або алкогольної етіології. Характерним для застійної печінки є асимптомний перебіг, тому більш цінними є не клінічні прояви, а лабораторні показники дисфункції печінки [3, 5-8, 12].
При гострій серцевій недостатності (ГСН) внаслідок гострої гіпоперфузії може розвиватися гостра застійна «шокова» печінка, яка характеризується центральним печінковим некрозом. Гострий венозний застій призводить до швидкого збільшення розмірів печінки та значного розтягнення глісонової капсули, що клінічно проявляється різким болем у правому підребер’ї, напруженням м’язів черевної стінки, печінковою енцефалопатією, значним підвищенням рівнів аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ). Цей стан необхідно диференціювати з блискавичним гепатитом, а при появі жовтяниці – з гострими хірургічними захворюваннями [3, 5, 7].
Лабораторні відхилення
Для оцінки глибини ураження печінки у к лінічній практиці використовують визначення білкового спектра (альбумін, загальний білок) та показників згортання крові. Печінка – основний орган синтезу більшості факторів згортання крові як зовнішнього, так і внутрішнього шляхів коагуляції (ІІ, V, VII, IX, X, XI, XII, фібриноген та фібрин-стабілізуючий фактор XIII). Період напіврозпаду цих білків короткий, тому гострий некроз гепатоцитів (наприклад, при кардіогенному шоці) може призвести до розвитку гострої коагулопатії, при цьому можна досягти швидкої регресії останньої при своєчасній стабілізації стану та корекції порушень функцій печінки. Виражене зниження протромбінової активності спостерігається при некрозі печінки та вторинному внутрішньопечінковому холестазі [8]. Існують дані, які доводять вплив на активність синтетичної функції печінки (за рівнями альбуміну, протромбіну й білірубіну) порушень ендотеліальної функції та активації імунозапальних процесів, про що свідчить зростання рівнів фактора некрозу пухлин (ФНПα), інтерлейкіну-4 (ІЛ-4) й ендотеліну-1 (ЕТ-1), а також порушення функцій антиоксидантної системи [13]. За даними різних авторів, активація ренін-ангіотензин-альдостеронової системи (РААС) також має негативний вплив на синтетичну функцію печінки [3, 13, 14].
Застійна гепатопатія характеризується часто нормальним рівнем печінкових показників, незначним (у 2-3 рази) підвищенням рівня АЛТ й АСТ; зростання рівня γ-глутамілтрансферази (ГГТ) виявляється у 30% хворих із ХСН, помірне зниження рівня альбуміну (>25 г/л) – у 30-50%, підвищення рівня загального білірубіну– у 70%, подовження протромбінового часу – у 80% [3, 5, 7].
Гострому ішемічному ураженню печінки притаманне значне підвищення рівнів АЛТ, АСТ, ЛДГ (у 10-20 та більше разів) і подовження протромбінового часу, які досягають своїх максимальних значень через 1-3 доби після епізоду гіпотензії; гіпербілірубінемія зустрічається значно рідше. Після стабілізації стану рівень ферментів нормалізується протягом 7-14 діб [3, 5, 7]. Від інших форм гострого гепатиту ішемічне ураження печінки відрізняється співвідношенням АЛТ/ЛДГ, яке становить <1,5 [7].
Прогностичне значення лабораторних показників дисфункції печінки
V.M. van Deursen і співавт. проаналізували дані пацієнтів із ХСН, яким проводилася терапія з 1989 по 2006 р. на базі Університетської клініки м. Гронінген (Нідерланди). У дослідженні взяли участь 323 особи, яким вимірювали ЦВТ методом катетеризації ПШ. Дослідники вивчали взаємозв’язок між змінами показників функції печінки та гемодинамічними показниками – ЦВТ і серцевим індексом (СІ). Виявлено кореляцію між рівнями ЦВТ і СІ та рівнями загального білірубіну, АЛТ й АСТ. Підвищення рівнів АСТ й АЛТ асоціювалося зі зниженням СІ, зміни рівня білірубіну – як зі зниженим СІ, так і з підвищеним ЦВТ. Щодо прогнозу, то було зроблено висновок, що рівні ГГТ, лужної фосфатази (ЛФ), АСТ та ЛДГ є предикторами смерті внаслідок усіх причин [15].
V.M. van Deursen і співавт. у 2014 р. опублікували результати аналізу взаємозв’язку порушень функцій печінки та ГСН на основі даних мультицентрового рандомізованого дослідження Pre-RELAX-AHF (Relaxin for the Treatment of Patients With Acute Heart Failure), до якого були залучені 234 хворих із 8 країн, госпіталізовані з приводу ГСН. Комбінована кінцева точка – смерть і повторна госпіталізація пацієнтів з приводу декомпенсації СН протягом 60 діб після виписки та смерть протягом 180 діб. Середній вік хворих – 70 років, 56% становили чоловіки. Більшість пацієнтів – з ІІІ-ІV функціональним класом (ФК) СН за NYHA (Нью-Йоркська асоціація серця), з них у 70% встановлено діагноз «ішемічна хвороба серця». Протягом 180 діб 28 пацієнтів померли або були повторно госпіталізовані протягом 60 діб, у 36 виявлено погіршення стану впродовж 5 діб після першої госпіталізації. У 20% хворих із ГСН зареєстровано зміни рівнів АСТ, загального білірубіну й альбуміну, у 10% – АЛТ, ЛФ та загального білка. Результати аналізу показали, що підвищення рівнів АЛТ й АСТ і зниження рівня альбуміну були асоційовані зі смертністю протягом 180 діб. Для комбінованої кінцевої точки прогностичне значення мали підвищення рівнів АЛТ, АСТ, ЛФ і зниження рівнів альбуміну та загального білка. Декомпенсація клінічного стану асоціювалася з підвищенням рівнів АЛТ, АСТ і зниженням рівня загального білка. Результати були підтверджені, коли пацієнтів розподілили на групи залежно від рівня печінкових показників. Найвищі рівні АЛТ й АСТ і найнижчі концентрації альбуміну були асоційовані з вищим рівнем смертності впродовж 180 діб. Для комбінованої точки аналогічна залежність була виявлена для рівнів АЛТ, АСТ, альбуміну та загального білка. Зниження рівня альбуміну асоціювалося з рівнем смертності внаслідок усіх причин [16] (рис. 2).
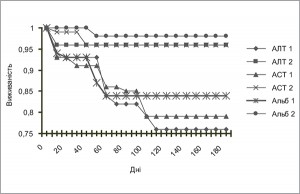 Рис. 2. Залежність виживаності пацієнтів з ХСН протягом 180 діб спостереження від рівня АЛТ, АСТ та альбуміну. Високі рівні АЛТ та АСТ (АЛТ 1, АСТ 1) та низькі рівні альбуміну (Альб 1) асоціювались із вищим ризиком смертності протягом 180 діб [16].
Рис. 2. Залежність виживаності пацієнтів з ХСН протягом 180 діб спостереження від рівня АЛТ, АСТ та альбуміну. Високі рівні АЛТ та АСТ (АЛТ 1, АСТ 1) та низькі рівні альбуміну (Альб 1) асоціювались із вищим ризиком смертності протягом 180 діб [16].У 2014 р. були оприлюднені результати аналізу хворих з ГСН і дисфункцією печінки, які брали участь у мультицентровому дослідженні ESCAPE (Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness), проведеному в Національному інституті серця, легень та крові (Флорида, США). Було проаналізовано дані 346 пацієнтів з ГСН ІV ФК за NYHA та з фракцією викиду (ФВ) ≤30%. Функціональні печінкові тести проводили під час госпіталізації, перед випискою зі стаціонару, через 2 тижні, 1, 2, 3 та 6 міс після виписки. Також для оцінки стану печінки використовували Модель термінального захворювання печінки без урахування міжнародного нормалізованого відношення (MELD-XI), яка зазвичай застосовується для оцінки стану хворих перед трансплантацією печінки та базується на показниках функції печінки і нирок, зокрема рівнів загального білірубіну та креатиніну. У пацієнтів з більшими значеннями за цією шкалою (≥11,4) встановлено вищі рівні загального, прямого білірубіну та креатиніну. Крім того, більшість хворих – чоловіки старшого віку із встановленим діагнозом «ішемічна кардіоміопатія». У 90% пацієнтів виявлено підвищення більш як одного показника функції печінки. У хворих із підвищеними рівнями загального білірубіну й АСТ реєстрували значно нижчі рівні СІ та вищі рівні ЦВТ. Залежність гемодинамічних змін від рівня альбуміну не була виявлена. Із 346 пацієнтів 55,8% (193) померли, були повторно госпіталізовані або їм проводилась операція із трансплантації серця протягом 6 міс спостереження. 18% хворих з MELD-XI ≥16,8 мали значно гірший прогноз порівняно з пацієнтами, показник яких становив <16,8. Прогностичне значення зберігалося навіть у тому разі, якщо вищезазначені показники поверталися до нормальних цифр. 6-місячна виживаність вдвічі краща у хворих з показником за шкалою MELD-XI <16,8-46,2% на противагу 23,5% відповідно. Було проаналізовано наявність залежності рівня досягнення комбінованої кінцевої точки (смерть, повторна госпіталізація або трансплантація серця) від рівня показника за шкалою MELD-XI. Виявлено, що вищий ризик досягнення комбінованої кінцевої точки спостерігається у пацієнтів з вищим рівнем креатиніну. Для загального білірубіну такої залежності не встановлено [17] (рис. 3).
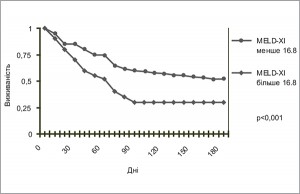 Рис. 3. Крива виживаності для комбінованої кінцевої точки (смерть, повторна госпіталізація або трансплантація серця), асоційованої з Моделлю термінального захворювання печінки без врахування Міжнародного нормалізованого відношення (MELD-XI) [17]
Рис. 3. Крива виживаності для комбінованої кінцевої точки (смерть, повторна госпіталізація або трансплантація серця), асоційованої з Моделлю термінального захворювання печінки без врахування Міжнародного нормалізованого відношення (MELD-XI) [17]Hisahito Shinagava і співавт. у своєму дослідженні довели прогностичне значення рівня загального білірубіну у хворих із ХСН. У дослідженні взяли участь 188 пацієнтів з ФВ ≤40%. Комбінованою кінцевою точкою були повторна госпіталізація внаслідок декомпенсації ХСН або смерть внаслідок серцево-судинного захворювання. Рівень загального білірубіну корелював з рівнем ЦВТ та СІ при одночасному вимірюванні. При найвищих рівнях білірубіну рівень ЦВТ був найвищим, а СІ – найменшим. Отже, високий рівень білірубіну в поєднанні з високим ЦВТ і низьким СІ був предиктором несприятливого віддаленого прогнозу у хворих із ХСН за рахунок схильності до застою і гіпоперфузії тканин. Рівень загального білірубіну більшою мірою змінювався у пацієнтів з декомпенсацією ХСН, ніж у стабільних хворих. Також виявлено, що рівень загального білірубіну на момент госпіталізації був незалежним предиктором кардіальної смерті та повторної госпіталізації з приводу декомпенсації ХСН. Це не стосувалося рівня загального білірубіну на момент виписки. Рівень загального білірубіну, рівень САТ при госпіталізації та вік пацієнта – незалежні предиктори віддалених серцевих подій. Прогностичної значущості рівня печінкових ферментів у хворих із ХСН не виявлено [18] (рис. 4).
Завданням одного із субаналізів великого когортного дослідження CHARM (Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity program), у якому взяли участь 2679 пацієнтів із 26 країн світу, було вивчення прогностичного впливу показників функції печінки у хворих із ХСН. Кінцевими точками були кардіоваскулярна смерть або госпіталізація з приводу декомпенсації стану та смерть унаслідок усіх причин. Виявлено, що у пацієнтів із ФВ ≤40% удвічі частіше спостерігався високий рівень загального білірубіну, ніж у хворих з ФВ ≥40%. Також рівень загального білірубіну був значно вищим у пацієнтів з ознаками некомпенсованої ХСН (ритм галопу, наявність хрипів у легенях, венозний застій). Зроблено висновок, що рівень загального білірубіну є точнішим предиктором прогнозу, ніж ФВ, ФК за NYHA, рівень креатиніну або наявність цукрового діабету, та важливим предиктором смерті внаслідок усіх причин [19] (рис. 5).
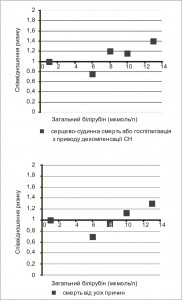 Рис. 5. Співвідношення ризиків за загальним білірубіном для (а) серцево-судинної смерті або госпіталізації з приводу декомпенсації ХСН та (б) смерті від усіх причин у дослідженні CHARM [19]
Рис. 5. Співвідношення ризиків за загальним білірубіном для (а) серцево-судинної смерті або госпіталізації з приводу декомпенсації ХСН та (б) смерті від усіх причин у дослідженні CHARM [19]Lau і співавт. дослідили залежність печінкових показників від ступеня вираження тристулкової недостатності (ТН). Було виявлено підвищення показників холестазу – ЛФ, ГГТ та білірубіну, а також гіпоальбумінемію у хворих з ХСН при недостатності тристулкового клапана, ступінь змін яких корелював зі ступенем вираження ТН [20].
Однією з ланок у глобальному проспективному рандомізованому подвійному сліпому плацебо-контрольованому дослідженні EVEREST (Efficacy of Vasopressin Antagonism in Heart Failure Outcome Study with Tolvaptan) було вивчення впливу рівня показників печінкової функції на віддалений прогноз (захворюваність та смертність після виписки зі стаціонару) у пацієнтів, госпіталізованих з приводу декомпенсації ХСН і які не мають первинного захворювання печінки. Критерії відбору: ФВ ≤40%, ІІІ-VІ ФК за NYHA та наявність двох або більше симптомів застою у великому колі кровообігу. У дослідження тривалістю 3 роки (з 2003 по 2006 р.) було залучено 2061 хворого. Andrew P. Ambrosy і співавт. дійшли висновку, що зниження рівня альбуміну асоційоване зі зниженням ФВ і патологічними значеннями лабораторних показників функції печінки. Виражене зниження рівня альбуміну (<34 г/л) і значне підвищення рівня загального білірубіну під час госпіталізації були асоційовані зі зростанням показників смертності внаслідок усіх причин, але не з комбінованою кінцевою точкою (серцево-судинна смерть або госпіталізація з приводу декомпенсації ХСН). Утім, динамічне зниження рівня альбуміну та підвищення рівня загального білірубіну під час стаціонарного лікування асоціювались із високим ризиком досягнення обох кінцевих точок. Внутрішньогоспітальне підвищення рівня альбуміну було пов’язане зі зниженням показників смертності внаслідок усіх причин і комбінованої кінцевої точки [21].
Аналогічні висновки зробили й китайські вчені, які проаналізували дані 16 681 пацієнта, госпіталізованого з приводу ХСН з ФВ <50%. Протягом 3 років спостереження померли 38% хворих. У 71% випадків виявлено зміни в лабораторних показниках функції печінки. З них у 33% пацієнтів встановлено підвищення рівня прямого білірубіну, у 32% – збільшення рівня ГГТ та у 30% – підвищений рівень АЛТ. Зростання рівня ЛФ спостерігалось у 3% випадків, у 4% зареєстровано зниження цього показника. Рівень загального білірубіну вище норми та гіпоальбумінемія були виявлені у 19 та 23% хворих відповідно. На підставі отриманих даних високий рівень загального, прямого білірубіну та зниження концентрації альбуміну були визначені як незалежні фактори зростання загальної смертності та корелювали зі значенням ФВ і кінцево-діастолічним розміром лівого шлуночка [22].
У 2011 р. були опубліковані висновки згідно з проведеним з 2000 по 2008 р. в Австрії великим когортним рандомізованим дослідженням за участю пацієнтів з ХСН щодо впливу на прогноз змін лабораторних показників печінкових ферментів. Дослідження містило дані 1032 хворих. Виявлено, що рівні загального білірубіну, ГГТ і ЛФ, але не АСТ й АЛТ, були предикторами смерті або трансплантації серця [23] (рис. 6).
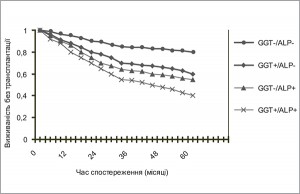 Рис. 6. Крива виживаності без трансплантації печінки для пацієнтів, стратифікованих залежно від рівня ГГТ та ЛФ [23]
Рис. 6. Крива виживаності без трансплантації печінки для пацієнтів, стратифікованих залежно від рівня ГГТ та ЛФ [23]
Особливості лікування пацієнтів із ХСН за наявності порушення функції печінки
На сьогодні не існує стандартів лікування застійної гепатопатії. За даними різних авторів [3, 5-8, 13], ефективність лікування таких хворих полягає в адекватній корекції застійної СН згідно з рекомендаціями. Необхідно ретельно моніторувати рівень АТ під час активної діуретичної терапії або призначення препаратів, що знижують серцевий викид, для запобігання розвитку вираженої гіпотензії. Гостра ішемія і некроз печінки є значно серйознішими ускладненнями, ніж хронічний застій. Результатом адекватного лікування є підвищення серцевого викиду та зменшення застою в печінці, завдяки чому можливе відновлення функції органа. Необхідно пам’ятати, що з порушенням функцій печінки асоціюється зміна терапевтичних ефектів лікарських засобів, які активуються або метаболізуються в зазначеному органі чи зв’язуються з білками плазми [3, 7, 24].
У хворих із вираженим набряковим синдромом, особливо за наявності асциту, лікування зазвичай починають з призначення діуретичних засобів. Препаратами першого ряду є петльові діуретики (фуросемід, торасемід) й антагоністи мінералокортикоїдних рецепторів – АМР (спіронолактон, еплеренон) [7, 24-26].
Серед петльових діуретиків, які практично на 100% зв’язуються з білками плазми крові, доцільно використовувати фуросемід, який, на відміну від торасеміду, елімінується переважно нирками [24, 26].
Враховуючи те, що при застійній гепатопатії, як і при ХСН, виявляється вторинний гіперальдостеронізм, прийом АМР є обов’язковим. Крім того, доведено вплив тривалого прийому АМР на ризик передчасної смерті та повторних госпіталізацій з приводу декомпенсації кровообігу [27, 28]. Спіронолактон майже повністю зв’язується з білками плазми та метаболізується в печінці, на відміну від еплеренону, який зв’язується з білками лише на 50%, але метаболізується за допомогою системи цитохрому Р450, що може також призводити до накопичення препарату в організмі [7, 24-26].
Результати двох досліджень свідчать, що кращий сечогінний ефект із найменшим ризиком кумуляції препаратів досягається при поєднанні двох груп препаратів із поступовим титруванням доз протягом 7 діб, починаючи із 40 мг фуросеміду та 100 мг спіронолактону, щоденним підвищенням доз на 40 мг та 100 мг відповідно, максимально – до 160 мг/добу фуросеміду та 400 мг/добу спіронолактону [25, 29, 30].
Серед інгібіторів ангіотензинперетворювального ферменту (ІАПФ) з доведеним впливом на прогноз [31, 32] (еналаприл, каптоприл, лізиноприл, раміприл, трандолаприл) перевагу надають тим препаратам, які меншою мірою зв’язуються з білками плазми: якщо у хворого виявлено гіпоальбумінеміюі гіпопротеїнемію, призначають лізиноприл та еналаприл. Крім того, лізиноприл – це активна речовина (не потребує активації в печінці), виводиться переважно нирками, але біодоступність зазначеного лікарського засобу становить 30%. Еналаприл, навпаки, має високу біодоступність – до 70%, але потребує активації в печінці до еналаприлату, елімінується також переважно нирками [7, 24, 26].
Щодо блокаторів рецепторів ангіотензину ІІ (БРА), які можуть бути альтернативою ІАПФ згідно з чинними стандартами, то вони практично повністю зв’язуються з білками плазми, переважно з альбуміном, і їх концентрація зростає при порушенні білково-синтетичної функції печінки. Тому необхідно з обережністю титрувати дозу у пацієнтів із дисфункцією печінки для запобігання розвитку побічних ефектів. Хоча, за даними досліджень, фармакокінетика та фармакодинаміка ірбесартану суттєво не змінюються, відповідно, коригування дози не потрібне [7, 24, 26, 33, 34].
β-Адреноблокатори (β-АБ) показані усім хворимі з ХСН з ФВ ≤40-45%. β-АБ з доведеним впливом на віддалений прогноз (зниження ризику передчасної смерті та повторних госпіталізацій з приводу декомпенсації кровообігу) у пацієнтів із ХСН [35-39] (небіволол, метопролол, карведилол) є ліпофільними, тобто метаболізуються переважно в печінці. При порушенні кровообігу в печінці кліренс цих препаратів знижується, збільшується період напіввиведення, результатом чого є їх кумуляція та збільшення ймовірності виникнення побічних ефектів. Потенційною перевагою бісопрололу є його здатність у рівних співвідношеннях виводитися печінкою та нирками. Гідрофільні β-АБ, які елімінуються нирками, не рекомендовані пацієнтам із ХСН через те, що їх вплив на прогноз не доведений [7, 24, 26].
Івабрадин – єдиний представник інгібіторів if-каналів, який метаболізується системою цитохрому Р450 і на 70% зв’язується з білками плазми, тому при порушенні функції печінки цей препарат необхідно призначати обережно [7, 24, 40].
Варфарин метаболізується в системі цитохрому Р450 й екскретується із жовчю. При печінковій недостатності здатність печінки до інактивації варфарину знижується, і дія препарату значно підсилюється, тому необхідно пам’ятати, що у таких хворих початкова доза варфарину має принаймні не перевищувати 5 мг (за наявності коагулопатії при тяжкій печінковій недостатності слід ретельно зважити доцільність призначення препарату) [7].
При тяжкій ХСН для корекції гіпотензії з метою запобігання розвитку гострої ішемії печінки доцільно застосовувати лікарські засоби з позитивним інотропним ефектом (добутамін, допамін, левосимендан) [3, 5-7, 24]. Цікаве дослідження було проведено в Японії Hisahito Shinagava і співавт., у якому взяли участь 133 пацієнти з декомпенсованою ХСН з ФВ ≤40% і рівнем САТ 90-120 мм рт. ст. Учені проаналізували можливість вирішення питання про необхідність введення інотропних засобів залежно від рівня загального білірубіну. Було зроблено висновок, що рівень білірубіну >22 ммоль/л на фоні декомпенсації ХСН може бути предиктором необхідності введення інотропних препаратів [41].
Для корекції гіпоальбумінемії доцільно застосовувати 10-20% альбумін під контролем його рівня у плазмі крові [5, 6, 25]. Утім, існує думка, що у пацієнтів з гіпоальбумінемією і резистентним асцитом введення альбуміну в поєднанні з петльовими діуретиками є неефективним [42].
На фоні зниження детоксикаційної функції печінки в крові значно зростає вміст циркулюючих ендогенних нейротоксинів. Для зниження інтоксикації, а також при печінковій енцефалопатії ефективним може бути застосування лактулози, яка зв’язує продукти розпаду білка (аміак та інші токсини) у кишечнику за рахунок пригнічення росту протеолітичної мікрофлори, посилення росту лактобактерій та прискорення евакуації вмісту кишечнику, що скорочує час, потрібний для утворення аміаку [43].
Для збільшення виведення аміаку доцільно використовувати L-орнітин-L-аспартат, основною дією якого є утворення сечовини з аміаку (орнітиновий цикл утворення сечовини) та збільшення утворення НАДФ у мітохондріях гепатоцитів. Також аспартат шляхом трансформації в аланін попереджує виснаження запасів АТФ і знижує активність трансаміназ гепатоцитів [43].
Препарати артишоку мають гепатопротекторні, регенеративні та жовчогінні властивості. Завдяки прискоренню елімінації жовчі токсини, що містяться у ній, швидше потрапляють до кишечнику, де інактивуються. Крім того, артишок має додаткові діуретичний і антиоксидантний ефекти [44-46].
Силімарин чинить гепатопротекторний, антиоксидантний та мембраностабілізуючий ефект, опосередковано впливає на синтез білка гепатоцитами через стимулювання активності РНК-полімерази. Цитопротекторний ефект опосередковується через пригнічення утворення циклооксигенази, лейкотриєнів і вільних радикалів у клітинах Купфера, що зменшує запальні процеси. Результати низки досліджень свідчать про наявність у силімарину імуномодуляторного, антифібротичного та антипроліферативного ефектів. Силімарин інтегрується в мембрани гепатоцитів і перешкоджає проникненню токсинів і ксенобіотиків [47-50]. Автори інших досліджень також повідомляють про кардіопротекторний, антидіабетичний, гіполіпідемічний та нейропротекторний ефекти препарату [51-54]. Ефективною дозою вважається 1200-1500 мг/добу, розділена на 2-3 прийоми [51].
У разі кровотечі з варикозно розширених вен стравоходу можливе призначення соматостатину, механізм дії якого полягає в пригніченні зовнішньої секреції підшлункової залози, утворення соляної кислоти та гастрину. Унаслідок прямого впливу на гладку мускулатуру судин соматостатин знижує артеріальний кровоплин вісцеральних органів і портальний кровоплин [22, 55].
Резюме
Отже, печінка бере активну участь у патогенезі застійної СН. Показники функції печінки можуть використовуватись як незалежні предиктори віддаленого прогнозу у пацієнтів із СН. Такі хворі вимагають постійного моніторингу не тільки показників порушення функції печінки (рівень загального білка, альбуміну, показників згортання крові), а й показників холестазу та активації цитолізу (рівень АЛТ, АСТ, ЛФ, ГГТ, загального білірубіну і його фракцій) з метою контролю стану печінки та для оцінки віддаленого прогнозу. Своєчасна адекватна специфічна терапія може позитивно вплинути не лише на стан пацієнтів, а й потенційно – на тривалість їх життя. Останнє має бути доведено у відповідних спланованих дослідженнях.
Література
1. Eipel Ch., Abshagen K., Vollmar B. Regulation of hepatic blood flow: The hepatic arterial buffer responce revisited // World J. of Gastroenterology. 2010; 48: 6046-6057.
2. Ezzat W.R., Lautt W.W. Hepatic arterial pressure-flow autoregulation is adenosine mediated // Amer. J. Physiol. 1987; 252: H836-H845.
3. Сторожаков Г.И., Эттингер О.А. Поражение печени при хронической сердечной недостаточности // Сердечная Недостаточность. – 2005. – Т. 6. – №1. – C. 28-32.
4. Seeto R.K., Fenn B., Rockey D.C. Ishemic hepatitis clinical presentation and pathogenesis // Amer. J. Medicine. 2000; 109: 109-113.
5. Лиховський О.І. Ураження печінки при серцевій недостатності: діагностика та лікування поєднаної гепато-кардіальної патології // Медичний всесвіт. – 2004. – T. 4. – №1. – C. 64-67.
6. Шевченко О.С. Застойная печень при хронической сердечной недостаточности // Врачебная практика. – 2005. – №5. – C. 60-64.
7. Alvarez A.M. et al. Liver Abnormalities in Cardiac Diseases and Heart Failure // Int. J. Angiol. 2001; 20: 135-142.
8. Якупов И.Ф. Влияние состояния печени на течение сердечно- сосудистых заболеваний // Кардиология-кардиохирургия. Лекции для врачей общей практики, практическая медицина. – 2012. – 05 (60). – C. 104-106.
9. Kierman F. The anatomy and physiology of the liver Philosophical Transactions of the Royal Society of London. 1833; 123: 711-770.
10. Sherlock S. The liver in heart failure: relation of anatomical, functional, and circulatory changes. Br Heart J. 1951;13(3): 273-293.
11. Bynum T.E., Boinott J.K., Maddrey W.C. Ischemic hepatitis. Dig. Dis. Sci. 1979; 24(2): 129-135.
12. Henrion J., Schapira M., Luwaert R., Colin L., Delannoy A., Heller F.R. Hypoxic hepatitis. Clinical and hemodynamic study in 142 consecutive cases // Medicine. 2003; 82: 392-406.
13. Кравчун П.Г., Шевченко О.С., Ярмиш Н.В. Функція печінки і прогресування хронічної серцевої недостатності // Сучасна гастроентерологія. – 2005. – №5. – C. 44-47.
14. Катикова О.Ю., Кабакова Т.А. Нарушение функций печени у больных с застойной недостаточностью кровообращения // Клиническая геронтология. – 2002. – № 2. – C. 14-19.
15. Van Deursen V.M., Damman K., Hillege H.L., Van Beek A.P., Van Veldhuisen D.J., Voors A.A. Abnormal Liver Function in Relation to Hemodynamic Profile in Heart Failure Patients // J. Cardiac Failure. 2009; 16: 84-90.
16. Van Deursen V.M., Edwards Ch., Cotter G., Davison B.A.,Damman K.,Teerlink J.R., Metra M., Felker G.M., Ponikowski P., Unemori E., Severin Th.,Voors A.A. Liver Function, In-Hospital, and Post-Discharge Clinical Outcome in Patients With Acute Heart Failure-Results From the Relaxin for the Treatment of Patients With Acute Heart Failure Study // J. Cardiac Failure. 2014; 20: 407-413.
17. Scholfield M., Schabath M.B., Guglin M. Longitudinal Trends, Hemodynamic Profiles, and Prognostic Value of Abnormal Liver Function Tests in Patients With Acute Decompensated Heart Failure: An Analysis of the ESCAPE Trial // J. Cardiac Failure. 2014; 20: 476-484.
18. Shinagava H., Inomata T., Koitabashi T., Nakano H., Takeuchi I., Naruke T., Ohsaka T., Nishii M., Takehana H., Izimi T. Prognostic Significance of Increased Serum Bilirubin Levels Coincident With Cardiac Decompensation in Chronic Heart Failure // Circilation J. 2008; 72: 364-369.
19. Allen L.A., Felker G.M., Pocock S., McMurray J.J.V, Pfeffer M.A., Swedberg K., Wang D., Yusuf S., Michelson E.L., Granger Ch.B. Liver function abnormalities and outcome in patients with chronic heart failure: data from the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) program // European J. Heart Failure. 2009; 11: 170-177.
20. Lau G.T., Tan H.C., Kritharides L. Type of liver dysfunction in heart failure and its relation to the severity of tricuspid regurgitation // Am. J. Cardiol. 2002; 90: 1405-1409.
21. Ambrosy A.P., Vaduganathan M., Huffman M.D., Khan S., Kwasny M.J., Fought A.J., Maggioni A.P., Swedberg K., Konstam M.A., Zannad F., Gheorghiade M. Clinical course and predictive value of liver function tests in patients hospitalized for worsening heart failure with reduced ejection fraction: an analysis of the EVEREST trial // European J. Heart Failure. 2012; 14: 302-311.
22. Yu S.B., Cui H.Y., Qin M., Liu T., Kong B., Zhao Q.Y., Huang H., Huang C.X. Prevalence and prognostic value of liver function abnormalities in patients with chronic systolic heart failure // Zhonghua Yi Xue Za Zhi. 2011; 91: 2673-2677.
23. Poelzl G., Ess M., Mussner-Seeber Ch., Pachinger O., Frick M., Ulmer H. Liver dysfunction in chronic heart failure: prevalence, characteristics and prognostic significance // European J. Clinical Investigation. 2011; 42: 153-163.
24. Рекомендації з діагностики та лікування хронічної серцевої недостатності Асоціації кардіологів України та Української асоціації фахівців із серцевої недостатності // УКЖ. – 2013. – Додаток 1.
25. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatoranal syndrome in cirrhosis of the European Association for the Study of Liver // J. Hepatology. 2010; 53: 397-417.
26. Герасименко О.В., Рудик Ю.С., Сахарова Т.С. Зміни фармакокінетичних параметрів деяких лікарських засобів на тлі розвитку застійних явищ у печінці при хронічній серцевій недостатності // Український терапевтичний журнал. – 2014. – № 3-4. – C. 133-141.
27. Pitt B., Zannad F., Remme W.J. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators // N.Engl.G.Med. 1999; 341: 709-717.
28. Zannad F., Mcmurray J.J., Krum Het. et al. Eplerenone in patients with systolic heart failure and mild symptoms // Eur. J. Heart Fail. 2005; 7: 537-541.
29. Angeli P., Fasolato S., Mazza E. et al. Combined versus sequential diuretic treatment of ascites in nonazotemic patients with cirrhosis: results of an open randomized clinical trial // Gut. 2010; 59: 98-104.
30. Santos J., Planas R., Pardo A. et al. Spironolactone alone or in combination with furosemide in the treatment of moderate ascites in nonazotemic cirrhosis. A randomized comparative study of efficacy and safety // J. Hepatol. 2003; 39: 187-192.
31. Effect of enalapril on survival in patients with reduce left ventricular ejection fraction and congestive heart failure. The SOLVS Investigators // N. Engl. J. Med. 1991; 325: 293-302.
32. Effect of enalapril on mortality in several congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). The CONSENSUS Trial Study Group // N.Engl.G.Med. 1987; 316: 1429-1435.
33. Marino M.R., Langenbacher K.M., Raymond R.H., Ford N.F., Lasseter K.C. Pharmacokinetics and pharmacodynamics of irbesartan in patients with hepatic cirrosis // J.Clin.Pharmacol. 1998; 38: 347-356.
34. Brookman L.J., Rolan P.E., Benjamin I.S., Wyld P.J., Lloyd P., Flesch G., Waldmeier F., Sioufi S., Mullins F. Pharmacocinetics of valsartan in patients with liver disease // Clin.Pharnacol.Ther. 1997; 62: 272-278.
35. Effects of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial In congestive heart failure (MERIT-HF) // Lancet. 1999; 353: 2001-2007.
36. Hjalmarson A., Goldstein S., Fagerberg B. et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: Metoprolol CR/XL Randomised Intervention Trial In congestive heart failure (MERIT-HF). The MERIT-HF Study Group // J.A.M.A. 2000; 283: 1295-1302.
37. Packer M., Coats A.J., Fowler M.B. et al. Effect of carvedilol on survival in severe chronic heart failure // N.Engl.J.Med. 2001; 344: 1651-1658.
38. Packer M., Fowler M.B., Roecker E.B. et al. Effect of carvedilol on morbidity of patients with severe chronic heart failure: results of the carvedilol prospective randomized cumulative survival (COPERNICUS) study // Circulation. 2002; 106: 2194-2199.
39. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomized trial // Lancet. 1999; 353: 9-13.
40. Bohm M., Borer J., Ian Ford et al. Heart rate at baseline influences the effect of ivabradine on cardiovascular outcomes in chronic heart failure: analysis from the SHIFT study // Clinical research in cardiology. – 2012.
41. Shinagawa H., Inomata T., Koitabashi T., Nakano H., Takeuchi I., Osaka T., Nishii M., Takehana H., Izumi T. Increased Serum Bilirubin Levels Coincident With Heart Failure Decompensation Indicate the Need for Intravenous Inotropic Agents // Int. Heart. J. 2007; 48: 195-204.
42. Chalasani N., Gorski J.Ch., Horlander J.C., Craven R.., Hoen H., Maya J., Brater D.C. Effects of Albumin/Furosemide Mixtures on Responses Furosemide in Hypoalbuminemic Patients // J.Am.Soc.Nephrol. 2001; 12: 1010-1016.
43. Полунина Т.Е., Маев И.В. Печеночная энцефалопатия. Алгоритм дифференциальной диагностики и тактика ведения // Медицинский альманах. 2010; №1: 169-170.
44. Gebhardt R. Prevention of taurolithate-induced hepatic bile canalicular distortions by HPLC-characterized extracts of artichoke (Cynara scolymus) leaves // Planta Med. 2002; 68(9): 776-79.
45. Gebhardt R. Antioxidative and protective properties of extracts from leaves of the artichoke (Cynara scolymus L.) against hydroperoxide-induced oxidative stress in cultured rat hepatocytes// Toxicology and Applied Pharmacology. 1997; 144: 279-286.
46. Оzlem Aksu, Basar Altinterim. Hepatoprotective effects of artichoke (Cynara scolymus) // Cilt. 2013; 1: 44-49.
47. Vargas-Mendoza N., Madrigal-Santillan E., Morales-Gonzalez A., Esquivel-Soto J., Esquivel-Chirino C., Garcia-Luna M., Gayosso-de-Lucio J.A. Hepatoprotective effect of silymarin // World J. Hepatol. 2014; 6(3): 144-149.
48. Dehmlow C., Erhard J., de Groot H. Inhibition of Kupffer cell functions as an explanation for the hepatoprotective properties of silibinin // Hepatology. 1996; 23: 749-754.
49. Flora K., Hahn M., Rosen H., Benner K. Milk thistle (Silybum marianum) for the therapy of liver disease // Am. J. Gastroenterol. 1998; 93: 139-143.
50. Karimi G., Vahabzadeh M., Lari P., Rashedinia M., Moshiri M. «Silymarin», a promising pharmacological agent for treatment of diseases // Iran J. Basic Med. Sci. 2011; 14: 308-317.
51. Shamama J., Kanchan Kohli; Mushir Ali. Reassessing Bioavailability of Silymarin // Alternative Medicine Review. 2011; 16: 239-249.
52. Lirussi F., Beccarello A., Zanette G. et al. Silybin-betacyclodextrin in the treatment of patients with diabetes mellitus and alcoholic liver disease. Efficacy study of a new preparation of an anti-oxidant agent // Diabetes Nutr. Metab. 2002; 15:222-231.
53. Rao P.R., Viswanath R.K. Cardioprotective activity of silymarin in ischemia-reperfusion-induced myocardial infarction in albino rats // Exp. Clin. Cardiol. 2007;12: 179-187.
54. Radko L., Cybulski W. Application of silymarin in human and animal medicine // J. Preclin. Clin. Res. 2007; 1: 22-26.
55. Ушкалова Е.А. Применение октреотида в гастроэнтерологии // Фарматека. – 2005. – №1.